一种生物反应器中的CHO细胞培养方法与流程
本发明涉及一种细胞培养,更具体的说,它涉及一种生物反应器中的cho细胞培养方法。
背景技术:
抗体类药物由于具有靶向明确、副作用小等优势,已经成为生物制药领域中的领头羊。在当前上市的抗体新药中,绝大部分是以cho细胞大规模培养为基础进行生产的。为了保证抗体的表达量和质量符合要求,生物反应器中的培养工艺也需要进行筛选及优化工作,由于体积放大,这一阶段的研发成本显著增加。在抗体药物前期的研发过程中,大量的筛选及工艺开发工作大部分是在孔板、摇瓶或摇管中进行,由于培养模式的不同,如何将筛选出的细胞株及培养工艺快速地过渡到反应器中进行放大培养成为了本领域一直难于解决的问题之一。
在已有的一些文献中,报道了某些特定的转速、温度、ph以及溶氧控制均会对细胞的生长和抗体的质量产生影响,但是这些研究往往只考虑了单一因素的影响,相较于摇瓶培养,通用性较差,同时对抗体的产量和质量并无明显的提高。
技术实现要素:
针对现有技术存在的不足,本发明的目的在于提供一种适用性较广,能够明显减少成本、缩短周期的生物反应器中的cho细胞培养方法。
为实现上述目的,本发明提供了如下技术方案:一种生物反应器中的cho细胞培养方法,其步骤为:
(1)起始控制生物反应器;
(2)在培养的前期对ph进行控制;
(3)在培养中期对ph进行调整,同时控制生物反应器的搅拌速度;
(4)在步骤(2)的过程中接入基础培养基;
(5)在步骤(3)的过程添加流加培养基。
本发明进一步设置为:步骤(1)中,生物反应器起始控制参数为搅拌速度为140rpm,温度控制为37℃,溶氧控制为40%。
本发明进一步设置为:步骤(2)中,ph控制在7.0~7.3。
本发明进一步设置为:步骤(3)中,ph控制范围调整为6.8~7.0。
本发明进一步设置为:步骤(3)中,生物反应器的搅拌速度控制为220rpm。
本发明进一步设置为:步骤(4)中,基础培养基为dynamis、balancdchogrowtha、actipro的一种或多种。
本发明进一步设置为:步骤(5)中,流加培养基为efficientfeedtmc+、balancdchofeed4、cellboost7a/7b的一种或多种。
本发明具有下述优点:整合了生物反应器中的多个变量控制参数,使其能够快速、稳定地对cho细胞进行放大培养,同时保证抗体表达量和质量与摇瓶筛选中的结果一致,甚至有明显提升。该培养工艺适用性较广,能够明显减少成本、缩短周期;
生物反应器作为大规模细胞培养的关键技术环节,其控制变量较多,对细胞的生长和最终的抗体质量影响十分显著。快速地完成由摇瓶到反应器的工艺转移是本发明主要解决的核心问题。在满足抗体产量和质量要求的基础上,快速的确定合适的参数控制范围,为后续的逐级放大提供数据支撑。
附图说明
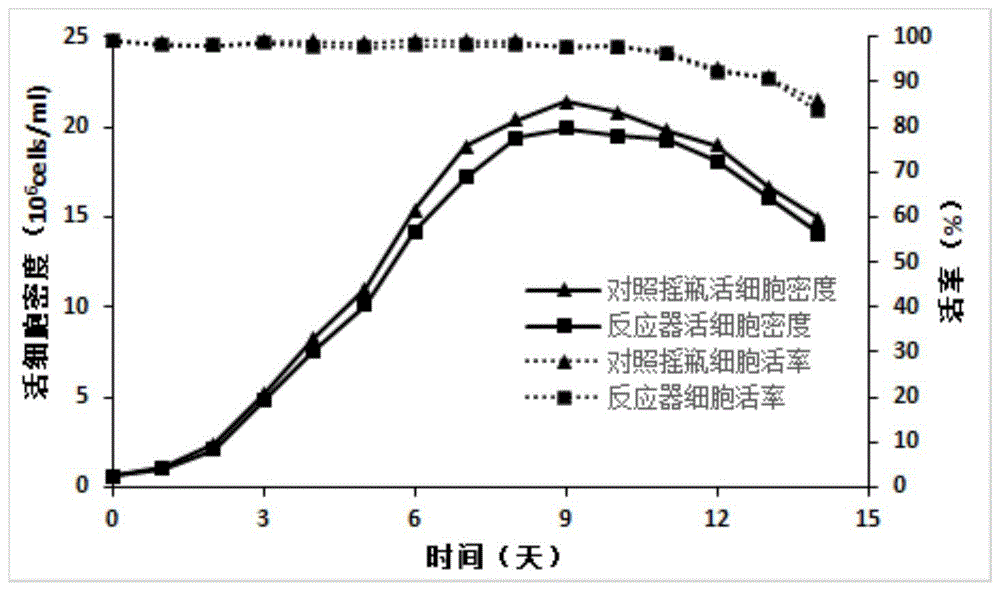
图1为本发明的实例1中细胞株a在摇瓶和反应器中的密度、活率对比折线图;
图2为本发明的实例1中细胞株b在摇瓶和反应器中的密度、活率对比折线图;
图3为本发明的实例1中细胞株在摇瓶和反应器中的抗体产量对比柱状图;
图4为本发明的实例2中细胞株c在摇瓶和反应器中的密度、活率对比折线图;
图5为本发明的实例2中细胞株c和反应器中的抗体产量对比柱状图;
图6为本发明的实例2中细胞株c在摇瓶和反应器中抗体糖型结果对比柱状图。
具体实施方式
本实施例的一种生物反应器中的cho细胞培养方法,其步骤为:
(1)起始控制生物反应器;
(2)在培养的前期对ph进行控制;
(3)在培养中期对ph进行调整,同时控制生物反应器的搅拌速度;
(4)在步骤(2)的过程中接入基础培养基;
(5)在步骤(3)的过程添加流加培养基。
本发明进一步设置为:步骤(1)中,生物反应器起始控制参数为搅拌速度为140rpm,温度控制为37℃,溶氧控制为40%。
本发明进一步设置为:步骤(2)中,ph控制在7.0~7.3。
本发明进一步设置为:步骤(3)中,ph控制范围调整为6.8~7.0。
本发明进一步设置为:步骤(3)中,生物反应器的搅拌速度控制为220rpm。
本发明进一步设置为:步骤(4)中,基础培养基为dynamis、balancdchogrowtha、actipro的一种或多种。
本发明进一步设置为:步骤(5)中,流加培养基为efficientfeedtmc+、balancdchofeed4、cellboost7a/7b的一种或多种。
通过采用上述技术方案,
实施例1
本实施例的cho细胞培养过程如下:
(1)反应器中接入基础培养基,分别接种2株gs-cho抗体表达细胞株a、b,接种密度为0.6106cells/ml,设置溶氧40%,温度控制37c,转速140rpm,采用co2和nahco3溶液调节ph为7.07.3;
(2)培养一定时间后(第3天),控制ph范围为6.87.0,同时在第6天调整转速为220rpm;
(3)从第4天开始,每隔2天流加一次,每次添加所述流加培养基的体积为初始培养体积的5%,待细胞活率降至80%以下停止流加;
(4)基础培养基为dynamis,流加培养基为efficientfeedtmc+;
(5)摇瓶培养为对照组,摇瓶培养条件为:温度控制37c,co2浓度控制8%,转速控制130rpm;
(6)待细胞活率降至60%以下,结束细胞培养,收获上清液。
从细胞培养第3天开始采用细胞计数仪检测活细胞数及细胞活率,根据nova自动生化分析仪检测结果维持24g/l的葡萄糖,hplc进行蛋白含量测定。两株细胞流加培养实验的活细胞密度、活率、抗体表达量依次见图1、图2、图3。
细胞株a在反应器中的生长状况和抗体表达量与对照摇瓶的结果完全一致;细胞株b的抗体表达量更是由5.64g/l提高至6.51g/l。从本实例的结果可看出,筛选出的细胞株及流加培养工艺,经过本发明中的反应器培养方法,可快速的实现摇瓶到反应器的工艺转移,从而进行下一步的放大培养。
实施例2
本实施例采用与实施例1相同的方法进行培养,其中基础培养基为actipro,流加培养基为cellboost7a/7b,接种细胞株为gs-cho抗体表达细胞株c,本实施例还以摇瓶培养为对照组。
对最终的抗体产量与质量进行检测,具体结果如图4、图5、图6所示。细胞株c在反应器中的生长趋势及活率状况与摇瓶中的结果保持一致,虽然最高细胞密度有所降低,但是细胞株c在反应器中的抗体产量与摇瓶中的结果并无差异,其中,纯化后的抗体进行糖型检测分析,结果详见图6所示,其中g0、gof、g1f、g2以及g2f含量比例与对照组的结果完全一致。
针对细胞株c,在本发明的生物反应器培养方法下,可完全重复摇瓶中的培养结果。
上述实施例的结果可看出,本发明中的生物反应器培养方法可快速、稳定的将摇瓶筛选的结果进行重复及放大培养,在工艺转移的过程中不会造成不良的影响。此方法适用性较广,在多个细胞株及流加培养工艺中均得到了验证,本发明中所列举的各原料都能实现本发明,在此不一一列举实施例。
以上所述仅是本发明的优选实施方式,本发明的保护范围并不仅局限于上述实施例,凡属于本发明思路下的技术方案均属于本发明的保护范围。应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理前提下的若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!