一种铵态氮高效利用的核桃砧木培育方法与流程
本发明涉及植物转基因领域,尤其是一种铵态氮高效利用的核桃砧木培育方法。
背景技术:
氮素作为植物需求量最大的矿质元素,是作物高产、稳产的重要生理基础和关键限制因子,在光合作用、呼吸作用以及抗氧化系统等关键生理代谢过程中都具有十分重要的作用。研究表明,目前全世界每年施用氮肥超过1.2亿吨。然而,当前主要作物对氮素利用效率却极其低下,仅为33%,我国主要粮食作物的氮肥利用率更是远低于国际水平,部分蔬菜高产区氮肥利用率更低得惊人,仅为10%~20%。大量施用的氮肥在提高农作物产量的同时,也极大增加了生产成本,更导致了包括气候变化、土壤酸化及水体富营养化等在内的环境危机与生态灾难。目前,氮污染已被认为是21世纪人类环境面临的最大挑战之一。然而,另一方面,人口爆炸对作物以及果蔬的产量带来了巨大的需求,因此,如何培育氮素高效利用的农作物新种质已成为当前解决我国乃至世界农业环境与资源之间关键矛盾的重大课题。铵态氮(ammoniumn,nh4+-n)和硝态氮(nitraten,no3--n)是植物吸收和利用的主要无机氮源,铵态氮被植物吸收后,可被直接同化为各种氨基酸,而硝态氮则须还原成铵态氮才能进入代谢过程,由此可见铵态氮是生物体内氮代谢的中心环节,铵态氮在植株体内的吸收和转运主要由铵转运蛋白(ammoniumtransporter,amt)通过与其偶联的h+-atpase所提供的细胞质膜内外化学渗透势梯度来介导。植物体内铵转运蛋白以基因家族的形式存在,进化分析显示植物铵转运蛋白家族可分为两大类:amt1和amt2。目前,关于amt基因的报道大多限于草本植物。水稻是鉴定出铵转运蛋白最多的植物种属,水稻中共发现了十几个铵转运蛋白基因,如osamt:1、osamtl:4、osamt2:3、osamt3:1和osamt5等,osmti:4和osamt5具有使nh4+吸收缺陷的酵母突变体重新恢复吸收nh4+的能力,其中osamt5为叶特异表达,osamti:4的表达会受到nh4+因子以外其他因素的调节;拟南芥中有atamtl:1、atamt1:5和atamt2等,其中的atamt1:3基因能介导铵的同系物甲基铵的吸收,对铵和甲基铵的吸收具有浓度依赖性和电压依赖性。但是,对木本果树amt基因的研究却鲜有报道。
经检索,尚未发现有关基于过量表达amt基因的核桃铵态氮高效利用方面的资料报道。因此,研发核桃过量表达amt基因的铵态氮高效利用新种质,不但为核桃,还为木本果树铵态氮高效利用开劈了一条新途径或借鉴之路。
技术实现要素:
有鉴于此,本发明的目的是提供一种铵态氮高效利用的核桃砧木培育方法,能够针对当前作物对氮素利用效率低下,大量施用的氮肥增加了农业生产成本,更导致了包括气候变化、土壤酸化及水体富营养化等环境危机,依靠传统的核桃新品种选育方式,仍无法满足现实生产的需求。为此,本发明要解决的技术问题是提供一种过量表达铵转运蛋白基因的核桃嫁接砧木培育方法。
为了实现上述目的,本发明提供如下技术方案:
一种铵态氮高效利用的核桃砧木培育方法,包括以下步骤:
1)rna提取
对生长良好的核桃体细胞胚取样,进行总rna提取,获得总rna提取液;
2)总rna反转录cdna
将步骤1)得到的总rna提取液进行逆转录得到cdna;
3)pcr扩增
根据核桃amt基因的全长序列,设计正向引物和反向引物,以步骤2)得到的cdna为模板进行扩增;
4)核桃jramt基因目的片段的回收
向步骤3)得到的扩增产物中加入10×loadingbuffer,进行1.5%的琼脂糖凝胶电泳,电泳结束用回收琼脂糖凝胶中的jramt基因目的片段;
5)构建jramt-pc1300过量表达载体
将步骤4)得到的核桃jramt基因目的片段与pc1300-gfp载体连接,构建过量表达载体;采用构建的过量表达载体转化大肠杆菌感受态细胞,pcr检测扩增,获取与目的片段大小一致的菌液,从菌液中提取核桃jramt-gfp质粒并转化感受态农杆菌;
6)核桃jramt-pc1300遗传转化
将步骤5)得到的含有jramt-gfp载体的农杆菌单菌落进行扩大培养,得到农杆菌工程菌液,并将农杆菌工程菌液浸染生长良好的核桃体细胞胚,并将浸染的核桃体细胞胚置于dkw固体培养中培养;并将共培养的核桃体细胞胚移至dkw固体培养基中筛选培养,获得jramt转化阳性体胚;
7)核桃jramt基因过量表达植株再生
步骤6)得到的jramt转化阳性体胚生长至子叶胚阶段接入dkw萌发培养基中,置于光照条件下进行萌发培养,得到jramt阳性再生核桃植株。
优选地,正向引物和反向引物的序列如下:
jramt-f:5`-gagctcggtacccggggatccatgaataccacaccggccta-3`;
jramt-f:5`-tcgcccttgctcaccatgtcgaccaaattgatggtcacacctc-3`。
优选地,步骤3)扩增条件为:94℃预变性7min;94℃变性30s;60℃退火30s;72℃延伸1min30s;共34个循环;最后一轮72℃延伸2min。
优选地,步骤5)中,构件过量表达载体条件为在bamhi,sali酶切位点处,对pc1300-gfp载体进行双酶切,电泳后回收目的基因;再将载体酶切产物与目的基因相连接,16℃连接过夜,得到过量表达载体。
优选地,步骤5)中,pcr检测扩增条件为94℃2min;98℃10sec,68℃45sec,45个循环;72℃10min;4℃保存。
优选地,步骤5)中,所述过量表达载体的全长序列如seqidno.1所示
优选地,步骤6)具体包括:
a)农杆菌工程菌菌液制备:
将含有jramt-pc1300载体的农杆菌单菌落接入lb液体培养基中,置于200rpm,28℃条件下培养24h;所述lb液体培养基中含50mg/l利福平和50mg/l卡那霉素;
b)菌液侵染
将上述制备好的含有jramt-pc1300载体的农杆菌工程菌液浸染生长良好的核桃体细胞胚10min,侵染完用无菌水将体胚清洗干净,用无菌滤纸将水吸干;所述含有jramt-pc1300载体的农杆菌工程菌液的od值为0.6;
c)共培养
将浸染的核桃体细胞胚置于dkw固体培养中培养3d后洗菌,无菌水洗5~6次后,前3次每次洗5min,后2~3次洗30min;再用羧苄青霉素洗三次,每次30min;dkw固体培养基中含有40mg/l的乙酰丁香酮;
d)筛选培养
将步骤c)得到的共培养的核桃体细胞胚移至dkw固体培养基中筛选培养28d,获得jramt转化阳性体胚;dkw固体培养基中含有50mg/l潮霉素和50mg/l羧苄青霉素。
优选地,步骤7)中,所述dkw固体培养基中含有1.0mg/l的6-苄氨基腺嘌呤和0.1mg/l的吲哚丁酸。
优选地,步骤7)中,所述光照条件为每日光暗周期为光16h、暗8h,光照强度为1500lx-2000lx,培养温度为25±2℃。
本发明提供的一种铵态氮高效利用的核桃砧木培育方法,操作简便,无需昂贵精密的仪器设备,成本低,周期短,同时,再生植株能更高效地吸收铵态氮,长势强、遗传稳定性好,苗木健壮、有良好的抗逆性。
附图说明
图1为铵态氮、硝态氮和总氮标准曲线图;
图2为野生型核桃体胚和jramt转化阳性体胚的不同发育阶段形态图;
图3为野生型核桃体胚和jramt转化阳性体胚、野生型核桃植株和jramt阳性再生核桃植株的荧光检测图;
图4为野生型核桃植株和jramt阳性再生核桃植株不同组织的电泳图;
图5为jramt-gfp在野生型核桃植株和jramt阳性再生核桃植株不同组织中的相对表达量;
图6为野生型核桃植株和jramt阳性再生核桃植株在不同培养时间的表型图;
图7为野生型核桃植株和jramt阳性再生核桃植株在不同培养时间的株高图;
图8为野生型核桃植株和jramt阳性再生核桃植株的干物质量测定图;
图9为野生型核桃植株和jramt阳性再生核桃植株的叶片叶绿素含量测定图;
图10为野生型核桃植株和jramt阳性再生核桃植株的氮含量测定图;
图11为jramt阳性再生核桃植株图。
具体实施方式
本发明提供的一种铵态氮高效利用的核桃砧木培育方法,首先是选取生长良好的核桃体细胞胚;提取总rna;反转录成cdna;根据核桃amt基因的全长序列,设计引物;进行pcr扩增;扩增产物进行1.5%的琼脂糖凝胶电泳,电泳结束用上海生工公司胶回收试剂盒回收琼脂糖凝胶中的目的条带;将jramt基因目的片段与pc1300-gfp载体连接,构建过量表达载体;连接产物转化大肠杆菌感受态细胞,pcr检测扩增,获取与目的片段大小一致的获得的菌液;大肠杆菌菌液pcr检测与测序,测序正确的菌液质粒命名为jramt-gfp;对序列正确的菌液提取质粒并转化农杆菌感受态细胞;将农杆菌单菌落进行扩大培养,制备农杆菌工程菌;对农杆菌菌液浓度进行检测;将浓度合格(od值0.6)的农杆菌菌液侵染生长良好的核桃体细胞胚(10-15min);转移至含有乙酰丁香酮的共培养基上培养3-5d天;将共培养后的核桃体细胞胚转移至附加潮霉素和羧苄青霉素的dkw固体培养基中筛选培养,获得jramt转化阳性体胚;生长至子叶胚阶段的体细胞胚转接入附加ba和iba的dkw萌发培养基中,置于光照条件下进行萌发培养;进一步对再生植株进行pcr及rt-pcr检测验证阳性可靠性;最后对阳性植株铵态氮及总氮含量检测验证铵态氮利用效率。再生植株铵态氮利用率显著高于野生型核桃植株的确定为铵态氮高效利用的核桃砧木,对铵态氮高效利用的核桃砧木再生植株进行生根培养。
为了进一步说明本发明,下面结合实施例对本发明提供的一种铵态氮高效利用的核桃砧木培育方法进行详细地描述,但不能将它们理解为对本发明保护范围的限定。
实施例
一、材料和方法
1.1实验材料
野生型核桃体胚。培养条件如下:温度25℃,光照强度1500lx-2000lx,相对湿度80%。取生长健壮的体胚和植株,分装于无rna酶的离心管并迅速放入液氮速冻,-80℃保存。
1.2实验方法
1.2.1核桃jramt1基因全长cdna序列的获取及过表达载体的构建
选用北京天根生化科技有限公司的多糖多酚植物总rna提取试剂盒(离心柱型)提取核桃体细胞胚的rna。提取成熟核桃体胚的rna并分离出mrna后,以mrna反转录合成cdna,即互补脱氧核糖核酸,本实验选取的是takara生物科技有限公司的逆转录试剂盒。
根据核桃amt基因的全长序列,在ncbi与其他物种的该基因进行blast发现该序列具有高度保守性,设计正向引物jramt1f为和反向引物jramt1,引物序列如下:
jramt1f:5`-gagctcggtacccggggatccatgaataccacaccggccta-3`;
jramt1:5`-tcgcccttgctcaccatgtcgaccaaattgatggtcacacctc-3`。
以逆转录的cdna为模板进行pcr扩增,扩增反应条件为:94℃预变性7min;94℃变性30s;60℃退火30s;72℃延伸1min30s;共34个循环;最后一轮72℃延伸2min;扩增结束后,向扩增产物中加入10×loadingbuffer,进行1.5wt%的琼脂糖凝胶电泳,电泳结束用上海生工公司胶回收试剂盒回收琼脂糖凝胶中的jramt基因目的片段;
采用bamhi,sali酶切位点,对(携带绿色荧光标签)pc1300-gfp载体进行双酶切,电泳后回收目的条带;采用诺唯赞clon
1.2.2jramt-gfp载体转化核桃体胚
首先采用液氮冻融法法将jramt-gfp质粒转入感受态农杆菌eha105中,在含50mg/l卡那霉素和20mg/l利福平的lb固体平板培养基上划线培养,置于200rpm,28℃条件下培养24h,得到含有jramt-pc1300载体的农杆菌单菌落。
取生长健壮的野生型核桃体胚(子叶胚),用上述活化的农杆菌工程菌(od值为0.6)侵染10min,随后用无菌水将侵染后的体胚清洗干净,用无菌滤纸将水吸干;将浸染的核桃体细胞胚在含有40mg/l乙酰丁香酮的固体dkw培养基中共培养3d后对体胚进行脱菌处理(无菌水清洗6次,前3次每次清洗5min,后3次清洗30min;50mg/l的羧苄青霉素洗3次,每次30min),再将脱菌后的核桃体胚转接至附加潮霉素(50mg/l)和羧苄青霉素抗性(50mg/l)的dkw固体培养基上进行筛选培养,每3d转接至成分相同的新鲜培养中培养,4周后可获得阳性体胚。选取生长健壮的阳性子叶胚转接至附加1.0mg/l的6-苄氨基腺嘌呤和0.1mg/l的吲哚丁酸的dkw固体培养基中进行萌发培养。培养条件:每日光暗周期为光16h、暗8h,温度25℃,光照强度1500lx-2000lx。1个月后再生植株长至2~3cm,供下一步实验使用。
1.2.3核桃jramt-gfp体胚及再生植株的阳性鉴定
1.2.3.1jramt-gfp阳性核桃体胚和植株的荧光检测
jramt-gfp载体携带gfp标签,可激发绿色荧光,体式荧光显微镜下检测可激发绿色荧光的体胚和植株初步判断为阳性,将筛选培养30d的核桃体胚和再生植株进行荧光检测并拍照。体视荧光显微镜型号为leieamzfliii,滤光片为gfp2,激发滤光片为480/40nm,封阻滤光片为510nm。
1.2.3.2核桃jramt-gfp体胚和再生植株的pcr和rt-pcr检测
(1)基因组dnapcr扩增检测
用植物基因组dna提取试剂盒(tiangen)提取携带jramt-gfp载体的阳性核桃茎、叶、胚和胚根的dna进行pcr扩增检测,同时以野生型核桃茎、叶、胚和胚根的dna作为对照,正向引物jramt-f和反向引物gfp-r,序列如下:
jramt-f:5`-gagctcggtacccggggatccatgaataccacaccggccta-3`;
gfp-r:5`-aaccgatgatacgaacgaaagc-3`。
反应条件为:94℃预变性7min;94℃变性30s;60℃退火30s;72℃延伸1min30s;共34个循环;最后一轮72℃延伸2min。
(2)jramt基因相对表达量测定
分别提取携带jramt-gfp载体和野生型核桃植株茎、叶、胚和胚根的总rna,反转录获得cdna,进行rt-pcr检测植株各部位的表达量,同时以野生型核桃植株叶作为对照。实时荧光定量pcr在roch480荧光定量pcr仪上进行,荧光染料采用takara公司sybrgreenpcrmastermix。rt-pcr的正向引物jramt-f和反向引物jramt-r如下:
jramt-f:5`-gagctcggtacccggggatccatgaataccacaccggccta-3`;
jramt-r:5`-tcgcccttgctcaccatgtcgaccaaattgatggtcacacctc-3`。
使用核桃actin基因作为内参基因,并设计引物如下:
正向引物jractin-f:5`-gccgaacgggaaattgtc-3`;
反向引物jractin-r:5`-agagatggctggaagagg-3`。
pcr反应程序为95℃预变性3min;95℃变性20s,60℃退火30s,72℃延伸30s,45循环;95℃30s,60℃30s,逐渐升温到95℃,速度0.11℃·s-1。扩增结果采用2-δδct法计算目的基因的相对表达水平。
1.2.4过量表达jramt基因对核桃表型及部分生理指标的影响
1.2.4.1过量表达jramt基因对核桃表型的影响
取jramt-gfp与野生型核桃植株相同高度(1cm)的茎尖接种于附加6-ba和iba的dkw固体培养基中进行组织培养(培养条件:每日光暗周期为光16h、暗8h,温度25℃,光照强度1500lx-2000lx,),分别于培养后10d、20d和30d时统计jramt-gfp阳性再生植株和野生型核桃植株株高。分别取生长10d、20d和30d时的jramt阳性再生与野生型核桃植株整株,重复3次,清洗晾干,于105℃下杀青,80℃烘干至恒重,统计干物质量。每处理重复3次。
1.2.4.2过量表达jramt基因对核桃叶片叶绿素含量的影响
分别取培养30d的jramt-gfp和野生型核桃再生植株从基部向上3-5片叶片,经分光光度计检测,得到a663和a665的数值,代入以下公式,计算出叶绿素a、叶绿素b和总叶绿素的含量,每处理重复3次。
叶绿素a(mg/g)=[12.7a663-2.69a645]v/1000×w
叶绿素b(mg/g)=[22.7a645-4.68a663]v/1000×w
总叶绿素(mg/g)=[20.2a645+8.02a663]v/1000×w
1.2.4.3过量表达jramt基因对阳性再生核桃植株氮含量的影响
使用h2so4-h2o2消煮法检测铵态氮、硝态氮和总氮含量。取培养30d的野生型和过表达jramt核桃植株,分别称取植株样品0.5g,使用h2so4-h2o2分别对植物样品进行消煮获得提取液,移入50ml容量瓶中,定容,每组处理重复3次。铵态氮在紫外光区a625nm处有特征吸收峰,可测定试液的吸光度以定量铵态氮;硝态氮在紫外光区a220nm处有特征吸收峰,可测定试液的吸光度以定量硝态氮;总氮在波长a210nm处有特征吸收峰,可直接测定试液的吸光度以定量总氮。
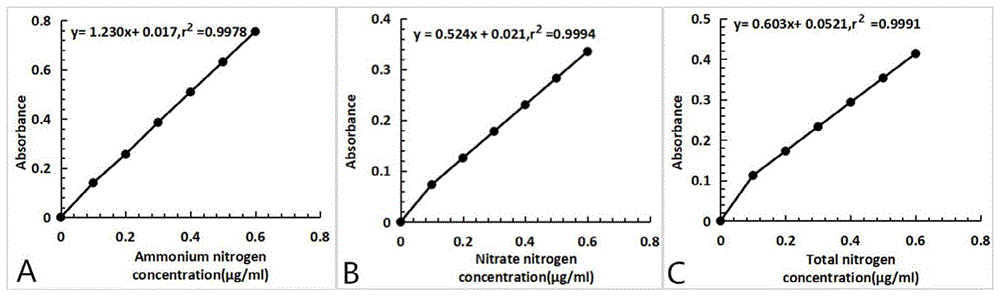
标准曲线绘制及氮含量计算:分别吸取铵态氮和硝态氮标准液(总氮标准液可使用硝态氮标准液)0、1、2、3、4、5、6ml放入50ml容量瓶中,加入稀释十倍的空白消煮液定容,则分别成为浓度为0、0.1、0.2、0.3、0.4、0.5、0.6μg/ml的氮标准溶液。以标准液的浓度(0、0.1、0.2、0.3、0.4、0.5、0.6μg/ml)为横坐标,以不同浓度标准液检测到的吸光值(表1)为纵坐标,绘制标准曲线(图1),图1a为铵态氮标准曲线,图1b为硝态氮标准曲线,图1c为总氮标准曲线,可得到回归方程。将样品提取液在波长a625nm、a220nm、a210nm处检测得到的吸光值代入相应回归方程,可分别计算得到样品提取液的铵态氮、硝态氮和总氮浓度(分别写作cnh4+、cno3-、ct)。将得到的cnh4+、cno3-、ct分别代入公式,可计算得到植株的铵态氮、硝态氮和总氮含量。
表1铵态氮、硝态氮和总氮标准液浓度与吸光值
回归方程如下:
a625=1.230cnh4++0.017
a220=0.524cno3-+0.021
a210=0.603ct+0.0521
a625、a220、a210分别为625、220、210nm波长下的吸光度;cnh4+、cno3-和ct分别代指铵态氮、硝态氮和总氮浓度。
氮含量计算公式:
铵态氮含量(μg/g)=cnh4+×v/w
硝态氮含量(μg/g)=cno3-×v/w
总氮含量(μg/g)=ct×v/w
cnh4+、cno3-和ct分别代指铵态氮、硝态氮和总氮浓度;v为提取液的体积(ml),50ml;w为植株质量(g),0.5g。
1.3核桃jramt-gfp阳性再生植株的生根培养
待萌发的不定芽长至3-5cm时,转接至生根培养基,即附加iba的dkw中进行生根培养。培养30~45d,生根率达95%。光照培养,光暗周期为光16h/暗8h,光照强度为1500lx-2000lx,培养温度为25±2℃。
二、实验结果
2.1核桃jramt基因全长序列的获得及过表达载体构建
提取核桃体胚总rna,经1%琼脂糖电泳检测,28s,18s,5s条带清晰,说明rna完整性较好,可反转录cdna。以野生型核桃体胚cdna为模板,根据获得的核桃amt基因保守序列分别设计目的基因的5'和3'特异引物,扩增得到长度为1400bp,与预期大小基本相符。经过ncbi在线序列比对表明,该基因编码的蛋白属于铵转运蛋白家族,将该基因命名为jramt,具有如seqidno.1所示的核苷酸序列。起始密码子为atg,终止密码子为tga,编码461个氨基酸。将上述条带割胶纯化回收后与克隆载体过表达载体pc1300-gfp连接,获得基因过量表达载体jramt-gfp,转化后进行菌液pcr,将检测结果中获得约与预期大致相同的菌液送出测序,测序结果显示为1464bp。
2.2jramt-gfp载体转化核桃体胚
野生型核桃体胚的生长发育都经过了以下4个阶段,即球形胚、心形胚、鱼雷形胚和子叶胚4个阶段具体参见图2a~d,其中用适合农杆菌侵染的体胚为子叶胚(图2d)。将子叶胚经侵染和共培养后进行阳性体胚筛选培养。筛选培养4周后,镜检结果表明,jramt-gfp核桃阳性体胚发育正常,同样经历了球形胚、心形胚、鱼雷形胚和子叶胚4个阶段(图2e~h)。其中,e1代次生胚的诱导率为55.2%,e2代次生胚诱导率为93.7%。
注:用于侵染的第一代体胚标记为e0,从e0代体胚上增殖产生的次生体胚标记为e1代,从e1代体胚上增殖产生的次生体胚标记为e2代。
2.3过量表达jramt核桃体胚和再生植株的阳性检验及表达分析
2.3.1核桃jramt-gfp阳性体胚和植株可激发绿色荧光
由于jramt-gfp载体携带有绿色荧光gfp标签,在蓝色激发下,jramt-gfp阳性体胚有明显的绿色荧光信号,而野生型核桃体胚则没有绿色荧光信号(图3a,b,e,f);荧光显微镜检测结果初步表明,e0代阳性率为30.2%,e1代阳性率为53.3%,e2代阳性体胚达88.6%。同样,在白光下jramt-gfp阳性核桃再生植株和野生型核桃植株间无明显区别,而在绿色荧光照射下,jramt-gfp阳性再生核桃植株有明显的绿色荧光信号激发,而野生型核桃植株则无绿色荧光信号,初步说明jramt-gfp载体已成功转入核桃体胚和再生植株(图3c,d,g,h)。
注:图3中a,e为野生型核桃体胚分别在白光和荧光下呈像;b,f为jramt转化阳性体胚分别在白光下和荧光下呈像;c,g为野生型核桃植株分别在白光下和荧光下呈像;d,h为过量表达jramt基因的核桃阳性再生植株分别在白光下和荧光下呈像;
wt指的是野生型核桃,jramt指的是过量表达jramt基因的核桃阳性再生植株。
2.3.2核桃jramt-gfp阳性体胚和再生植株的pcr和rt-pcr检测
对阳性体胚和再生植株基因组dna的pcr扩增检测实验。研究结果显示,jramt阳性体胚、胚根以及阳性再生植株的茎、叶均在2000bp处检测到目的片段,而野生型核桃植株中无相应条带,具体参见图4。结合图4可获得jramt-gfp已成功转入核桃植株体内。
图5为rt-pcr检测jramt基因在阳性体胚和再生植株体内的相对表达量,根据图5可以看出,jramt基因在阳性体胚及植株各组织部位均有表达,其中根中表达量显著高于茎、叶中的表达量。与野生型核桃植株比,jramt-gfp阳性再生植株中jramt基因相对表达量显著升高,其中根表达量最高,说明jramt基因为根部特异表达,对植物从土壤中吸收铵离子具有重要作用。
注:图4和图5中,1-1:wt叶;1-2:wt茎;1-3:wt根;2-1:jramt叶;2-2:jramt茎;2-3:.jramt根;wt指的是野生型核桃,jramt指的是过量表达jramt基因的核桃阳性再生植株。
2.4核桃jramt-gfp阳性再生植株的表型以及生理指标测定
2.4.1过量表达jramt基因对核桃表型的影响
与野生型核桃植株相比过量表达jramt基因的核桃阳性再生植株在转接10d后株高即出现明显变化,具体参见图6,7。研究表明,转接培养10d后,野生型核桃植株株高为1.29cm,过量表达jramt基因的核桃阳性再生植株的株高达到2.29cm;野生型核桃植株单株干物质量为0.014g,过量表达jramt基因的核桃阳性再生植株的干物质量为0.021g,比对照高0.007g。转接培养20天后,野生型株高为2.48cm,过量表达jramt基因的核桃阳性再生植株为3.18cm,比野生型对照高0.7cm;野生型核桃植株干物质量为0.02g,过量表达jramt基因的核桃阳性再生植株的干物质量比野生型核桃植株的干物质量高0.009g,为0.029g。转接培养30天后,野生型核桃植株的株高为3.57cm,而过量表达jramt基因的核桃阳性再生植株的株高为4.03cm,比野生型核桃植株的株高高0.46cm;野生型核桃植株的干物质量为0.036g,过量表达jramt基因的核桃阳性再生植株的干物质量为0.042g,比野生型核桃植株的株高高0.006g,具体参见图6和图8。
上述实验结果表明,过量表达jramt1基因可加速对阳性植株生长速度,在茎的伸长生长以及植株干物质量积累中具有重要的促进作用。
注:图6中a为0d时野生型核桃植株和过量表达jramt基因的核桃阳性再生植株;b为培养10d时野生型核桃植株和过量表达jramt基因的核桃阳性再生植株;c为培养20d时野生型核桃植株和过量表达jramt基因的核桃阳性再生植株;d为培养30d时野生型核桃植株和过量表达jramt基因的核桃阳性再生植株;
图6~8中wt指的是野生型核桃,jramt指的是过量表达jramt基因的核桃阳性再生植株。
2.4.2过量表达jramt基因对核桃再生植株叶片叶绿素含量的影响
检测过量表达jramt基因的核桃阳性再生植株和野生型核桃植株中叶片的叶绿素含量,结果见图9。从图9中可以看出野生型核桃植株的叶绿素a的含量为5.77mg/g,过量表达jramt基因的核桃阳性再生植株的叶绿素a含量为7.91mg/g,比野生型核桃植株高2.14mg/g;野生型核桃植株叶绿素b的含量为0.34mg/g,过量表达jramt基因的核桃阳性再生植株的叶绿素b的含量为1.86mg/g,比野生型核桃植株高1.52mg/g;野生型核桃植株总叶绿素含量为5.90mg/g,过量表达jramt基因的核桃阳性再生植株的总叶绿素含量为8.12mg/g,比野生型核桃植株高2.22mg/g。
并且通过观察可以发现,过量表达jramt基因的核桃阳性再生植株的叶色比野生型植物叶色深。因此过量表达jramt基因对核桃再生植株叶片的叶绿素合成具有明显的促进作用。
注:图9中wt指的是野生型核桃,jramt指的是过量表达jramt基因的核桃阳性再生植株。
2.4.2过量表达jramt基因对植株氮含量的影响
为了检测过量表达jramt1基因对氮的利用效率,检测过量表达jramt基因的核桃阳性再生植株的氮含量。根据图10可知,野生型核桃植株铵态氮含量为0.28mg/g,过量表达jramt基因的核桃阳性再生植株铵态氮含量为0.41mg/g,比野生型高0.13mg/g;野生型核桃植株总氮含量为1.33mg/g,过量表达jramt基因的核桃阳性再生植株总氮含量为1.55mg/g,比野生型核桃植株高0.22mg/g。表明过量表达jramt基因对核桃植株的氮素合成利用中具有一定的促进作用。
注:图10中wt指的是野生型核桃,jramt指的是过量表达jramt基因的核桃阳性再生植株。
三、核桃jramt-gfp阳性植株的生根培养
待萌发的不定芽长至3-5cm时,转接至生根培养基,即附加1.0mg/l的吲哚乙酸的dkw中进行生根培养,培养30~45d,生根率达95%,参见图11,图11a为过量表达jramt基因的核桃阳性再生植株的生根图片,图11b为过量表达jramt基因的核桃阳性再生植株的栽种图片。
上述说明,使本领域专业技术人员能够实现或使用本对所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖性特点相一致的最宽的范围。
序列表
<110>浙江农林大学
<120>一种铵态氮高效利用的核桃砧木培育方法
<130>1
<160>1
<170>siposequencelisting1.0
<210>1
<211>1464
<212>dna
<213>过量表达载体(未知)
<400>1
atgaataccacaccggcctacggagctgtcagcccagccgtgccaccatggctaaacaag60
ggcgacaacgcatggcaaatgacagcgtcgactctcgtaggcctccagagcatgccaggc120
ctggtcatcctctatgccagcatcgtcaagaagaaatgggcagtaaactcggccttcatg180
gctctctacgccttcgccgctgtgcttatttgctgggtcctcgtctgctaccgcatggcc240
ttcggtgacgaactcctccccttctggggaaagggcgcacccgctcttggccaaaagttc300
ctcgtccagcaggccaaagtccccgagagtaatcacactactgaaggtggcggctgggag360
atcgttgagcccttttatccaatggccacgctcgtttacttccaattcactttcgccgcc420
attaccatgattttacttgctgggtctgttctggggcgcatgaacatcaaggcatggatg480
gcgtttgtccctctttggcttgtgttctcctacaccgtcggagcctttagtctttggggt540
ggtggctttttgtatcactggggtgtcatagattactccggcggctatgtcatccatcct600
tcctcgggaattgccggtttcactgccgcttattgggttggcccgaggctaaagagtgac660
agggagaggtttcctcccaacaacgtcttgcttatgcttgccggtgcggggctgctgtgg720
atgggatggtcaggtttcaatggtggggcaccatacgcggcaaacatcgacgcttccatg780
gcagtgttaaacacaaacatatgtgcggcgacgagtcttcttgtctggacgtctctggac840
gtcgtcttcttcgggaagccgtcggtgataggtgctgttcaagggatgatgaccggacta900
gtgtgcattactccaggagcaggtttggtacaatcgtgggcggctatagtgatggggatc960
ctttctggtagcattccatgggtgtcgatgatgatccttcacaaaaagtctactttgcta1020
caaaaggtggatgacactttaggcgtatttcacacgcacgcagtggctgggctattggga1080
gggcttctaactgggcttttcgcagagcccaagctttgcgaactcattctcccagaaagc1140
aacacaaggggtgcattctatggtggaaatggtgggaagcaattcctcaagcaactggtt1200
gcagccctgtttgtggctggttggaacttagtgtccacgaccctaattcttctggccata1260
aggttgttcatcccattaaggatgcctgatgaggaactggcaattggagacgacgctgtg1320
catggagaggaggcttatgctctttggggagatggagaaaaatatgaccctacaaagcat1380
ggttggaatacatcatcctacgcgcaggacattgcaccatctccatatgtcaatggtgcc1440
agaggtgtgaccatcaatttgtag1464
- 还没有人留言评论。精彩留言会获得点赞!