一种凤丹PoFBA基因、表达载体及其制备方法和应用与流程
本发明属于植物生物技术领域,具体涉及一种凤丹pofba基因、表达载体及其制备方法和应用。
背景技术:
干旱是影响植物生长发育的一个主要环境因素,它对植物的伤害主要表现为对植物细胞膜的通透性和细胞内外正常的渗透压平衡的破坏。凤丹(paeoniaostii)属于芍药科芍药属的多年生木本植物,具有较高的结实性,目前主要用于以提取籽油为目的而栽培的一种新型油料作物。凤丹虽为肉质根,但干旱仍会对其正常生长发育产生不利影响(zhao等,physiologicalandtranscriptomicanalysisoftreepeony(paeoniasectionmoutandc.)inresponsetodroughtstress,forests,2019,10:135)。
果糖-1,6-二磷酸醛缩酶(fructose-1,6-bisphosphatealdolase,fba)既存在于糖酵解和糖异生途径中,同时也存在于磷酸戊糖循环和卡尔文循环中,是调控光合作用速率的重要酶之一,对植物的非生物胁迫响应起着至关重要的调控作用。目前,花生(陈娜等,花生果糖-1,6-二磷酸醛缩酶基因ahfba1的克隆与表达,作物学报,2014,40(5):934-941)、油菜(谢小玉等,油菜fba基因克隆、表达分析及其与抗旱性的关系,生态学报,2020,40(16):5708-5717)、紫花苜蓿(龙瑞才等,紫花苜蓿果糖-1,6-二磷酸醛缩酶基因全长克隆及分析,西北植物学报,2010,30(6):1075-1082)、甘薯(苏在兴等,甘薯果糖-1,6-二磷酸醛缩酶5基因(ibfba5)的克隆与生物信息学分析,分子植物育种,2015,13(11):2469-2476)等多种植物的fba基因相继被克隆,并且研究不断深入。而凤丹的遗传背景比较薄弱,尚未见到关于凤丹fba基因的报道。对凤丹fba基因的深入研究不仅可以拓展凤丹分子生物学研究领域,而且对于制备耐旱转基因植物具有广泛的应用前景。
技术实现要素:
目的:为了克服现有技术中存在的不足,本发明提供一种凤丹pofba基因、表达载体及其制备方法和应用。
本发明的目的之一是提供一种凤丹果糖-1,6-二磷酸醛缩酶基因pofba基因,该基因的核苷酸序列如seqidno.1所示。
本发明的目的之二是提供上述凤丹pofba基因编码的蛋白质pofba,其氨基酸序列如seqidno.2所示。
本发明的目的之三是提供一种带有上述凤丹pofba基因的真核表达载体。进一步,由序列如seqidno.1所示的凤丹pofba基因与中间植物表达载体pcambia1301构成。
本发明的目的之四提供一种上述凤丹pofba基因、上述真核表达载体在制备耐旱转基因植物中的应用。
本发明的目的之五是提供一种含有上述凤丹pofba基因的耐旱转基因植物的制备方法,包括:
(1)真核表达载体的构建:合成凤丹pofba基因cdna全长序列,设计引物,pcr扩增目的片段,对目的片段及表达载体pcambia1301进行双酶切反应,再将目的片段与表达载体的酶切产物进行连接、转化,重组产物转化至大肠杆菌感受态细胞,经卡那霉素筛选获得成功重组的真核表达载体;
(2)农杆菌介导的转化:将构建成功的真核表达载体质粒转化至农杆菌,将阳性克隆接种至yeb液体培养基中培养到od600=0.3-0.4,离心后用乙酰丁香酮和ms0液体培养基重悬沉淀,再将烟草无菌苗叶片块浸泡在侵染培养基中,而后取出叶片接种在共培养的培养基中进行共培养,而后转入到抗性芽筛选分化培养基中,不断继代,直至分化出芽,将不定芽转接到生根筛选培养基进行生根筛选,直至获得完整植株;
(3)转基因株系的筛选:将获得的植株先后进行rt-pcr和qrt-pcr验证,最后获得含耐旱基因pofba的烟草植株。
为实现上述目的,本发明采用的技术方案:
本发明采用race技术克隆了凤丹耐旱基因果糖-1,6-二磷酸醛缩酶基因pofba,所述耐旱基因pofba具有seqidno.1所示的核苷酸序列,其中,序列表中的seqidno.1由1321个碱基组成。该凤丹果糖-1,6-二磷酸醛缩酶基因pofba能够编码pofba蛋白,此种蛋白具有seqidno.2所示的氨基酸序列,其中,序列表中的seqidno.2由357个氨基酸组成。
本发明中pofba基因编码的蛋白与番茄(np_001296956)、马铃薯(xp_006346102)、博落回(ova05112)、油橄榄(xp_022857619)等植物同源蛋白的同源性超过90%。
可用现有的植物双元表达载体pcambia1301构建含有pofba基因的重组表达载体。将携带有本发明基因pofba的植物表达载体转入农杆菌eha105细胞中,再通过叶盘法转化到植物组织中,被转化的宿主植物是烟草。进一步的,构建真核表达载体中设计的引物为seqidno.6和seqidno.7。
通过rt-pcr和qrt-pcr验证来筛选转化的烟草植株。进一步的,进行rt-pcr的上游引物为seqidno.8,下游引物为seqidno.9。进行qrt-pcr检测,以烟草actin为内参基因,设计引物为:上游引物ntactin-f:5'-tcctcatgcaattcttcg-3'(seqidno.10);下游引物ntactin-r:5'-acctgcccatctggtaac-3'(seqidno.11);设计pofba基因引物为:上游引物pofba-f:5'-cgtgtcgcccttctaata-3'(seqidno.12);下游引物pofba-r:5'-ctgctgccaaaataccct-3'(seqidno.13)。
本发明所提供的获得耐旱的转基因植物的方法,是将上述凤丹果糖-1,6-二磷酸醛缩酶基因pofba导入植物中,得到耐旱转基因植株。
凤丹果糖-1,6-二磷酸醛缩酶基因pofba的核苷酸序列(seqidno.1)
tagggcacgacggcagttgatctgactcaggatcactcgtgttacactgcaatcgcgtgtcgcccttctaatacgactcactatagggcaagcagtggtatcaacgcagagtacatgggggcattttcccccttgaccattgctttactacaaaaccatgtctgcctttataggaaagtatgcagatgaattaatcaagaatgccaagtacatagccacccctggaaagggtattttggcagcagatgagagcacaggcaccattggcaagcgtctagctagcattaacgtcgacaacatcgagtccaaccgtcaagcccttcgcgagctcctcttcaccaccccgaacgccctgccttacctctccggtgtcattcttttcgaggaaactctataccaaaaaaccaccgacggaaagccattcgtcgaactactccaggaaaacaatgtcgtcccggggatcaaagtcgacaagggcacggtcgatttggcgggcactaatggcgagaccaccacccaaggcctcgactcgctcggagctcgttgtgcacagtactacaaggccggagcgcgatttgccaagtggcgctcggtcctcaagatcggtcccactgaaccgtctgaattgtcaatccagcagaatgcgcagggattggctcgttacgccattatttgccaggaaaatgggcttgtacccattgttgagcctgagattttgactgatgggaaccatgatattaagagatgtgctgctgctactgaaatggtacttgcagcagtttataaggcactcaatgaacaacatgttcttcttgaaggaacactcttgaagcccaacatggttacaccaggatctgacagccccaaggtggcacctgaggtgattgctgaatacacagtaacagcattgcgccgaactgtaccaccagcagttccaggaattgtgtttttgtcagggggacaaagcgaggaagaggcaacgttgaatctaaacgccatgaataagcttgaggtgttgaagccatggacactttccttctcttttgggcgagctctgcagcagagcacactcaagttatggggtggaaagaaagaaaatgttggaaaagctcaagtgggattcttggcaaggtgcaaggctaattctgatgccactcttggcaagtataccggtggcagtgggggtgggttggctactgagagtttgtatgttaaggggtacaagtactaggcttcagatgtatggtgaagatgaatattgtcctgtggatgtcaaacttgtattgaatatgtatatccttctttgattaaaaaaaaaaaa
由凤丹果糖-1,6-二磷酸醛缩酶基因pofba的核苷酸序列推测得到的氨基酸序列(seqidno.2)
msafigkyadeliknakyiatpgkgilaadestgtigkrlasinvdniesnrqalrellfttpnalpylsgvilfeetlyqkttdgkpfvellqennvvpgikvdkgtvdlagtngetttqgldslgarcaqyykagarfakwrsvlkigptepselsiqqnaqglaryaiicqenglvpivepeiltdgnhdikrcaaatemvlaavykalneqhvllegtllkpnmvtpgsdspkvapeviaeytvtalrrtvppavpgivflsggqseeeatlnlnamnklevlkpwtlsfsfgralqqstlklwggkkenvgkaqvgflarckansdatlgkytggsggglateslyvkgyky。
附图说明
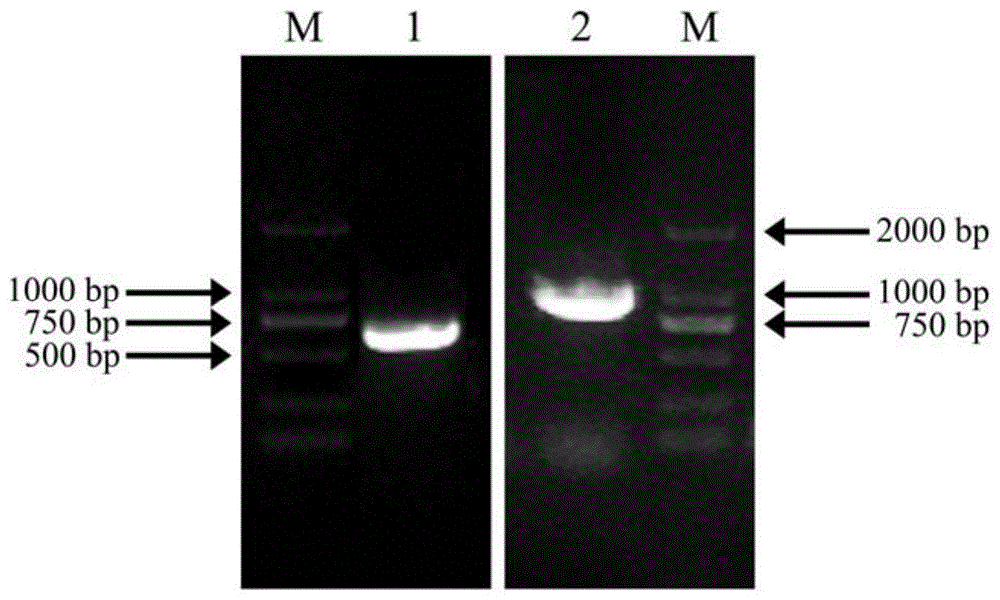
图1:凤丹果糖-1,6-二磷酸醛缩酶基因pofba的cdna全长race结果检测:其中,m:dl2000marker;1:3'-race扩增产物;2:5'-race扩增产物;
图2:凤丹与其他4种植物fba基因推测得到的氨基酸序列同源性比对分析:其中,黑色部分为所有物种同源性为100%的序列;
图3:基于rt-pcr检测的转凤丹果糖-1,6-二磷酸醛缩酶基因pofba烟草株系筛选;其中,m:dl2000marker;1-3:转基因烟草植株;4:野生型烟草;
图4:基于qrt-pcr检测的转凤丹果糖-1,6-二磷酸醛缩酶基因pofba烟草株系筛选;
图5:自然干旱胁迫后烟草植株的表型:其中,野生型烟草叶片萎蔫、下垂;转入凤丹果糖-1,6-二磷酸醛缩酶基因pofba的烟草保持正常生长状态;
图6:自然干旱胁迫后土壤含水量与叶片含水量测定;
图7:自然干旱胁迫后叶片相对电导率(rec)测定;
图8:自然干旱胁迫后叶片超氧阴离子(o2·-)积累水平观测;
图9:自然干旱胁迫后叶片过氧化氢(h2o2)积累水平观测。
具体实施方式
下面结合具体实施例和附图对本发明作进一步说明。
下面结合具体实施方式和说明书附图对本发明作进一步详细的描述。若无特别说明,本发明所述的实验方法,均为常规方法;所述的生物材料,均可从商业途径获得。
实施例1凤丹果糖-1,6-二磷酸醛缩酶基因pofba的cdna全长序列克隆
pofba基因3'端cdna序列的获得:选用干旱胁迫下凤丹叶片作为材料,采用minibestplantrnaextractionkit(takara)试剂盒提取总rna。采用3'fullracecoresetver.2.0(takara)反转录生产cdna的第一条链,反转录体系为:1μlrna、1μl3'-raceadaptor、1μldntpmixture(10mmeach)、2μl5×m-mlvbuffer、0.25μlrnaseinhibitor、0.25μlreversetranscriptasem-mlv(rnaseh-)、4.5μlrnasefreeddh2o;反转录程序:42℃反应60min,70℃延伸15min。在此基础之上,3'-race分别进行两轮pcr扩增。第一轮pcr扩增体系为:2μlcdna、8μl1×cdnadilutionbufferⅱ、2μl3'-raceouterprimer、2μlgenespecificouterprimer(10μm)(5'-aaaccaccgacggaaagc-3'(seqidno.3))、5μl10×lapcrbufferⅱ(mg+plus)、0.5μlladnapdymerase、30.5μlrnasefreeddh2o。反应条件为:94℃预变性3min;94℃变性30s,52℃退火30s,72℃延伸120s,循环20次;72℃延伸10min。第二轮pcr扩增体系为:1μl第一轮pcr扩增产物、8μldntpmixture(2.5mmeach)、2μl3'-raceinnerprimer(5'-aggcactcaatgaacaac-3'(seqidno.4))、2μlgenespecificinnerprimer、5μl10×lapcrbufferⅱ(mg+plus)、0.5μlladnapdymerase、31.5μlrnasefreeddh2o。反应条件为:94℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸120s,循环30次;72℃延伸10min。将产物进行1%琼脂糖凝胶电泳检测,结果见图1。
pofba基因5'端cdna序列的获得:采用smartertmracecdnaamplificationkitusermanual(clontech)反转录生产cdna的第一条链,反转录反应分为三步,首先进行体系一:1μlrna、1μl5'-racecdsptimera、9μldeionizedh2o。反应程序为:72℃反应3min后,42℃反应2min。然后进行体系二:11μl体系一的反应液、4μl5×frist-standbuffer、0.5μldithiothreitol(100mm)、1μldntpmixture(20mmeach)、0.5μlrnaseinhibitor、2μlsmartscribereversetranscriptase、1μlsmarteriiaoligonudeatide。反应程序为:42℃反应90min后,70℃反应10min。最后进行体系三:20μl体系二的反应液、50μltricine-edtabuffer。反应程序为:25℃条件下静置15min,稀释cdna。在此基础之上,5'-race进行pcr扩增,反应体系为:2.5μl5'cdna、25μl2×seqampbuffer、1μlseqampdnapolymerase、5μl10×upm、1μl5'genespecificprimer(5'-cccatcagtcaaaatctcaggctcaacaa-3'(seqidno.5))、15.5μlrnasefreeddh2o。反应条件为:94℃反应30s、72℃反应3min,循环5次;94℃反应30s、70℃反应30s、72℃反应3min,循环5次;94℃反应30s、68℃退火30s、72℃延伸3min,循环25次。将产物进行1%琼脂糖凝胶电泳检测,结果见图1。
实施例2凤丹与其他4种植物pofba基因推测得到的氨基酸序列同源性比对分析
将凤丹与其他4种植物pofba基因推测得到的氨基酸序列分别用fasta格式表示,保存为txt文件,再载入dnaman5.2.2软件中进行同源性比对,可以观察到它们最同源的氨基酸序列,结果见图2。
实施例3凤丹果糖-1,6-二磷酸醛缩酶基因pofba真核表达载体在烟草中的表达
凤丹pofba真核表达载体构建:将已获得的pofba基因全长序列送武汉思特进科技发展有限公司进行全基因合成,再进行pcr扩增,体系为:1μldntpmixture(25mmeach)、pofba-forwardprimer(5'-gagaacacgggggactggtacccggggatccatgtctgcctttataggaa-3'(seqidno.6))和pofba-reverseprimer(5'-acagctcctcgcccttgctcaccatgtcgacgtacttgtaccccttaac-3'(seqidno.7))各2μl、5μl10×pfubuffer、0.4μlpfu高温聚合酶(5u/μl)、40μlrnasefreeddh2o。扩增程序为:95℃预变性3min;94℃变性30s,55℃退火30s,72℃延伸90s,循环35次;72℃延伸6min。将目的片段切下,进行胶回收,检测无误后与载体进行连接。随后,对目的基因及表达载体pcambia1301进行双酶切反应。分别对载体pcambia1301和扩增片段pofba分别用bamhi和sali进行酶切。载体酶切体系为:10μl质粒(300μg/ml)、1μlbamhi(10u/μl)、1μlsali(10u/μl)、5μl10×buffer、33μlrnasefreeddh2o。扩增片段酶切体系为:43μlpcr产物、1μlbamhi(10u/μl)、1μlsali(10u/μl)、5μl10×buffer。以上体系放入37℃恒温水浴锅中反应3h。对酶切的产物进行胶回收,洗脱后备用。再将目的片段与表达载体进行连接、转化,连接体系为:6μl酶切目的片段(50ng)、8μl酶切载体(100ng)、2μl10×t4dnaligasebuffer、1μlt4dnaligase、3μlrnasefreeddh2o,然后16℃水浴2h即可。重组产物取10μl加入200μl预冷的dh5α感受态中,42℃热击90s,冰上静置2min,加入790μl无抗生素的lb液体培养基,37℃下100rpm培养1h,铺板后放入恒温培养箱,37℃倒置培养18h。挑取培养基上的单菌株放入3mllb液体培养基(50mg/lkan)中,37℃下200rpm过夜培养后进行菌液pcr验证。pcr验证体系:2.5μl10×pcrbufferⅱ(mg2+)、2μldntpmixture(2.5mmeach)、2μl质粒dna、1.25μlforwardprimer(5'-gactggtacccggggatccatgtctgcctttataggaa-3'(seqidno.8))、1.25μlreverseprimer(5'-cccttgctcaccatgtcgacgtacttgtaccccttaac-3'(seqidno.9))、0.25μllataqdna聚合酶(5u/μl)、15.75μlddh2o。反应程序:94℃预变性3min;94℃变性30s,52℃退火30s,72℃延伸1min,循环32次;72℃延伸10min。对pcr反应液进行电泳检测以验证扩增片断大小。最后提取质粒进行双酶切验证,体系为:1μlbamhi、1μlsali、10μl上一步提取的质粒dna、2μl10×kbuffer、6μlddh2o,37℃反应1.5h,直至凤丹pofba真核表达载体构建成功。
凤丹pofba真核表达载体转化烟草:将100ml的yeb固体培养基(kan50mg/l、rif50mg/l)分装至6个培养皿,用接种针蘸取农杆菌菌液,在培养基上分区划线,暗培养36-48h;挑选单菌落,放入yeb液体培养基(kan50mg/l、rif50mg/l)中,28℃下200rpm过夜培养后取2ml菌液加入50mlyeb液体培养基(kan50mg/l、rif50mg/l)中,28℃下200rpm培养到od600=0.3-0.4;摇好的菌液倒入50ml的离心管中,25℃下5,000rpm离心10min,倒掉上清液;小三角瓶灭菌后依次加入400μlas(20mg/ml)和5mlms0液体培养基(不用调ph,不要加入蔗糖、琼脂),用枪打匀菌体,倒入上述小三角瓶中,然后加ms0液体培养基至50ml;纱布灭菌,然后用橡皮筋绑紧覆盖在烧杯口;将50mlms0倒入另一个灭过菌的小三角瓶中备用;把烟草无菌苗叶片切成1cm×1cm小块,切100-150片,放入含有50mlms0的小三角瓶中,然后把叶片倒入烧杯中,再把过滤后的叶片放到含有菌液的小三瓶中,不断摇动,侵染8min;过滤菌液,取出叶片,用无菌滤纸吸干表面的菌液,接种在共培养的培养基[ms0+naa(0.1mg/l)+6-ba(3.0mg/l)+6.66%琼脂+蔗糖(30g/l)]中,暗培养3d左右;共培养结束以后,转入到抗性芽筛选分化培养基[ms0+naa(0.1mg/l)+6-ba(3.0mg/l)+蔗糖(30g/l)+6.66%琼脂+hyg(25mg/l)+cb(100mg/l)]中,大概两周继代一次,直至分化出芽;当分生不定芽长到2cm以上时,用刀切下不定芽,转接到生根筛选培养基[1/2ms+6.66%琼脂+蔗糖(30g/l)+cb(50mg/l)+iba(3.0mg/l)+hyg(8mg/l)]进行生根筛选。经过3个月的培养,可获得转pofba基因烟草。
转凤丹pofba基因烟草株系的筛选:
rt-pcr检测:采集烟草叶片为材料,参照minibestplantgenomicdnaextractionkit(takara)试剂盒提取dna,以提取的dna为模板,通过pcr进行序列分析扩增,pofba扩增的上游引物pofba-f:5'-gactggtacccggggatccatgtctgcctttataggaa-3'(seqidno.8),下游引物pofba-r:5'-cccttgctcaccatgtcgacgtacttgtaccccttaac-3'(seqidno.9);25μl反应体系:10×pcrbuffer(mg2+plus)2.5μl,上游引物、下游引物各1.25μl(10mm),dntpmixture(2.5mmeach)2.0μl,lataq®高保真酶0.25μl,dna模板2.0μl,ddh2o15.75μl;反应程序:94℃预变性5min,然后94℃变性30sec,55℃退火30sec,72℃延伸60sec,反应35个循环,72℃延伸10min;使用1%琼脂糖凝胶电泳检测。从图3中可以看出,转pofba烟草植株能够扩增出1条清晰明亮的条带,而野生型烟草的带条暗弱。
qrt-pcr检测:采集烟草叶片为材料,参照rnaisoplus(totalrna提取)试剂盒(takara)说明书方法提取总rna,按照primerscripttmrtreagentkitwithgdnaeraser试剂盒(takara)取1.0μg总rna反转录成cdna。将反转录所得的cdna按照transstart®tipgreenqpcrsupermix试剂盒(trans)进行qrt-pcr检测,以烟草actin为内参基因,设计引物为:上游引物ntactin-f:5'-tcctcatgcaattcttcg-3'(seqidno.10);下游引物ntactin-r:5'-acctgcccatctggtaac-3'(seqidno.11);设计pofba基因引物为:上游引物pofba-f:5'-cgtgtcgcccttctaata-3'(seqidno.12);下游引物pofba-r:5'-ctgctgccaaaataccct-3'(seqidno.13);25μl反应体系:2×transstart®tipgreenqpcr12.5μl,cdna模板2.0μl,上游引物、下游引物各1.0μl(10mm),ddh2o8.5μl;反应程序:94℃预变性30sec,然后94℃变性5sec,52.2℃退火30sec,72℃延伸30sec,反应45个循环,溶解曲线65℃-95℃,每5sec升温0.5℃;采用公式2-△△ct法计算基因的相对表达量。从图4可以看出,pofba在野生型烟草植株中的表达水平与转pofba烟草植株存在显著差异。
实施例4转凤丹果糖-1,6-二磷酸醛缩酶基因pofba烟草植株的耐干旱能力鉴定
干旱胁迫下烟草植株的表型:将烟草植株置于22℃、10h光照条件下进行自然干旱胁迫,32天后可以观察到野生型烟草叶片出现萎蔫、下垂等干旱伤害症状,而转凤丹pofba基因烟草并未出现上述的干旱伤害症状,仍然保持正常的生长状态,表明转pofba基因烟草具有较强的耐干旱能力,结果见图5。
干旱胁迫下烟草植株的相关胁迫生理指标测定:(1)土壤含水量:取适量盆土称重并记为鲜重(fw),而后将其在烘箱(9423a,上海精宏实验设备有限公司)中105℃处理5min,再在65℃处理2h以上,将烘干恒重的样品称量并记为干重(dw),并按下列公式计算叶片相对含水量:土壤含水量(%)=(fw-dw)/fw×100%。(2)叶片含水量:取适量新鲜叶片称重并记为鲜重(fw),而后将其在烘箱(9423a,上海精宏实验设备有限公司)中105℃处理5min,再在65℃处理2h以上,将烘干恒重的样品称量并记为干重(dw),并按下列公式计算叶片相对含水量:叶片相对含水量(%)=(fw-dw)/fw×100%。(3)相对电导率(rec):称取0.1g用直径1cm打孔器获得的叶片圆片,放入含有适量去离子水的注射器中,堵住注射器前端抽真空直至叶片沉入水下。然后一起倒入玻璃试管中,加去离子水至总体积达为20ml。室温静置4h,摇匀后用电导率仪(dds-307a,上海雷磁仪器有限公司)测定溶液电导率c1。接下来将试管封口,沸水浴30min,等温度冷却至室温后测定此时溶液电导率为c2。每个处理按下列公式计算叶片rec:rec(%)=c1/c2×100%。(4)超氧阴离子(o2·-)积累水平:采用荧光探针法观察o2·-积累量,具体操作参照活体细胞氧化应激ros原位染色试剂盒(上海哈灵公司)说明书并稍作修改,具体步骤如下:①滴100μl清理液于载玻片上,捏紧2片不锈钢双面剃须刀片快速切割滤纸上的新鲜叶片,避开主叶脉;②用细头毛笔沾取切好的样品放于载玻片清理液中,并调整好位置;③叶片样品全部放好后将载玻片上清理液尽量吸取干净,然后加入10μl荧光染色剂二氢溴化乙啶(dhe),37℃孵育20min;④在荧光显微镜(axioimagerd2,zeiss,德国)下观察并且拍照。(5)过氧化氢(h2o2)积累水平:采用二氨基联苯胺(dab)染色法观察h2o2的积累量。使用50mm的tris-acetate缓冲液来配制浓度为0.1mg/ml、ph为5.0的dab染色液。用染色液在黑暗中充分浸泡叶片24h后,取出叶片放入95%(v/v)酒精中进行沸水浴,在15min后进行拍照。从图6-9可以看出,与野生型烟草相比,转pofba基因烟草植株具有显著较高的叶片含水量、较低的相对电导率、o2·-和h2o2积累水平,而两者之间的土壤含水量差异不显著,表明转pofba基因烟草植株在干旱胁迫下受到的伤害少,具有较强的耐旱能力。
综上所述,本发明获得了1个凤丹果糖-1,6-二磷酸醛缩酶基因pofba的cdna全长序列,并通过将构建的pofba基因真核表达载体转化到烟草中进行表达,制备了耐旱转基因烟草。
以上所述的仅是本发明的优选实施方式,但并非是对本发明的实施方式的限定。本领域普通技术人员应该理解的是,在不脱离本发明创造构思的前提下,以本发明为基础做出的任何修改、等同替换和改进等,都属于本发明的要求保护范围之列。
序列表
<110>扬州大学
<120>一种凤丹pofba基因、表达载体及其制备方法和应用
<160>13
<170>siposequencelisting1.0
<210>1
<211>1321
<212>dna
<213>人工序列(artificialsequence)
<400>1
tagggcacgacggcagttgatctgactcaggatcactcgtgttacactgcaatcgcgtgt60
cgcccttctaatacgactcactatagggcaagcagtggtatcaacgcagagtacatgggg120
gcattttcccccttgaccattgctttactacaaaaccatgtctgcctttataggaaagta180
tgcagatgaattaatcaagaatgccaagtacatagccacccctggaaagggtattttggc240
agcagatgagagcacaggcaccattggcaagcgtctagctagcattaacgtcgacaacat300
cgagtccaaccgtcaagcccttcgcgagctcctcttcaccaccccgaacgccctgcctta360
cctctccggtgtcattcttttcgaggaaactctataccaaaaaaccaccgacggaaagcc420
attcgtcgaactactccaggaaaacaatgtcgtcccggggatcaaagtcgacaagggcac480
ggtcgatttggcgggcactaatggcgagaccaccacccaaggcctcgactcgctcggagc540
tcgttgtgcacagtactacaaggccggagcgcgatttgccaagtggcgctcggtcctcaa600
gatcggtcccactgaaccgtctgaattgtcaatccagcagaatgcgcagggattggctcg660
ttacgccattatttgccaggaaaatgggcttgtacccattgttgagcctgagattttgac720
tgatgggaaccatgatattaagagatgtgctgctgctactgaaatggtacttgcagcagt780
ttataaggcactcaatgaacaacatgttcttcttgaaggaacactcttgaagcccaacat840
ggttacaccaggatctgacagccccaaggtggcacctgaggtgattgctgaatacacagt900
aacagcattgcgccgaactgtaccaccagcagttccaggaattgtgtttttgtcaggggg960
acaaagcgaggaagaggcaacgttgaatctaaacgccatgaataagcttgaggtgttgaa1020
gccatggacactttccttctcttttgggcgagctctgcagcagagcacactcaagttatg1080
gggtggaaagaaagaaaatgttggaaaagctcaagtgggattcttggcaaggtgcaaggc1140
taattctgatgccactcttggcaagtataccggtggcagtgggggtgggttggctactga1200
gagtttgtatgttaaggggtacaagtactaggcttcagatgtatggtgaagatgaatatt1260
gtcctgtggatgtcaaacttgtattgaatatgtatatccttctttgattaaaaaaaaaaa1320
a1321
<210>2
<211>357
<212>prt
<213>人工序列(artificialsequence)
<400>2
metseralapheileglylystyralaaspgluleuilelysasnala
151015
lystyrilealathrproglylysglyileleualaalaaspgluser
202530
thrglythrileglylysargleualaserileasnvalaspasnile
354045
gluserasnargglnalaleuarggluleuleuphethrthrproasn
505560
alaleuprotyrleuserglyvalileleupheglugluthrleutyr
65707580
glnlysthrthraspglylysprophevalgluleuleuglngluasn
859095
asnvalvalproglyilelysvalasplysglythrvalaspleuala
100105110
glythrasnglygluthrthrthrglnglyleuaspserleuglyala
115120125
argcysalaglntyrtyrlysalaglyalaargphealalystrparg
130135140
servalleulysileglyprothrgluprosergluleuserilegln
145150155160
glnasnalaglnglyleualaargtyralaileilecysglngluasn
165170175
glyleuvalproilevalgluprogluileleuthraspglyasnhis
180185190
aspilelysargcysalaalaalathrglumetvalleualaalaval
195200205
tyrlysalaleuasngluglnhisvalleuleugluglythrleuleu
210215220
lysproasnmetvalthrproglyseraspserprolysvalalapro
225230235240
gluvalilealaglutyrthrvalthralaleuargargthrvalpro
245250255
proalavalproglyilevalpheleuserglyglyglnsergluglu
260265270
glualathrleuasnleuasnalametasnlysleugluvalleulys
275280285
protrpthrleuserpheserpheglyargalaleuglnglnserthr
290295300
leulysleutrpglyglylyslysgluasnvalglylysalaglnval
305310315320
glypheleualaargcyslysalaasnseraspalathrleuglylys
325330335
tyrthrglyglyserglyglyglyleualathrgluserleutyrval
340345350
lysglytyrlystyr
355
<210>3
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>3
aaaccaccgacggaaagc18
<210>4
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>4
aggcactcaatgaacaac18
<210>5
<211>29
<212>dna
<213>人工序列(artificialsequence)
<400>5
cccatcagtcaaaatctcaggctcaacaa29
<210>6
<211>50
<212>dna
<213>人工序列(artificialsequence)
<400>6
gagaacacgggggactggtacccggggatccatgtctgcctttataggaa50
<210>7
<211>49
<212>dna
<213>人工序列(artificialsequence)
<400>7
acagctcctcgcccttgctcaccatgtcgacgtacttgtaccccttaac49
<210>8
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>8
gactggtacccggggatccatgtctgcctttataggaa38
<210>9
<211>38
<212>dna
<213>人工序列(artificialsequence)
<400>9
cccttgctcaccatgtcgacgtacttgtaccccttaac38
<210>10
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>10
tcctcatgcaattcttcg18
<210>11
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>11
acctgcccatctggtaac18
<210>12
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>12
cgtgtcgcccttctaata18
<210>13
<211>18
<212>dna
<213>人工序列(artificialsequence)
<400>13
ctgctgccaaaataccct18
- 还没有人留言评论。精彩留言会获得点赞!