用于光电器件的有机分子的制作方法
1.发明涉及有机分子以及有机分子在有机发光二极管(oled)中和在其它光电器件中的应用。
背景技术:
技术实现要素:
2.本发明的目的在于提供适用于在光电器件中使用的有机分子。
3.该目的通过提供了一种新型的有机分子的发明来实现。
4.根据发明,有机分子是纯有机分子,即,与已知用于光电器件中的金属配合物相比,有机分子不包含任何金属离子。然而,发明的有机分子包括准金属(具体地,b、si、sn、se和/或ge)。
5.根据本发明,有机分子在蓝色光谱范围、天蓝色光谱范围或绿色光谱范围内表现出发射最大值。具体地,有机分子在420nm与520nm之间(优选地在440nm与495nm之间,更优选地在450nm与470nm之间)表现出发射最大值。具体地,根据发明的有机分子的光致发光量子产率是50%或更大。在光电器件(例如,有机发光二极管(oled))中使用根据发明的有机分子导致光电器件的较高的效率或较高的色纯度(其由发射的半峰全宽(fwhm)表达)。对应的oled具有比具有已知的发射体材料和可比颜色的oled高的稳定性。
6.根据发明的有机分子包括式i的结构或由式i的结构组成,
[0007][0008][0009]
其中,
[0010]
两个基团t均是r1或两个基团v均是r1,而不是r1的基团t或基团v选自于由以下组成的组:氢;氘;c
1-c5烷基;以及ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu和ph组成的组中的一个或更多个取代基;
[0011]
其中,
[0012]
r1具有下面的式f的结构:
[0013][0014]
即,r1具有取代有两个基团r6的甲基和可选地取代有n个r6的一个苯基的结构,其中,n是在每次出现时选自于由0、1、2、3、4和5组成的组中的整数;
[0015]
式f中的虚线标记与式i中所示结构的结合位置;
[0016]
r6在每次出现时彼此独立地选自于由以下组成的组:氢;氘;以及c
1-c5烷基;
[0017]ri
、r
ii
、r
iii
、r
iv
、rv、r
vi
、r
vii
、r
viii
、r
ix
和r
x
彼此独立地选自于由以下组成的组:r1;氢;氘;n(r5)2;or5;sr5;si(r5)3;b(or5)2;oso2r5;cf3;cn;卤素;c
1-c
40
烷基,可选地取代有一个或更多个取代基r5,并且其中,一个或更多个不相邻的ch2基团可选地被r5c=cr5、c≡c、si(r5)2、ge(r5)2、sn(r5)2、c=o、c=s、c=se、c=nr5、p(=o)(r5)、so、so2、nr5、o、s或conr5取代;c
1-c
40
烷氧基,可选地取代有一个或更多个取代基r5,并且其中,一个或更多个不相邻的ch2基团可选地被r5c=cr5、c≡c、si(r5)2、ge(r5)2、sn(r5)2、c=o、c=s、c=se、c=nr5、p(=o)(r5)、so、so2、nr5、o、s或conr5取代;c
1-c
40
硫代烷氧基,可选地取代有一个或更多个取代基r5,并且其中,一个或更多个不相邻的ch2基团可选地被r5c=cr5、c≡c、si(r5)2、ge(r5)2、sn(r5)2、c=o、c=s、c=se、c=nr5、p(=o)(r5)、so、so2、nr5、o、s或conr5取代;c
2-c
40
烯基,可选地取代有一个或更多个取代基r5,并且其中,一个或更多个不相邻的ch2基团可选地被r5c=cr5、c≡c、si(r5)2、ge(r5)2、sn(r5)2、c=o、c=s、c=se、c=nr5、p(=o)(r5)、so、so2、nr5、o、s或conr5取代;c
2-c
40
炔基,可选地取代有一个或更多个取代基r5,并且其中,一个或更多个不相邻的ch2基团可选地被r5c=cr5、c≡c、si(r5)2、ge(r5)2、sn(r5)2、c=o、c=s、c=se、c=nr5、p(=o)(r5)、so、so2、nr5、o、s或conr5取代;c
6-c
60
芳基,可选地取代有一个或更多个取代基r5;以及c
3-c
57
杂芳基,可选地取代有一个或更多个取代基r5;
[0018]
r5在每次出现时彼此独立地选自于由以下组成的组:氢;氘;oph(ph=苯基);sph;cf3;cn;f;si(c
1-c5烷基)3;si(ph)3;c
1-c5烷基,其中,可选地一个或更多个氢原子彼此独立地被氘、cn、cf3或f取代;c
1-c5烷氧基,其中,可选地一个或更多个氢原子彼此独立地被氘、cn、cf3或f取代;c
1-c5硫代烷氧基,其中,可选地一个或更多个氢原子彼此独立地被氘、cn、cf3或f取代;c
2-c5烯基,其中,可选地一个或更多个氢原子彼此独立地被氘、cn、cf3或f取代;c
2-c5炔基,其中,可选地一个或更多个氢原子彼此独立地被氘、cn、cf3或f取代;c
6-c
18
芳基,可选地取代有一个或更多个c
1-c5烷基取代基;c
3-c
17
杂芳基,可选地取代有一个或更多个c
1-c5烷基取代基;n(c
6-c
18
芳基)2;n(c
3-c
17
杂芳基)2;以及n(c
3-c
17
杂芳基)(c
6-c
18
芳基)。
[0019]rxi
选自于由氢、氯和c
1-c5烷基组成的组。
[0020]
根据发明,两个基团t均是r1或两个基团v均是r1。式i中的所有变量t和v是r1是不可能的。
[0021]
换句话说,发明的有机分子包括选自于由式ia和式ib组成的组中的结构,或者由选自于由式ia和式ib组成的组中的结构组成:
[0022][0023]
其中,
[0024]v#
选自于由以下组成的组:氢;氘;c
1-c5烷基;以及ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu和ph组成的组中的一个或更多个取代基。
[0025][0026]
其中,
[0027]
t
#
选自于由以下组成的组:氢;氘;c
1-c5烷基;以及ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu和ph组成的组中的一个或更多个取代基。
[0028]
根据发明,r1经由通过式f中所示的虚线标记的位置结合,这意味着式ia相同地由以下结构表示:
[0029][0030]
并且式ib相同地由以下结构表示:
[0031][0032]
发明的有机分子具有至少两个具有式f的结构的基团,但是可以具有至多12个具有式f的结构的基团。有机分子的特定实施例具有两个或四个具有式f的结构的基团。
[0033]
在优选的实施例中,有机分子包括选自于由式ia和式ib组成的组中的结构,或者由选自于由式ia和式ib组成的组中的结构组成,其中,t
#
和v
#
选自于由以下组成的组:氢;氘;me;ipr;
t
bu;以及ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu和ph组成的组中的一个或更多个取代基。
[0034]
在优选的实施例中,t和v选自于由以下组成的组:r1;氢;氘;me;ipr;
t
bu;以及ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu和ph组成的组中的一个或更多个取代基。
[0035]
根据整数n的值,r1可以具有如下所示的结构:
[0036]
对于n=0:
[0037][0038]
对于n=1:
[0039][0040]
对于n=2:
[0041][0042]
对于n=3:
[0043][0044][0045]
对于n=4
[0046][0047]
对于n=5
[0048][0049]
其中,r6在每次出现时彼此独立地选自于由以下组成的组:氢;氘;以及c
1-c5烷基,其中,在特定实施例中,c
1-c5烷基可以是me、ipr、
t
bu或新戊基。
[0050]
在特定实施例中,r6在每次出现时彼此独立地选自于由以下组成的组:氢;氘;me;ipr;
t
bu;以及新戊基。
[0051]
在其它实施例中,r6在每次出现时彼此独立地选自于由以下组成的组:氢;以及me。
[0052]
在优选的实施例中,r1在每次出现时是由式r
1a
和式r
1b
组成的组:
[0053][0054]
r1的具体示例包括例如以下结构:
[0055]
[0056][0057]
在一个特别优选的实施例中,r1选自于由式r
1c
和式r
1d
组成的组:
[0058][0059]
在一个实施例中,r
xi
选自于氢、me、ipr和
t
bu的组。
[0060]
在一个实施例中,r
xi
选自于氢或me的组。
[0061]
在一个实施例中,r
xi
是氢。
[0062]
在一个实施例中,r
xi
是氯。
[0063]
在一个实施例中,r
xi
是me。
[0064]
在有机分子的一个实施例中,ri、r
ii
、r
iii
、r
iv
、rv、r
vi
、r
vii
、r
viii
、r
ix
和r
x
彼此独立地选自于由以下组成的组:r1;氢;氘;卤素;me;ipr;
t
bu;cn;cf3;sime3;siph3;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;吡啶基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;嘧啶基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;咔唑基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;三嗪基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0065]
在一个实施例中,ri、r
ii
、r
iii
、r
iv
、rv、r
vi
、r
vii
、r
viii
、r
ix
和r
x
彼此独立地选自于由以下组成的组:r1;氢;氘;卤素;me;ipr;
t
bu;cn;cf3;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;吡啶基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;嘧啶基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;咔唑基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;三嗪基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0066]
在一个实施例中,ri、r
ii
、r
iii
、r
iv
、rv、r
vi
、r
vii
、r
viii
、r
ix
和r
x
彼此独立地选自于由以下组成的组:r1;氢;氘;卤素;me;ipr;
t
bu;cn;cf3;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;吡啶基,可选地取代有彼此独
立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;嘧啶基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;三嗪基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0067]
在一个实施例中,ri、r
ii
、r
iii
、r
iv
、rv、r
vi
、r
vii
、r
viii
、r
ix
和r
x
彼此独立地选自于由以下组成的组:r1;氢;氘;me;ipr;
t
bu;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu和ph组成的组中的一个或更多个取代基;咔唑基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0068]
在一个实施例中,ri、r
ii
、r
iii
、r
iv
、rv、r
vi
、r
vii
、r
viii
、r
ix
和r
x
彼此独立地选自于由以下组成的组:r1;氢;氘;me;ipr;
t
bu;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0069]
在一个实施例中,ri、r
ii
、r
iii
、r
iv
、rv、r
vi
、r
vii
、r
viii
、r
ix
和r
x
彼此独立地选自于由以下组成的组:r1;氢;氘;me;ipr;
t
bu;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0070]
在一个实施例中,ri、r
ii
、r
iii
、r
iv
、rv、r
vi
、r
vii
、r
viii
、r
ix
和r
x
彼此独立地选自于由以下组成的组:r1;氢;
t
bu;以及ph。
[0071]
在发明的一个实施例中,r
x
=ri,r
ix
=r
ii
,r
viii
=r
iii
,r
vii
=r
iv
,并且rv=r
vi
,其产生了包括式ii的结构或由式ii的结构组成的有机分子:
[0072][0073]
在一个实施例中,有机分子包括式ii的结构或由式ii的结构组成,其中,ri、r
ii
、r
iii
、r
iv
和rv彼此独立地选自于由以下组成的组:r1;氢;氘;卤素;me;ipr;
t
bu;cn;cf3;sime3;siph3;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;吡啶基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;嘧啶基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;咔唑基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;三嗪基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0074]
在一个实施例中,有机分子包括式ii或由式ii组成,其中,ri、r
ii
、r
iii
、r
iv
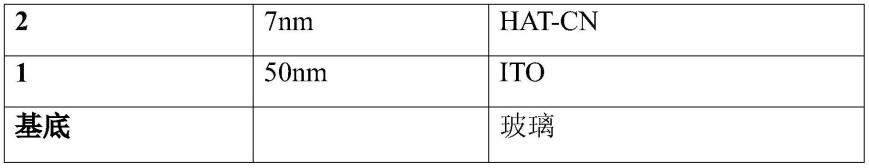
和rv彼此独立地选自于由以下组成的组:r1;氢;氘;卤素;me;ipr;
t
bu;cn;cf3;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;吡啶基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;
嘧啶基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;咔唑基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;三嗪基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0075]
在一个实施例中,有机分子包括式ii或由式ii组成,其中,ri、r
ii
、r
iii
、r
iv
和rv彼此独立地选自于由以下组成的组:r1;氢;氘;卤素;me;ipr;
t
bu;cn;cf3;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;吡啶基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;嘧啶基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;三嗪基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0076]
在一个实施例中,有机分子包括式ii或由式ii组成,其中,ri、r
ii
、r
iii
、r
iv
和rv彼此独立地选自于由以下组成的组:r1;氢;氘;me;ipr;
t
bu;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu和ph组成的组中的一个或更多个取代基;咔唑基,可选地取代有彼此独立地选自于由me、ipr、
t
bu、cn、cf3和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0077]
在一个实施例中,有机分子包括式ii或由式ii组成,其中,ri、r
ii
、r
iii
、r
iv
和rv彼此独立地选自于由以下组成的组:r1;氢;氘;me;ipr;
t
bu;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0078]
在一个实施例中,有机分子包括式ii或由式ii组成,其中,ri、r
ii
、r
iii
、r
iv
和rv彼此独立地选自于由以下组成的组:r1;氢;氘;me;ipr;
t
bu;ph,可选地取代有彼此独立地选自于由me、ipr、
t
bu和ph组成的组中的一个或更多个取代基;以及n(ph)2。
[0079]
在一个实施例中,有机分子包括式ii或由式ii组成,其中,ri、r
ii
、r
iii
、r
iv
和rv彼此独立地选自于由以下组成的组:r1;氢;
t
bu;以及ph。
[0080]
在一个实施例中,有机分子包括选自于由式ii-1和式ii-2组成的组中的结构,或者由选自于由式ii-1和式ii-2组成的组中的结构组成:
[0081][0082]
包括选自于由式ii-1和式ii-2组成的组中的结构或者由选自于由式ii-1和式ii-2组成的组中的结构组成的根据发明的有机分子的示例如下:
[0083]
[0084][0085]
在发明的特定实施例中,有机分子包括选自于由式iia、式iib、式iic和式iid组成的组中的结构,或者由选自于由式iia、式iib、式iic和式iid组成的组中的结构组成:
[0086][0087]
在下面示出了针对包括选自于由式iia、式iib、式iic和式iid组成的组中的结构或者由选自于由式iia、式iib、式iic和式iid组成的组中的结构组成的有机分子的示例:
[0088][0089]
在一个实施例中,有机分子包括选自于由式iiia和式iiib组成的组中的结构,或者由选自于由式iiia和式iiib组成的组中的结构组成:
[0090][0091]
在优选的实施例中,有机分子包括选自于由式iiia-1和式iiib-1组成的组中的结构,或者由选自于由式iiia-1和式iiib-1组成的组中的结构组成:
[0092][0093]
在一个实施例中,有机分子包括选自于由式iv-1和式iv-2组成的组中的结构,或者由选自于由式iv-1和式iv-2组成的组中的结构组成:
[0094]
[0095][0096]
在一个实施例中,有机分子包括选自于由式iva和式ivb组成的组中的结构,或者由选自于由式iva和式ivb组成的组中的结构组成:
[0097][0098]
在一个实施例中,有机分子包括选自于由式iv-3和式iv-4组成的组中的结构,或者由选自于由式iv-3和式iv-4组成的组中的结构组成:
[0099][0100]
在一个实施例中,有机分子包括选自于由式ivc和式ivd组成的组中的结构,或者由选自于由式ivc和式ivd组成的组中的结构组成:
[0101]
[0102]
具体实施方式
[0103]
如在整个本技术中所使用的,术语“芳基”和“芳香族”可以在最广泛的意义上被理解为任何单环、双环或多环芳香族部分。因此,芳基包含6个至60个芳香环原子,杂芳基包含其至少一个是杂原子的5个至60个芳香环原子。尽管如此,在整个申请中,芳香环原子的数量可以在某些取代基的定义中作为下标数字给出。具体地,杂芳香环包括一个至三个杂原子。同样,术语“杂芳基”和“杂芳香族”可以在最广泛的意义上被理解为包括至少一个杂原子的任何单环、双环或多环杂芳香族部分。杂原子在每次出现时可以相同或不同,并且可以单独地选自于由n、o和s组成的组。因此,术语“亚芳基”指具有与其它分子结构的两个结合点且因此用作连接基结构的二价取代基。在示例性实施例中的基团被定义为与这里所给出的定义不同(例如,芳香环原子的数量或杂原子的数量与给定的定义不同)的情况下,将应用示例性实施例中的定义。根据发明,缩合(环化)芳香多环或杂芳香多环由经由缩合反应形成多环的两个或更多个单芳香环或杂芳香环构成。
[0104]
具体地,如通篇所使用的,术语“芳基或杂芳基”包括可以经由芳香族基团或杂香芳族基团的任何位置结合的基团,该基团衍生自苯、萘、蒽、菲、芘、二氢芘、苝、荧蒽、苯并蒽、苯并菲、并四苯、并五苯、苯并芘、呋喃、苯并呋喃、异苯并呋喃、二苯并呋喃、噻吩、苯并噻吩、异苯并噻吩、二苯并噻吩、吡咯、吲哚、异吲哚、咔唑、吡啶、喹啉、异喹啉、吖啶、菲啶、苯并-5,6-喹啉、苯并-6,7-喹啉、苯并-7,8-喹啉、吩噻嗪、吩噁嗪、吡唑、吲唑、咪唑、苯并咪唑、萘并咪唑、菲并咪唑、吡啶并咪唑、吡嗪并咪唑、喹喔啉并咪唑、噁唑、苯并噁唑、萘并噁唑、蒽并噁唑、菲并噁唑、异噁唑、1,2-噻唑、1,3-噻唑、苯并噻唑、哒嗪、苯并哒嗪、嘧啶、苯并嘧啶、1,3,5-三嗪、喹喔啉、吡嗪、吩嗪、萘啶、咔啉、苯并咔啉、菲咯啉、1,2,3-三唑、1,2,4-三唑、苯并三唑、1,2,3-噁二唑、1,2,4-噁二唑、1,2,5-噁二唑、1,2,3,4-四嗪、嘌呤、蝶啶、中氮茚和苯并噻二唑或者上述基团的组合。
[0105]
如通篇所使用的,术语“环基团”可以在最广泛的意义上被理解为任何单环部分、双环部分或多环部分。
[0106]
如通篇所使用的,作为取代基的术语“联苯”可以在最广泛的意义上被理解为邻联苯、间联苯或对联苯,其中,邻、间和对是关于与另一化学部分的结合位所定义的。
[0107]
如通篇所使用的,术语“烷基”可以在最广泛的意义上被理解为任何直链、支链或
环状的烷基取代基。具体地,术语烷基包括这样的取代基:甲基(me)、乙基(et)、正丙基(npr)、异丙基(ipr)、环丙基、正丁基(nbu)、异丁基(ibu)、仲丁基(sbu)、叔丁基(
t
bu)、环丁基、2-甲基丁基、正戊基、仲戊基、叔戊基、2-戊基、新戊基、环戊基、正己基、仲己基、叔己基、2-己基、3-己基、新己基、环己基、1-甲基环戊基、2-甲基戊基、正庚基、2-庚基、3-庚基、4-庚基、环庚基、1-甲基环己基、正辛基、2-乙基己基、环辛基、1-双环[2,2,2]辛基、2-双环[2,2,2]辛基、2-(2,6-二甲基)辛基、3-(3,7-二甲基)辛基、金刚烷基、2,2,2-三氟乙基、1,1-二甲基-正己-1-基、1,1-二甲基-正庚-1-基、1,1-二甲基-正辛-1-基、1,1-二甲基-正癸-1-基、1,1-二甲基-正十二烷-1-基、1,1-二甲基-正十四烷-1-基、1,1-二甲基-正十六烷-1-基、1,1-二甲基-正十八烷-1-基、1,1-二乙基-正己-1-基、1,1-二乙基-正庚-1-基、1,1-二乙基-正辛-1-基、1,1-二乙基-正癸-1-基、1,1-二乙基-正十二烷-1-基、1,1-二乙基-正十四烷-1-基、1,1-二乙基-正十六烷-1-基、1,1-二乙基-正十八烷-1-基、1-(正丙基)-环己-1-基、1-(正丁基)-环己-1-基、1-(正己基)-环己-1-基、1-(正辛基)-环己-1-基和1-(正癸基)-环己-1-基。
[0108]
如通篇所使用的,术语“烯基”包括直链、支链和环状的烯基取代基。术语“烯基”例如包括这样的取代基:乙烯基、丙烯基、丁烯基、戊烯基、环戊烯基、己烯基、环己烯基、庚烯基、环庚烯基、辛烯基、环辛烯基或环辛二烯基。
[0109]
如通篇所使用的,术语“炔基”包括直链、支链和环状的炔基取代基。术语“炔基”例如包括乙炔基、丙炔基、丁炔基、戊炔基、己炔基、庚炔基或辛炔基。
[0110]
如通篇所使用的,术语“烷氧基”包括直链、支链和环状的烷氧基取代基。术语“烷氧基”示例性地包括甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、仲丁氧基、叔丁氧基和2-甲基丁氧基。
[0111]
如通篇所使用的,术语“硫代烷氧基”包括其中示例性地烷氧基的o被s代替的直链、支链和环状的硫代烷氧基取代基。
[0112]
如通篇所使用的,术语“卤素”和“卤代”可以在最广泛的意义上被理解为优选地氟、氯、溴或碘。
[0113]
每当在此提到氢(h)时,氢(h)也可以在每次出现时被氘代替。
[0114]
将理解的是,当分子片段被描述为取代基或以其它方式附着到另一部分时,其名称可以被写成好像它是一个片段(例如,萘基、二苯并呋喃基)或好像它是整个分子(例如,萘、二苯并呋喃)。如在此所使用的,指定取代基或附着片段的这些不同方式被认为是等效的。
[0115]
在一个实施例中,根据发明的有机分子在室温下在具有2重量%的有机分子的聚(甲基丙烯酸甲酯)(pmma)的膜中具有不超过150μs、不超过100μs、具体地不超过50μs、更优选地不超过10μs或者不超过7μs的激发态寿命。
[0116]
在发明的又一实施例中,根据发明的有机分子在室温下在具有2重量%的有机分子的聚(甲基丙烯酸甲酯)(pmma)的膜中具有在可见光或最接近紫外光范围内(即,在380nm至800nm的波长范围内)的发射峰且小于0.23ev(优选地小于0.20ev,更优选地小于0.19ev,甚至更优选地小于0.18ev或者甚至小于0.17ev)的半峰全宽。
[0117]
轨道和激发态能量也可以通过实验方法的方式确定。最高占据分子轨道能量(e
homo
)通过本领域技术人员已知的方法经由具有0.1ev的精度的循环伏安法测量确定。最
低未占分子轨道能量(e
lumo
)被计算为e
homo
+e
gap
,其中,e
gap
如下确定:对于主体化合物,除非另有说明,否则在聚(甲基丙烯酸甲酯)(pmma)中具有10重量%的主体的膜的发射光谱的起始点被用作e
gap
。对于发射体分子,e
gap
被确定为在pmma中具有10重量%的发射体的膜的激发光谱和发射光谱交叉所处的能量。对于根据发明的有机分子,e
gap
被确定为在pmma中具有2重量%的有机分子的膜的激发光谱和发射光谱交叉所处的能量。
[0118]
第一激发三重态(t1)的能量是通过低温下(通常地,77k下)的发射光谱的起始点确定的。对于其中第一激发单重态和最低三重态在能量上相差》0.4ev的主体化合物,在2-me-thf中在稳态光谱中磷光通常是可见的。因此,三重态能量可以被确定为磷光光谱的起始点。对于tadf发射体分子,如果没有另外说明,则第一激发三重态(t1)的能量是通过77k下的延迟发射光谱的起始点确定的,该延迟发射光谱是在具有10重量%的发射体且在根据发明的有机分子的情况下具有2重量%的根据发明的有机分子的pmma的膜中所测量的。对于主体和发射体化合物两者,如果没有另外说明,则第一激发单重态(s1)的能量是通过发射光谱的起始点确定的,该发射光谱是在具有10重量%的主体或发射体化合物且在根据发明的有机分子的情况下具有2重量%的根据发明的有机分子的pmma的膜中所测量的。
[0119]
发射光谱的起始点是通过计算发射光谱的切线与x轴的交点所确定的。发射光谱的切线被设定在发射带的高能侧处且在发射光谱的最大强度的半高度(half maximum)的点处。
[0120]
在一个实施例中,根据发明的有机分子在室温下在具有2重量%的有机分子的聚(甲基丙烯酸甲酯)(pmma)的膜中具有发射光谱的在能量上接近发射最大值的起始点,即,发射光谱的起始点与发射最大值的能量之间的能量差低于0.14ev(优选地低于0.13ev,或者甚至低于0.12ev),同时有机分子的半峰全宽(fwhm)小于0.23ev(优选地小于0.20ev,更优选地小于0.19ev,甚至更优选地小于0.18ev或者甚至小于0.17ev),使得ciey坐标低于0.20(优选地低于0.18,更优选地低于0.16,或者甚至更优选地低于0.14)。
[0121]
发明的又一方面涉及发明的有机分子在光电器件中作为发光发射体或作为吸收体以及/或者作为主体材料和/或作为电子传输材料和/或作为空穴注入材料和/或作为空穴阻挡材料的应用。
[0122]
优选的实施例涉及根据发明的有机分子在光电器件中作为发光发射体的应用。
[0123]
光电器件可以在最广泛的意义上被理解为基于有机材料的任何器件,该有机材料适用于发射可见光或最接近紫外光(uv)范围内(即,380nm至800nm的波长范围内)的光。更优选地,光电器件可以能够发射可见光范围(即,400nm至800nm)内的光。
[0124]
在这种应用的背景下,光电器件更具体地选自于由以下组成的组:
[0125]
·
有机发光二极管(oled);
[0126]
·
发光电化学电池;
[0127]
·
oled传感器,尤其是未与周围环境密封地隔离的气体和蒸汽传感器;
[0128]
·
有机二极管;
[0129]
·
有机太阳能电池;
[0130]
·
有机晶体管;
[0131]
·
有机场效应晶体管;
[0132]
·
有机激光器;以及
[0133]
·
下变频元件。
[0134]
在这种应用的背景下的优选的实施例中,光电器件是选自于由有机发光二极管(oled)、发光电化学电池(lec)和发光晶体管组成的组中的器件。
[0135]
在该应用的情况下,光电器件中(更具体地,oled中)的发射层中的根据发明的有机分子的分数是0.1重量%至99重量%(更具体地,1重量%至80重量%)。在替代实施例中,发射层中的有机分子的比例是100重量%。
[0136]
在一个实施例中,发光层(或称为“发射层”)不仅包括根据发明的有机分子,而且包括其三重态(t1)能级和单重态(s1)能级在能量上比有机分子的三重态(t1)能级和单重态(s1)能级高的主体材料。
[0137]
发明的又一方面涉及一种组合物,该组合物包括以下成分或由以下成分组成:
[0138]
(a)至少一种根据发明的有机分子,具体地呈发射体和/或主体的形式;和
[0139]
(b)与根据发明的有机分子不同的一种或更多种发射体和/或主体材料;以及
[0140]
(c)可选地,一种或更多种染料以及/或者一种或更多种溶剂。
[0141]
在一个实施例中,发光层包括组合物(或基本上由组合物组成),该组合物包括以下成分或由以下成分组成:
[0142]
(a)至少一种根据发明的有机分子,具体地呈发射体和/或主体的形式;和
[0143]
(b)与根据发明的有机分子不同的一种或更多种发射体和/或主体材料;以及
[0144]
(c)可选地,一种或更多种染料以及/或者一种或更多种溶剂。
[0145]
在具体的实施例中,发光层(eml)包括组合物(或基本上由组合物组成),该组合物包括以下成分或由以下成分组成:
[0146]
(i)0.1重量%至10重量%(优选地,0.5重量%至5重量%,具体地1重量%至3重量%)的一种或更多种根据发明的有机分子(e);
[0147]
(ii)5重量%至99重量%(优选地,15重量%至85重量%,具体地20重量%至75重量%)的至少一种主体化合物(h);以及
[0148]
(iii)0.9重量%至94.9重量%(优选地,14.5重量%至80重量%,具体地24重量%至77重量%)的至少一种另一主体化合物(d),该另一主体化合物(d)具有与根据发明的有机分子的结构不同的结构;以及
[0149]
(iv)可选地,0重量%至94重量%(优选地,0重量%至65重量%,具体地0重量%至50重量%)的溶剂;以及
[0150]
(v)可选地,0重量%至30重量%(具体地,0重量%至20重量%,优选地0重量%至5重量%)的至少一种另一发射体分子(f),该另一发射体分子(f)具有与根据发明的有机分子的结构不同的结构。
[0151]
优选地,能量可以从主体化合物(h)转移到一种或更多种根据发明的有机分子,具体地,能量可以从主体化合物(h)的第一激发三重态(t1(h))转移到一种或更多种根据发明的有机分子(e)的第一激发三重态(t1(e)),以及/或者从主体化合物(h)的第一激发单重态(s1(h))转移到一种或更多种根据发明的有机分子(e)的第一激发单重态(s1(e))。
[0152]
在一个实施例中,主体化合物(h)具有具备在-5ev至-6.5ev的范围内的能量(e
homo
(h))的最高占据分子轨道(homo(h)),至少一种另一主体化合物(d)具有具备能量(e
homo
(d))的最高占据分子轨道(homo(d)),其中,e
homo
(h)》e
homo
(d)。
[0153]
在又一实施例中,主体化合物(h)具有具备能量(e
lumo
(h))的最低未占分子轨道(lumo(h)),至少一种另一主体化合物(d)具有具备能量(e
lumo
(d))的最低未占分子轨道(lumo(d)),其中,e
lumo
(h)》e
lumo
(d)。
[0154]
在一个实施例中,主体化合物(h)具有具备能量(e
homo
(h))的最高占据分子轨道(homo(h))和具备能量(e
lumo
(h))的最低未占分子轨道(lumo(h)),并且
[0155]
至少一种另一主体化合物(d)具有具备能量(e
homo
(d))的最高占据分子轨道(homo(d))和具备能量(e
lumo
(d))的最低未占分子轨道(lumo(d)),
[0156]
根据发明的有机分子(e)具有具备能量(e
homo
(e))的最高占据分子轨道(homo(e))和具备能量(e
lumo
(e))的最低未占分子轨道(lumo(e)),
[0157]
其中,
[0158]ehomo
(h)》e
homo
(d),并且根据发明的有机分子(e)的最高占据分子轨道(homo(e))的能级(e
homo
(e))与主体化合物(h)的最高占据分子轨道(homo(h))的能级(e
homo
(h))之间的差在-0.5ev与0.5ev之间(更优选地在-0.3ev与0.3ev之间,甚至更优选地在-0.2ev与0.2ev之间,或者甚至在-0.1ev与0.1ev之间);以及
[0159]elumo
(h)》e
lumo
(d),并且根据发明的有机分子(e)的最低未占分子轨道(lumo(e))的能级(e
lumo
(e))与至少一种另一主体化合物d的最低未占分子轨道(lumo(d))的能级(e
lumo
(d))之间的差在-0.5ev与0.5ev之间(更优选地在-0.3ev与0.3ev之间,甚至更优选地在-0.2ev与0.2ev之间,或者甚至在-0.1ev与0.1ev之间)。
[0160]
在发明的一个实施例中,主体化合物(d)和/或主体化合物(h)是热激活延迟荧光(tadf)材料。tadf材料表现出同小于2500cm-1
的第一激发单重态(s1)与第一激发三重态(t1)之间的能量差对应的δe
st
值。优选地,tadf材料表现出小于3000cm-1
、更优选地小于1500cm-1
、甚至更优选地小于1000cm-1
或者甚至小于500cm-1
的δe
st
值。
[0161]
在一个实施例中,主体化合物(d)是tadf材料,主体化合物(h)表现出大于2500cm-1
的δe
st
值。在具体的实施例中,主体化合物(d)是tadf材料,主体化合物(h)选自于由cbp、mcp、mcbp、9-[3-(二苯并呋喃-2-基)苯基]-9h-咔唑、9-[3-(二苯并噻吩-2-基)苯基]-9h-咔唑、9-[3,5-双(2-二苯并呋喃基)苯基]-9h-咔唑和9-[3,5-双(2-二苯并噻吩基)苯基]-9h-咔唑组成的组。
[0162]
在一个实施例中,主体化合物(h)是tadf材料,主体化合物(d)表现出大于2500cm-1
的δe
st
值。在具体的实施例中,主体化合物(h)是tadf材料,主体化合物(d)选自于由t2t(2,4,6-三(联苯-3-基)-1,3,5-三嗪)、t3t(2,4,6-三(三联苯-3-基)-1,3,5-三嗪)和/或tst(2,4,6-三(9,9'-螺二芴-2-基)-1,3,5-三嗪)组成的组。
[0163]
在又一方面,发明涉及一种光电器件,光电器件包括这里所描述的有机分子或这里所描述类型的组合物,光电器件更具体地呈选自于由有机发光二极管(oled)、发光电化学电池、oled传感器(更具体地,未密封外部地隔离的气体和蒸汽传感器)、有机二极管、有机太阳能电池、有机晶体管、有机场效应晶体管、有机激光器和下变频元件组成的组中的器件的形式。
[0164]
在优选的实施例中,光电器件是选自于由有机发光二极管(oled)、发光电化学电池(lec)和发光晶体管组成的组中的器件。
[0165]
在发明的光电器件的一个实施例中,根据发明的有机分子(e)用作发光层(eml)中
的发射材料。
[0166]
在发明的光电器件的一个实施例中,发光层(eml)由这里所描述的根据发明的组合物组成。
[0167]
当光电器件是oled时,其可以例如具有以下层结构:
[0168]
1、基底
[0169]
2、阳极层,a
[0170]
3、空穴注入层,hil
[0171]
4、空穴传输层,htl
[0172]
5、电子阻挡层,ebl
[0173]
6、发射层,eml
[0174]
7、空穴阻挡层,hbl
[0175]
8、电子传输层,etl
[0176]
9、电子注入层,eil
[0177]
10、阴极层,c,
[0178]
其中,oled包括选自于hil、htl、ebl、hbl、etl和eil的组中的每个层,仅可选地,不同的层可以合并,oled可以包括以上定义的每个层类型中的一个以上的层。
[0179]
此外,在一个实施例中,光电器件可以包括一个或更多个保护层,该保护层保护器件免受暴露于环境中的有害物质(包括例如湿气、蒸汽和/或气体)的损坏。
[0180]
在发明的一个实施例中,光电器件是具有以下倒置层结构的oled:
[0181]
1、基底
[0182]
2、阴极层,c
[0183]
3、电子注入层,eil
[0184]
4、电子传输层,etl
[0185]
5、空穴阻挡层,hbl
[0186]
6、发射层,eml
[0187]
7、电子阻挡层,ebl
[0188]
8、空穴传输层,htl
[0189]
9、空穴注入层,hil
[0190]
10、阳极层,a,
[0191]
其中,oled包括选自于hil、htl、ebl、hbl、etl和eil的组中的每个层,仅可选地,不同的层可以合并,oled可以包括以上定义的每个层类型中的一个以上的层。
[0192]
在发明的一个实施例中,光电器件是可以具有堆叠体系结构的oled。在这种体系结构中,与其中oled并排放置的典型布置相反,各个单元堆叠在彼此的顶部上。可以用表现出堆叠体系结构的oled产生混合光,具体地,可以通过堆叠蓝色oled、绿色oled和红色oled产生白光。此外,表现出堆叠体系结构的oled可以包括电荷产生层(cgl),电荷产生层(cgl)典型地定位在两个oled子单元之间并且典型地由n掺杂层和p掺杂层组成且一个cgl的n掺杂层典型地定位为靠近阳极层。
[0193]
在发明的一个实施例中,光电器件是在阳极与阴极之间包括两个或更多个发射层的oled。具体地,这种所谓的串联oled包括三个发射层,其中,一个发射层发射红光,一个发
射层发射绿光,一个发射层发射蓝光,并且可选地可以进一步在各个发射层之间包括诸如电荷产生层、阻挡层或传输层的层。在又一实施例中,发射层相邻地堆叠。在又一实施例中,串联oled包括在每两个发射层之间的电荷产生层。另外,可以合并相邻的发射层或被电荷产生层分开的发射层。
[0194]
基底可以由任何材料或材料的组合形成。最常见地,载玻片被用作基底。可选地,可以使用薄金属层(例如,铜、金、银或铝膜)或者塑料膜或载玻片。这可以允许较高程度的柔性。阳极层(a)主要地由允许获得(基本上)透明膜的材料组成。由于两个电极中的至少一个应(基本上)透明以允许从oled发射光,因此阳极层(a)或阴极层(c)是透明的。优选地,阳极层(a)包括大量的透明导电氧化物(tco),或者甚至由透明导电氧化物(tco)组成。这种阳极层(a)可以例如包括氧化铟锡、氧化铝锌、氟掺杂的氧化锡、氧化铟锌、pbo、sno、氧化锆、氧化钼、氧化钒、氧化钨、石墨、掺杂的si、掺杂的ge、掺杂的gaas、掺杂的聚苯胺、掺杂的聚吡咯和/或掺杂的聚噻吩。
[0195]
阳极层(a)(基本上)可以由氧化铟锡(ito)(例如,(ino3)
0.9
(sno2)
0.1
)组成。可以通过使用空穴注入层(hil)来补偿由透明导电氧化物(tco)引起的阳极层(a)的粗糙度。此外,因为准电荷载流子从tco到空穴传输层(htl)的传输被促进,所以hil可以促进准电荷载流子(即,空穴)的注入。空穴注入层(hil)可以包括聚(3,4-乙撑二氧噻吩)(pedot)、聚苯乙烯磺酸盐(pss)、moo2、v2o5、cupc或cui(具体地,pedot和pss的混合物)。空穴注入层(hil)也可以防止金属从阳极层(a)扩散到空穴传输层(htl)中。hil可以例如包括pedot:pss(聚(3,4-乙撑二氧噻吩):聚苯乙烯磺酸盐)、pedot(聚(3,4-乙撑二氧噻吩))、mmtdata(4,4',4
”‑
三[苯基(间甲苯基)氨基]三苯胺)、螺-tad(2,2',7,7'-四(n,n-二苯基氨基)-9,9'-螺二芴)、dntpd(n1,n1'-(联苯-4,4'-二基)双(n1-苯基-n4,n4-二-间甲苯基苯-1,4-二胺))、npb(n,n'-双(1-萘基)-n,n'-双-苯基-(1,1'-联苯)-4,4'-二胺)、npnpb(n,n'-二苯基-n,n'-二[4-(n,n-二苯基-氨基)苯基]联苯胺)、meo-tpd(n,n,n',n'-四(4-甲氧基苯基)联苯胺)、hat-cn(1,4,5,8,9,12-六氮杂三亚苯六甲腈)和/或螺-npd(n,n'-二苯基-n,n'-双(1-萘基)-9,9'-螺二芴-2,7-二胺)。
[0196]
与阳极层(a)或空穴注入层(hil)相邻,典型地定位有空穴传输层(htl)。在此,可以使用任何空穴传输化合物。例如,诸如三芳胺和/或咔唑的富电子杂芳香族化合物可以用作空穴传输化合物。htl可以降低阳极层(a)与发光层(eml)之间的能量势垒。空穴传输层(htl)也可以是电子阻挡层(ebl)。优选地,空穴传输化合物具有相当高的其三重态(t1)的能级。例如,空穴传输层(htl)可以包括诸如三(4-咔唑-9-基苯基)胺(tcta)、聚-tpd(聚(4-丁基苯基-二苯基-胺))、α-npd(2,2'-二甲基-n,n'-二[(1-萘基)-n,n'-二苯基]-1,1'-联苯-4,4'-二胺)、tapc(4,4'-环己基-双[n,n-双(4-甲基苯基)苯胺])、2-tnata(4,4',4
”‑
三[2-萘基(苯基)氨基]三苯胺)、螺-tad、dntpd、npb、npnpb、meo-tpd、hat-cn和/或tris-pcz(9,9'-二苯基-6-(9-苯基-9h-咔唑-3-基)-9h,9'h-3,3'-联咔唑)的星形杂环。另外,htl可以包括可以由有机空穴传输基质中的无机掺杂剂或有机掺杂剂组成的p掺杂层。诸如氧化钒、氧化钼或氧化钨的过渡金属氧化物可以例如用作无机掺杂剂。四氟四氰基醌二甲烷(f
4-tcnq)、五氟苯甲酸铜(cu(i)pfbz)或过渡金属配合物可以例如用作有机掺杂剂。
[0197]
ebl可以例如包括mcp(1,3-双(咔唑-9-基)苯)、tcta、2-tnata、mcbp(3,3-二(9h-咔唑-9-基)联苯)、tris-pcz、czsi(9-(4-叔丁基苯基)-3,6-双(三苯基甲硅烷基)-9h-咔
唑)和/或dcb(n,n'-二咔唑基-1,4-二甲基苯)。
[0198]
与空穴传输层(htl)相邻,典型地定位有发光层(eml)。发光层(eml)包括至少一种有机分子。具体地,eml包括至少一种根据发明的有机分子(e)。在一个实施例中,发光层仅包括根据发明的有机分子。典型地,eml附加地包括一种或更多种主体材料(h)。例如,主体材料(h)选自于cbp(4,4'-双(n-咔唑基)联苯)、mcp、mcbp、sif87(二苯并[b,d]噻吩-2-基三苯基硅烷)、czsi、sif88(二苯并[b,d]噻吩-2-基二苯基硅烷)、dpepo(双[2-(二苯基膦基)苯基]醚氧化物)、9-[3-(二苯并呋喃-2-基)苯基]-9h-咔唑、9-[3-(二苯并噻吩-2-基)苯基]-9h-咔唑、9-[3,5-双(2-二苯并呋喃基)苯基]-9h-咔唑、9-[3,5-双(2-二苯并噻吩基)苯基]-9h-咔唑、t2t(2,4,6-三(联苯-3-基)-1,3,5-三嗪)、t3t(2,4,6-三(三联苯-3-基)-1,3,5-三嗪)和/或tst(2,4,6-三(9,9'-螺二芴-2-基)-1,3,5-三嗪)。主体材料(h)典型地应被选择为表现出在能量上比有机分子的第一三重态(t1)和第一单重态(s1)能级高的第一三重态(t1)和第一单重态(s1)能级。
[0199]
在发明的一个实施例中,eml包括具有至少一种空穴主导主体和一种电子主导主体的所谓的混合主体体系。在具体的实施例中,eml恰好包括根据发明的一种有机分子和混合主体体系,该混合主体体系包括作为电子主导主体的t2t以及作为空穴主导主体的选自于cbp、mcp、mcbp、9-[3-(二苯并呋喃-2-基)苯基]-9h-咔唑、9-[3-(二苯并噻吩-2-基)苯基]-9h-咔唑、9-[3,5-双(2-二苯并呋喃基)苯基]-9h-咔唑和9-[3,5-双(2-二苯并噻吩基)苯基]-9h-咔唑的主体。在又一实施例中,eml包括50重量%至80重量%(优选地,60重量%至75重量%)的主体、10重量%至45重量%(优选地,15重量%至30重量%)的t2t以及5重量%至40重量%(优选地,10重量%至30重量%)的根据发明的有机分子,该主体选自于cbp、mcp、mcbp、9-[3-(二苯并呋喃-2-基)苯基]-9h-咔唑、9-[3-(二苯并噻吩-2-基)苯基]-9h-咔唑、9-[3,5-双(2-二苯并呋喃基)苯基]-9h-咔唑和9-[3,5-双(2-二苯并噻吩基)苯基]-9h-咔唑。
[0200]
与发光层(eml)相邻,可以定位有电子传输层(etl)。在此,可以使用任何电子传输剂。示例性地,可以使用诸如以苯并咪唑、吡啶、三唑、噁二唑(例如1,3,4-噁二唑)、氧化膦和砜为例的贫电子化合物。电子传输体也可以是诸如1,3,5-三(1-苯基-1h-苯并[d]咪唑-2-基)苯(tpbi)的星形杂环。etl可以包括nbphen(2,9-双(萘-2-基)-4,7-二苯基-1,10-菲咯啉)、alq3(三(8-羟基喹啉)铝)、tspo1(二苯基-4-三苯基甲硅烷基苯基-膦氧化物)、bpytp2(2,7-二(2,2'-联吡啶-5-基)三亚苯基)、sif87(二苯并[b,d]噻吩-2-基三苯基硅烷)、sif88(二苯并[b,d]噻吩-2-基二苯基硅烷)、bmpyphb(1,3-双[3,5-二(吡啶-3-基)苯基]苯)和/或btb(4,4'-双[2-(4,6-二苯基-1,3,5-三嗪基)]-1,1'-联苯)。可选地,etl可以掺杂有诸如liq的材料。电子传输层(etl)也可以阻挡空穴,或者引入空穴阻挡层(hbl)。
[0201]
hbl可以例如包括bcp(2,9-二甲基-4,7-二苯基-1,10-菲咯啉=浴铜灵)、balq(双(8-羟基-2-甲基喹啉)-(4-苯基苯氧基)铝)、nbphen(2,9-双(萘-2-基)-4,7-二苯基-1,10-菲咯啉)、alq3(三(8-羟基喹啉)铝)、tspo1(二苯基-4-三苯基甲硅烷基苯基-膦氧化物)、t2t(2,4,6-三(联苯-3-基)-1,3,5-三嗪)、t3t(2,4,6-三(三联苯-3-基)-1,3,5-三嗪)、tst(2,4,6-三(9,9'-螺二芴-2-基)-1,3,5-三嗪)和/或tcb/tcp(1,3,5-三(n-咔唑基)苯/1,3,5-三(咔唑-9-基)苯)。
[0202]
与电子传输层(etl)相邻,可以定位有阴极层(c)。阴极层(c)可以例如包括金属
(例如al、au、ag、pt、cu、zn、ni、fe、pb、li、ca、ba、mg、in、w或pd)或金属合金,或者可以由金属(例如al、au、ag、pt、cu、zn、ni、fe、pb、li、ca、ba、mg、in、w或pd)或金属合金组成。出于实际原因,阴极层也可以由诸如mg、ca或al的(基本上)不透明的金属组成。可选地或附加地,阴极层(c)也可以包括石墨和/或碳纳米管(cnt)。可选地,阴极层(c)也可以由纳米级银线组成。
[0203]
oled可以进一步可选地包括在电子传输层(etl)与阴极层(c)之间的保护层(其可以被指定为电子注入层(eil))。该层可以包括氟化锂、氟化铯、银、liq(8-羟基喹啉锂)、li2o、baf2、mgo和/或naf。
[0204]
可选地,电子传输层(etl)和/或空穴阻挡层(hbl)也可以包括一种或更多种主体化合物(h)。
[0205]
为了进一步修改发光层(eml)的发射光谱和/或吸收光谱,发光层(eml)可以进一步包括一种或更多种另一发射体分子(f)。这样的发射体分子(f)可以是本领域已知的任何发射体分子。优选地,这种发射体分子(f)是具有与根据发明的有机分子(e)的结构不同的结构的分子。发射体分子(f)可以可选地是tadf发射体。可选地,发射体分子(f)可以可选地是能够使发光层(eml)的发射光谱和/或吸收光谱移位的荧光和/或磷光发射体分子。示例性地,通过发射与通过有机分子发射的光相比典型地红移的光,三重态和/或单重态激子可以在弛豫到基态(s0)之前从根据发明的有机分子转移到发射体分子(f)。可选地,发射体分子(f)也可以引起双光子效应(即,两个光子对吸收最大值的能量的一半的吸收)。
[0206]
可选地,光电器件(例如,oled)例如可以是基本上白色的光电器件。例如,这种白色光电器件可以包括至少一种(深)蓝色发射体分子以及发射绿光和/或红光的一种或更多种发射体分子。然后,如上所述的两种或更多种分子之间也可以可选地存在能量转移性(energy transmittance)。
[0207]
如在此所使用的,如果在具体上下文中没有更具体地定义,则发射和/或吸收光的颜色的指定如下:
[0208]
紫色:》380nm至420nm的波长范围;
[0209]
深蓝色:》420nm至480nm的波长范围;
[0210]
天蓝色:》480nm至500nm的波长范围;
[0211]
绿色:》500nm至560nm的波长范围;
[0212]
黄色:》560nm至580nm的波长范围;
[0213]
橙色:》580nm至620nm的波长范围;
[0214]
红色:》620nm至800nm的波长范围。
[0215]
对于发射体分子,这种颜色指发射最大值。因此,例如,深蓝色发射体具有》420nm至480nm的范围内的发射最大值,天蓝色发射体具有》480nm至500nm的范围内的发射最大值,绿色发射体具有》500nm至560nm的范围内的发射最大值,红色发射体具有》620nm至800nm的范围内的发射最大值。
[0216]
深蓝色发射体可以优选地具有低于480nm、更优选地低于470nm、甚至更优选地低于465nm或者甚至低于460nm的发射最大值。它将典型地高于420nm、优选地高于430nm、更优选地高于440nm或者甚至高于450nm。
[0217]
因此,本发明的又一方面涉及一种oled,该oled在1000cd/m2下表现出大于8%(更
优选地大于10%,更优选地大于13%,甚至更优选地大于15%,或者甚至大于20%)的外量子效率,以及/或者表现出在420nm与500nm之间(优选地在430nm与490nm之间,更优选地在440nm与480nm之间,甚至更优选地在450nm与470nm之间)的发射最大值,以及/或者在500cd/m2下表现出大于100小时(优选地大于200小时,更优选地大于400小时,甚至更优选地大于750小时,或者甚至大于1000小时)的lt80值。因此,本发明的又一方面涉及一种oled,该oled的发射表现出小于0.45(优选地小于0.30,更优选地小于0.20,或者甚至更优选地小于0.15,或者甚至小于0.10)的ciey色坐标。
[0218]
本发明的又一方面涉及一种以不同的颜色点发射光的oled。根据本发明,oled发射具有窄发射带(小的半峰全宽(fwhm))的光。一方面,根据发明的oled发射具有小于0.30ev(优选地小于0.25ev,更优选地小于0.20ev,甚至更优选地小于0.19ev,或者甚至小于0.17ev)的主发射峰的fwhm的光。
[0219]
本发明的又一方面涉及一种oled,该oled发射具有ciex和ciey色坐标(ciex=0.131,ciey=0.046)(该ciex和ciey色坐标(ciex=0.131,ciey=0.046)接近如由itu-r recommendation bt.2020(rec.2020)所定义的基色蓝色的ciex(=0.131)和ciey(=0.046)色坐标)的光,并且因此适用于在超高清(uhd)显示器(例如,uhd-tv)中应用。因此,本发明的又一方面涉及一种oled,该oled的发射表现出在0.02与0.30之间(优选地在0.03与0.25之间,更优选地在0.05与0.20之间,或者甚至更优选地在0.08与0.18之间,或者甚至在0.10与0.15之间)的ciex色坐标以及/或者在0.00与0.45之间(优选地在0.01与0.30之间,更优选地在0.02与0.20之间,或者甚至更优选地在0.03与0.15之间,或者甚至在0.04与0.10之间)的ciey色坐标。
[0220]
在又一方面,发明涉及一种用于制造光电组件的方法。在这种情况下,使用发明的有机分子。
[0221]
可以通过气相沉积和/或液体处理的任何方式来制造根据本发明的光电器件(具体地,oled)。因此,至少一层:
[0222]-通过升华工艺的方式制备,
[0223]-通过有机气相沉积工艺的方式制备,
[0224]-通过载气升华工艺的方式制备,
[0225]-溶液处理或印刷。
[0226]
根据本发明的用于制造光电器件(具体地,oled)的方法是本领域已知的。通过随后的沉积工艺的方式,在合适的基底上单独地且连续地沉积不同的层。可以使用相同或不同的沉积方法来沉积各个层。
[0227]
气相沉积工艺例如包括热(共)蒸发、化学气相沉积和物理气相沉积。对于有源矩阵oled显示器,amoled背板用作基底。可以采用适当的溶剂从溶液或分散体处理各个层。溶液沉积工艺例如包括旋涂、浸涂和喷射印刷。可以可选地在惰性气氛中(例如,在氮气氛中)进行液体处理,可以通过本领域已知的方式完全地或部分地去除溶剂。
[0228]
示例
[0229]
一般合成方案i
[0230]
一般合成方案i提供了用于根据发明的有机分子的合成方案,其中,r
x
=ri,r
ix
=r
ii
,r
viii
=r
iii
,r
vii
=r
iv
,并且rv=r
vi
:
[0231][0232]
可选地,硼酸三甲酯可以用作硼化试剂,得到与i3对应的硼酸衍生物。
[0233][0234]
可选地,底物i3的对应的硼酸衍生物可以在相同条件下用作原料。
[0235]
将i2直接转换为p1的替代的一锅闭环方案(one-pot ring closure scheme)。
[0236][0237]
用于合成aav1的一般步骤:
[0238][0239]
在氮气氛下在甲苯中在80℃下搅拌e1(1.00当量)、e2(1.10当量)、三(二亚苄基丙酮)二钯pd2(dba)3(0.01当量;cas:51364-51-3)、三叔丁基膦(p(
t
bu)3,cas:13716-12-6,0.04当量)和叔丁醇钠(nao
t
bu;1.70当量)1小时至16小时。在冷却至室温(rt)之后,用甲苯和水萃取反应混合物,并且分离相。用无水mgso4干燥合并的有机层,然后减压去除溶剂。通过重结晶或柱色谱法纯化所获得的粗产物,获得作为固体或油的i1。
[0240]
用于合成aav2的一般步骤:
[0241][0242]
在氮气氛下在甲苯中在110℃下搅拌i1(2.20当量)、e3(1.00当量)、三(二亚苄基丙酮)二钯pd2(dba)3(0.02当量;cas:51364-51-3)、三叔丁基膦(0.08当量,p(
t
bu)3,cas:13716-12-6)和叔丁醇钠(nao
t
bu;3.30当量)1小时至16小时。在冷却至室温(rt)之后,用甲苯和水萃取反应混合物,并且分离相。用无水mgso4干燥合并的有机层,然后减压去除溶剂。通过重结晶或柱色谱法纯化所获得的粗产物,获得作为固体的i2。
[0243]
用于合成aav3的一般步骤:
[0244][0245]
在氮气氛下,将i2(1.00当量)溶解在无水thf中。将所得溶液冷却至-10℃。随后,缓慢地加入tert-buli(2.20当量,cas:594-19-4)并且在0℃下继续搅拌。在完全锂化之后,加入2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧硼杂环戊烷(3.00当量,cas:61676-62-8,或者可选地,硼酸三甲酯,cas121-43-7),然后在40℃下加热2小时。在冷却至室温(rt)之后,加入水并且分离相。用无水mgso4干燥合并的有机层,过滤并且减压浓缩。通过重结晶或柱色谱法纯化所获得的粗产物,以分别得到作为固体的i3或对应的硼酸。
[0246]
用于合成aav4的一般步骤:
[0247][0248]
在氮气氛下在氯苯中在120℃下搅拌i3(1.00当量)、n,n-二异丙基乙胺(10当量,cas:7087-68-5)和alcl3(10当量,cas:7446-70-0)4h。在冷却至室温(rt)之后,在甲苯与水之间萃取反应混合物,并且分离相。用无水mgso4干燥合并的有机层,然后减压去除溶剂。通过重结晶或柱色谱法纯化所获得的粗产物,获得作为固体的p1。
[0249]
用于合成aav5的一般步骤:
[0250][0251]
在氮气氛下将i2(1.00当量)溶解在叔丁基苯中,并且将溶液冷却至-30℃。逐滴加
入叔丁基锂(
t
buli)(2.20当量,cas:594-19-4)的溶液并且使反应混合物升温至0℃。在60℃下搅拌120分钟之后,减压去除
t
buli溶液的溶剂和副产物,并且将反应混合物再次冷却至-30℃。逐滴加入三溴化硼(bbr3,cas:10294-33-4,2.20当量)的溶液,去除冷却浴并且使反应混合物升温至室温(rt)。在rt下搅拌30分钟之后,将反应混合物冷却至0℃并且加入n,n-二异丙基乙胺(cas:7087-68-5,3.00当量)。将反应混合物升温至rt,然后在120℃下回流加热3小时。随后,将反应混合物倒入到水中,并且将所得沉淀物过滤并且用最少量的乙酸乙酯洗涤,以获得作为固体产物的p1。可以通过重结晶或通过快速色谱法进一步纯化p1。
[0252]
一般合成方案ii
[0253]
一般合成方案ii提供了用于根据发明的有机分子的合成方案,其中,r
x
=ri,r
ix
=r
ii
,r
viii
=r
iii
,r
vii
=r
iv
,并且rv=r
vi
:
[0254]
[0255][0256]
将i5转化为p2的替代的一锅步骤。
[0257][0258]
用于合成aav6的一般步骤
[0259][0260]
在氮气氛下在甲苯中在80℃下搅拌e3(1.00当量)、e1(2.20当量)、三(二亚苄基丙酮)二钯pd2(dba)3(0.01当量;cas:51364-51-3)、三叔丁基膦(p(
t
bu)3,cas:13716-12-6,0.04当量)和叔丁醇钠(nao
t
bu;3.30当量)1小时至16小时。在冷却至室温(rt)之后,用甲苯和水萃取反应混合物,并且分离相。用无水mgso4干燥合并的有机层,然后减压去除溶剂。通过重结晶或柱色谱法纯化所获得的粗产物,获得作为固体或油的i4。
[0261]
用于合成aav7的一般步骤
[0262][0263]
在氮气氛下在甲苯中在110℃下搅拌i4(1.00当量)、e2.2(2.20当量)、三(二亚苄基丙酮)二钯pd2(dba)3(0.02当量;cas:51364-51-3)、三叔丁基膦(0.08当量,p(
t
bu)3,cas:13716-12-6)和叔丁醇钠(nao
t
bu;3.30当量)1小时至16小时。在冷却至室温(rt)之后,用甲苯和水萃取反应混合物,并且分离相。用无水mgso4干燥合并的有机层,然后减压去除溶剂。通过重结晶或柱色谱法纯化所获得的粗产物,获得作为固体的i5。
[0264][0265]
根据aav3使用化合物i5作为原料获得硼酸酯i6。可选地,硼酸三甲酯可以用作硼化试剂,得到与i6对应的硼酸衍生物。
[0266][0267]
根据aav4使用硼酸酯i6作为原料合成目标化合物p2。可选地,与i6对应的硼酸可以用作用于合成p2的原料。
[0268]
将i5转化为p2的替代的一锅步骤。
[0269][0270]
经由一锅法进行目标p2的合成,其中,氯化物前驱体i5按照aav5中所描述的步骤直接转化为p2。
[0271]
一般合成方案iii
[0272]
一般合成方案iii提供了用于根据发明的有机分子的合成方案,其中,不适用方案i和方案ii的限制(即,r
x
=ri,r
ix
=r
ii
,r
viii
=r
iii
,r
vii
=r
iv
,并且rv=r
vi
)。
[0273][0274]
按照aav1所描述的步骤使用e2.2(1.1当量)和胺e1作为反应物进行化合物i7.1的合成。
[0275][0276]
按照aav1所描述的步骤使用e2.2(1.1当量)和胺e1作为反应物进行化合物i7.2的合成。
[0277][0278]
根据aav8合成化合物i8。
[0279][0280]
根据aav9合成化合物i9。
[0281][0282]
如aav3中所描述的使用前驱体i9作为底物进行硼酸酯i10的合成。可选地,硼酸三甲酯可以用作硼化试剂,得到与i10对应的硼酸衍生物。
[0283][0284]
根据aav4使用硼酸酯i10作为原料合成目标化合物p3。可选地,与i10对应的硼酸
可以用作用于合成p3的原料。
[0285]
将i9转化为p3的替代的一锅步骤。
[0286][0287]
经由一锅法进行目标p3的合成,其中,氯化物前驱体i9按照aav5中所描述的步骤直接转化为p3。
[0288]
用于合成aav8的一般步骤:
[0289][0290]
在氮气氛下在甲苯中在80℃下搅拌e3.2(1.10当量)、i7.1(1.00当量)、三(二亚苄基丙酮)二钯pd2(dba)3(0.01当量;cas:51364-51-3)、三叔丁基膦(p(
t
bu)3,cas:13716-12-6,0.04当量)和叔丁醇钠(nao
t
bu;1.70当量)5h。在冷却至室温(rt)之后,在甲苯与盐水之间萃取反应混合物,并且分离相。用无水mgso4干燥合并的有机层,然后减压去除溶剂。通过重结晶或柱色谱法纯化所获得的粗产物,获得作为固体的i8。
[0291]
用于合成aav9的一般步骤:
[0292][0293]
在氮气氛下在甲苯中在110℃下搅拌i7.2(1.10当量)、i8(1.00当量)、三(二亚苄基丙酮)二钯pd2(dba)3(0.01当量;cas:51364-51-3)、三叔丁基膦(p(
t
bu)3,cas:13716-12-6,0.04当量)和叔丁醇钠(nao
t
bu;1.70当量)5h。在冷却至室温(rt)之后,在甲苯与盐水之间萃取反应混合物,并且分离相。用无水mgso4干燥合并的有机层,然后减压去除溶剂。通过
重结晶或柱色谱法纯化所获得的粗产物,获得作为固体的i9。
[0294]
一般合成方案iv
[0295]
一般合成方案iv提供了用于根据发明的有机分子的合成方案,其中,r
x
=ri,r
ix
=r
ii
,r
viii
=r
iii
,r
vii
=r
iv
,并且rv=r
vi
:
[0296][0297]
如aav2中所描述的从1,3-二溴-2,5-二氯苯(1.0当量,cas:81067-41-6)和胺i2开始进行二氯衍生物i2-cl的合成。
[0298][0299]
按照aav3的步骤由i2-cl合成硼酸酯i3-cl,其中,可选地,硼酸三甲酯可以用作硼化试剂,得到与i3-cl对应的硼酸衍生物。
[0300][0301]
如aav4中所描述的由p1-cl合成对氯衍生物p1-cl。
[0302]
可选地,在相同条件下,底物i3-cl的对应的硼酸衍生物可以用作原料,得到p1-cl。
[0303]
直接将i2-cl转化为p1-cl的替换的一锅闭环方案。
[0304][0305]
如aav5中所描述的进行从i2-cl开始的p1-cl的一锅合成。
[0306]
用于合成aav10的一般步骤:
[0307][0308]
在氮气氛下,在甲苯和二噁烷(1:1)的混合物中在100℃下搅拌化合物p1-cl(1.0当量)、硼酸r
v-b(oh)2(6.0当量)、乙酸钯(ii)(0.06当量,cas:3375-31-3)、x-phos(0.24当量,cas:564483-18-7)和磷酸三钾(9.0当量,cas:7778-53-2)1小时。在冷却至室温(rt)之后,用甲苯和水萃取反应混合物,并且分离相。用活性炭处理合并的有机层10分钟,然后通过(硅藻土(kieselgur))垫过滤。用无水mgso4干燥滤液,然后减压去除溶剂。通过重结晶或柱色谱法纯化所获得的粗产物,获得作为固体的p1。
[0309]
一般合成方案v
[0310]
一般合成方案v提供了用于根据发明的有机分子的合成方案,其中,r
x
=ri,r
ix
=r
ii
,r
viii
=r
iii
,r
vii
=r
iv
,并且rv=r
vi
:
[0311][0312]
根据步骤aav6合成化合物i4-cl,其中,1,3-二溴-2,5-二氯苯(1.0当量,cas 81067-41-6)和伯胺e1用作反应物。
[0313][0314]
通过按照步骤aav7使用仲双胺i4-cl和1-溴-3,5-二苯基苯(cas:103068-20-8)作为反应物获得化合物i5-cl。
[0315][0316]
根据aav3使用化合物i5-cl作为原料获得硼酸酯i6-cl。可选地,在相同条件下,硼酸三甲酯可以用作硼化试剂,得到与16-cl对应的硼酸衍生物。
[0317][0318]
如aav5中所描述的使用i5-cl作为底物进行p2-cl的合成。
[0319]
[0320]
如aav10中所描述的使用p2-cl作为原料合成目标材料p2。
[0321]
一般合成方案vi
[0322]
一般合成方案vi提供了用于根据发明的有机分子的合成方案,其中,不适用方案i和方案ii的限制(即,r
x
=ri,r
ix
=r
ii
,r
viii
=r
iii
,r
vii
=r
iv
,并且rv=r
vi
)。
[0323][0324]
如aav8中所描述的合成化合物i8-cl,其中,1-溴-2,3,5-三氯苯(1.0当量)和伯胺i7.1用作反应物。
[0325][0326]
根据aav9由i7.2和i8-cl合成化合物i9-cl。
[0327][0328]
如aav3中所描述的使用前驱体i9-cl作为底物进行硼酸酯i10-cl的合成。可选地,硼酸三甲酯可以用作硼化试剂,得到与i10-cl对应的硼酸衍生物。
[0329][0330]
根据aav4使用硼酸酯i10-cl作为原料合成化合物p3-cl。可选地,与i10-cl对应的硼酸可以用作用于合成p3-cl的原料。
[0331]
将i9-cl转化为p3-cl的替代的一锅步骤。
[0332][0333]
如aav5中所描述的使用i9-cl作为底物进行p3-cl的合成。
[0334][0335]
如aav10中所描述的使用p3-cl作为原料合成目标材料p3。
[0336]
循环伏安法
[0337]
循环伏安图是通过在二氯甲烷或合适的溶剂以及合适的支持电解质(例如,0.1mol/l的四丁基六氟磷酸铵)中具有浓度为10-3
mol/l的有机分子的溶液测量的。在室温下在氮气氛下使用三电极组件(工作电极和对电极:pt线,参比电极:pt线)进行测量,并且使用fecp2/fecp
2+
作为内标进行校准。使用二茂铁作为内标对饱和甘汞电极(sce)校正homo数据。
[0338]
密度泛函理论计算
[0339]
采用bp86泛函和分辨率同一性方法(ri,resolution of identity approach)优化分子结构。采用时间依赖dft(td-dft)法使用(bp86)优化的结构计算激发能量。用b3lyp泛函计算轨道和激发态能量。使用def2-svp基组和用于数值积分法的m4网格。turbomole步
骤包用于所有计算。
[0340]
光物理测量
[0341]
样品预处理:旋涂。
[0342]
仪器:spin150,sps euro。
[0343]
样品浓度是10mg/ml,溶解在合适的溶剂中。
[0344]
步骤:1)在400u/min下3秒。2)以1000upm/s在1000u/min下20秒。3)以1000upm/s在4000u/min下10秒。在涂覆之后,在70℃下干燥膜1min。
[0345]
光致发光光谱和时间相关单光子计数(tcspc)
[0346]
由配备有150w氙弧灯、激发和发射单色器以及hamamatsu r928光电倍增管和时间相关单光子计数选项的horiba scientific modell fluoromax-4测量稳态发射光谱。使用标准校正拟合校正发射和激发光谱。
[0347]
使用tcspc法与fm-2013设备和horiba yvon tcspc集线器采用同一体系确定激发态寿命。
[0348]
激发源:
[0349]
纳米led 370(波长:371nm,脉冲持续时间:1.1ns)
[0350]
纳米led 290(波长:294nm,脉冲持续时间:《1ns)
[0351]
光谱led 310(波长:314nm)
[0352]
光谱led 355(波长:355nm)。
[0353]
使用软件套件datastation和das6分析软件完成数据分析(指数拟合)。使用卡方检验指定拟合。
[0354]
光致发光量子产率测量
[0355]
对于光致发光量子产率(plqy)测量,使用绝对pl量子产率测量c9920-03g系统(hamamatsu photonics)。使用软件u6039-05 3.6.0版确定量子产率和cie坐标。
[0356]
发射最大值以nm给出,量子产率φ以%给出,cie坐标作为x值、y值。
[0357]
使用以下协议确定plqy:
[0358]
1)质量保证:使用乙醇中的蒽(已知浓度)作为参考
[0359]
2)激发波长:确定有机分子的吸收最大值,使用该波长激发分子
[0360]
3)测量
[0361]
对于样品,在氮气氛下测量溶液或膜的量子产率。使用等式计算产率:
[0362][0363]
其中,n
光子
表示光子计数,int.表示强度。
[0364]
光电器件的制造和表征
[0365]
可以经由真空蒸发法来制造包括根据发明的有机分子的光电器件(具体地,oled器件)。如果层包含一种以上的化合物,则一种或更多种化合物的重量百分比以%给出。总重量百分比值是100%,因此如果未给出值,则该化合物的分数等于给定值与100%之间的差。
[0366]
使用标准方法且测量电致发光光谱、依赖于强度的外量子效率(以%计)对未完全
地优化的oled进行表征,依赖于强度的外量子效率(以%计)是使用由光电二极管检测的光和电流计算的。oled器件寿命是从在恒定电流密度下操作期间的亮度的改变提取的。lt50值与测量的亮度降低至初始亮度的50%的时间点对应,类似地,lt80值与测量的亮度降低至初始亮度的80%的时间点对应,lt95值与测量的亮度降低至初始亮度的95%的时间点对应等。
[0367]
(例如,应用增大的电流密度)进行加速寿命测量。例如,使用以下等式确定在500cd/m2下的lt80值:
[0368][0369]
其中,l0表示施加电流密度下的初始亮度。
[0370]
该值与几个(典型地2个至8个)像素的平均值对应,给出了这些像素之间的标准偏差。
[0371]
hplc-ms
[0372]
在通过具有ms检测器(thermo ltq xl)的安捷伦(agilent)(1100系列)的hplc上进行hplc-ms分析。
[0373]
示例性地,典型的hplc法如下:在hplc中使用安捷伦的反相色谱柱4.6mm
×
150mm,粒径3.5μm(zorbax eclipse plusc18,4.6mm
×
150mm,3.5μm hplc色谱柱)。在室温(rt)下按照梯度进行hplc-ms测量。
[0374][0375]
使用以下溶剂混合物:
[0376]
溶剂a:h2o(90%)mecn(10%)溶剂b:h2o(10%)mecn(90%)溶剂c:thf(50%)mecn(50%)
[0377]
从具有浓度为0.5mg/ml的分析物的溶液取样5μl的进样量用于测量。
[0378]
使用大气压化学电离(apci)源在正(apci+)或负(apci-)电离模式下进行探头的电离。
[0379]
示例1
[0380][0381]
根据以下步骤合成示例1:
[0382]
aav1(49%产率),其中,4-氯二苯基甲烷(cas 831-81-2)用作反应物e2,并且4-苄基苯胺(cas 1135-12-2)用作e1;
[0383]
aav2(42%产率),其中,1,3-二溴-2-氯苯(cas 19230-27-4)用作反应物e3;
[0384]
以及aav5(48%产率)。
[0385]
ms(hplc-ms,apci,正电离),m/z(保留时间):781.6(6.16min)。
[0386]
示例1(2重量%,在pmma中)的发射最大值在464nm处,半峰全宽(fwhm)是0.17ev,ciey坐标是0.12,plqy是73%。发射光谱的起始点在2.79ev处被确定。
[0387]
示例2
[0388][0389]
根据以下步骤合成示例2:
[0390]
aav1(49%产率),其中,4-氯二苯基甲烷(cas 831-81-2)用作反应物e2,并且4-苄基苯胺(cas 1135-12-2)用作e1;
[0391]
aav2(69%产率),其中,4-氯-3,5-二溴甲苯(cas 202925-05-1)用作反应物e3;
[0392]
以及aav5(13%产率)。
[0393]
ms(hplc-ms,appi,正电离),m/z(保留时间):795.6(6.26min)。
[0394]
示例2(2重量%,在pmma中)的发射最大值在462nm处,半峰全宽(fwhm)是0.17ev,ciey坐标是0.11,plqy是76%。发射光谱的起始点在2.79ev处被确定。
[0395]
示例3
[0396][0397]
根据以下步骤合成示例1:
[0398]
aav2(83%产率),其中,1,3-二溴-2-氯苯(cas 19230-27-4)和4,4'-双(α,α-二甲基苄基)二苯胺(cas 10081-67-1)分别用作反应物e3和i1;
[0399]
aav3(32%产率),其中,硼酸三甲酯(cas 121-43-7)用作硼化试剂,并且其中,获得i3的对应的硼酸衍生物;
[0400]
以及aav4(23%产率)。
[0401]
ms(hplc-ms,appi,正电离),m/z(保留时间):893.7(7.66min)。
[0402]
示例3(2重量%,在pmma中)的发射最大值在462nm处,半峰全宽(fwhm)是0.16ev,ciey坐标是0.10,并且plqy是80%。发射光谱的起始点在2.79ev处被确定。
[0403]
示例4
[0404][0405]
根据以下步骤合成示例4:
[0406]
aav2(72%产率),其中,4-氯-3,5-二溴甲苯(cas 202925-05-1)和4,4'-双(α,α-二甲基苄基)二苯胺(cas 10081-67-1)分别用作反应物e3和i1;
[0407]
aav3(50%产率),其中,硼酸三甲酯(cas 121-43-7)用作硼化试剂,并且其中,对应的二氯化物i2-cl用作反应物,并且其中,获得i3-cl的对应的硼酸衍生物;
[0408]
aav4(58%产率);
[0409]
以及aav10(81%产率),其中,对应的原料p1-cl与甲硼酸(cas:13061-96-6)反应。
[0410]
ms(hplc-ms),m/z(保留时间):907.80(7.68min)。
[0411]
示例4(2重量%,在pmma中)的发射最大值在461nm处,半峰全宽(fwhm)是0.17ev,ciey坐标是0.10,并且plqy是81%。发射光谱的起始点在2.81ev处被确定。
[0412]
示例d1
[0413]
在被制造有以下层结构的oled d1中测试示例1:
[0414][0415]
[0416][0417]
oled d1在1000cd/m2下产生了12.1%的外量子效率(eqe)。在3.6v下发射最大值在468nm处且fwhm是26nm。对应的ciey值是0.12。
[0418]
示例d2
[0419]
在被制造有以下层结构的oled d2中测试示例2:
[0420]
[0421][0422]
oled d2在1000cd/m2下产生了10.9%的外量子效率(eqe)。在3.8v下发射最大值在464nm处且fwhm是28nm。对应的ciey值是0.10。
[0423]
示例d3
[0424]
在被制造有以下层结构的oled d3中测试示例3:
[0425]
层号厚度d39100nmal82nmliq711nmnbphen620nmmat1520nmmat2(98%):示例3(2%)410nmmat3350nmmat427nmhat-cn150nmito基底 玻璃
[0426]
oled d3在1000cd/m2下产生了11.8%的外量子效率(eqe)。在3.5v下发射最大值在466nm处且fwhm是26nm。对应的ciey值是0.10。
[0427]
示例d4
[0428]
在被制造有以下层结构的oled d4中测试示例4:
[0429]
[0430][0431]
oled d4在1000cd/m2下产生了11.2%的外量子效率(eqe)。在3.6v下发射最大值在464nm处且fwhm是26nm。对应的ciey值是0.09。
[0432]
发明的有机分子的附加的示例
[0433]
[0434]
[0435]
[0436]
[0437]
[0438]
[0439]
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1