包含编码具有羟化酶活性的蛋白质的基因的微生物和使用其降低样品中氟化甲烷浓度的方法与流程
本申请要求在韩国专利局于2015年5月13日提交的韩国专利申请No.10-2015-006694、2015年10月23日提交的韩国专利申请No.10-2015-0148032、2015年12月7日提交的韩国专利申请10-2015-0173293、2015年12月23日提交的韩国专利申请No.10-2015-0185093、和2016年4月21日提交的韩国专利申请No.10-2016-0048960的权益,其公开内容通过提述完整并入本文。
发明背景
1.领域
本公开涉及包含编码具有羟化酶活性的蛋白质的基因的微生物,用于降低样品中氟化甲烷浓度的组合物,包含编码具有羟化酶活性的蛋白质的基因的微生物的组合物,以及降低样品中氟化甲烷浓度的方法。
2.相关技术描述
加速全球变暖的温室气体的排放是一个严重的环境问题,而且已经加紧了降低和防止温室气体排放的调控。在温室气体中,氟化气体(F气体)如碳氟化合物(PFC)、氢氟烃(HFC)或SF6显示低绝对排放,但具有较长的半衰期和非常高的全球暖化潜力,从而产生显著的不良环境影响。从半导体和电子工业排放(其为F气体排放的主要原因)的F气体的量已超过了温室气体排放的指定量且持续增加。因此,温室气体降解需要的成本和温室气体排放补助逐年增加。
热解或催化性热氧化工艺已普遍地用于F气体的分解。然而,该工艺的缺点在于分解率有限,次级污染物的排放,高成本等。为了解决此问题,采用了利用微生物生物催化剂对F气体的生物分解。因此,预期克服化学分解工艺的限制和以更经济和环境友好的方式来处理F气体。
羟化酶是催化羟基基团(-OH)引入到含碳化合物(RH)的碳,从而将含碳化合物中的CH基团转化成COH基团的酶。羟化酶包括单加氧酶和脱卤素酶。 单加氧酶催化一个氧原子纳入到含碳化合物的碳位置并将另一个氧原子还原成水。单加氧酶包括细胞色素P450和甲烷单加氧酶(MMO)。细胞色素P450属于含有血红素辅因子的蛋白质超家族,且因此细胞色素P450是血红素蛋白。脱卤素酶是催化卤素原子从底物移除的一类酶。
尽管现有技术中进行了多种努力,但尚未有关于包含作用于氟化甲烷的羟化酶的微生物、使用所述微生物用于降低样品中氟化甲烷浓度的组合物和方法的报道。
发明概述
一个方面提供了重组微生物,其包含一种或多种编码具有羟化酶活性的蛋白质的外来基因,其中所述微生物相比于该重组微生物的亲本菌株具有增加的羟化酶活性。
另一个方面提供了用于降低样品中CHnF4-n(其中n是0至3的整数)浓度的组合物,所述组合物包含重组微生物、其裂解物、或裂解物的水性级分,其中所述重组微生物包含一种或多种编码具有羟化酶活性的蛋白质的外来基因,且所述重组微生物相比于该重组微生物的亲本菌株具有增加的羟化酶活性。
再一个方面提供降低样品中CHnF4-n浓度的方法,所述方法包括使重组微生物、其裂解物、或裂解物的水性级分与含有CHnF4-n(其中n是0至3的整数)的样品接触以降低样品中CHnF4-n(其中n是0至3的整数)的浓度,其中所述重组微生物包含一种或多种编码具有羟化酶活性的蛋白质的外来基因,且所述重组微生物相比于该重组微生物的亲本菌株具有增加的羟化酶活性。
附图简述
这些和/或其他方面从以下实施方案的描述,连同所附附图将变得明显和更容易领会的。
图1A显示通过重组大肠杆菌分解三氟甲(fluoroform)的实验结果;
图1B显示通过引入卤代烷脱卤素酶的大肠杆菌分解三氟甲的实验结果;
图2A显示通过引入卤代烷脱卤素酶的大肠杆菌分解全氟甲烷的实验结果;
图2B显示通过大肠杆菌BL21star/pMALc2-CfrA样品中CF4浓度的变化,其使用阴性对照值标准化,其中△峰面积代表CfrA面积-阴性对照面积,且分解 率(%)代表(△峰面积/阴性对照面积)X100;
图3显示pETDuet-camC-camAB载体的载体图谱;
图4显示当在与含CHF3的气体接触的培养基中培养大肠杆菌BL21/pETDuet-camC-camAB时CHF3顶空(headspace)浓度随时间的变化;
图5A显示当在含CHCl3的培养基中培养大肠杆菌BL21/pETDuet-camC-camAB时CHCl3顶空浓度随时间的变化;
图5B显示当在与含CF4的气体接触的培养基中培养大肠杆菌BL21/pETDuet-camC-camAB时CF4顶空浓度随时间的变化;
图6显示pET28a-P450BM3载体的载体图谱;
图7显示pACYCDuet-zwf载体的载体图谱;
图8显示当在与含CHF3的气体接触的溶液中培养大肠杆菌BL21/pET28a-P450BM3或BL21/pET28a-P450BM3+pACYCDuet-zwf菌株时CHF3顶空浓度随时间的变化;
图9A显示当在含CHCl3的培养基中培养大肠杆菌BL21/pET28a-P450BM3时CHCl3顶空浓度随时间的变化;
图9B显示当在与含CF4的气体接触的培养基中培养大肠杆菌BL21/pET28a-P450BM37天时CF4顶空浓度随时间的变化;
图10A显示pET28a-mmoXYBZDC载体的载体图谱;
图10B显示pETDuet-mmoXY-ZD载体的载体图谱;
图10C显示pACYCDuet-mmoBC载体的载体图谱;
图10D显示pACYCDuet-mmoG-BC载体的载体图谱;
图11显示当在与含CHF3的气体接触的培养基中培养重组大肠杆菌时CHF3顶空浓度的变化;
图12A显示当在含CHCl3的培养基中培养重组大肠杆菌时CHCl3顶空浓度的变化;
图12B显示当在与含CF4的气体接触的培养基中培养重组大肠杆菌BL21/pET28a-mmoXYBZDC达7天时CF4顶空浓度的变化;
图13A显示通过自养黄色杆菌(X.autotrophicus)GJ10的四氟甲烷分解;和
图13B显示通过自养黄色杆菌GJ10Xantho_dhlA的四氟甲烷分解。
发明详述
一个方面提供了重组微生物,其包含一种或多种编码具有羟化酶活性的蛋白质的外来基因,其中所述微生物相比于该重组微生物的亲本菌株具有增加的羟化酶活性。微生物的亲本菌株是没有给定的遗传修饰(例如引入外来基因)的同一类型的微生物,其产生所述重组微生物。
就微生物而言,具有羟化酶活性的蛋白质可以是催化羟基基团(-OH)引入到含碳化合物(RH)的碳的酶。羟化酶可以催化含碳化合物中的CH基团转化成COH基团。具有羟化酶活性的蛋白质可以作用于氟代烷化合物的碳-氟或碳-氢键。
具有羟化酶活性的蛋白质可以选自下组:脱卤素酶和单加氧酶。
脱卤素酶是催化卤素原子从底物移除的一类酶。脱卤素酶可属于EC3.8.1.-。脱卤素酶可以是氯仿还原性脱卤素酶CfrA、四氯乙烯还原性脱卤素酶、二氯甲烷脱卤素酶、卤代烷脱卤素酶、烷基卤化酶、(S)-2-卤酸脱卤素酶、(R)-2-卤酸脱卤素酶、2-卤酸脱卤素酶(构象反转)、卤代乙酸脱卤素酶、或其组合。
具有羟化酶活性的蛋白质可以具有与SEQ ID NO:1或2为95%或更高、96%或更高、97%或更高、98%或更高或99%或更高的序列同一性。具有羟化酶活性的蛋白质可以具有SEQ ID NO:1或2的氨基酸序列。具有SEQ ID NO:1的氨基酸序列的蛋白质可归类为卤代烷脱卤素酶。具有SEQ ID NO:1的氨基酸序列的蛋白质可以是催化从作为底物的1-卤代烷和水产生伯醇和卤化物的酶。具有SEQ ID NO:2的氨基酸序列的蛋白质可以归类为(S)-2-卤酸脱卤素酶。进一步地,具有SEQ ID NO:2的氨基酸序列的蛋白质可以是催化从作为底物的(S)-2-卤酸和水产生(R)-羟基酸和卤化物的酶。编码具有羟化酶活性的蛋白质的一种或多种外来基因可以具有SEQ ID NO:3和4的核苷酸序列。此外,所述基因可以相对于作为宿主细胞的重组微生物密码子优化。密码子优化指产生以下基因,其中一个或多个内源密码子被用于同一氨基酸但在相应宿主中具有偏好性的密码子替换。SEQ ID NO:3和4的核苷酸序列是分别编码源自自养黄色杆菌的卤代烷脱卤素酶(dhlA)和(S)-2-卤酸脱卤素酶(dhlB)的基因。SEQ ID NO:61的核苷酸序列是针对大肠杆菌密码子优化的编码卤代烷脱卤素酶(dhlA)的基因。氯仿还原性脱卤素酶CfrA可以具有SEQ ID NO:57的氨基酸序列,且可以由SEQ ID NO:56的核苷酸序列编码。已知CfrA使氯仿(CF)和1,1,1-三氯乙烷(1,1,1-TCA),而不是1,1-二氯乙烷脱氯。
对于重组微生物,单加氧酶催化将一个氧原子纳入到含碳化合物的碳位置并将另一个氧原子还原成水的单加氧酶反应。单加氧酶可以属于EC1.14.13.-。单加氧酶包括甲烷单加氧酶(MMO)和细胞色素P450。甲烷单加氧酶是能氧化甲烷中的C-H键的酶。细胞色素P450(CYP)属于含有血红素辅因子的蛋白质超家族,且因此细胞色素P450是血红素蛋白。
甲烷单加氧酶可以是可溶性甲烷单加氧酶(sMMO)、特别甲烷单加氧酶、氨单加氧酶、樟脑5-单加氧酶、或其组合。sMMO蛋白可以属于EC 1.14.13.25。sMMO蛋白可以源自荚膜甲基球菌(Methylococcus capsulatus)(Bath)。sMMO蛋白可包含MmoX、MmoY、和MmoZ、MmoB、MmoC、和MmoD的复合物。MmoX、MmoY、MmoZ、MmoB、MmoC、和MmoD可分别具有SEQ ID NO:5、7、9、11、13、和15的氨基酸序列。编码MmoX、MmoY、MmoZ、MmoB、MmoC、和MmoD的多核苷酸可分别具有SEQ ID NO:6,8,10,12,14和16的核苷酸序列。对于重组微生物,基因可以包含具有SEQ ID NO:6的核苷酸序列的多核苷酸、具有SEQ ID NO:8的核苷酸序列的多核苷酸、具有SEQ ID NO:10的核苷酸序列的多核苷酸、具有SEQ ID NO:12的核苷酸序列的多核苷酸、具有SEQ ID NO:14的核苷酸序列的多核苷酸、和具有SEQ ID NO:16的核苷酸序列的多核苷酸。对于重组微生物,基因可包括具有SEQ ID NO:35的核苷酸序列的多核苷酸。换言之,所述重组微生物可以包括具有SEQ ID NO:35的核苷酸序列的多核苷酸。
所述重组微生物可以进一步包含编码MmoG的外来基因。MmoG可具有SEQ ID NO:17的氨基酸序列。编码MmoG的多核苷酸可具有SEQ ID NO:18的核苷酸序列。
所述重组微生物可以属于埃希氏菌属(Escherichia)或黄色杆菌属(xanthobacter)。埃希氏菌属可包括大肠杆菌(Escherichia coli)。黄色杆菌属可包括自养黄色杆菌。
对于重组微生物,细胞色素P450可以是任意细胞色素P450,只要其从微生物中的基因表达为具有单加氧酶活性。细胞色素P450可以是细菌P450。细胞色素P450蛋白可以属于EC 1.14.15.1或EC 1.14.14.1。细胞色素P450蛋白可以是P450Cam或P450BM3。P450Cam可源自恶臭假单胞菌(Pseudomonas putida)PpG786。P450BM3可源自巨大芽孢杆菌(Bacillus megaterium)(ATCC14581)。细胞色素P450蛋白可以是CamA,CamB和CamC的复合物。CamA, CamB和CamC可分别具有SEQ ID NO:37,39和41的氨基酸序列。编码CamA,CamB和CamC的基因可分别具有SEQ ID NO:36,38和40的核苷酸序列。
P450BM3可以是具有SEQ ID NO:43的氨基酸序列的蛋白质。编码P450BM3的基因可具有SEQ ID NO:42的核苷酸序列。
所述基因可包含SEQ ID NO:36,38,40和42的核苷酸序列的一种或多种。
重组微生物可具有增加以下酶水平的遗传修饰,所述酶催化NADPH生产反应以通过该反应增加胞内NADPH水平。所述遗传修饰包括内源基因的扩增和外来基因的引入。所述酶可以是属于EC 1.1.1.49的蛋白质。该酶可以是葡萄糖-6-磷酸脱氢酶(G6PD或G6PDH)。重组微生物可进一步包含编码G6PDH的外来基因。
对于重组微生物,所述微生物可包含一种或更多种,例如2种以上、3种以上、4种以上、5种以上、10种以上、或50种以上的编码具有羟化酶活性的蛋白质的外来基因。当所述微生物中包括多种基因时,基因可以彼此不同或它们可包含相同基因的多个拷贝。基因可以整合到微生物的基因组中,或者独立于基因组。
重组微生物可以降低样品中CHnF4-n(其中n是0至3的整数)(下文称为“氟化甲烷”)的浓度。该降低可以通过将羟基基团引入氟化甲烷的碳(通过蛋白质作用于其C-F或C-H键)或通过积累微生物细胞内部的氟化甲烷来实施。进一步地,降低可包括切割CHnF4-n的C-F键,将CHnF4-n转化成其他材料,或CHnF4-n的胞内积累。样品可以是液态或气态。样品可以是工业废水或废气。样品可以是包含氟化甲烷的任何样品。氟化甲烷可包含CF4、CHF3、CH2F2、CH3F、或其混合物。
所述重组微生物可包含编码选自下组的具有羟化酶活性的一种或多种蛋白质的外来基因:源自自养黄色杆菌的卤代烷脱卤素酶(dhlA)、源自自养黄色杆菌的(S)-2-卤酸脱卤素酶(dhlB)、源自恶臭假单胞菌的P450CAM、源自巨大芽孢杆菌的P450BM3、和源自荚膜甲基球菌的可溶甲烷单加氧酶(sMMO)。
对于重组微生物,可通过本领域中已知的一般方法将基因引入微生物,例如转化、电穿孔等。
另一个方面提供了用于降低样品中CHnF4-n(其中n是0至3的整数)浓度的 组合物,所述组合物包含重组微生物、其裂解物、或裂解物的水性级分,其中所述重组微生物包含一种或多种编码具有羟化酶活性的蛋白质的外来基因,且所述重组微生物相比于该重组微生物的亲本菌株具有增加的羟化酶活性。
对于组合物,重组微生物、样品和氟化甲烷与上文所描述的相同。
裂解物指暴露于细胞外部的微生物内容物,其通过破坏微生物获得。裂解物可通过使用酶如蛋白酶和脂肪酶、热、压力等破坏微生物来获得。“水性级分”可从溶解于水性溶剂的材料获得。水性溶剂可以是水。在一些实施方案中,“水性级分”是全部水性级分,即用水性溶剂萃取且没有从水性级分进一步纯化或分离组分的级分。
对于组合物,术语“降低”包括降低样品中氟化甲烷的浓度或从样品完全除去氟化甲烷。样品可以是气体或液体。样品可以没有微生物。组合物还可包含增加氟化甲烷在培养基或培养物中溶解度的材料。
所述组合物可通过与样品接触来降低样品中氟化甲烷的浓度。接触可在液相或固相进行。接触可以例如通过使微生物的培养物与样品在培养期间接触来进行。培养可以在微生物可增殖的条件下进行。
仍在另一个方面,提供了降低样品中CHnF4-n浓度的方法,所述方法包括使重组微生物、其裂解物、或裂解物的水性级分与含有CHnF4-n(其中n是0至3的整数)的样品接触以降低样品中CHnF4-n(其中n是0至3的整数)的浓度,其中所述重组微生物包含一种或多种编码具有羟化酶活性的蛋白质的外来基因,且所述重组微生物相比于该重组微生物的亲本菌株具有增加的羟化酶活性。
对于所述方法,由于重组微生物包含编码具有羟化酶活性的蛋白质的一种或多种外来基因,所述微生物相比于该重组微生物的亲本菌株具有增加的羟化酶活性,其裂解物、或裂解物的水性级分、和含CHnF4-n(其中n是0至3的整数)的样品与上文描述的相同。
对于所述方法,接触可在液相或固相进行。接触可以例如通过培养的微生物的培养物与样品在培养期间接触来进行。培养可以在其中微生物可增殖的条件下进行。接触可以在密封的容器中实施。接触可以在微生物的生长阶段在指数期或稳定期时实施。培养可以在需氧或厌氧条件下实施。接触可以在其中重组微生物可存活的条件下在密封的容器中实施。重组微生物可存活的条件可以是重组微生物可增殖的条件或重组微生物可允许处于静息态 (resting state)的条件。
对于所述方法,样品可以是液态或气态。样品可以是工业废水或废气。样品可以包含使样品与微生物的培养物被动接触,和使样品与微生物的培养物主动接触。样品可以例如喷射到微生物的培养物中。亦即,样品可以喷射到培养基或培养物中。喷射可以是样品从培养基或培养物的底部喷射到顶部。喷射可以是注入样品的液滴。
对于所述方法,接触可以以分批或连续方式实施。接触可包括例如使新鲜重组微生物、其裂解物或裂解物的水性级分与降低中获得的样品接触,其中所述重组微生物包含一种或多种编码具有羟化酶活性的蛋白质的外来基因,且所述重组微生物相比于该重组微生物的亲本菌株具有增加的羟化酶活性。与新鲜微生物、其裂解物或裂解物的水性级分的接触可以实施两次或更多次,例如两次、三次、五次或十次或更多。可以持续或重复接触直至样品中氟化甲烷的浓度达到期望的降低的浓度。
根据一个方面的重组微生物可用于除去样品中的CHnF4-n。
根据另一个方面的组合物可用于除去样品中的CHnF4-n。
根据又一个方面的降低样品中CHnF4-n浓度的方法可用于有效降低样品中CHnF4-n的浓度。
现将对实施方案进行具体提述,其例子在所附附图中示例,其中类似的参照编号贯穿全文指代类似的要素。在此方面,当前实施方案可以具有不同的形式且不应理解为局限于本文中列出的描述。因此,仅在下文通过参照附图描述实施方案来解释各方面。
下文中,本发明将参照实施例更详细地描述。然而,这些实施例仅用于例示性目的,且本发明的范围不意图受这些实施例限制。
实施例
实施例1:通过引入脱卤素酶的大肠杆菌分解三氟甲
(1)将脱卤素酶基因引入大肠杆菌
(1.1)dhlA和dhlB基因的引入
选择自养黄色杆菌GJ10的卤代烷脱卤素酶(dhlA)和(S)-2-卤酸脱卤素酶(dhlB)作为具有分解含氟烃的活性的酶。自养黄色杆菌GJ10购自德国微生物和细胞培养物保藏中心(German Collection of Microorganisms and Cell Cultures)(DSMZ)。
将编码卤代烷脱卤素酶(dhlA)的基因(SEQ ID NO:3)和编码(S)-2-卤酸脱卤素酶(dhlB)的基因(SEQ ID NO:4)分别插入pET28a载体(Novagen)的NdeI和HindIII位点,从而获得表达dhlA的载体pET28a_dhlA,和表达dhlB的载体pET28a_dhlB。将这些载体分别引入大肠杆菌中,然后通过测序确认其引入。引入卤代烷脱卤素酶的大肠杆菌和引入(S)-2-卤酸脱卤素酶的大肠杆菌分别称为大肠杆菌_dhlA和大肠杆菌_dhlB。
(1.2)CfrA基因的引入
将编码脱卤杆菌菌种(Dehalobacter sp.)CF的氯仿还原性脱卤素酶(CfrA)的基因(SEQ ID NO:56)插入pMALc2载体(New England Biolabs Inc.)的EcoRI位点以获得表达CrfA的载体pMALc2-CfrA。将该载体引入大肠杆菌BL21Star中,且其引入通过测序确认。引入CfrA基因的大肠杆菌称为大肠杆菌BL21star/pMALc2-CfrA。
(2)通过引入卤代烷脱卤素酶的大肠杆菌分解三氟甲
将在第(1)部分中获得的大肠杆菌_dhlA和大肠杆菌_dhlB分别以2x109个细胞/ml的密度置于含M9培养基的摇动反应器(Daihan Labtech)中,并在30℃在230rpm的摇动下与初始浓度为顶空体积中200ppm(见图1A)或600ppm(仅对大肠杆菌_dhlA实施:见图1B)的CHF3一起在摇动培养箱(Daihan Labtech)中温育48小时。然后,分析顶空中CHF3的量。为了分析,使用注射器从顶空收集0.5ml并注射到GC(Agilent 7890,Palo Alto,CA,USA)。注射的CHF3经由CP-PoraBOND Q柱(25m长度,0.32mm i.d.,5um膜厚度,Agilent)分离,并通过MSD(Agilent 5973,Palo Alto,CA,USA)分析CHF3浓度的变化。作为载体气体使用氦气,并以1.5ml/min的流速应用于柱。GC条件如下:入口温度为250℃,初始温度维持在40℃达2分钟,且温度以20℃/min的速率升至290℃。MS条件如下:电离能量为70eV,界面温度为280℃,离子源温度为230℃,和四极(quadrupole)温度为150℃。除非另外提述,对气体如CHF3,CHCl3和CF4的分析通过使用上述方法进行。作为对照组,将200ppm的CHF3在相同条件下在没有细胞时温育,然后测量。M9培养基包含0.015g/l的CaCl2,6g/l的Na2HPO4,3g/l的KH2PO4,0.5g/l的NaCl,1g/l的NH4Cl,0.5g/l的MgSO4,和2.0g/l葡萄糖。
图1A显示通过重组大肠杆菌分解三氟甲的实验结果。如图1A中显示的, 大肠杆菌_dhlA和大肠杆菌_dhlB分别显示三氟甲量中6%和7%降低。图1A的这一结果表明卤代烷脱卤素酶和(S)-2-卤酸脱卤素酶具有三氟甲分解能力。
图1B显示通过引入卤代烷脱卤素酶的大肠杆菌分解三氟甲的实验结果。如图1B中显示的,与对照组相比,大肠杆菌_dhlA显示三氟甲量中12.4%的降低。图1B的这一结果表明当三氟甲烷的初始浓度更高时,引入卤代烷脱卤素酶的大肠杆菌每小时能分解更大量的三氟甲烷。
(3)通过引入卤代烷脱卤素酶的大肠杆菌分解全氟甲烷
检查引入自养黄色杆菌GJ10来源的卤代烷脱卤素酶的大肠杆菌是否具有分解全氟甲烷(CF4)的能力。
以与第(2)部分中相同的方式来分析CF4浓度的降低,只是使用大肠杆菌_dhlA且以顶空浓度600ppm来添加CF4。
图2A显示通过引入卤代烷脱卤素酶的大肠杆菌分解全氟甲烷的实验结果。如图2A中显示的,与对照组相比,大肠杆菌_dhlA显示全氟甲烷量中的7.6%降低。图2A的这一结果表明引入卤代烷脱卤素酶的大肠杆菌具有全氟甲烷分解能力。
另外,将第(1)部分中制备的大肠杆菌BL21star/pMALc2-CfrA接种到摇动培养箱中的培养基中,并在存在0.2mM IPTG和1μM钴胺素辅因子的情况下在20℃温育20小时以诱导CfrA基因的表达。从培养物获得细胞团粒,并裂解于作为裂解溶液的PBS缓冲液(Sigma-Aldrich Inc.)中以获得裂解物。从裂解物获得粗提取物。接着,将2mM Ti(III)-NTA,2mM甲基紫精(methylviologen)和5ml粗提取物添加到血清瓶,并以1,000ppm的顶空浓度添加CF4。将该瓶密封并在30℃温育预定的时间。以相同的方式准备阴性对照(NC),只是使用大肠杆菌BL21star。结果,最终分解了12%CF4。细胞的比活性为0.0044单位/g细胞。对CF4的分析与上文所述相同。
图2B显示通过大肠杆菌BL21star/pMALc2-CfrA样品中CF4浓度的变化,其使用阴性对照值标准化。在图2B中,△峰面积代表CfrA面积-阴性对照面积,且分解率代表△峰面积/阴性对照值。
实施例2:表达P450CAM基因的重组大肠杆菌和通过使用其从样品中除去卤代甲烷
在本实施例中,制备表达P450CAM基因的重组大肠杆菌,并检查通过使用其除去样品中卤代甲烷即CHF3,CF4或CHCl3的效果。
(1)制备表达P450CAM基因的重组大肠杆菌
作为P450CAM基因,从恶臭假单胞菌PpG786菌株的CAM质粒分别扩增camC、camA和camB基因。camC、camA和camB基因具有SEQ ID NO:40,36和38的核苷酸序列,且编码SEQ ID NO:41,37和39的氨基酸序列。具体而言,在LB培养基中在30℃以230rpm过夜培养恶臭假单胞菌PpG786菌株DSM7162,然后使用总DNA提取试剂盒(Invitrogen Biotechnology)分离CAM质粒。使用CAM质粒作为模板和具有SEQ ID NO:46和47的核苷酸序列的一组引物;具有SEQ ID NO:48和49的核苷酸序列的一组引物;和具有SEQ ID NO:50和51的核苷酸序列的一组引物具有SEQ ID NO:46和47的核苷酸序列的一组引物来实施PCR以分别扩增和获得camA、camB和camC基因。
使用InFusion克隆试剂盒(Clontech Laboratories,Inc.),将通过使用具有SEQ ID NO:46和47的核苷酸序列的一组引物的PCR扩增的camC基因与用限制酶NcoI和HindII消化的pETDuet(Novagen,货号71146-3)连接来制备pETDuet-camC载体。进一步地,将制备的pETDuet-camC载体用限制酶NdeI和XhoI消化,并使用InFusion克隆试剂盒(Clontech Laboratories,Inc.)与扩增的camA和camB基因片段连接来制备pETDuet-camC-camAB载体。
图3显示pETDuet-camC-camAB载体的载体图谱。
接着,通过热休克方法(Sambrook,J&Russell,D.W.,New York:Cold Spring Harbor Laboratory Press,2001)使大肠杆菌BL21菌株引入制备的pETDuet-camC-camAB载体,然后在含有氨苄青霉素(100μg/mL)的LB板上培养。选择显示氨苄青霉素抗性的菌株。最后,将如此选出的菌株命名为重组大肠杆菌BL21/pETDuet-camC-camAB。
(2)通过表达P450CAM基因的重组大肠杆菌从样品除去CHF3或CHCl3的效果
在此部分中,检查在第(1)部分中制备的引入P450CAM基因的大肠杆菌BL21/pETDuet-camC-camAB菌株是否影响从样品除去CHF3或CHCl3。具体而言,在30℃在以230rpm搅拌下在Terrific Broth(TB)培养基中培养大肠杆菌BL21/pETDuet-camC-camAB。在OD600约0.5时,向其添加0.5mM的IPTG,接着在25℃在以230rpm搅拌下过夜培养。收获细胞并悬浮于M9培养基中至细胞密度为OD600为2.5。将10ml的该细胞悬液添加至60ml血清瓶,然后将该瓶密封。TB培养基包含12g的胰化蛋白胨、24g的酵母提取物、5g的甘油和 89mM磷酸盐缓冲剂每1L蒸馏水。
接着,使用注射器经由血清瓶盖的橡胶塞注射气相CHF3至其顶空浓度为200ppm。进一步地,使用注射器经由血清瓶盖的橡胶塞注射液相CHCl3至其在培养基中浓度为0.02mM。之后,将血清瓶在30℃和200rpm温育18小时至152小时,同时搅拌。每种实验一式三份实施。在预定的时间分析顶空气体。
图4显示当在与含CHF3的气体接触的培养基中培养大肠杆菌BL21/pETDuet-camC-camAB时CHF3顶空浓度随时间的变化。
图5A显示当在含CHCl3的培养基中培养大肠杆菌BL21/pETDuet-camC-camAB时CHCl3顶空浓度随时间的变化。在图4、5A和5B中,NC表示阴性对照组,而‘CAM’表示通过使用大肠杆菌BL21/pETDuet-camC-camAB实施的实验。如图4中显示的,当培养大肠杆菌BL21/pETDuet-camC-camAB达62小时和152小时时,与对照组相比,CHF3的顶空浓度降低了约5.62%和约17.3%。进一步地,如图5A中显示的,当培养大肠杆菌BL21/pETDuet-camC-camAB达18小时时,与对照组相比,CHCl3的顶空浓度降低了约14.8%。
(3)通过表达P450CAM基因的重组大肠杆菌除去样品中CF4的效果
在此部分中,检查在第(1)部分中制备的引入P450CAM基因的大肠杆菌BL21/pETDuet-camC-camAB菌株是否影响样品中CF4的除去。
以与第(2)部分中针对CHF3实施的方法相同的方式实施实验,只是使用CF4而不是CHF3,并使用注射器经由血清瓶盖的橡胶塞注射气相CF4至其顶空浓度为1000ppm。之后,以相同方式实施实验,只是将血清瓶在30℃和200rpm温育7天,同时搅拌。结果与图5B中相同。
图5B显示当在与含CF4的气体接触的培养基中培养大肠杆菌BL21/pETDuet-camC-camAB时CF4顶空浓度随时间的变化。如图5B中显示的,当培养大肠杆菌BL21/pETDuet-camC-camAB达7天时,与对照组相比,CF4的顶空浓度降低了约3.57%。
实施例3:表达P450BM3基因的重组大肠杆菌和通过使用其除去样品中的卤代甲烷
在本实施例中,制备表达P450BM3基因的重组大肠杆菌,并检查通过使用其除去样品中卤代甲烷即CHF3、CF4或CHCl3的效果。
(1)制备表达P450BM3基因的重组大肠杆菌
扩增巨大芽孢杆菌(ATCC 14581)菌株的P450BM3基因。P450BM3基因具有SEQ ID NO:42的核苷酸序列,且编码SEQ ID NO:43的氨基酸序列。具体而言,在LB培养基中在30℃在230rpm搅拌下过夜培养巨大芽孢杆菌(ATCC14581),然后使用总DNA提取试剂盒(Invitrogen Biotechnology)分离基因组DNA。使用该基因组DNA作为模板和具有SEQ ID NO:52和53的核苷酸序列的一组引物实施PCR以扩增和获得P450BM3基因。使用InFusion克隆试剂盒(Clontech Laboratories,Inc.),将如此扩增的P450BM3基因与用限制酶NcoI和XhoI消化的pET28a(Novagen,货号69864-3)连接来制备pET28a-P450BM3载体。图6显示pET28a-P450BM3载体的载体图谱。
进一步地,为了增加胞内NADPH水平,扩增编码大肠杆菌K12(MG1655)的葡萄糖6-磷酸脱氢酶的zwf基因。Zwf基因具有SEQ ID NO:44的核苷酸序列,且编码SEQ ID NO:45的氨基酸序列。详细而言,在LB培养基中在30℃在230rpm搅拌下过夜培养大肠杆菌,然后使用总DNA提取试剂盒(Invitrogen Biotechnology)分离基因组DNA。使用该基因组DNA作为模板和具有SEQ ID NO:54和55的核苷酸序列的一组引物实施PCR以扩增和获得zwf基因。使用InFusion克隆试剂盒(Clontech Laboratories,Inc.),将如此扩增的zwf基因与用限制酶NcoI和SacI消化的pACYCDuet(Novagen,货号71147-3)连接来制备pACYCDuet-zwf载体。图7显示pACYCDuet-zwf载体的载体图谱。
然后,通过热休克方法使大肠杆菌BL21菌株引入制备的pET28a-P450BM3载体,然后在含有卡那霉素(50μg/mL)的LB板上培养。选择显示卡那霉素抗性的菌株。最后,将如此选出的菌株命名为重组大肠杆菌BL21/pET28a-P450BM3。
进一步地,通过热休克方法使大肠杆菌BL21菌株引入制备的pET28a-P450BM3载体和pACYCDuet-zwf载体,然后在含有卡那霉素(50μg/mL)和氯霉素(35μg/mL)的LB板上培养。选择显示卡那霉素抗性和氯霉素抗性的菌株。最后,将如此选出的菌株命名为重组大肠杆菌BL21/pET28a-P450BM3+pACYCDuet-zwf。
(2)通过表达P450BM3基因的重组大肠杆菌除去样品中CHF3或CHCl3的效果
在此部分中,检查在第(1)部分中制备的引入P450BM3基因的重组大肠杆菌BL21/pET28a-P450BM3菌株或BL21/pET28a-P450BM3+pACYCDuet-zwf菌株 是否影响样品中CHF3或CHCl3的除去。
具体而言,在30℃在以230rpm搅拌下在TB培养基中培养大肠杆菌BL21/pET28a-P450BM3或BL21/pET28a-P450BM3+pACYCDuet-zwf菌株。在OD600约0.5时,向其添加0.2mM的IPTG,接着在25℃和230rpm过夜培养。收获细胞并悬浮于M9培养基中至细胞密度为OD600为2.5。将10ml的该细胞悬液添加至60ml血清瓶,然后将该瓶密封。TB培养基和M9培养基与实施例2中描述的那些相同。
接着,使用注射器经由血清瓶盖的橡胶塞注射气相CHF3至其顶空浓度为200ppm。进一步地,使用注射器经由血清瓶盖的橡胶塞注射液相CHCl3至其在培养基中浓度为0.02mM。之后,将血清瓶在30℃和230rpm温育15小时至142小时,同时搅拌。每种实验一式三份实施。
在与实施例2的(2)相同的条件下,在培养期间以预定的时间间隔分析血清瓶中CHF3或CHCl3的顶空浓度。
图8显示当在与含CHF3的气体接触的培养基中培养大肠杆菌BL21/pET28a-P450BM3或BL21/pET28a-P450BM3+pACYCDuet-zwf菌株达142小时时CHF3顶空浓度随时间的变化。
图9A显示当在含CHCl3的培养基中培养大肠杆菌BL21/pET28a-P450BM3达15小时时CHCl3顶空浓度的变化。在图8、9A和9B中,NC表示阴性对照组,‘BM3’表示通过使用大肠杆菌BL21/pET28a-P450BM3实施的实验,而‘BM3+Zwf’表示通过使用大肠杆菌BL21/pET28a-P450BM3+pACYCDuet-zwf实施的实验。如图8中显示的,当培养大肠杆菌BL21/pET28a-P450BM3和大肠杆菌BL21/pET28a-P450BM3+pACYCDuet-zwf达70小时和142小时时,与对照组相比,CHF3的顶空浓度对于70小时分别降低了约3.93%和4.57%,对于142小时分别降低了约4.15%和11.03%。进一步地,如图9A中显示的,当其培养15小时时,与对照组相比,CHCl3的顶空浓度降低了约4.1%。
(3)通过表达P450BM3基因的重组大肠杆菌除去样品中CF4的效果
在此部分中,检查在第(1)部分中制备的引入P450BM3基因的重组大肠杆菌BL21/pET28a-P450BM3菌株是否影响样品中CF4的除去。
以与第(2)部分中针对CHF3实施的方法相同的方式实施实验,只是使用CF4而不是CHF3,并使用注射器经由血清瓶盖的橡胶塞注射气相CF4至其顶空浓度为1000ppm。之后,以相同方式实施实验,只是将血清瓶在30℃和200 rpm温育7天,同时搅拌。结果与图9B中相同。
图9B显示当在与含CF4的气体接触的培养基中培养大肠杆菌BL21/pET28a-P450BM3达7天时CF4顶空浓度随时间的变化。如图9B中显示的,当培养大肠杆菌BL21/pET28a-P450BM达7天时,与对照组相比,CF4的顶空浓度降低了约3.03%。
实施例4:表达sMMO基因的重组大肠杆菌和通过使用其除去样品中的卤代甲烷
在本实施例中,制备表达sMMO基因的重组大肠杆菌,并检查通过使用其除去样品中卤代甲烷即CHF3,CF4或CHCl3的效果。
(1)制备表达sMMO基因的重组大肠杆菌
从荚膜甲基球菌(Bath)菌株分别扩增sMMO基因,即mmoX,mmoY,mmoZ,mmoB,mmoC,mmoD和mmoG基因。mmoX,mmoY,mmoZ,mmoB,mmoC,mmoD和mmoG基因分别具有SEQ ID NO:6,8,10,12,14,16和18的核苷酸序列,且分别编码SEQ ID NO:5,7,9,11,13,15和17的氨基酸序列。
具体而言,使用荚膜甲基球菌(Bath)菌株(ATCC 33009D-5)的染色体DNA作为模板和具有SEQ ID NO:19和20的核苷酸序列的一组引物实施PCR以扩增SEQ ID NO:35的区域,其包含所有mmoX,mmoY,mmoZ,mmoB,mmoC和mmoD基因。使用InFusion克隆试剂盒(Clontech Laboratories,Inc.),将扩增的基因片段与用限制酶NcoI和XhoI消化的pET28a(Novagen,货号69864-3)连接来制备pET28a-mmoXYBZDC载体。图10A显示pET28a-mmoXYBZDC载体的载体图谱。
进一步地,为了使用大肠杆菌核糖体结合位点(RBS)表达sMMO基因,分别扩增mmoX,mmoY,mmoZ,mmoB,mmoC和mmoD,然后插入表达载体中。使用mmoX基因片段和mmoY基因片段作为模板和具有SEQ ID NO:21和24的核苷酸序列的一组引物扩增包含mmoX和mmoY基因的区域,所述mmoX基因片段通过使用具有SEQ ID NO:21和22的核苷酸序列的一组引物的PCR扩增,所述mmoY基因片段通过使用具有SEQ ID NO:23和24的核苷酸序列的一组引物的PCR扩增。使用InFusion克隆试剂盒(Clontech Laboratories,Inc.),将如此扩增的基因片段与用限制酶NcoI和HindIII消化的pETDuet(Novagen,货号71146-3)连接来制备pETDuet-mmoXY载体。进一步地,使用mmoZ基因片段和mmoD基因片段作为模板和具有SEQ ID NO:25和28的核 苷酸序列的一组引物扩增包含mmoZ和mmoD基因的区域,所述mmoZ基因片段通过使用具有SEQ ID NO:25和26的核苷酸序列的一组引物的PCR扩增,所述mmoD基因片段通过使用具有SEQ ID NO:27和28的核苷酸序列的一组引物的PCR扩增。使用InFusion克隆试剂盒(Clontech Laboratories,Inc.),将如此扩增的基因片段与用限制酶NdeI和XhoI消化的pETDuet-mmoXY连接来制备pETDuet-mmoXY-ZD载体。图10B显示pETDuet-mmoXY-ZD载体的载体图谱。
使用mmoB基因片段和mmoC基因片段作为模板和具有SEQ ID NO:29和32的核苷酸序列的一组引物扩增包含mmoB和mmoC基因的区域,所述mmoB基因片段通过使用具有SEQ ID NO:29和30核苷酸序列的一组引物的PCR扩增,所述mmoC基因片段通过使用具有SEQ ID NO:31和32的核苷酸序列的一组引物的PCR扩增。使用InFusion克隆试剂盒(Clontech Laboratories,Inc.),将如此扩增的基因片段与用限制酶NdeI和EcoRV消化的pACYCDuet(Novagen,货号71147-3)连接来制备pACYCDuet-mmoBC载体。图10C显示pACYCDuet-mmoBC载体的载体图谱。
使用InFusion克隆试剂盒(Clontech Laboratories,Inc.),将通过使用具有SEQ ID NO:33和34的核苷酸序列的一组引物的PCR扩增的mmoG基因片段与用限制酶NcoI和HindIII消化的pACYCDuet(Novagen,货号71147-3)连接来制备pACYCDuet-mmoG载体。进一步地,使用mmoB基因片段和mmoC基因片段作为模板和具有SEQ ID NO:29和32的核苷酸序列的一组引物扩增包含mmoB和mmoC基因的区域,所述mmoB基因片段通过使用具有SEQ ID NO:29和30核苷酸序列的一组引物的PCR扩增,所述mmoC基因片段通过使用具有SEQ ID NO:31和32的核苷酸序列的一组引物的PCR扩增。使用InFusion克隆试剂盒(Clontech Laboratories,Inc.),将如此扩增的基因片段与用限制酶NdeI和EcoRV消化的pACYCDuet-mmoG连接来制备pACYCDuet-mmoG-BC载体。图10D显示pACYCDuet-mmoG-BC载体的载体图谱。
接着,通过热休克方法使大肠杆菌BL21菌株分别引入制备的pETDuet-mmoXY-ZD载体和pACYCDuet-mmoBC载体,pETDuet-mmoXY-ZD和pACYCDuet-mmoG-BC载体,和pET28a-mmoXYBZDC载体中的每种,然后在含有100μg/mL氨苄青霉素和35μg/mL氯霉素或50μg/mL卡那霉素的LB板上培养。选择显示氨苄青霉素抗性和氯霉素或卡那霉素抗性的菌株。最后, 将如此选出的3种菌株命名为重组大肠杆菌BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoBC,BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoG-BC和BL21/pET28a-mmoXYBZDC。
(2)通过表达sMMO基因的重组大肠杆菌除去样品中CHF3或CHCl3的效果
在此部分中,检查在第(1)部分中制备的引入sMMO基因的重组大肠杆菌BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoBC,BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoG-BC和BL21/pET28a-mmoXYBZDC是否影响除去样品中的CHF3或CHCl3。作为对照组,使用引入空载体(不含sMMO基因)的大肠杆菌BL21/pETDuet+pACYCDuet或BL21/pET28a。
具体而言,在30℃和230rpm在搅拌下在Terrific Broth(TB)培养基中培养重组大肠杆菌BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoBC、BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoG-BC和BL21/pET28a-mmoXYBZDC的每种。在OD600约0.5时,向其添加0.1mM的IPTG和0.1mg/ml的柠檬酸铁、0.1mg/ml的硫酸亚铁、0.1mg/ml的柠檬酸铁铵和1mM半胱氨酸,接着在25℃和230rpm过夜培养。对于每种重组大肠杆菌,收获细胞并悬浮于含有4g/L葡萄糖的M9培养基中至细胞密度为OD600为2.5。将10ml的每种细胞悬液添加至60ml血清瓶,然后将该瓶密封。
接着,在CHF3反应的情况中,使用注射器经由血清瓶盖的橡胶塞注射气相CHF3至其顶空浓度为1000ppm。另外,在CHCl3反应的情况中,使用注射器经由血清瓶盖的橡胶塞注射液相CHCl3至其在培养基中浓度为0.02mM。之后,在30℃和200rpm,将CHF3反应的血清瓶温育94小时,将CHCl3反应的血清瓶温育25小时,同时搅拌。每种实验一式三份实施。
在与实施例2的(2)相同的条件下,在温育期间在预定的时间后,分析血清瓶中CHF3或CHCl3的顶空浓度。
图11显示当在与含CHF3的气体接触的培养基中培养重组大肠杆菌时CHF3顶空浓度的变化。在图11中,1表示对照组,而2至4表示分别使用重组大肠杆菌BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoBC,BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoG-BC和 BL21/pET28a-mmoXYBZDC实施的实验。如图11中显示的,当重组大肠杆菌BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoBC培养达94小时时,与对照组相比,CHF3的顶空浓度降低了约10%。另外,当重组大肠杆菌BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoG-BC和BL21/pET28a-mmoXYBZDC的每种培养达94小时时,与对照组相比,CHF3的顶空浓度降低了约15%。
图12A显示当在含CHCl3的培养基中培养重组大肠杆菌时CHCl3顶空浓度的变化。在图12A中,1至4与图11中描述的相同。如图12A显示的,当重组大肠杆菌BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoBC和BL21/pETDuet-mmoXY-ZD+pACYCDuet-mmoG-BC的每种培养达25小时时,与对照组相比,CHCl3的顶空浓度降低了约20%。此外,当BL21/pET28a-mmoXYBZDC培养达25小时时,与对照组相比,CHCl3的顶空浓度也降低了与其类似的水平。
(3)通过表达sMMO基因的重组大肠杆菌除去样品中CF4的效果
在此实施例中,检查在第(1)部分中制备的引入sMMO基因的重组大肠杆菌BL21/pET28a-mmoXYBZDC是否影响样品中CF4的除去。作为对照组,使用引入空载体(不含sMMO基因)的大肠杆菌BL21/pET28a。
以与第(2)部分中针对CHF3实施的方法相同的方式实施实验,只是使用CF4而不是CHF3,并使用注射器经由血清瓶盖的橡胶塞注射气相CF4至其顶空浓度为1000ppm,之后,将血清瓶在30℃和200rpm温育7天,同时搅拌。结果与图12B中相同。
图12B显示当在与含CF4的气体接触的培养基中培养重组大肠杆菌BL21/pET28a-mmoXYBZDC达7天时CF4顶空浓度的变化。在图12B中,NC表示阴性对照组,而‘MMO’表示通过使用大肠杆菌BL21/pET28a-mmoXYBZDC实施的实验。如图12B中显示的,当重组大肠杆菌BL21/pET28a-mmoXYBZDC培养达7天时,与对照组相比,CF4的顶空浓度降低了约3.42%。
实施例5:通过引入脱卤素酶的自养黄色杆菌分解四氟甲烷
实施PCR,其使用购自德国微生物和细胞培养物保藏中心(DSMZ)的自养黄色杆菌GJ10的基因组序列作为模板和具有SEQ ID NO:58和59的核苷酸序列的一组引物,并使用In-Fusion HD克隆试剂盒(Clontech),将如此扩增的 dhlA基因(SEQ ID NO:3)引入pTSa载体以制备pTSa_DhlA载体(SEQ ID NO:60)(ORF:2982-3914)。
将如此制备的载体通过电穿孔转化到自养黄色杆菌GJ10菌株中,并将确认具有dhlA基因的菌株称为Xantho_dhlA。在30℃在以230rpm搅拌下在含有50mL M9培养基的250mL塑料烧瓶中过夜培养该菌株。
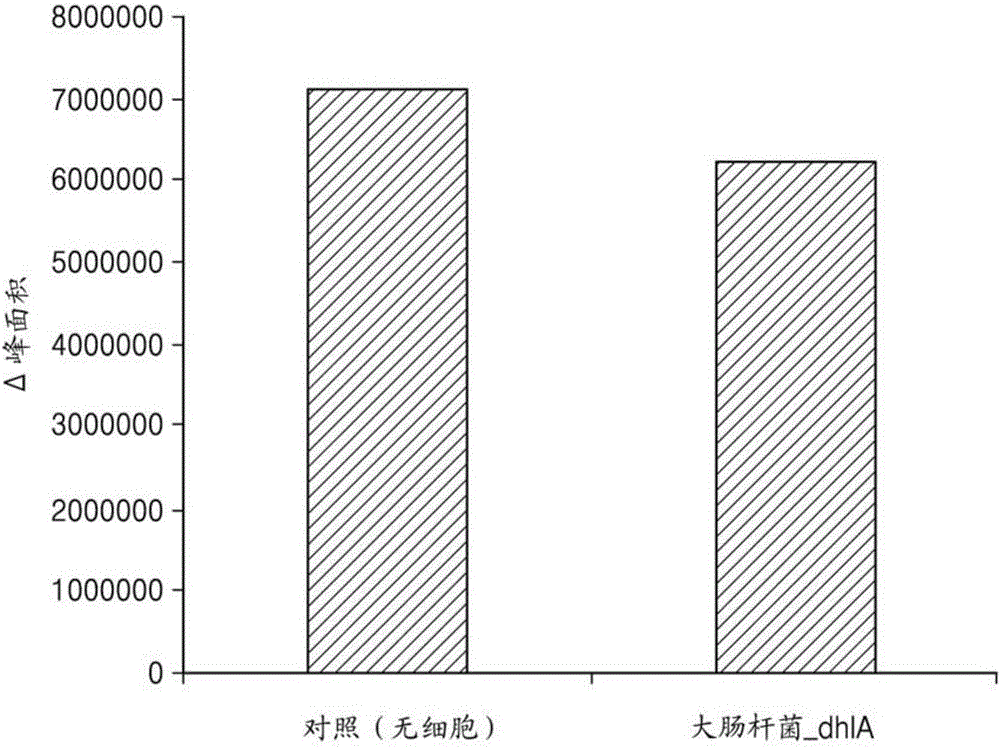
将含有10ml M9培养基中2x109个细胞/ml的Xantho_dhlA和顶空中600ppm或1000ppm的CF4的血清瓶在30℃在以230rpm搅拌下在摇动培养箱(Daihan Labtech)中温育48小时。之后,分析CF4的顶空浓度。以相同方式准备阴性对照,只是在无细胞情况下使用顶空浓度为600ppm或1000ppm的CF4和在相同条件下使用自养黄色杆菌GJ10。结果在图13A和13B中给出。在图13A和13B中,Xantho表示自养黄色杆菌GJ10,Xantho_dhlA表示自养黄色杆菌GJ10Xantho_dhlA,而垂直轴表示峰面积,即△峰面积。
图13A显示通过自养黄色杆菌GJ10对四氟甲烷的分解。如图13A显示的,当CF4的顶空浓度为600ppm时,与对照组相比,自养黄色杆菌GJ10将四氟甲烷的量降低了约12.94%。
图13B显示通过自养黄色杆菌GJ10Xantho_dhlA对四氟甲烷的分解。如图13B显示的,当CF4的顶空浓度为1000ppm时,与对照组相比,黄色自养杆菌GJ10Xantho_dhlA和黄色自养杆菌GJ10将四氟甲烷的量分别降低了约16.29%和12.04%。因此,与黄色自养杆菌GJ10相比,黄色自养杆菌GJ10Xantho_dhlA显示显著有效的CF4分解。
应当理解,应当仅以描述性意义而非为了限制目的考虑本文中描述的例示性实施方案。每个实施方案内的特征或方面的描述应当通常认为可用于其它实施方案中的其它类似的特征或方面。
尽管已参照附图描述了一个或多个实施方案,但本领域普通技术人员将理解可对其中进行形式和细节的多种变化而不背离如由权利要求所限定的精神和范围。
本文中引用的所有参考文献,包括出版物,专利申请,和专利在此通过提及并入,其程度就像每篇参考文献单独且明确指示为通过提及并入并且在本文中完整列出一样。
除非本文中另外指示或与上下文清楚地冲突,术语“一个/一种”和“该”及“至少一个/一种”及类似指代物在描述本发明的背景中(尤其在所附权利 要求的背景中)的使用应理解为涵盖单数和复数。术语“至少一个/种”及伴随的一批一个或多个项(例如,“A和B中的至少一种”)的使用应当解释为意指选自列出项的一项(A或B)或两种或更多种列出项的任何组合(A和B),除非本文中另有指示或上下文明显矛盾。术语“包含”、“具有”、“包括”和“含有”应当解释为开放式术语(即意味着“包括但不限于”),除非另有记录。本文中数值范围的叙述仅意图充当单独提及落入范围内的每个分开数值的简写方法,除非本文中另有指示,并且每个分开数值就像其单独在本文中叙述一样并入说明书。可以以任何合适的次序实施本文中描述的所有方法,除非本文中另有指示或上下文另外明显矛盾。本文中提供的任何和所有例子,或例示性语言(例如“如”)的使用仅意图更好阐明本发明,并且不对本发明的范围造成限制,除非另有要求。说明书中的语言不应解释为指示任何不要求保护的要素为本发明的实践必需的。
本文中描述了本发明的优选实施方案,包括用于实施本发明的发明人已知的最佳模式。那些优选的实施方案的变型在阅读前述描述后对于本领域普通技术人员会变得显而易见。发明人预期熟练技术人员在适当时采用此类变型,并且发明人意图本发明以与本文中的明确描述不同的方式实施。因而,本发明包括可适用法律容许的所附权利要求书中叙述的主题的所有修改和等同方案。此外,本发明涵盖其所有可能变型中的上文描述的要素的任何组合,除非本文中另有指示或上下文另外明显矛盾。
- 还没有人留言评论。精彩留言会获得点赞!
- 腈水解酶突变体及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白AsTMK1及其编码基因和应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种花狭口蛙的基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种泽陆蛙基因及其编码的多肽和该多肽的用途的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 甘薯耐逆相关蛋白IbFBA2、编码基因、重组载体与应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 植物抗旱相关蛋白EtSnRK2.2及其编码基因和应用的制造方法与工艺
- OsSAPK7蛋白及其编码基因在提高水稻白叶枯病抗性中的应用的制造方法与工艺
- 一种抗除草剂抗虫融合基因、编码蛋白及应用的制造方法与工艺
- 毛果杨PtrZFP103基因及其编码蛋白和应用的制造方法与工艺
- 大豆bHLH转录因子基因GmFER及其编码蛋白和应用的制造方法与工艺
- 一种水稻MIT1基因、其编码蛋白及应用的制造方法与工艺
- 蛋白StTrxF、编码基因及其在提高植物淀粉含量中的应用的制造方法与工艺
- 蛋白质及其编码基因在调控植物抗黄萎病性中的应用的制造方法与工艺
- 植物抗旱相关蛋白ZmNAC111及其编码基因与应用的制造方法与工艺
- 核盘菌凝集素SSL‑6蛋白及其编码基因与应用的制造方法与工艺