一种β‑肾上腺受体激动剂多残留检测电化学传感器及其检测方法与流程
本发明属于食品安全检测和分析技术领域,涉及一种电化学传感器及其检测方法,具体地涉及一种β-肾上腺素受体激动剂多残留检测电化学传感器及其检测方法。
背景技术:
β-肾上腺素受体激动剂是属于苯乙醇胺类衍生物,有包括克伦特罗(CLB)在内的20多个结构和性质相类似的化合物,因可提高动物蛋白质含量而曾经被用作动物饲料添加剂。因β-肾上腺素受体激动剂具有导致人体产生内分泌紊乱、染色体畸变及恶性肿瘤甚至致死等危害,目前我国和世界上大多数国家都明文禁止此类化合物用作饲料添加剂。
目前,β-肾上腺素受体激动剂类药物残留的检测方法主要包括高效液相色谱法(HPLC)、液相色谱-质谱联用法(LC-MS)、气相色谱-质谱联用法(GC-MS)、酶联免疫法(ELISA)和荧光免疫法(FIA)等。
色谱法是β-肾上腺素受体激动剂残留的主要检测方法,但是色谱法检测成本高、操作复杂费时、不适合大量样品的快速检测;而免疫法的核心是抗体,具有特异性强、样品前处理简单等优点,但抗体的特异性识别也决定了它的致命缺点:即一种抗体检测一种β-肾上腺素受体激动剂,无法检测其它的同类型化合物;因此一个样品如需检测多种β-激动剂的残留量需要使用多种检测产品,大大提高了检测成本和工作时间,失去了快速筛选的意义。此外,不断出现的新的β-激动剂替代品由于缺乏相应的抗体及针对性检测技术,极容易造成漏检。
β-肾上腺素受体在人体中主要分布于骨骼肌、肝脏血管平滑肌、心肌和脂肪细胞等部位,能与β-肾上腺素受体激动剂结合而引起腺苷酸环化酶(AC)的活化,生成环磷酸腺苷(cAMP),活化蛋白激酶A(PKA),从而实现舒张平滑肌、促进脂肪代谢等作用。β-肾上腺素受体能与所有β-肾上腺素受体激动剂相结合,甚至包括未被发现的β-肾上腺素受体激动剂,只是结合强弱有所不同,这种对β-肾上腺素受体激动剂的宽谱识别性使得其在实现β-肾上腺素受体激动剂多残留检测方面有很好的应用前景。
技术实现要素:
本发明的目的在于提供一种β-肾上腺素受体激动剂多残留检测电化学传感器,所述的传感器可用于β-激动剂多残留检测。
本发明的另一目的还在于提供一种β-肾上腺素受体激动剂多残留电化学检测方法,所述的方法操作简单、检测时间短、成本低,同时具有非常高的灵敏度(pg级)和很宽的线性范围(10-2~102ng/ml),可应用于食品中多种β-激动剂的检测。
为实现上述目的,本发明所采用的技术方案如下:
一种β-肾上腺素受体激动剂多残留检测电化学传感器,包括基底玻碳电极,其特征在于,所述的基底玻碳电极表面修饰纳米金颗粒,将巯基乙酸自组装在所述的纳米金颗粒表面,采用N-溴代琥珀酰亚胺(NHS)和1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)活化羧基后,β-肾上腺素受体通过酰胺键偶联到电极表面修饰的纳米金颗粒上;
所述的β-肾上腺素受体为人源β2-肾上腺素受体重组蛋白,其氨基酸序列如序列表SEQ IDNO:1。
所述电化学传感器采用以下方法制备:首先将经过打磨、抛光和超声清洗的基底玻碳浸入氯金酸溶液中,采用恒电位法将氯金酸电化学还原为纳米金颗粒,并沉积于玻碳电极表面;再将玻碳电极置于质量浓度为0.5%的巯基乙酸水溶液中,通过自组装的方法在纳米金颗粒表面修饰巯基乙酸;再将玻碳电极置于含有0.05mol/L的N-溴代琥珀酰亚胺(NHS)和0.05mol/L的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)的2-(N-吗啡啉)乙磺酸缓冲液(MES)中,活化羧基;在上述活化羧基后的玻碳电极表面滴涂浓度为0.5mg/L的人源β2-肾上腺素受体重组蛋白,4℃条件下反应,制得所述的β-肾上腺素受体激动剂多残留检测电化学传感器。
采用所述的多残留检测电化学传感器,本发明还涉及一种β-肾上腺素受体激动剂多残留电化学检测方法,其特征在于,所述检测方法包括以下步骤:
(1)电化学检测传感器的制备:
首先对玻碳电极进行打磨、抛光和超声清洗;然后将纳米金颗粒修饰于电极表面,再通过自组装将巯基乙酸修饰在纳米金颗粒表面,最后采用NHS/EDC活化羧基后将β-肾上腺素受体通过酰胺键偶联到电极表面修饰的纳米金颗粒上;
(2)标准溶液的配制:配制一组包括空白标样在内的含有不同已知浓度的游离β-肾上腺素受体激动剂的三羟甲基氨基甲烷-盐酸(Tris-HCl)缓冲溶液为标准溶液;
(3)工作曲线的建立:将所述电化学传感器分别浸入步骤(2)中配制的标准溶液中孵育,用Tris-HCl缓冲溶液冲洗电化学传感器,置于含有K3[Fe(CN)6]的KCl溶液中进行电化学阻抗谱(EIS)扫描,测得结果以Nyquist图表示;代入Randles等效电路模型,计算出电化学传感器电极表面的电荷转移电阻(Rct);将激动剂浓度为零时所得的Rct值记为R0,含有β-肾上腺素受体激动剂标准溶液的Rct值记为Rx,Rct变化的百分比值(%)等于R0与Rx的差值与R0的百分比值,即(R0-Rx)/R0×100(%);将所述Rct变化的百分比值与β-肾上腺素受体激动剂标准溶液浓度对数值lgC绘制成(R0-Rx)/R0×100(%)-lgC工作曲线,或采用线性回归法得到(R0-Rx)/R0×100(%)-lgC线性回归方程;
(4)β-肾上腺素受体激动剂浓度的检测:
配制含β-肾上腺素受体激动剂的待测样品的三羟甲基氨基甲烷-盐酸(Tris-HCl)缓冲溶液,相同条件下按照步骤(3)对电化学传感器进行孵育和电化学阻抗谱(EIS)扫描,计算得到Rct变化的百分比值(%),根据(R0-Rx)/R0×100(%)-lgC工作曲线或线性回归方程,计算得到β-肾上腺素受体激动剂的浓度。
所述β-肾上腺素受体激动剂包括但不限于克伦特罗、沙丁胺醇、莱克多巴胺、特步他林、齐帕特罗和非诺特罗。
将本发明提供的电化学传感器及其检测方法用于多种β-肾上腺素受体激动剂的检测,其检出限分别为:克伦特罗3.5pg/ml,沙丁胺醇6.0pg/ml,莱克多巴胺8.5pg/ml,特步他林6.2pg/ml,齐帕特罗8.2pg/ml,非诺特罗9.3pg/ml;检测线性范围分别为:克伦特罗为0.01~100ng/ml,沙丁胺醇和特步他林为0.03~150ng/ml,莱克多巴胺为0.05~150ng/ml,齐帕特罗和非诺特罗为0.05~200ng/ml。
有益效果:本发明所述的电化学传感器是一种β-肾上腺素受体共价修饰的高灵敏β-激动剂多残留检测电化学传感器,所述的电化学传感器采用电化学阻抗法,以K3[Fe(CN)6]为探针,测量检测对象中β-肾上腺素受体激动剂与电化学传感器结合后电化学阻抗的变化。基于β-肾上腺素受体对β-肾上腺素受体激动剂的宽谱识别性,能实现对包括但不限于克伦特罗、沙丁胺醇、莱克多巴胺、特步他林、齐帕特罗和非诺特罗等β-激动剂的检测。所述的电化学传感器快速、高效、灵敏度极高、检测范围大,所述的方法具有非常低的检出限(3.5~9.3pg/ml)和很宽的线性范围(0.01~100ng/ml或0.05~200ng/ml)。
下面结合具体实施例对本发明进行详细描述。本发明的保护范围并不以具体实施方式为限,而是由权利要求加以限定。
附图说明
图1为本发明所述电化学传感器在含有不同浓度的克伦特罗(a)0ng/ml,(b)0.01ng/ml,(c)0.1ng/ml,(d)1ng/ml,(e)10ng/ml,(f)50ng/ml,(g)100ng/ml的孵育液中孵育后,在含有2mmol/L的K3[Fe(CN)6]的KCl溶液(浓度为0.1mol/L)中的EIS曲线图。
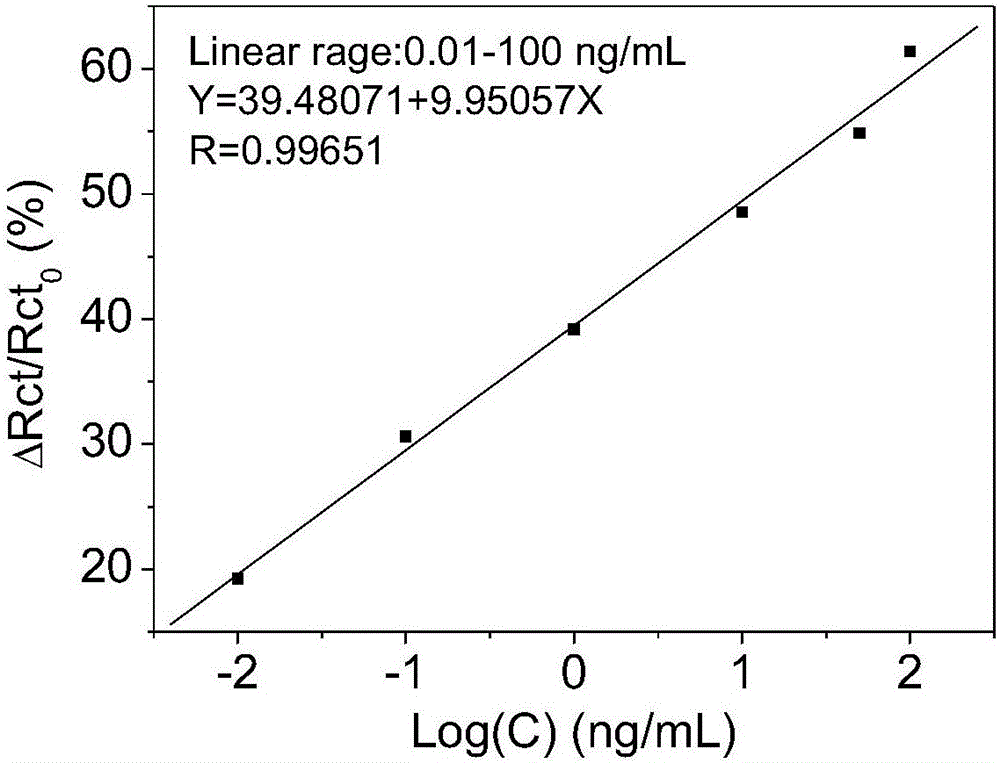
图2为Rct变化的百分比值(R0-Rx)/R0×100(%)与克伦特罗浓度对数值lgC的工作曲线图。
图3为本发明所述电化学传感器在含有不同浓度的莱克多巴胺(a)0ng/ml,(b)0.05ng/ml,(c)0.1ng/ml,(d)1ng/ml,(e)10ng/ml,(f)50ng/ml,(g)150ng/ml的孵育液中孵育后,在2mmol/L的K3[Fe(CN)6]的KCl溶液(浓度为0.1mol/L)中的EIS曲线图。
图4为Rct变化的百分比值(R0-Rx)/R0×100(%)与莱克多巴胺浓度对数值lgC的工作曲线图。
图5为本发明所述电化学传感器在含有不同浓度的齐帕特罗(a)0,(b)0.05ng/ml,(c)0.1ng/ml,(d)1ng/ml,(e)10ng/ml,(f)50ng/ml,(g)200ng/ml的孵育液中孵育后,在2mmol/L的K3[Fe(CN)6]的KCl溶液(浓度为0.1mol/L)中的EIS曲线图。
图6为Rct变化的百分比值(R0-Rx)/R0×100(%)与齐帕特罗浓度对数值lgC的工作曲线图。
具体实施方式
以下实施例中,采用电化学阻抗法进行β-激动剂多残留检测,所采用的电化学传感器是一种β-肾上腺素受体共价修饰的高灵敏β-激动剂多残留检测电化学传感器,所述的β-肾上腺素受体为人源β2-肾上腺素受体重组蛋白,其氨基酸序列为(SEQ ID NO:1):
MGQPGNGSAFLLAPNRSHAPDHDVTQQRDEVWVVGMGIVMSLIVLAIVFGNVLVITAIAKFERLQTVTNYFITSLACADLVMGLAVVPFGAAHILMKMWTFGNFWCEFWTSIDVLCVTASIETLCVIAVDRYFAITSPFKYQSLLTKNKARVIILMVWIVSGLTSFLPIQMHWYRATHQEAINCYANETCCDFFTNQAYAIASSIVSFYVPLVIMVFVYSRVFQEAKRQLQKIDKSEGRFHVQNLSQVEQDGRTGHGLRRSSKFCLKEHKALKTLGIIMGTFTLCWLPFFIVNIVHVIQDNLIRKEVYILLNWIGYVNSGFNPLIYCRSPDFRIAFQELLCLRRSSLKAYGNGYSSNGNTGEQSGYHVEQEKENKLLCEDLPGTEDFVGHQGTVPSDNIDSQGRNCSTNDSLL。
实施例1电化学传感器的制备
将直径为3mm的玻碳电极用0.3μm的氧化铝粉末在抛光绒布上打磨,依次用无水乙醇-蒸馏水(V/V=1/1)、蒸馏水超声清洗30s,再用蒸馏水冲洗干净。将上述电极插入质量浓度为1%的氯金酸溶液中进行恒电位电化学沉积(电压为-0.2V,沉积时间60s),用蒸馏水冲洗干净后浸入质量浓度为0.5%的巯基乙酸溶液中,置于冰箱中4℃过夜。将上述电极用蒸馏水冲洗干净后置于含有0.05mol/L的N-溴代琥珀酰亚胺(NHS)和0.05mol/L的1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)的2-(N-吗啡啉)乙磺酸缓冲液(MES)中,活化羧基60分钟。在上述活化羧基后的电极表面滴涂50μL人源β2肾上腺素受体重组蛋白(0.5mg/L),置于冰箱中4℃过夜,得到β2肾上腺素受体重组蛋白/纳米金修饰电极(β2AR-Au-GCE),即电化学传感器。
实施例2电化学传感器对克伦特罗(CL)的检测
将实施例1制备的电化学传感器浸入包括空白标样在内的含有一系列不同已知浓度的克伦特罗标准物质的三羟甲基氨基甲烷-盐酸(Tris-HCl)缓冲溶液(pH为8.0,体积为50μL)中,在37℃孵育30min,用Tris-HCl缓冲液冲洗后置于含有2mmol/L的K3[Fe(CN)6]的KCl溶液(0.1mol/L)中进行电化学阻抗谱(EIS)扫描,结果以Nyquist图表示(如附图1所示)。代入Randles等效电路模型,计算出其电极表面的电荷转移电阻(Rct);将克伦特罗浓度为零时所得的Rct值记为R0,含有一定浓度的克伦特罗标准物质时所得的Rct值记为Rx,计算Rct变化的百分比值(R0-Rx)/R0×100(%),以(R0-Rx)/R0×100(%)对克伦特罗的浓度对数值lgC(克伦特罗浓度C的单位为ng/ml)作图可得(R0-Rx)/R0×100(%)-lgC工作曲线(如附图2所示)。采用线性回归法得到(R0-Rx)/R0×100(%)-lgC线性回归方程:Y=39.48071+9.95057X(其中Y为Rct变化的百分比值(R0-Rx)/R0×100(%),X为克伦特罗的浓度对数值lgC),克伦特罗的浓度对数值lgC在-2.0~2.0范围内(即克伦特罗的浓度在0.01~100ng/ml范围内)与(R0-Rx)/R0×100(%)成正比,线性相关系数为0.99651。以大于噪音信号3倍的阻抗信号对应的浓度为最低检出限,重复5次以上实验得出,上述方法的最低检出限为3.5pg/ml。
实施例3电化学传感器对莱克多巴胺(RAC)的检测
将实施例1制备的电化学传感器浸入包括空白标样在内的含有一系列不同已知浓度的莱克多巴胺标准物质的Tris-HCl缓冲溶液(pH为8.0,体积为50μL)中,在37℃孵育30min,用Tris-HCl缓冲液冲洗后置于含有2mmol/L的K3[Fe(CN)6]的KCl溶液(0.1mol/L)中进行EIS扫描,结果以Nyquist图表示(如附图3所示)。代入Randles等效电路模型,计算出其电极表面的电荷转移电阻(Rct);将莱克多巴胺浓度为零时所得的Rct值记为R0,含有一定浓度的莱克多巴胺标准物质时所得的Rct值记为Rx,以与实施例2中相同的方法将(R0-Rx)/R0×100(%)对莱克多巴胺的浓度对数值lgC(莱克多巴胺浓度C的单位为ng/ml)作图可得(R0-Rx)/R0×100(%)-lgC工作曲线(如附图4所示)。采用线性回归法得到(R0-Rx)/R0×100(%)-lgC线性回归方程:Y=37.03335+10.19632X(其中Y为Rct变化的百分比值(R0-Rx)/R0×100(%),X为克伦特罗的浓度对数值lgC),莱克多巴胺的浓度对数值lgC在-1.301~2.176范围内(即莱克多巴胺的浓度在0.05~150ng/ml范围内)与(R0-Rx)/R0×100(%)成正比,线性相关系数为0.99655。以大于噪音信号3倍的阻抗信号对应的浓度为最低检出限,重复5次以上实验得出,上述方法的最低检出限为8.5pg/ml。
实施例4电化学传感器对齐帕特罗(ZIP)的检测
将实施例1制备的电化学传感器浸入包括空白标样在内的含有一系列不同已知浓度的齐帕特罗标准物质的Tris-HCl缓冲溶液(pH为8.0,体积为50μL)中,在37℃孵育30min,用Tris-HCl缓冲液冲洗后置于含有2mmol/L的K3[Fe(CN)6]的KCl溶液(0.1mol/L)中进行EIS扫描,结果以Nyquist图表示(如附图5所示)。代入Randles等效电路模型,计算出其电极表面的电荷转移电阻(Rct);将齐帕特罗浓度为零时所得的Rct值记为R0,含有一定浓度的齐帕特罗标准物质时所得的Rct值记为Rx,以与实施例2中相同的方法将(R0-Rx)/R0×100(%)对齐帕特罗的浓度对数值lgC(齐帕特罗浓度C的单位为ng/ml)作图可得(R0-Rx)/R0×100(%)-lgC工作曲线(如附图6所示)。采用线性回归法得到(R0-Rx)/R0×100(%)-lgC线性回归方程:Y=39.74209+7.03228X(其中Y为Rct变化的百分比值(R0-Rx)/R0×100(%),X为齐帕特罗的浓度对数值lgC),齐帕特罗的浓度对数值lgC在-1.301~2.301范围内(即齐帕特罗的浓度在0.05~200ng/ml范围内)与(R0-Rx)/R0×100(%)成正比,线性相关系数为0.99409。以大于噪音信号3倍的阻抗信号对应的浓度为最低检出限,重复5次以上实验得出,上述方法的最低检出限为8.2pg/ml。
实施例5猪肉样品中加标沙丁胺醇(SAL)的测定
1)猪肉样品的加标处理:称取1±0.0050g猪肉于到10ml的样品管中,加入沙丁胺醇标准液,和3ml乙腈-丙酮提取液(V:V=4:1),混合物超声振荡30分钟,于2000r/m下离心10分钟,将上清液转移至氮吹管中,残渣用3ml的相同提取液重复提取1次,上清液合并在氮吹管中。提取物在氮吹条件下于50℃温度下浓缩蒸发,浓缩物加入1ml的Tris-HCl缓冲液溶解后用于电化学分析。
2)猪肉样品中加标沙丁胺醇的测定:分别取等量的不同猪肉提取液样品,加入Tris-HCl缓冲液混合配成总体积为50μl的孵育液。将实施例1制备的电化学传感器浸入孵育液中,在37℃孵育30min,用Tris-HCl缓冲液冲洗后置于含有2mmol/L的K3[Fe(CN)6]的KCl溶液(0.1mol/L)中进行EIS扫描,采用与实施例2中相同的方法计算得到Rct变化的百分比值(R0-Rx)/R0×100(%)。
以与实施例2中相同的方法获得Rct变化的百分比值(R0-Rx)/R0×100(%)与沙丁胺醇浓度对数值lgC的工作曲线,并计算添加沙丁胺醇的浓度,检测回收率结果如表1。
表1为电化学传感器检测加标猪肉中的沙丁胺醇浓度的回收率
实施例6鸡肉样品中加标特步他林(TER)的测定
1)鸡肉样品的加标处理:称取1±0.0050g鸡肉于到10ml的样品管中,加入特步他林标准液,和3ml乙腈-丙酮提取液(V:V=4:1),混合物超声振荡30分钟,于2000r/m下离心10分钟,将上清液转移至氮吹管中,残渣用3ml的相同提取液重复提取1次,上清液合并在氮吹管中。提取物在氮吹条件下于50℃温度下浓缩蒸发,浓缩物加入1ml的Tris-HCl缓冲液溶解后用于电化学分析。
2)鸡肉样品中加标特步他林的测定:分别取等量的不同鸡肉提取液样品,加入Tris-HCl缓冲液混合配成总体积为50μl的孵育液。将实施例1制备的电化学传感器浸入孵育液中,在37℃孵育30min,用Tris-HCl缓冲液冲洗后置于含有2mmol/L的K3[Fe(CN)6]的KCl溶液(0.1mol/L)中进行EIS扫描,采用与实施例2中相同的方法计算得到Rct变化的百分比值(R0-Rx)/R0×100(%)。
以与实施例2中相同的方法获得Rct变化的百分比值(R0-Rx)/R0×100(%)与特步他林浓度对数值lgC的工作曲线,并计算添加特步他林的浓度,检测回收率结果如表2。
表2为电化学传感器检测加标鸡肉中的特步他林浓度的回收率
实施例7猪肝样品中加标非诺特罗的测定
1)猪肝样品的加标处理:称取1±0.0050g猪肝于到10ml的样品管中,加入非诺特罗标准液,和3ml乙腈-丙酮提取液(V:V=4:1),混合物超声振荡30分钟,于2000r/m下离心10分钟,将上清液转移至氮吹管中,残渣用3ml的相同提取液重复提取1次,上清液合并在氮吹管中。提取物在氮吹条件下于50℃温度下浓缩蒸发,浓缩物加入1ml的Tris-HCl缓冲液溶解后用于电化学分析。
2)猪肝样品中加标非诺特罗的测定:分别取等量的不同猪肝提取液样品,加入Tris-HCl缓冲液混合配成总体积为50μl的孵育液。将实施例1制备的电化学传感器浸入孵育液中,在37℃孵育30min,用Tris-HCl缓冲液冲洗后置于含有2mmol/L的K3[Fe(CN)6]的KCl溶液(0.1mol/L)中进行EIS扫描,采用与实施例2中相同的方法计算得到Rct变化的百分比值(R0-Rx)/R0×100(%)。
以与实施例2中相同的方法获得Rct变化的百分比值(R0-Rx)/R0×100(%)与非诺特罗浓度对数值lgC的工作曲线,并计算添加非诺特罗的浓度,检测回收率结果如表3。
表3为电化学传感器检测加标猪肝中的非诺特罗浓度的回收率
- 还没有人留言评论。精彩留言会获得点赞!
- 包含与β-3-肾上腺素能受体激动剂组合的去氨加压素的方法和组合物的制作方法
- 具有毒蕈碱受体拮抗体和β2肾上腺素能受体激动剂两种活性的2-氨基-1-羟乙基-8-羟基 ...的制作方法
- 靶向于肌动蛋白结合蛋白Transgelin-2的化合物及其新用图
- 一种α-2肾上腺素受体和σ受体配体的组合物的制作方法
- 天然植物皂苷功效组分的筛选方法及用图
- 通过玻璃体内和前房内途径用于治疗眼内压和眼部疾病的α-2肾上腺素能激动剂的制作方法
- 用于治疗组织创伤的α-肾上腺素能激动剂的制作方法
- 具有β2肾上腺素能受体激动剂和M3毒蕈碱受体拮抗剂两种活性的2-氨基-1-羟乙基-8-羟 ...的制作方法
- 具有毒蕈碱受体拮抗剂和β2肾上腺素能受体激动剂活性的化合物的制作方法
- 具有毒蕈碱受体拮抗剂和β2肾上腺素能受体激动剂活性的化合物的制作方法
- 主链带有环氧官能基的乙缩醛共聚物的制作方法
- 作为肾上腺素能激动剂和毒蕈碱拮抗剂的磺胺衍生物的制作方法
- 用作药物的取代的吡嗪酮衍生物的制作方法
- (r)-5-(2-氨基丙基)-2-甲氧基苯磺酰胺的合成方法
- 作为α<sub>2C</sub>-肾上腺素受体拮抗剂的取代的吡嗪酮衍生物的制作方法
- 新颖的异喹啉衍生物或其盐的制作方法
- 用于治疗抑郁症的n-芳氧基乙基胺衍生物的制作方法
- 用作α1-肾上腺素能受体拮抗剂的嘧啶二酮、嘧啶三酮、三嗪二酮、四氢喹唑啉二酮衍生物的制作方法
- 可用作β3-肾上腺素能受体激动剂和β1和β2-肾上腺素能受体拮抗剂的芳氧基和芳硫基丙 ...的制作方法
- α<sub>1</sub>-肾上腺素受体拮抗剂及其制备方法和医药用途的制作方法
- 对氨基苯乙酸的制备方法
- 作为β2肾上腺素受体激动剂的4-(2-氨基-1-羟乙基)苯酚的氟化衍生物的制作方法
- 用作β的制作方法
- 作为β2肾上腺素受体的促效剂的4-(2-氨基-1-羟基乙基)苯酚衍生物的制作方法
- β2肾上腺素能受体激动剂的制作方法
- 作为β2肾上腺素受体促效剂的5-(2-{[6-(2,2-二氟-2-苯基乙氧基)己基]胺基}-1-羟乙 ...的制作方法
- 作为β-肾上腺素受体激动剂的茚满-2-基氨基-羟基乙基-喹啉酮马来酸盐衍生物的多晶形式的制作方法
- 作为β2肾上腺素受体激动剂的4-(2-氨基-1-羟乙基)酚衍生物的制作方法
- β2-肾上腺素能受体激动剂的制作方法
- 作为β2肾上腺素受体激动剂的7-(2-氨基-1-羟基-乙基)-4-羟基苯并噻唑-2(3H)-酮衍生物的制作方法