一种均相免疫检测试剂盒、检测方法及其应用与流程
本发明属于生物技术领域,具体涉及一种均相免疫试剂盒、检测方法及其在联合检测同一病毒抗原、抗体中的应用。
背景技术:
在某些运用化学发光方法检测的体外诊断项目中,需要对样本中的抗原和抗体同时进行检测。例如人类免疫缺陷病毒(humanimmunodeficiencyvirus,hiv)的检测,已由之前仅对病毒抗体检测的三代试剂发展为当前较通用的抗原、抗体联合检测的四代艾滋检测试剂。这样就可以避免窗口期的患者因体内只有病毒抗原而没有相应的抗体或相应抗体滴度还不足以被检出时造成漏检的风险。因此,建立高效、可靠的抗原抗体联合检测的方法在诊断试剂开发领域乃至医疗卫生行业均有其重要的意义。
目前化学发光抗原抗体联检的方法,其通过标记抗原和标记抗体与待测样本中的抗体或抗原形成夹心复合物最终产生信号来进行检测。样本中有待测抗原或抗体中的任何一种结果都反应为信号上升。其弊端在于无法区分阳性信号值是由抗原引起还是由抗体引起,从而不能准确判断病程,无法给临床治疗提供可靠的信息。另外,该检测试剂中的标记原料需经严格筛选,标记的抗原和抗体不能有交叉反应,这就增加了试剂研发的难度并延长了研发周期。同时由于人为的避开某些位点,因此势必会牺牲一部分抗原和/或抗体检测的灵敏度。
技术实现要素:
本发明针对现有技术的不足提供了一种均相免疫检测试剂盒,以及利用所述试剂盒联合检测同一病毒抗原、抗体的均相免疫方法。所述方法集竞争法和夹心法于一体,只需要标记抗原或抗体即可,不必同时标记抗原和抗体,避免了潜在的交叉反应,降低了原料筛选的难度,同时使检测的灵敏度得到提升。另外,本发明提供的方法在结果判读上更有临床意义,通过结果可以判断待测样本是抗原阳性或抗体阳性,为疫病诊断和治疗方案的制定提供依据。
为此,本发明第一方面提供了一种均相免疫检测试剂盒,其包括:
试剂ⅰ,其包含第一对应物,所述第一对应物为已知抗原或能够与待测样本中的待测抗原特异性结合的已知抗体;试剂ⅰ可用于稀释待测样本;
试剂ⅱ,其包含能够与单线态氧反应生成可检测信号的受体以及与之结合的第二对应物,所述第二对应物能够与第一对应物特异性结合;
试剂ⅲ,其包含能够与第一对应物特异性结合的第三对应物;
试剂ⅳ,其包含能够在激发状态产生单线态氧的供体。
在本发明的一些实施方式中,所述第一对应物为能够与待测样本中的待测抗原特异性结合的已知抗体,且所述第二对应物和第三对应物均为已知抗原。
在本发明的一些具体实施方式中,所述已知抗体为单克隆抗体或抗体阳性血清。
在本发明的另一些实施方式中,所述第一对应物为已知抗原,且所述第二对应物和第三对应物均为能够与已知抗原特异性结合的第二抗体。
在本发明的一些具体实施方式中,所述第二抗体为单克隆抗体和/或多克隆抗体。
根据本发明,所述第三对应物表面包被有生物素,而供体表面包被有链霉亲和素。
在本发明的一些实施方式中,所述受体包含烯烃化合物和金属螯合物,且在含水介质中可溶。
在本发明的另一些实施方式中,所有试剂均为非粒子化的且在含水介质中均可溶。
在本发明第二方面提供了一种利用如本发明第一方面所述的试剂盒联合检测同一病毒抗原、抗体的均相免疫检测方法,其包括以下步骤:首先对不含待测抗原和待测抗体的阴性样本进行检测,并将所得到的检测结果作为本底信号值;然后再检测待测样本的化学发光信号值,并将待测样本的化学发光信号值与所述本底信号值进行比较,从而判断待测样本中是否存在待测抗原和/或待测抗体。
在本发明的一些实施方式中,试剂ⅰ中包含的第一对应物为能够与待测样本中的待测抗原特异性结合的已知抗体,此时:
如果检测到的待测样本的化学发光信号值等于本底信号值,那么待测样本不含待测抗原和待测抗体;
如果检测到的待测样本的化学发光信号值大于本底信号值,那么待测样本中含有待测抗体;
如果检测到的待测样本的化学发光信号值小于本底信号值,那么待测样本含有待测抗原。
在本发明的另一些实施方式中,试剂ⅰ中包含的第一对应物为已知抗原,此时:
如果检测到的待测样本的化学发光信号值等于本底信号值时,那么待测样本不含待测抗原和待测抗体;
如果检测到的待测样本的化学发光信号值大于本底信号值时,那么待测样本中含待测抗原;
如果检测得到的待测样本的化学发光信号值小于本底信号值时,那么待测样中含待测抗体。
根据本发明,所述待测样本的化学发光信号值的检测方法包括以下步骤:
s1,将待测样本与试剂ⅰ混合,得到第一混合物;
s2,向第一混合物中加入试剂ⅱ、试剂ⅲ和试剂ⅳ,得到第二混合物;
s3,利用能量或者活性化合物处理第二混合物,检测第二混合物的化学发光信号值;
s4,分析所述化学发光信号值,判断待测样本中是否包含待测抗原和/或待测抗体。
在本发明的一些实施方式中,步骤s2中,先加入试剂ⅱ和试剂ⅲ,然后再加入试剂ⅳ。
在本发明的另一些实施方式中,骤s1中,将待测样本加入到含有试剂ⅰ的溶液中。
在此,需要特别说明的是,上述方法为非疾病诊断目的的方法。
本发明第三方面提供了一种利用如本发明第一方面所述的试剂盒或者如本发明第二方面所述的方法在hcv抗原和抗体联合检测中的应用。
本发明中用语“已知抗原”可以为待测样本中待测抗原的标准品。
本发明中用语“与待测样本中的待测抗原特异性结合的已知抗体”可以为待测样本中待测抗体的标准品。
本发明中待测样本中的待测抗原与待测抗体可以为针对同一病毒的抗原和抗体。
本发明中用语“待测样本的化学发光信号值等于本底信号值”是指待测样本的化学发光信号值与本地信号值的接近程度可以在90%以上,优选在95%以上,更优选在99%以上。
本发明的有益效果为:
1.试剂组分简单,检测过程中只需加入标记的抗原或标记的抗体即可,不必同时加入两种。
2.原料筛选容易,无须考虑原料间的交叉反应,原料的可选择度更高,更容易找到合适的原料。
3.检测灵敏度高,无须为了避免交叉反应而在原料选择时牺牲部分表位,使可与待测物结合的表位更多,检测的灵敏度也就相应提升。
4.结果判读精准,检测时读取的信号值与本底信号值的比较不但可以判断出样本是否阳性,而且能够区分该阳性结果属于抗原阳性还是抗体阳性,比只有笼统的阳性结果更有意义。
5.抗勾状效应能力提升,因强阳而产生倒勾的样本会因检测时读取的信号值低于本底信号值而被检出。
附图说明
为了更清楚地说明本发明实施例中的技术方案,下面将对实施例描述中所需要使用的附图做简单地介绍,显而易见,下面简述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为本发明所述联合检测同一病毒抗原、抗体的均相免疫方法的原理图。图中附图标记的含义如下:1试剂ⅰ中含有的能够与待测样本中的待测抗原特异性结合的已知抗体;2待测样本中的待测抗体;3待测样本中的待测抗原;4已知抗原包被的发光微球;5生物素标记的已知抗原。
图2为本发明所述联合检测抗原抗体的均相免疫方法的流程图。
图3为实施例中丙肝核心抗原的检测结果示意图。
具体实施方式
为使本发明容易理解,下面将详细说明本发明。但在详细描述本发明前,应当理解本发明不限于描述的具体实施方式。还应当理解,本文中使用的术语仅为了描述具体实施方式,而并不表示限制性的。
在提供了数值范围的情况下,应当理解所述范围的上限和下限和所述规定范围中的任何其他规定或居间数值之间的每个居间数值均涵盖在本发明内。这些较小范围的上限和下限可以独立包括在较小的范围中,并且也涵盖在本发明内,服从规定范围中任何明确排除的限度。在规定的范围包含一个或两个限度的情况下,排除那些包括的限度之任一或两者的范围也包含在本发明中。
除非另有定义,本文中使用的所有术语与本发明所属领域的普通技术人员的通常理解具有相同的意义。虽然与本文中描述的方法和材料类似或等同的任何方法和材料也可以在本发明的实施或测试中使用,但是现在描述了优选的方法和材料。
ⅰ.术语
本发明所述用语“均相”所对应的英文定义为“homogeneous”,其是指无须对结合的抗原抗体复合物和剩余的游离抗原或抗体进行分离既可进行检测。
本发明所述用语“待测样本”是指可能含有被分析物的一种混合物,被分析物包括但不限于蛋白质、激素、抗体、抗原等。可以被用在本发明公开的方法中的典型待测样本包括体液,如血液、血浆、血清、尿、精液、唾液等。
本发明所述用语“抗体”以最广含义使用,包括任何同种型的抗体,保留对抗原的特异性结合的抗体片段,包括但不限于fab、fv、scfv、和fd片段、嵌合抗体、人源化抗体、单链抗体、双特异性抗体、和包含抗体的抗原结合部分和非抗体蛋白的融合蛋白。在任何需要的情况下,抗体可以进一步与其它部分,诸如特异性结合配对成员,例如生物素或链霉亲和素等缀合。
本发明所述用语“单克隆抗体”是指由单克隆的b淋巴细胞分泌的免疫球蛋白,其可以通过本领域技术人员所公知的方法来制备得到。
本发明所述用语“多克隆抗体”是指由一个以上的b淋巴细胞克隆产生的免疫球蛋白集合,其可以通过本领域技术人员所公知的方法来制备得到。
本发明所述用语“抗原”是指能够刺激机体产生免疫应答,并能与免疫应答产物抗体和致敏淋巴细胞在体内外结合,发生免疫效应的物质。
本发明所述用语“结合”指由于例如共价、静电、疏水、离子和/或氢键等相互作用,包括但不限于如盐桥和水桥等相互作用引起的两个分子间的直接联合。
本发明所述用语“特异性结合”,是指两种物质之间的相互辨别和选择性结合反应,从立体结构角度上说就是相应的反应物之间构象的对应性。
本发明所述用语“特异性结合配对成员”是指这样一对分子,它们能够相互特异性结合,例如,酶-底物、抗原-抗体、配基-受体。一个具体的特异性结合配对成员对的例子是生物素-链霉亲和素系统,其中“生物素”广泛存在于动植物组织中,其分子上有两个环状结构,分别为咪唑酮环和噻吩环,其中咪唑酮环是与链霉亲和素结合的主要部位。活化的生物素可以在蛋白质交联剂的介导下,与已知的几乎所有生物大分子偶联,包括蛋白质、核酸、多糖和脂类等;而“链霉亲和素”是由链霉菌分泌的一种蛋白质,分子量为65kd。“链霉亲和素”分子由4条相同的肽链组成,其中每条肽链都能结合一个生物素。因此每个抗原或抗体可同时偶联多个生物素分子,从而产生“触手效应”提高分析灵敏度。
在任何需要的情况下,本发明中所用的任何试剂,包括抗原、抗体、受体或供体,可以根据实际需要缀合生物素或链霉亲和素,例如:所述试剂ⅲ包含生物素包被的第三对应物;又例如:试剂ⅳ包含链霉亲和素包被的供体。
本发明所述用语“供体”是指通过能量或者活性化合物的激活后能够产生与受体反应的诸如单线态氧的活性中间体的敏化剂。供体可以是光活化的(如染料和芳香化合物)或者化学活化的(如酶、金属盐等)。
在本发明一些具体实施例中,所述供体是光敏剂,所述光敏剂可以是本领域已知的光敏剂,优选相对光稳定且不与单线态氧有效反应的化合物,其非限定性的例子包括例如美国专利us5709994(该专利文献在此全文引为参考)公开的亚甲基蓝、玫瑰红、卟啉、酞菁和叶绿素等化合物,以及这些化合物的具有1-50个原子取代基的衍生物,所述取代基用于使得这些化合物更具有亲脂性或更具有亲水性、和/或作为连接至特异性结合配对成员的连接基团。本领域技术人员已知的其他光敏剂的例子也可以在本发明中使用,例如美国专利us6406913中记载的内容,该专利文献并入本文以供参考。
在本发明另一些具体实施例中,所述供体是化学活化的其他敏化剂,其非限定性的例子是某些化合物,它们催化过氧化氢转化为单线态氧和水。其他一些供体的例子包括:1,4-二羧基乙基-1,4-萘内过氧化物、9,10-二苯基蒽-9,10-内过氧化物等,加热这些化合物或者这些化合物直接吸收光会释放单线态氧。
本发明所述用语“受体”是指能够与单线态氧反应可以产生可检测信号的化合物。供体被能量或者活性化合物诱导激活并释放高能态的单线态氧,该高能态的单线态氧被近距离的受体俘获,从而传递能量以激活所述受体。
在本发明的一些具体实施例中,所述受体是这样的物质:其经历与单线态氧的化学反应以形成不稳定的亚稳态中间体,所述亚稳态中间体可以分解,同时或随后发光。这些物质的典型例子包括但不限于:烯醇醚、烯胺、9-烷叉黄原胶、9-烷叉-n-烷基吖啶满、芳乙烯醚、双环氧乙烯、二甲基噻吩、芳香性咪唑或光泽精。
在本发明的另一些具体实施例中,所述受体是能够与单线态氧反应以形成可以分解成酮类或羧酸衍生物的氢过氧化物或二氧环丁烷的烯烃类;可以通过光的作用分解的稳定二氧环丁烷;可以与单线态氧反应以形成二酮类的乙炔类;可以形成偶氮化合物或偶氮羰基化合物的腙类或酰肼类,诸如鲁米诺;和可以形成内过氧化物类的芳族化合物。可以根据本公开和要求保护的发明利用的受体的具体的、非限制性实例记载于美国专利号us5340716(该专利文献在此全文引为参考)。
在本发明另一些具体实施例中,所述受体包含烯烃化合物和金属螯合物,其是非粒子化的且可溶于含水介质中,这种受体的制备方法可参见专利pct/us2010/025433(该专利文献在此全文引为参考)。
在本发明另一些具体实施例中,所述“供体”和/或“受体”可以通过功能基团被包被在基体上形成“供体微球”和/或“受体微球”。本发明所述“基体”是本领域技术人员所公知的微球或微粒,其可以是任何尺寸的,其可以是有机的或是无机的,其可以是可膨胀或不可膨胀的,其可以是多孔的或非多孔的,其具有任何密度,但优选具有和水接近的密度,优选能漂浮于水中,且由透明、部分透明或不透明的材料构成。所述基体可以有或没有电荷,当带有电荷时,优选是负电荷。所述基体可以是固体(如聚合物、金属、玻璃、有机和无机物诸如矿物、盐和硅藻)、小油滴(如碳氢化合物、碳氟化合物、硅质流体)、囊泡(如合成的诸如磷脂、或天然的诸如细胞、及细胞器官)。基体可以是乳胶颗粒或是含有有机或无机聚合物的其他颗粒、脂双层如脂质体、磷脂囊泡、小油滴、硅颗粒、金属溶胶、细胞和微晶染料。基体通常具有多功能性,或者能够通过特异或非特异的共价或非共价相互作用而结合到供体或受体上。有许多官能团是可用的或者将其合并进来。典型的官能团包括羧酸、乙醛、氨基、氰基、乙烯基、羟基、巯基等。适用于本发明的基体的一个非限制性的例子是羧基改性的乳胶颗粒。这种基体的详细情况可参见美国专利us5709994与us5780646(这两篇专利文献在此全文引为参考)。
ⅱ.实施例
如前所述目前采用均相免疫检测方法进行同一病毒抗原、抗体联合检测时,由于无法区分阳性信号值是由抗原引起还是由抗体引起,从而不能准确判断病程,无法给临床治疗提供可靠的信息。另外,检测过程中采用的检测试剂中的标记原料需经严格筛选,标记的抗原和标记的抗体不能有交叉反应,增加了试剂研发的难度,同时降低了检测的灵敏度。本申请的发明人通过研究发现,在试剂ⅰ(样本稀释液)中添加一定量的与待测样本中的待测抗原的特异性结合的已知抗体或已知抗原,然后采用竞争法和夹心法对待测样本中的同一病毒抗原、抗体进行检测,只需加入标记的抗原或标记的抗体既可,最后通过信号值的变化来判断待测样本是抗体阳性还是抗原阳性,更加具有临床诊断意义。
下面以在试剂ⅰ(样本稀释液)中添加一定量与待测样本中的待测抗原的特异性结合的已知抗体为例,详细说明本发明的检测原理,具体的检测原理图见图1。
由于试剂ⅰ(样本稀释液)中添加的是与待测样本中的待测抗原的特异性结合的已知抗体,则试剂ⅱ包括已知抗原包被的的受体、试剂ⅲ中包括生物素标记的已知抗原。
当待测样本中即不含待测抗原也不含待测抗体时,待测样本与样本稀释液中的已知抗体不发生反应,后续加入与已知抗原包被的受体和生物素标记的已知抗原后,包被在受体上的已知抗原和生物素标记的已知抗原与样本稀释液中的已知抗体发生反应,形成夹心复合物。加入试剂ⅳ中包含的链霉亲和素标记的供体后,通过680nm的光线激发,这些夹心复合物中的受体会与就近供体散发的单线态氧反应,产生的能量以610nm波长的光的形式发射出去,通过检测610nm处波长的信号值,作为检测的本底信号值。
当待测样本中含有待测抗体时,待测样本与样本稀释液混合后,总抗体量增加,则最终反应的信号值会高于本底信号值。此时的检测方法为夹心法检测,夹心反应增强,反应信号值增强。
当待测样本中含有待测抗原时,待测样本与样本稀释液混合后,待测样本中的待测抗原与样本稀释液中的已知抗体发生反应,中和消耗部分已知抗体,使得后续可与包被在受体上的已知抗原和生物素标记的已知抗原发生反应的抗体量减少,最终反应后的信号值会低于本地信号值。此时的检测的方法为竞争法检测。
相应地,若试剂ⅰ(样本稀释液)中添加的是一定量已知抗原,则试剂ⅱ包括与已知抗原特异性结合的第二抗体包被的受体、试剂ⅲ中包括生物素标记的能够与已知抗原特异性结合的第二抗体。
此时,当待测样本中含有待测抗原时,待测样本与样本稀释液混合后,总抗原量增加,则最终反应后的信号值高于本地信号值。此时的检测的方法为夹心法检测,夹心反应越强,反应信号值越强。
当待测样本中含有待测抗体时,待测样本与样本稀释液混合后,待测样本中的待测抗体与样本稀释液中的已知抗原发生反应,中和消耗部分已知抗原,使得后续可与包被在受体上的第二抗体和生物素标记的第二抗体发生反应的抗原量减少,则最终反应后的信号值低于本地信号值,且检测的方法为竞争法检测。
因此,本发明第一方面所涉及的均相免疫检测试剂盒,其包括:
试剂ⅰ,其包含第一对应物;所述第一对应物为已知抗原或能够与待测样本中的待测抗原特异性结合的已知抗体;
试剂ⅱ,其包含能够与单线态氧反应生成可检测信号的受体以及与之结合的第二对应物,所述第二对应物能够与第一对应物特异性结合;
试剂ⅲ,其包含能够与第一对应物特异性结合的第三对应物。
试剂ⅳ,其包含能够在激发状态产生单线态氧的供体。
根据本发明,所述第三对应物表面包被有生物素,而供体表面包被有链霉亲和素。
在本发明的一些实施方式中,所述试剂盒具体包括:
试剂ⅰ,其包含能够与待测样本中的待测抗原特异性结合的已知抗体;
试剂ⅱ,其包含已知抗原包被的受体;
试剂ⅲ,其包含生物素包被的已知抗原;
试剂ⅳ,其包含链霉亲和素包被的供体。
在本发明的另一些实施方式中,所述试剂盒具体包括:
试剂ⅰ,其包含已知抗原;
试剂ⅱ,其包含能够与已知抗原特异性结合的第二抗体包被的受体;
试剂ⅲ,其包含生物素包被的与已知抗原特异性结合的第二抗体;
试剂ⅳ,其包含链霉亲和素包被的供体。
上述试剂中的供体和受体可以被包被在基体上形成粒子化的供体微球和受体微球,其也可以是非粒子化的试剂,可溶于含水介质中。
在本发明的一些具体实施例中,所述试剂盒具体包括:
试剂ⅰ,其包含能够与待测样本中的待测抗原特异性结合的已知抗体;
试剂ⅱ,其包含与已知抗原结合的受体微球;
试剂ⅲ,其包含生物素包被的已知抗原;
试剂ⅳ,其包含链霉亲和素包被的供体微球。
在本发明的另一些具体实施例中,述试剂盒具体包括:
试剂ⅰ,其包含已知抗原;
试剂ⅱ,其包含能够与已知抗原特异性结合的第二抗体包被的受体微球;
试剂ⅲ,其包含生物素包被的与已知抗原特异性结合的第二抗体;
试剂ⅳ,其包含链霉亲和素包被的供体微球。
在本发明第二方面涉及的利用如本发明第一方面所述的试剂盒联合检测同一病毒抗原、抗体的均相免疫检测方法,其包括以下步骤:首先对不含待测抗原和待测抗体的阴性样本进行检测,并将所得到的检测结果作为本底信号值;然后再检测待测样本的化学发光信号值,并将待测样本的化学发光信号值与所述本底信号值进行比较,从而判断待测样本中是否存在待测抗原和/或待测抗体。
在本发明的一些实施方式中,试剂ⅰ中包含的第一对应物为能够与待测样本中的待测抗原特异性结合的已知抗体,此时:
如果检测到的待测样本的化学发光信号值等于本底信号值,那么待测样本不含待测抗原和待测抗体;
如果检测到的待测样本的化学发光信号值大于本底信号值,那么待测样本中含有待测抗体;
如果检测到的待测样本的化学发光信号值小于本底信号值,那么待测样本含有待测抗原。
在本发明的另一些实施方式中,试剂ⅰ中包含的第一对应物为已知抗原,此时:
如果检测到的待测样本的化学发光信号值等于本底信号值时,那么待测样本不含待测抗原和待测抗体;
如果检测到的待测样本的化学发光信号值大于本底信号值时,那么待测样本中含待测抗原;
如果检测得到的待测样本的化学发光信号值小于本底信号值时,那么待测样中含待测抗体。
根据本发明,所述待测样本的化学发光信号值的检测方法包括以下步骤:
s1,将待测样本与试剂ⅰ混合,得到第一混合物;
s2,向第一混合物中加入试剂ⅱ、试剂ⅲ和试剂ⅳ,得到第二混合物;
s3,利用能量或者活性化合物处理第二混合物,检测第二混合物的化学发光信号值;
s4,分析所述化学发光信号值,判断待测样本中是否包含待测抗原和/或待测抗体。具体的反应流程图见图2。
在本发明的一些实施方式中,步骤s2中,先加入试剂ⅱ和试剂ⅲ,然后再加入试剂ⅳ。
在本发明的另一些实施方式中,骤s1中,将待测样本加入到含有试剂ⅰ的溶液中。
本发明所述方法中,所有试剂组合后,均可以根据需要进行混匀和/或温育。具体地,所述温育的温度可以是35-45℃,时间可以是10-20min;优选地,所述温育的温度可以选自36℃、37℃、38℃、39℃、40℃、41℃、42℃、43℃或44℃;温育的时间可以选自12min、15min、16min或18min。
在本发明的一些具体实施例中,采用波长为680nm的光激发供体和/供体微球生成单线态氧,所述受体能够与单线态氧反应产生615nm波长的化学发光信号。
具体地,在本发明的一些具体实施例中,所述待测样本的化学发光信号值的检测方法包括以下步骤:
s1,向预稀释板中加入试剂ⅰ,然后加入待测样本,振荡混匀后于35-40℃下温育10-15min,获得第一混合物;
s2,将第一混合物加入到检测区域内,然后加入试剂ⅱ和试剂ⅲ,35-40℃下反应10-15min后,再加入试剂ⅳ,并于35-40℃下温育10-15min,获得第二混合物;
s3,采用波长为680nm的光处理第二混合物,激发其中所述供体和/或供体微球产生单线态氧,产生的单线态氧与受体和/或受体微球结合产生615nm波长的化学发光信号;
s4,检测所述化学发明信号,根据获取的化学发光信号值判断待测样本中是否存在待测抗原和/或待测抗体。
根据本发明,所述方法的检测灵敏度小于10ng/ml。
本发明第三方面涉及一种利用如本发明第一方面所述的试剂盒或者如本发明第二方面所述的方法在hcv抗原和抗体联合检测中的应用。
为使本发明更加容易理解,下面将结合实施例来进一步详细说明本发明,这些实施例仅起说明性作用,并不局限于本发明的应用范围。本发明中所使用的原料或组分若无特殊说明均可以通过商业途径或常规方法制得。
下述实施例中所采用的光激化学发光分析仪为全自动光激化学发光分析仪。
实施例1:单孔联合检测人丙型肝炎核心抗原(hcvcoreag)的均相免疫方法的灵敏度实验
1、标记物的制备
采用上海博阳生产的hcv抗体检测试剂盒,批号为:1606l。其中各试剂组分的具体标记工艺略。
2、试剂ⅰ(样本稀释液)制备
用上述成品试剂盒中的样本稀释液对1份抗体阳性血清进行梯度稀释,分别稀释到10倍、100倍、1000倍、1万倍、10万倍和100万倍。将上述稀释度的溶液作为样本用该试剂盒进行检测,找到信号值约为20000左右的稀释度。以此稀释度作为向样本稀释液中添加抗体的比例,按此比例配制样本稀释液20ml。
3、重组hcv核心抗原浓度的检测
用重组hcvcoreag进行实验。抗原用磷酸盐缓冲液(pbs)进行稀释,分别稀释至2倍、5倍和10倍后,用bca蛋白浓度检测试剂盒进行检测。检测时,首先用牛血清白蛋白(bsa)校准液(0mg/ml、0.1mg/ml、0.25mg/ml、0.5mg/ml,0.75mg/ml和1mg/ml共6个点)进行定标,按照试剂盒说明书操作后,在酶标仪上od562nm进行读数。检测结果为原倍抗原浓度小于1mg/ml。
4、联合检测人丙型肝炎(hcv)核心抗原的均相免疫方法的灵敏度的检测
用pbs缓冲液对步骤3所述抗原进行梯度稀释,分别稀释10倍、1000倍、1万倍和10万倍。
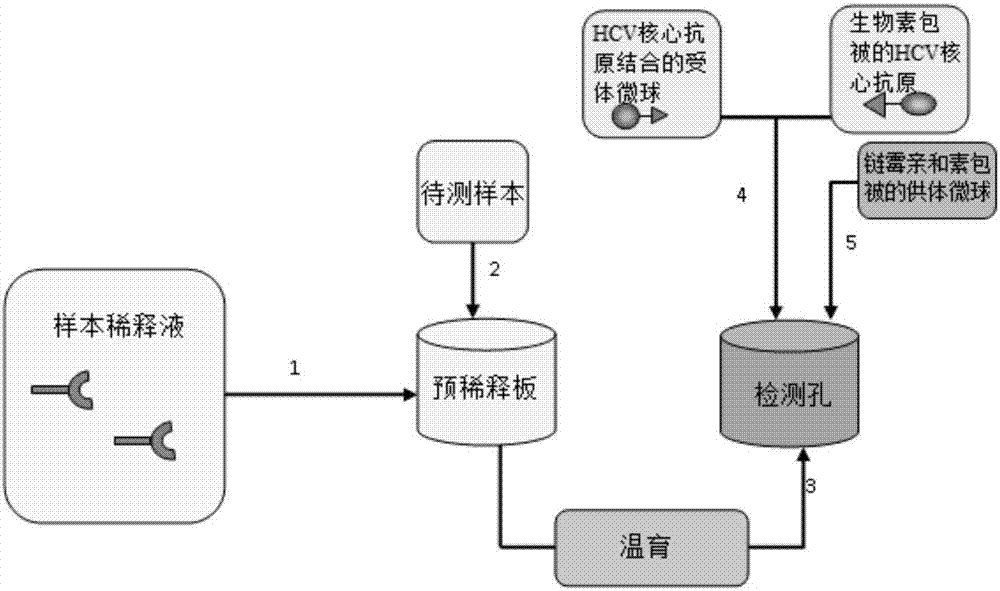
在预稀释板上加入样本稀释液,每孔25ul,然后将稀释好的hcv核心抗原溶液作为待测样本分别加入到样本稀释液中每孔25ul,振荡混匀,37℃温育10min后,获得第一混合物。
每孔吸取25ul第一混合物加入检测孔中,然后加入与hcv核心抗原结合的受体微球溶液和生物素包被的hcv核心抗原溶液各25ul,37℃反应15min后,再加入链霉亲和素包被的供体微球溶液175ul,37℃继续温育10min后,获得第二混合物。
采用波长为680nm的光处理第二混合物,激发供体微球产生单线态氧,产生的单线态氧与受体微球结合产生615nm波长的化学发光信号。检测所述化学发明信号,获取的化学发明信号值如图3所示。从图3可知,该hcv核心抗原稀释10万倍以后检测信号值变化不再明显,说明本方法对人丙型肝炎核心抗原检测的分析灵敏度小于10ng/ml。
应当注意的是,以上所述的实施例仅用于解释本发明,并不构成对本发明的任何限制。通过参照典型实施例对本发明进行了描述,但应当理解为其中所用的词语为描述性和解释性词汇,而不是限定性词汇。可以按规定在本发明权利要求的范围内对本发明作出修改,以及在不背离本发明的范围和精神内对本发明进行修订。尽管其中描述的本发明涉及特定的方法、材料和实施例,但是并不意味着本发明限于其中公开的特定例,相反,本发明可扩展至其他所有具有相同功能的方法和应用。
- 还没有人留言评论。精彩留言会获得点赞!