一种硼氢化物复合体系固态电解质材料及其制备方法和应用与流程
本发明涉及固态电解质材料,尤其涉及一种xLiBH4-NaBH4复合固态电解质材料,具有较高的室温离子导体特性,还涉及该材料的电化学稳定性。
背景技术:
目前锂离子二次电池的电解质广泛采用的是易燃的液态有机物,在电池的尺寸逐步放大、充放电功率逐步提高时,该类电解质将给电池的使用带来很多无法预估的安全隐患。近年来,人们开始提出采用无机物固相电解质来替代易燃的有机液相电解质,以此消除锂离子电池大规模应用过程中的安全隐患。截止目前,人们已开发出了多种硫化物和氧化物的体系,如钙钛矿(ABO3)型的,钛酸镧锂(LLT)及具有NaA2(PO4)3结构的钠超离子导体,锗酸锌锂和硫代锗酸锌锂(Thio-LISICON)等,这些都是目前已知的固态电解质。近来较为引人关注的是日本东北大学提出的硼氢化锂(LiBH4)作为固相电解质的新思路。他们发现在113℃附近,LiBH4由低温相(LT)向高温相(HT)发生相转变。在此过程中,该物质的电导率迅速升至10-3S cm-1。但是其低温导电性较差。
技术实现要素:
发明目的:针对现有技术中存在的问题,本发明提供一种硼氢化物复合体系固态电解质材料,具有优异的离子导体特性。本发明还提供了其制备方法和应用。
技术方案:
本发明所述的硼氢化物复合体系固态电解质材料,其为xLiBH4-NaBH4复合氢化物材料,x=1~4。
进一步的,x=1.6~4。具体的,x=1.6、2.3或4。
本发明还提供了所述硼氢化物复合体系固态电解质材料的制备方法,包括:惰性气体气氛下,将LiBH4和NaBH4按照摩尔比1~4:1混合后研磨。
所述的惰性气体可以为氩气。
研磨可采用球磨的方式。球磨的主要目的是使LiBH4和NaBH4的混合物混合均匀,并在球磨过程中破坏混合物的结晶度,如果结晶度不是很好,离子迁移路径和速率都会得到进一步的提升。
球磨时,球料比为38~42:1,公转转速为400~500rpm,球磨时间为20~50小时。进一步的,球磨时,球料比为40:1,公转转速为450rpm,球磨时间为20小时。
本发明还提供了所述的硼氢化物复合体系固态电解质材料在制备电池电解质中的应用。
本发明硼氢化物复合体系固态电解质材料对已有的硼氢化锂进行改进,将NaBH4与LiBH4复合后,提高了LiBH4在低温时的电导率,使其可以在低温时就达到较高的电导率,同时在低温时LiBH4-NaBH4复合体系的活化能比单纯的LiBH4要低。这一性质说明LiBH4-NaBH4可作为固态电解质的潜在材料。
与现有技术相比,本发明的有益效果为:
本发明获得的LiBH4-NaBH4复合体系具有比LiBH4性能更优异的低温电导率,室温下(室温下10-5S cm-1的数量级)约比后者高1~2个数量级。
本发明获得的LiBH4-NaBH4复合体系具有较宽泛的固态电解质的窗口电位(~5V),具有较高的电化学稳定性。
本发明材料优异的性能使其在制备固体电解质具有较好的应用前景。
附图说明
图1为实施例1制得材料xLiBH4-NaBH4(x=1.6,2.3,4)电导率随温度变化曲线;
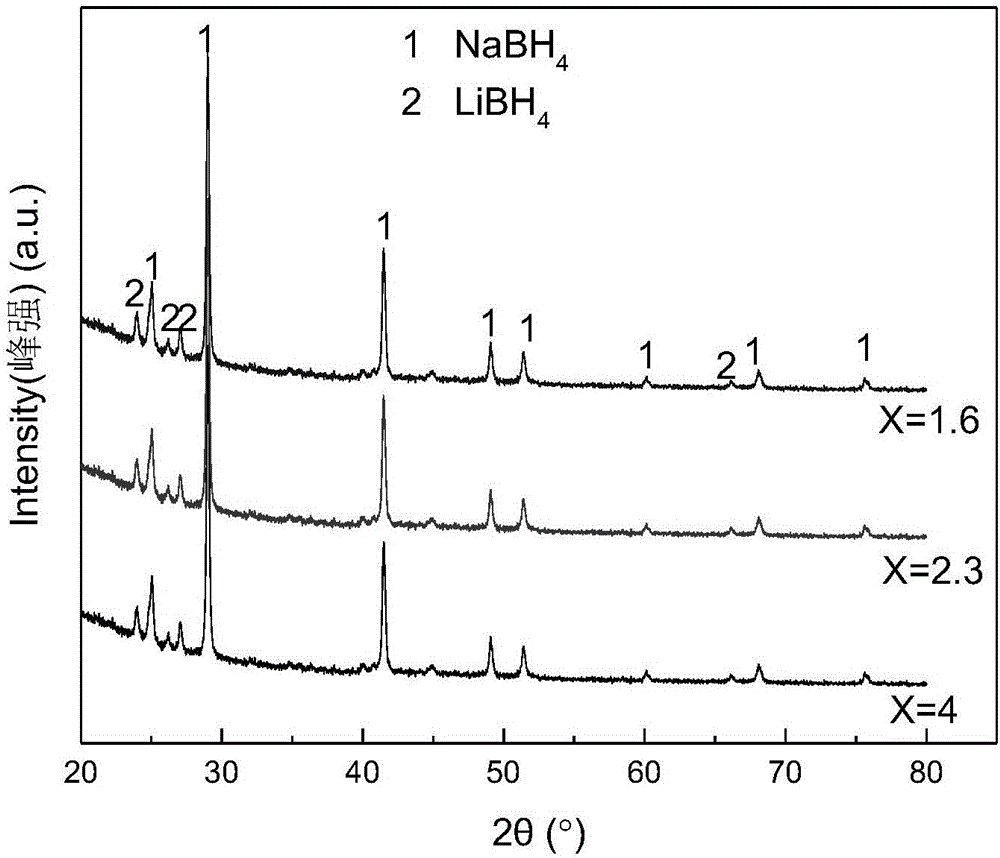
图2为实施例1制得材料xLiBH4-NaBH4(x=1.6,2.3,4)X射线衍射谱图;
图3为实施例1制得材料xLiBH4-NaBH4(x=1.6,2.3,4)低温区对应的活化能与单纯LiBH4活化能的对比图;
图4为实施例1制得材料xLiBH4-NaBH4(x=1.6)电极片进行循环伏安(CV)测试获得的循环曲线的图;
图5为实施例1制得材料xLiBH4-NaBH4(x=4)电极片进行循环伏安(CV)测试获得的循环曲线的图。
具体实施方式
下面结合具体实施例,进一步阐明本发明,应理解这些实施例仅用于说明本发明而不用于限制本发明的范围,在阅读了本发明之后,本领域技术人员对本发明的各种等价形式的修改均落于本申请所附权利要求所限定的范围。
硼氢化物复合体系固态电解质材料的制备方法如下:
将LiBH4颗粒与不同摩尔比的NaBH4混合,然后装入放有不锈钢磨球的不锈钢球罐中,球料比为40:1;采用行星轮式球磨机机械球磨方式,公转转速设定为400~500rpm,球磨时间为20~50小时,在高纯度(99.9999%)惰性气体保护下,球磨获得xLiBH4-NaBH4复合体系。由于样品容易与氧气和水发生反应,所有的样品操作均在充有高纯氩气的手套箱中进行,手套箱的氧气和水含量均低于1ppm浓度。
实施例1
在隔绝空气(H2O<1ppm,O2<0.1ppm)条件下(可在高纯氩气保护下),将LiBH4与NaBH4的混合物按照1~4:1(具体比例分别为1.6:1,2.3:1,4:1)的摩尔比放入装有不锈钢磨球的不锈装入钢球罐中;采用行星轮式球磨机机械球磨方式,在高纯度(99.9999%)惰性气体保护下,获得LiBH4-MgH2复合物颗粒。球罐容积为200ml,磨球与样品的重量比为40:1,公转转速设定为450rpm,球磨时间为20小时。
1、电导性能测试
样品的电导性能测试是在电化学工作站上以交流阻抗测试方法获得的。
具体方法为:所获得的LiBH4-NaBH4球磨样品以40MPa的压力被压制成一个直径10mm,厚度约1mm的圆片。将两块锂箔片放置在样品圆片的两面作为电极。再以1吨/cm2的压力将锂箔片与样品片压紧致。所有的制备和测试都在高纯氩气(99.9999%)下进行。交流阻抗测试的频率范围是从1MHz到100mHz。样品以2℃/min的速度升温,每间隔5℃采集一次阻抗谱。每次采集数据前,温度都要平衡至少50分钟。温度由室温升至120℃。通过获得的交流阻抗Nyquist谱图获得离子传输电阻和电导率,并作出电导率随温度的变化曲线(如图1)。
从图1中数据对比来看,加入NaBH4后,电导率有明显的升高。同时在不同比例的原料配比下,LiBH4-NaBH4(4:1)在所测试的成分比例范围内表现出最好的电导率,离子迁移最好。
2、XRD分析
取出不同原料配比样品的部分LiBH4-NaBH4复合物颗粒进行X射线衍射(XRD)实验,样品池被特定高分子膜覆盖,并以真空脂将其与载玻片密封,以阻止空气中水和氧气对样品的作用。所用X射线源的靶材为Cu靶,管电压为40kV,管电流为40mA。所得的XRD谱图(如图2)所示。
从XRD图中可以看出,LiBH4与NaBH4均存在于混合物中,且球磨后无新的物相生成。
3、活化能(Ea)计算
所获得的xLiBH4-NaBH4进行电导率测试后,经过理论计算得到的低温区的活化能,基于理论计算所作出的活化能与单纯LiBH4的低温区活化能的对比图(如图3)。
活化能是指反应中,从反应物分子变成活化分子所需的最低能量。所以从活化能对比图来看,单纯的LiBH4活化能较复合体系要高,加入NaBH4后,活化能降低,这一过程耗能更少,更易进行,离子迁移的效率提高,这一性质也对复合体系电导率的有提高起了一定的作用。
4、电化学稳定性测试
所获得的xLiBH4-NaBH4电极片进行循环伏安(CV)曲线测试,并作出5次循环的曲线(如图4、图5)。扫描的电极电位为-1to 5V,扫描速率为10mV s-1.
从图4、图5中可以看出,LiBH4-NaBH4复合体系的电化学窗口即可以达到5V,电化学窗口越宽,说明在这一范围内不会发生电解质的消耗,电池寿命增加。
- 还没有人留言评论。精彩留言会获得点赞!