酰基辅酶A:胆固醇酰基转移酶ACAT1抑制剂的新用途的制作方法
本发明属于生物技术领域,特别是涉及酰基辅酶a:胆固醇酰基转移酶acat1抑制剂的新用途。
背景技术:
恶性肿瘤是目前致死率最大的疾病之一,常规治疗手段如手术切除、放疗和化疗等手段较多应用于肿瘤治疗中,但目前这些手段在治疗肿瘤中有其局限性,且很难彻底治愈肿瘤,尤其是一些转移型恶性肿瘤。
免疫治疗一直以来是肿瘤治疗的研究热点。虽然靶标特异性弱且毒性较大,细胞因子白介素-2(interleukin-2,il2)和干扰素α(interferon-α,ifnα)被用于肾细胞癌和黑色素瘤治疗已有二十多年。近年来,随着抗pd-1和抗ctla-4等免疫检测点阻断抗体在肿瘤免疫治疗中得到应用,肿瘤免疫治疗已经取得突破性的进展。目前肿瘤免疫治疗的手段主要有t细胞过继疗法(adoptivecelltherapy,act)、免疫检测点阻断疗法(抗pd-1,抗pd-l1和抗ctla-4抗体治疗)、肿瘤疫苗以及嵌合抗原受体t细胞治疗(chimericantigenreceptort-cellimmunotherapy)等,这些方法虽然目前都已经在临床研究上取得不错的进展,但由于肿瘤细胞的异质性以及肿瘤微环境的复杂性,肿瘤免疫治疗目前仍然面临许多重要障碍。
cd8t细胞是肿瘤免疫治疗的核心,是肿瘤的特异性杀伤细胞,其杀伤能力强弱以及在肿瘤组织中的浸润情况直接与肿瘤的预后直接相关,而且直接关系肿瘤免疫治疗的成败。由于肿瘤微环境是一个免疫抑制的环境,cd8t细胞的功能受到肿瘤微环境的抑制,目前免疫检测点阻断抗体抗pd-1,抗pd-l1和抗ctla-4抗体在治疗黑色素瘤的临床试验中虽然整体效果不错,但单独使用时各自的客观反应率(objectiveresponserate)以及抗pd-1和抗ctla-4抗体联合治疗客观反应率还是不尽如人意。这意味着急需发展新的靶点以进一步增强肿瘤中cd8t细胞的功能。
细胞内胆固醇代谢通路包括胆固醇合成、转运以及储存等途径,其中胆固醇合成通路主要由scap/srebp复合物以及其下游胆固醇合成限速酶hmgcr调控;胆固醇的转运途径的调控主要受低密度脂蛋白受体(ldlreceptor)、内体(endosome)和溶酶体(lysosome)中npc1/2等蛋白及复合物的调控;而胆固醇存储则受胆固醇的酯化修饰以及去酯化修饰的调控,关键调控蛋白包括酰基辅酶a:胆固醇酰基转移酶acat1/2和胆固醇酯水解酶(ceh)。已 有研究表明,acat1是一个治疗动脉粥样硬化以及阿尔茨海默病的靶点,并已基于此开发了一些小分子抑制剂在进行临床实验,如avasimibe具有很好的临床安全性。但是现有技术并没有披露acat1与肿瘤的免疫治疗之间的关联。
技术实现要素:
鉴于以上所述现有技术的缺点,本发明的目的在于提供酰基辅酶a:胆固醇酰基转移酶acat1抑制剂的新用途。
本发明一方面提供了酰基辅酶a:胆固醇酰基转移酶acat1抑制剂在制备化学产品中的用途,所述化学产品至少具备以下功用之一:
1)增强cd8t细胞对肿瘤的杀伤活性;
2)增强cd8t细胞的效应功能;
3)促进cd8t细胞的增殖;
4)减少cd8t细胞的凋亡;
5)促进cd8t细胞细胞质膜上t细胞抗原受体(tcr)成簇;
6)促进cd8t细胞免疫突触的形成;
7)促进cd8t细胞定向释放细胞毒颗粒;
8)提高哺乳动物对于肿瘤的免疫能力。
所述酰基辅酶a:胆固醇酰基转移酶acat1的抑制剂是指对于酰基辅酶a:胆固醇酰基转移酶acat1具有抑制效果的化合物。
对于酰基辅酶a:胆固醇酰基转移酶acat1具有抑制效果包括但不限于:抑制酰基辅酶a:胆固醇酰基转移酶acat1活性,或者抑制酰基辅酶a:胆固醇酰基转移酶acat1的基因转录或表达。
所述的酰基辅酶a:胆固醇酰基转移酶acat1抑制剂可为sirna、shrna、抗体、小分子化合物。
如本发明实施例列举的,所述酰基辅酶a:胆固醇酰基转移酶acat1抑制剂选自:avasimibe、k604、cp113,818,所述酰基辅酶a:胆固醇酰基转移酶acat1抑制剂还可选自:purpactins、manassantina、diphenylpyridazinederivatives、glisoprenina、pactimibe、ci976、tmp-153、ym750、geri-bp002-a、sandoz58-035、vulm1457、cl-283,546、ci-999、e5324、ym17e,fr182980、pd132301-2、f-1394、hl-004、f-12511(eflucimibe)、cinnamicacidderivatives、dup128、rp-73163、pyripyropenec、fo-1289、as-183、spc-15549、beaui、beauiii、fo-6979、angelica、ginseng、decursin、terpendolec、beauvericin、spylidone、 pentacecilides、cl-283,546、cinnamicderivatives、betulinicacid、shikoninderivatives、esculeogenina和wu-v-23等。
所述化学产品必然包含酰基辅酶a:胆固醇酰基转移酶acat1抑制剂,并以酰基辅酶a:胆固醇酰基转移酶acat1抑制剂作为前述功用的有效成分。
所述化学产品中,发挥前述功用的有效成分可仅为酰基辅酶a:胆固醇酰基转移酶acat1抑制剂,亦可包含其他可起到类似功用的化学品。
所述化学产品可以为单成分物质,亦可为多成分物质。
所述化学产品的形式无特殊限制,可以为固体、液体、凝胶、半流质、气雾等各种物质形式。
所述化学产品所使用的领域可以为药品领域、保健品领域、食品领域等。
所述肿瘤免疫治疗针对的肿瘤包括实体瘤和非实体瘤,包括但不限于:鼻腔及鼻窦恶性肿瘤、鼻咽癌、口腔癌、喉癌、涎腺肿瘤、颅内肿瘤、甲状腺癌、舌癌、肺癌、食管癌、贲门癌、乳腺癌、纵膈肿瘤、胃癌、大肠癌、乙状结肠和直肠癌、肝癌、胰腺癌与壶腹周围癌、胆道癌、小肠肿瘤、肾癌、前列腺癌、膀胱癌、睾丸恶性肿瘤、阴茎癌、子宫颈癌、子宫内膜癌、卵巢癌、纤维组织细胞瘤、横纹肌肉瘤、滑膜肉瘤、黑色素瘤、骨肉瘤、尤文氏肉瘤、淋巴瘤、多发性骨髓瘤、白血病等。
所述肿瘤免疫治疗及提高对于肿瘤的免疫能力主要针对的对象为哺乳动物,如啮齿类动物、灵长类动物等。
本发明第二方面提供了一种肿瘤免疫治疗的方法,为向对象施用酰基辅酶a:胆固醇酰基转移酶acat1抑制剂。
所述的对象为哺乳动物或所述哺乳动物的cd8t细胞。所述哺乳动物优选为啮齿目动物、偶蹄目动物、奇蹄目动物、兔形目动物、灵长目动物等。所述灵长目动物优选为猴、猿或智人。所述cd8t细胞可为离体cd8t细胞。
所述对象可以是罹患肿瘤的患者或期待提高抗肿瘤免疫力的个体,或者所述对象为肿瘤患者或期待提高肿瘤预防能力的个体的离体ctl细胞。
所述酰基辅酶a:胆固醇酰基转移酶acat1抑制剂可以在接受肿瘤免疫治疗前、中、后向对象施用。
本发明第三方面提供了一种肿瘤免疫治疗药物,包括有效量的酰基辅酶a:胆固醇酰基转移酶acat1抑制剂及药用载体。
本发明第四方面提供了一种肿瘤联合治疗药物组合,包括有效量的酰基辅酶a:胆固醇酰基转移酶acat1抑制剂和至少一种其他肿瘤治疗药物。
所述其他肿瘤治疗药物是指除酰基辅酶a:胆固醇酰基转移酶acat1抑制剂以外的肿瘤治疗药物。
所述联合治疗药物组合可以是以下形式中的任意一种:
一)将酰基辅酶a:胆固醇酰基转移酶acat1抑制剂和其他肿瘤治疗药物分别制成独立的制剂,制剂的剂型可相同或不同,给药途径亦可相同或不同。
当其他肿瘤治疗药物为抗肿瘤抗体时,一般采用胃肠外给药型。当其他肿瘤治疗药物为化疗药物时,给药形式可以比较丰富,可以是胃肠道给药亦可以是非胃肠道给药。一般推荐针对各化疗药物的已知给药途径给药。
二)将酰基辅酶a:胆固醇酰基转移酶acat1抑制剂和其他肿瘤治疗药物配置成复方制剂。在将酰基辅酶a:胆固醇酰基转移酶acat1抑制剂和其他肿瘤治疗药物采用相同给药途径给药并同时施加时,可采用将两者配置成复方制剂的形式。
本发明第四方面提供了一种肿瘤治疗方法,为向对象施用有效量的酰基辅酶a:胆固醇酰基转移酶acat1抑制剂,以及向对象施用有效量的其他肿瘤治疗药物和/或向对象实施其他肿瘤治疗手段。
可以同步的或顺序地给予有效量的酰基辅酶a:胆固醇酰基转移酶acat1抑制剂和至少一种有效量的其他肿瘤治疗药物。
基于酰基辅酶a:胆固醇酰基转移酶acat1为新发现的肿瘤免疫治疗靶点,在与酰基辅酶a:胆固醇酰基转移酶acat1抑制剂以外的其他肿瘤治疗药物联合用药中,至少可以起到疗效相加的效果,进一步增强对于肿瘤的抑制。
所述其他肿瘤治疗药物指不具备包括但不限于:抗肿瘤抗体、化疗药物或靶向型药物等。
所述酰基辅酶a:胆固醇酰基转移酶acat1抑制剂可以是胃肠道给药或者胃肠外给药。所述其他肿瘤治疗药物可以是胃肠道给药或者胃肠外给药。对于抗肿瘤抗体或化疗药物,一般采用胃肠外给药。
本发明的优点在于:
(1)通过一系列体外实验,发现acat1在调控cd8t细胞免疫应答反应上起着关键作用,抑制acat1的活性可以增强cd8t细胞的抗原特异性免疫应答反应,增强其对靶细胞的杀伤能力,而不影响cd8t细胞对自身抗原的响应;
(2)通过胆固醇定量、显微成像、流式以及westernblot等方法,发现抑制acat1活性重编程cd8t细胞胆固醇代谢,上调cd8t细胞脂膜上胆固醇水平。细胞质膜胆固醇水平的上升一方面进而促进tcr微簇形成,增强tcr信号通路的活化,最终增强cd8t细胞的免疫应答反应;另一方面细胞质膜胆固醇水平提高后,可以促进cd8t细胞免疫突触的形成,增强cd8t细胞对靶细胞的直接杀伤能力;
(3)在动物水平上,t细胞特异性基因敲除acat1或者通过抑制剂抑制acat1活性可以增强cd8t细胞免疫应答能力,在小鼠黑色素瘤模型和小鼠肺癌模型中增强cd8t细胞的抗肿瘤活性;表明acat1作为关键免疫靶点,在肿瘤免疫治疗上有着潜在的临床应用价值。
(4)现有技术虽然论证了酰基辅酶a:胆固醇酰基转移酶acat1抑制剂的用药安全性,但是酰基辅酶a:胆固醇酰基转移酶acat1抑制剂原适应症的临床效果并不理想。本发明在肿瘤免疫治疗领域给酰基辅酶a:胆固醇酰基转移酶acat1抑制剂提供了新的临床应用价值,为其进一步的市场应用开辟了广阔的前景。
附图说明
图1.抑制胆固醇代谢相关通路影响cd8t细胞的效应功能。
a-d.分别抑制胆固醇合成(lovastatin:hmgcr抑制剂)、胆固醇运输(u18666a)和胆固醇酯酰化修饰(cp113,818和k604)后,通过胞内染色和流式细胞术检测cd8t细胞活化(α-cd3(5μg/ml)和α-cd28(5μg/ml)铺板刺激)后颗粒酶b(gzmb),细胞因子ifnγ和tnfα的表达。
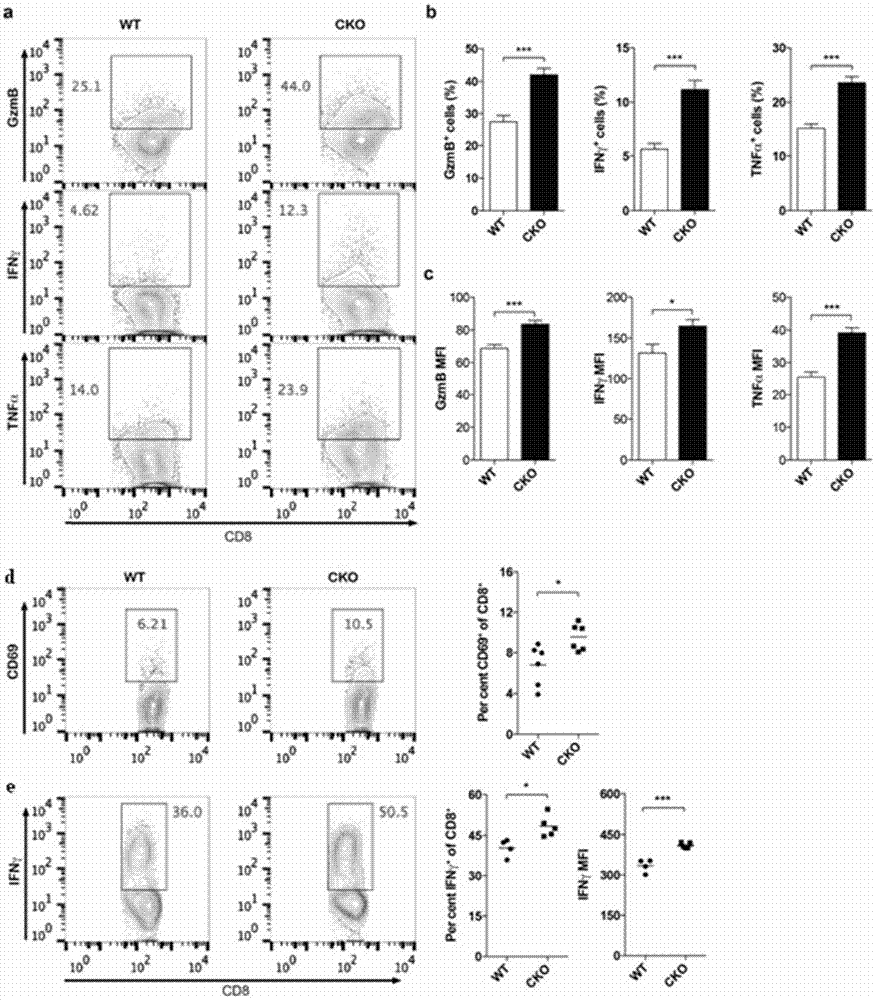
图2.t细胞特异性敲除acat1增强cd8t细胞功能。
a‐c.通过胞内染色和流式细胞术检测野生型(wt)和acat1基因敲除acat1cko(cko)cd8t细胞活化(α-cd3(5μg/ml)和α-cd28(5μg/ml)铺板刺激)后颗粒酶b,细胞因子ifnγ和tnfα的表达;
d‐e.野生型小鼠(wt)和acat1cko小鼠(cko)感染李斯特菌(listeriamonocytogenes)7天后,流式检测脾脏中cd8t细胞活化标志物cd69(n=6)和细胞因子ifnγ的表达(n=4-5)。
图3.acat1敲除促进cd8t细胞增殖以及减少cd8t细胞凋亡。
a.活细胞荧光染料cfse标记野生型(wt)和acat1基因敲除(cko)cd8t细胞,然后铺板抗体刺激细胞(1μg/mlα-cd3+1μg/mlα-cd28),通过流式检测cfse荧光强度检测细胞的分裂情况;
b.小鼠脾脏分离得到的cd8t细胞培养24小时后,annexinv和pi(propidiumidiode)染色,检测细胞的凋亡情况;
c.铺板抗体(5μg/mlα-cd3+5μg/mlα-cd28)刺激野生型和acat1ckocd8t细胞24小时,然后annexinv和pi(propidiumidiode)染色,检测细胞的凋亡情况。
图4.acat1敲除增强ot-icd8t细胞对特异性抗原的免疫应答,且并不引发对自身抗原的免疫应答。
a.c57bl/6小鼠来源的脾脏细胞呈递外来抗原(n4,a2,t4和g4)或者自身抗原(r4和catnb)后作为抗原递呈细胞(antigen-presentingcell,apc)刺激
b.c57bl/6小鼠来源的脾脏细胞呈递ova抗原(ova257-264)后作为抗原递呈细胞刺激
c.取3月龄小鼠血清,elisa方法检测血清中细胞因子ifnγ和自身抗体抗双链dnaigg水平。
图5.acat1敲除增强cd8t细胞抗肿瘤活性。
a-b.野生型小鼠和acat1cko小鼠中黑色素瘤生长速度以及小鼠的生存曲线分析。肿瘤生长曲线用two-wayanova统计方法分析,小鼠的生存曲线用log-rank(mantel-cox)统计方法分析;
c-d.野生型和acat1cko小鼠在注射b16f10黑色素瘤细胞后,在第16天将肿瘤取出,通过流式分析cd8t细胞中cd44、颗粒酶b、ifnγ和tnfα的表达,同时对肿瘤浸润的cd8t细胞进行计数,通过流式检测cd8/cd4t细胞比比率以及cd8t细胞增殖标志物ki-67的表达;
e.流式检测肿瘤浸润cd8t细胞表面免疫检测点受体pd-1和ctla-4的表达;
f.胞内染色和流式检测肿瘤浸润的treg细胞(cd4+foxp3+)的比例;
g-h.流式检测引流淋巴结中cd8t细胞中cd44、ifnγ的表达,同时对cd8t细胞进行计数,通过流式检测cd8/cd4t细胞比比率;
i-k.黑色素瘤肺转移模型,在注射黑色素瘤细胞后第20天,检测肺脏中肿瘤数量,同时继续记录剩余小鼠的生存率和生存时间,小鼠的生存曲线用log-rank(mantel-cox)统计方法分析;
l.黑色素瘤肺转移模型中,苏木精-伊红染色观察肿瘤细胞在肺脏中的浸润情况;
m.黑色素瘤肺转移模型中,流式检测肺脏中cd8t细胞cd44、颗粒酶b、ifnγ和tnfα 的表达;
n-p.将体外诱导分化成熟的野生型和acat1ckoot-ictl尾静脉注射到荷瘤b16f10-ova(b16f10黑色素瘤细胞中表达ovalbumin)的c57bl/6野生型小鼠中,检测肿瘤的生长以及小鼠的生存率。
图6.acat1敲除促进cd8t细胞tcr微簇形成并增强tcr信号通路活化。
a.野生型和acat1cko
b.流式检测野生型和acat1ckocd8t细胞表面tcr(cd3)和cd8水平;
c.storm对野生型和acat1ckocd8t细胞活化前后膜表面tcr的分布进行成像;
d-e.对图c获得的成像结果进行ripley’skfunction分析,r代表tcr微簇的大小,l(r)-r代表tcr微簇形成的程度。
图7.acat1敲除促进cd8t细胞免疫突触的形成。
a-b.tirfm对cd8t细胞的tcr进行活细胞动态成像,检测野生型和acat1ckocd8t细胞免疫突触的形成;
c-e.对免疫突触中tcr微簇的动态行为进行分析;追踪了来自19个野生型cd8t细胞和20个acat1ckocd8t细胞中超过1400个tcr微簇的运动,分析其平均平方位移msd(meansquaredisplacement),扩散系数的累计概率分布cpd(cumulativeprobabilitydistribution)和扩散系数diffusioncoefficient。
图8.acat1敲除不影响cd4t细胞的免疫应答反应。
a-b.α-cd3(5μg/ml)和α-cd28(5μg/ml)铺板刺激活化
c.实时定量pcr检测
d.α-cd3(5μg/ml)和α-cd28(5μg/ml)铺板刺激活化野生型和acat1cko
e-f.通过胞内染色和流式细胞术检测野生型(wt)和acat1敲除(cko)cd4t细胞活化(α-cd3(5μg/ml)和α-cd28(5μg/ml)铺板刺激活化后细胞因子il-2和tnfα的表达;
g-h.野生型小鼠(wt)和acat1敲除小鼠(cko)感染李斯特菌(listeriamonocytogenes)7天后,流式检测脾脏中cd4t细胞活化标志物cd69(n=6)和细胞因子ifnγ的表达(n =5–6)。
图9.acat抑制剂avasimibe处理增强cd8t细胞抗肿瘤能力。
a.野生型cd8t细胞用avasimibe处理(37℃,6小时,即于rpmi1640完全培养基中加药后,37℃co2培养箱中培养处理6小时,处理完之后用培养基或pbs离心清洗3次),随后通过铺板抗体α-cd3(5μg/ml)+α-cd28(5μg/ml)刺激24小时,然后胞内染色和流式检测颗粒酶b,细胞因子ifnγ和tnfα的表达;
b.avasimibe处理ot-ictl(37℃,6小时)处理方式同a,通过检测ldh的释放分析ot-ictl对靶细胞el-4的杀伤效率;
c.mts方法检测avasimibe处理对黑色素瘤细胞b16f10细胞活率的影响;
d-f.avasimibe处理b16f10黑色素瘤荷瘤c57bl/6野生型小鼠,检测肿瘤生长曲线和小鼠生存率;
g-h.在注射肿瘤后第18天将肿瘤取出,通过流式分析肿瘤浸润的cd8t细胞中cd44、颗粒酶b、ifnγ和tnfα的表达,同时对肿瘤浸润的cd8t细胞进行计数,通过流式检测cd8/cd4t细胞比比率以及cd8t细胞增殖标志物ki-67的表达;
i.流式检测肿瘤浸润cd8t细胞表面免疫检测点受体pd-1和ctla-4的表达;
j.胞内染色和流式检测肿瘤浸润的treg细胞(cd4+foxp3+)的比例;
k.流式检测肿瘤组织中mdsc细胞(gr1+cd11b+cd45+)的比例。
图10.avasimibe处理上调cd8t细胞质膜上胆固醇水平,促进tcr微簇和免疫突触形成,增强tcr信号通路的活化。
a-b.avasimibe处理cd8t细胞(37℃,6小时),filipiniii染色检测cd8t细胞游离胆固醇的分布;细胞质膜胆固醇的相对定量结果通过leicalasaf软件处理获取;
c.avasimibe处理cd8t细胞后,通过storm对cd8t细胞质膜表面tcr的分布进行分析;
d-e.对图c获得的成像信息进行ripley’kfunction分析,r代表tcr微簇的大小,l(r)-r代表tcr微簇形成的程度;
f-g.avasimibe处理cd8t细胞后,通过tirfm检测cd8t细胞免疫突触的形成;
h.avasimibe处理ot-ictl细胞后,用2μg/mlα-cd3和2μg/mlα-cd28激活ctl,然后western-blotting检测tcr近端信号通路和下游信号通路的活化情况;
i-k.storm对肿瘤浸润的cd8t细胞进行成像以及ripley’kfunction分析。
图11.acat2基因敲除不影响cd8t细胞的效应功能。
a-f.通过胞内染色和流式细胞术检测野生型(acat2+/+)和acat2基因敲除(acat2-/-)cd8t细胞活化(α-cd3+α-cd28铺板刺激)后颗粒酶b,细胞因子ifnγ和tnfα的表达。
图12.acat1基因敲除促进ctl细胞定向释放细胞毒颗粒
a.三维共聚焦荧光显微检测cd107a+细胞毒颗粒在ctl细胞中的分布,三维重构后用imaris软件计算免疫突触2μm范围内cd107a+细胞毒颗粒体积;mann-whitneyu检验用于差异显著性分析。
b.ot-ictl细胞与递呈ova257-264抗原肽的el-4靶细胞共培养,通过流式检测ctl细胞表面和内吞的cd107a来检测细胞毒颗粒脱颗粒效应;双尾t检验用于差异显著性分析。
图13.acat抑制剂增强人pbmc中cd8+t细胞的效应功能
*p<0.05;**p<0.01;***p<0.001。
图14.acat1基因敲除和avasimibe抑制小鼠llc肺癌发展进程。
a-c.llc肺癌在野生型小鼠和acat1基因敲除小鼠中的进程,小鼠生存曲线用log-rank(mantel-cox)统计方法进行分析;
d-g.avasimibe处理llc(lewislungcarcinoma)肺癌荷瘤的小鼠,评估avasimibe在治疗小鼠肺癌中的功效,给药路径、给药天数及每日剂量见图d,小鼠生存曲线用log-rank(mantel-cox)统计方法进行分析;
图15.avasimibe与α-pd-1抗体联合处理抑制小鼠黑色素瘤发展进程。
a-c.对b16f10黑色素瘤荷瘤的野生型c57bl/6小鼠进行avasimibe与α-pd-1抗体联合治疗,检测肿瘤生长曲线和小鼠生存率,比较联合治疗与单一疗法效果的差异,给药路径、给药天数及每日剂量见图a,小鼠生存曲线用log-rank(mantel-cox)统计方法进行分析(n=10)。
d.在注射肿瘤后第18天(avasimibe给药4次)将肿瘤取出,通过流式分析肿瘤浸润的pd-1高表达和低表达的dcd8t细胞中cd44、颗粒酶b、ifnγ和tnfα的表达;
e.在抗pd-1抗体给药3次后(注射肿瘤后18天),通过磁珠分选得到肿瘤浸润的cd8t细胞,抽提rna,检测相关基因的表达水平。
i.g.-灌胃给药,i.p.-腹腔注射给药
图16.avasimibe与化疗药dacarbazine联合用药抑制小鼠黑色素瘤发展进程。
a-c.对b16f10黑色素瘤荷瘤的野生型c57bl/6小鼠进行avasimibe与化疗药dacarbazine联合用药治疗,检测肿瘤生长曲线和小鼠生存率,比较联合治疗与单一疗法效果的差异,给药路径、给药天数及每日剂量见图a,小鼠生存曲线用log-rank(mantel-cox)统计方 法进行分析。
i.g.-灌胃给药,i.p.-腹腔注射给药
具体实施方式
本发明在研究中发现,acat1在调控cd8t细胞免疫应答反应上起着关键作用,抑制acat1的活性可增强cd8t细胞的免疫应答能力;增强cd8t细胞对肿瘤的杀伤活性;增强cd8t细胞的效应功能;促进cd8t细胞的增殖;减少cd8t细胞的凋亡;促进cd8t细胞细胞质膜上tcr成簇;促进cd8t细胞免疫突触的形成,且抑制acat1的活性不影响cd8t细胞对自身抗原的响应。由此认为酰基辅酶a:胆固醇酰基转移酶acat1抑制剂可用于肿瘤免疫治疗或者提高对于肿瘤的免疫能力。
酰基辅酶a:胆固醇酰基转移酶acat
酰基辅酶a:胆固醇酰基转移酶acat是调控细胞内胆固醇代谢的平衡的一种酶,在生物体内催化胆固醇与长链脂肪酸形成胆固醇酯。在哺乳动物细胞中发现两种同工异构酶acat1和acat2。acat1选择性地在组织与细胞中表达,与细胞内胆固醇代谢平衡有关;而acat2则广泛存在于肝脏、胃肠道等细胞中,主要参与饮食中胆固醇的吸收和载脂蛋白的装配。
酰基辅酶a:胆固醇酰基转移酶acat1抑制剂
是指对于酰基辅酶a:胆固醇酰基转移酶acat1具有抑制效果的化合物。对于酰基辅酶a:胆固醇酰基转移酶acat1具有抑制效果包括但不限于:抑制酰基辅酶a:胆固醇酰基转移酶acat1活性,或者抑制酰基辅酶a:胆固醇酰基转移酶acat1的基因转录或表达。
所述的酰基辅酶a:胆固醇酰基转移酶acat1抑制剂包括但不限于为sirna、shrna、抗体、小分子化合物。
所述酰基辅酶a:胆固醇酰基转移酶acat1抑制剂可以是对acat1与acat2没有选择性的acat抑制剂,已知的例如purpactins,manassantina,diphenylpyridazinederivatives,glisoprenina,cp113,818、avasimibe、pactimibe等,也可以是对acat1具有选择性抑制的抑制剂,已知的例如k604等。还可以选自ci976、tmp-153、ym750、geri-bp002-a、sandoz58-035、vulm1457、cl-283,546、ci-999、e5324、ym17e,fr182980、pd132301-2、f-1394、hl-004、f-12511(eflucimibe)、cinnamicacidderivatives、dup128、rp-73163、pyripyropenec、fo-1289、as-183、spc-15549、beaui、beauiii、fo-6979、angelica、ginseng、decursin、terpendolec、beauvericin、spylidone、pentacecilides、cl-283,546、cinnamicderivatives、betulinicacid、shikoninderivatives、esculeogenina和wu-v-23等。
抑制酰基辅酶a:胆固醇酰基转移酶acat1活性是指使酰基辅酶a:胆固醇酰基转移酶acat1酶活力下降。优选的,相比抑制前,酰基辅酶a:胆固醇酰基转移酶acat1酶活力降低至少10%,较佳的降低至少30%,再佳的降低至少50%,更佳的降低至少70%,最佳的降低至少90%。
抑制酰基辅酶a:胆固醇酰基转移酶acat1的基因转录或表达是指:使酰基辅酶a:胆固醇酰基转移酶acat1的基因不转录,或降低酰基辅酶a:胆固醇酰基转移酶acat1的基因的转录活性,或者使酰基辅酶a:胆固醇酰基转移酶acat1的基因不表达,或降低酰基辅酶a:胆固醇酰基转移酶acat1的基因的表达活性。
本领域技术人员可以使用常规方法对acat1基因转录或表达进行调节,如基因敲除、同源重组,干扰rna等。
酰基辅酶a:胆固醇酰基转移酶acat1的基因转录或表达的抑制可以通过pcr及westernblot检测表达量验证。
优选地,与野生型相比,acat1基因转录或表达降低至少10%,较佳的降低至少30%,再佳的降低至少50%,更佳的降低至少70%,又佳的降低至少90%,最佳地acat1基因完全没有表达。
小分子化合物
本发明中指由几个或几十个原子组成,分子质量在1000以下的化合物。
avasimibe(ci-1011)
化学名称:2,6-diisopropylphenyl2-(2,4,6-triisopropylphenyl)acetylsulfamate
分子式:c29h43no4s
ic50:acat,3.3μm;cyp2c9,2.9μm;cyp1a2,13.9μm;cyp2c19,26.5μm
casno.166518-60-1
结构式如下
k604
化学名称:
2-[4-[2-(benzimidazol-2-ylthio)ethyl]piperazin-1yl]-n-[2,4-bis(methyllthio)-6-methyl-3-pyridyl]acetamide
ic50:acat1,0.45μm;acat2,102.85μm
结构式:
在文献ikenoya,m.etal.aselectiveacat-1inhibitor,k-604,suppressesfattystreaklesionsinfat-fedhamsterswithoutaffectingplasmacholesterollevels..atherosclerosis191,290-297,doi:10.1016/j.atherosclerosis.2006.05.048(2007)中公开。
cp113,818
化学名称:(-)-n-(2,4-bis(methylthio)-6-methylpyridin-3-yl)-2-(hexylthio)decanoicamide
ic50:17-75nm
结构式:
在文献hutter-paier,b.etal.theacatinhibitorcp-113,818markedllyreducesamyloidpathologyinamousemodelofalzheimer'sdisease.neuron44,227-238,doi:10.1016/j.neuron.2004.08.043(2004)中公开
u18666a
casno.3039-71-2
ci976
化学名称:2,2-dimethyl-n-(2,4,6-trimethoxyphenyl)dodecanamide
分子式:c23h39no4
casno.114289-47-3;
ic50:soat1:ic50=73nm(human);acylcoenzymea:cholesterolacyltransferase1:ic50=73nm(rat);sterolo-acyltransferase,soat:ic50=110nm(rat);foamcellformation:ic50=3.8μm(ratperitonealmacrophages);golgi-associatedlpatactivity:ic50=15μm
结构式
tmp-153
分子式:c24h18cif2n3o
casno.128831-46-9
ic50:cholesterolacyltransferase(acat):ic50=5-10nm;acylcoenzymea:cholesterolacyltransferase1:ic50=5.8nm(rattusnorvegicus)
ym750
分子式:c31h36n2o
casno.138046-43-2
ic50:0.18μm
geri-bp002-a
化学名称:2,2'-methylenebis(6-tert-butyl-4-methyl-phenol);
分子式c23h32o2
casno.119-47-1
sandoz58-035
化学名称:
3-[decyldimethylsilyl]-n-[2-(4-methylphenyl)-1-phenethyl]propanamiidesa58-035
分子式:c30h47nosi
casno.78934-83-5
ic50:acat1,0.3μm(rat)
vulm1457
化学名称:
n-[2,6-bis(1-methylethyl)phenyl]-n'-[4-[(4-nitrophenyl)thio]phenyl]urea;
分子式:c25h27n3o3s
casno.228544-65-8
lovastatin,
结构式如下:
u18666a
casno.3039-71-2
ctl细胞
ctl细胞即为细胞毒性t淋巴细胞(cytotoxiclymphocyte,ctl),是一种终末分化的cd8t细胞,可以通过其tcr识别相应抗原并对表达相应抗原的肿瘤细胞或者受感染的细胞进行杀伤。
cd8t细胞
cd8t细胞即为cd8阳性t细胞。cd8(群集分化8)是作为协同受体的t细胞受体(tcr)的跨膜糖蛋白。
酰基辅酶a:胆固醇酰基转移酶acat1抑制剂制备药物
以酰基辅酶a:胆固醇酰基转移酶acat1抑制剂为主要活性成分或主要活性成分之一制备药物。通常,药物中除了有效成分外,根据不同剂型的需要,还会包括一种或多种药学上可接受的载体或辅料。
“药学上可接受的”是指当分子本体和组合物适当地给予动物或人时,它们不会产生不利的、过敏的或其它不良反应。
“药学上可接受的载体或辅料”应当与酰基辅酶a:胆固醇酰基转移酶acat1抑制剂相容,即能与其共混而不会在通常情况下大幅度降低药物组合物的效果。可作为药学上可接受的载体或辅料的一些物质的具体例子是糖类,如乳糖、葡萄糖和蔗糖;淀粉,如玉米淀粉和土豆淀粉;纤维素及其衍生物,如甲基纤维素钠、乙基纤维素和甲基纤维素;西黄蓍胶粉末;麦芽;明胶;滑石;固体润滑剂,如硬脂酸和硬脂酸镁;硫酸钙;植物油,如花生油、棉籽油、芝麻油、橄榄油、玉米油和可可油;多元醇,如丙二醉、甘油、山梨糖醇、甘露糖醇和聚乙二醇;海藻酸;乳化剂,如tween;润湿剂,如月桂基硫酸钠;着色剂;调味剂;压片剂、稳定剂;抗氧化剂;防腐剂;无热原水;等渗盐溶液;和磷酸盐缓冲液等。这些物质根据需要用于帮助配方的稳定性或有助于提高活性或它的生物有效性或在口服的情况下产生可接受的口感或气味。
本发明中,除非特别说明,药物剂型并无特别限定,可以被制成针剂、口服液、片剂、胶囊、滴丸、喷剂等剂型,可通过常规方法进行制备。药物剂型的选择应与给药方式相匹配。
联合治疗药物组合和施用方法
所述联合治疗药物组合可以是以下形式中的任意一种:
一)将酰基辅酶a:胆固醇酰基转移酶acat1抑制剂和其他抗肿瘤药物分别制成独立的制剂,制剂的剂型可相同或不同,给药途径亦可相同或不同。使用时,可几种药同时使用,也可几种药先后使用。先后给药时,应当在先用药物仍对机体有效的期间内向机体施加其他药物。
二)将酰基辅酶a:胆固醇酰基转移酶acat1抑制剂和其他抗肿瘤药物配置成复方制剂。在将酰基辅酶a:胆固醇酰基转移酶acat1抑制剂和其他抗肿瘤药物采用相同给药途径给药并同时施加时,可采用将两者配置成复方制剂的形式。
抗体常用的用药方法为静脉注射、静脉滴注或动脉灌注。其用法用量可参考现有技术。
小分子化合物常用的用药方法可以是胃肠道给药或者是胃肠外给药。sirna、shrna、抗体则一般采用胃肠外给药。可以是局部给药亦可以为全身给药。avasimibe为已知用于治疗动脉粥样硬化以及阿尔茨海默病的药物,其用法用量可参考现有技术,其他酰基辅酶a:胆固醇酰基转移酶acat1抑制剂的用法用量亦可参考avasimibe。
可以同步的或顺序地给予有效量的酰基辅酶a:胆固醇酰基转移酶acat1抑制剂和有效量的其他抗肿瘤药物。在部分实施例中,酰基辅酶a:胆固醇酰基转移酶acat1抑制剂采用胃肠道给药剂型,其他抗肿瘤药物采用胃肠外给药剂型。或者,酰基辅酶a:胆固醇酰基转移酶acat1抑制剂及其他抗肿瘤药物采用胃肠外给药剂型。或者,酰基辅酶a:胆固醇酰基转移酶acat1抑制剂对离体的ctl细胞进行处理,并在体外扩大培养ctl细胞后回输机体,而其他抗肿瘤药物直接对机体采用胃肠外给药。使用时,可两种药同时使用,也可两种药先后使用。先后给药时,应当在先用药物仍对生物体有效的期间内向生物体施加其他药物。
化疗药物包括烷化剂(如尼莫司汀、卡莫司汀、洛莫司汀、环磷酰胺、异环磷酰胺和甘磷酰芥等)、抗代谢药(如去氧氟鸟苷、多西弗鸟啶、氟尿嘧啶、巯嘌呤、甲氨蝶呤等核苷酸类似物)、抗肿瘤抗生素(如放线菌素d、阿霉素和柔红霉素等抗生素)、抗肿瘤动植物成分药(如长春瑞滨、紫杉醇、三尖杉酯碱、伊立替康、泰索帝和长春碱等)、抗肿瘤激素药(如阿他美坦、阿那曲唑、氨鲁米特、来曲唑、福美坦和他莫昔芬等)以及如顺铂、达卡巴嗪、奥沙利铂、乐沙定、可铂奥沙、米托蒽醌和丙卡巴肼等常用化疗药。
靶向型药物包括egfr阻断剂如吉非替尼(gefitinib、iressa和易瑞沙)和埃罗替尼(erlotinib、tarceva)、特定细胞标志物的单克隆抗体如西妥昔单抗(cetuximab、erbitux)和抗her-2单抗(赫赛汀,trastuzumab、herceptin)、酪氨酸激酶受体抑制剂如克唑替尼(crizotinib、xalkori)、抗肿瘤血管生成药物如bevacizumab、endostatin和bevacizumab等、bcr-abl酪氨酸激酶抑制剂如imatinib和dasatinib、抗cd20单抗如rituximab、igfr-1激酶抑制剂如nvp-aew541、mtor激酶抑制剂如cci-779、泛素-蛋白酶体抑制剂如bortezomib等。
其他肿瘤治疗手段可选自手术切除、射频消融、氩氦超导手术治疗、激光消融治疗、高强度聚焦超声以及放射治疗包括x-刀、r-刀、3d-crt和imrt中的一种或多种。
在进一步描述本发明具体实施方式之前,应理解,本发明的保护范围不局限于下述特定的具体实施方案;还应当理解,本发明实施例中使用的术语是为了描述特定的具体实施方案,而不是为了限制本发明的保护范围。
除非另外定义,本发明中使用的所有技术和科学术语与本技术领域技术人员通常理解的意义相同。除实施例中使用的具体方法、设备、材料外,根据本技术领域的技术人员对现有技术的掌握及本发明的记载,还可以使用与本发明实施例中所述的方法、设备、材料相似或等同的现有技术的任何方法、设备和材料来实现本发明。
除非另外说明,本发明中所公开的实验方法、检测方法、制备方法均采用本技术领域常规的分子生物学、生物化学、染色质结构和分析、分析化学、细胞培养、重组dna技术及相关领域的常规技术。这些技术在现有文献中已有完善说明,具体可参见sambrook等molecularcloning:alaboratorymanual,secondedition,coldspringharborlaboratorypress,1989andthirdedition,2001;ausubel等,currentprotocolsinmolecularbiology,johnwiley&sons,newyork,1987andperiodicupdates;theseriesmethodsinenzymology,academicpress,sandiego;wolffe,chromatinstructureandfunction,thirdedition,academicpress,sandiego,1998;methodsinenzymology,vol.304,chromatin(p.m.wassarmananda.p.wolffe,eds.),academicpress,sandiego,1999;和methodsinmolecularbiology,vol.119,chromatinprotocols(p.b.becker,ed.)humanapress,totowa,1999等。
1.材料和试剂
细胞培养基(dmem)、胎牛血清(fbs)购自lifetechnologies;filipiniii,lovastatin,mβcd,mβcd-cholesterol购自sigma;α-cd3和α-cd28购自biolegend;流式分析抗体α-mcd4(rm4-5),α-mcd8(53-6.7),α-mcd3ε(145-2c11),α-ifn-γ(xmg1.2),α-tnf-α(mp6-xt22),α-granzymeb(ngzb),α-cd44(im7),α-cd69(h1.2f3),α-pd-1(j43),α-ctla-4(uc10-4b9),α-ki67(16a8),α-foxp3(fjk-16s),α-gr1(rb6-8c5),α-cd11b(m1/70)和α-cd45(30-f11)购自ebioscience;western-blotting抗体α-pcd3ζ购自abcam,α-cd3ζ购自santacruze,α-pzap70,α-zap70,α-plat,α-lat,α-perk1/2和α-erk1/2购自cellsignaling;mts检测试剂盒购自promega;u18666a购自merck;avasimibe购自selleck;k604由中科院上海药物研究所合成;cp113,818由pierrefabre提供;b16f10细胞系和llc(lewislungcarcinoma)细胞系最 初来源于atcc,由中国科学院细胞库提供;李斯特菌由中国科学院巴斯德研究所冷启彬研究组提供;
2.实验动物
c57bl/6小鼠购自slac;ot-itcr转基因小鼠和acat2基因敲除小鼠来自jaxmice;cd4cre转基因小鼠由中国科学院生物化学与细胞生物研究所刘小龙研究组提供(最初来源于jaxmice);acat1flox/flox来自ingeneiouslabs,该试验动物在acat1基因的14号外显子毗邻的两个内含子上分别有一个loxp位点,该外显子编码有his460位点,该位点是acat1的酶活所必需的,acat1flox/flox可采用现有常规技术构建。实验中所有的动物都饲养在spf设施中。
3.t细胞分离,培养和流式检测
分离得到的细胞用含50μmβ-巯基乙醇的rpmi1640完全培养基在37℃co2培养箱培养。为进一步分析t细胞的功能表型,针对细胞表面标志物如cd8,cd44,cd69,细胞离心后直接用percp-α-cd8,fitc-α-cd44,pe-α-cd69进行染色,然后流式检测;而针对胞内颗粒酶和细胞因子的检测,分离到的细胞继续用1μmionomycin和50ng/mlpma刺激培养4个小时,在培养过程中加入5μg/mlbfa,以阻断颗粒酶和细胞因子向胞外分泌。刺激结束后,4%多聚甲醛(pfa)室温固定10分钟,然后胞内染色检测胞内颗粒酶和细胞因子的水平。
4.胆固醇定量
a.filipin染色和激光共聚焦成像技术对细胞质膜胆固醇进行相对定量
filipiniii溶于甲醇中至5mg/ml。t细胞用4%pfa固定,然后用50μg/mlfilipiniii于4℃染色30分钟,然后pbs洗5次以去除游离filipin。成像图片由leicasp8激光共聚焦显微成像系统获取,相对定量结果由leicalasaf软件分析得到。
b.基于胆固醇氧化的胆固醇定量方法
细胞经0.1%戊二醛固定15分钟后,pbs洗3次,然后用2u/ml胆固醇氧化酶室温处理15分钟以氧化细胞质膜上游离胆固醇;氧化反应结束后pbs洗3次以去除残留的胆固醇氧化酶,细胞内未被氧化的游离胆固醇用甲醇/氯仿(v:v=1:2)提取,然后用amplexred cholesterol检测试剂盒(lifetechnology)对游离胆固醇进行定量。细胞质膜胆固醇的含量由未被氧化酶处理的样品胆固醇含量减去氧化酶处理过的样品胆固醇含量得到。
5.mβcd和mβcd-cholesterol处理改变细胞质膜胆固醇水平
为降低细胞质膜胆固醇水平,0.1–1mmmβcd37℃处理cd8t细胞5分钟,然后pbs洗三次。为提高细胞质膜胆固醇水平,1-10μg/mlmbcd-cholesterol37℃处理cd8t细胞15分钟,然后pbs洗三次。
6.ova抗原激活ot-icd8t细胞
将c57bl/6小鼠脾脏细胞中的t细胞用t细胞阳性磁珠分选试剂盒(miltenyibiotech)去除,然后分别递呈ova抗原ova257-264(siinfekl,简称n4),及突变体sainfekl(简称a2),siitfekl(简称t4),siigfekl(简称g4)以及自身抗原rtytyekl(简称catnb)和阳性选择抗原siirfekl(简称r4)作为抗原递呈细胞(apc)。具体的,为分别将ova抗原ova257-264,a2,t4,g4,r4和自身抗原catnb与前述处理后的小鼠脾脏细胞一起在37℃孵育以得到抗原呈递细胞,同时;将阴性磁珠分选得到的ot-icd8t细胞与抗原递呈细胞共同培养(1:5)24小时,在培养的最后4小时加入5μg/mlbfa(是布雷菲德菌素a),以阻止细胞因子向胞外分泌,最后通过胞内染色和流式检测细胞因子的表达。
7.检测cd8t细胞(ctl)的细胞杀伤能力。
分离ot-i转基因小鼠的脾脏,红细胞裂解液去除红细胞后用5nmova257-264(n4)刺激,并在培养基中加入10ng/mlil-2,3天后换液补加il-2并继续培养2天得到分化成熟的杀伤性cd8t细胞(ctl)。将el-4小鼠淋巴瘤细胞分别与2nm抗原肽ova257-264及其突变体a2,t4,g4,r4和自身抗原catnb在37℃孵育30分钟以递呈相关抗原,pbs洗3次后将递呈抗原的el-4细胞和ctl重悬在无酚红rpmi1640培养基(含2%fbs)中,然后以1:1,1:2,1:5比例混合(el-4细胞数量为1×105)加入96孔板中,200g离心2分钟。37℃co2培养箱培养4小时,200g离心5分钟,取培养上清液,通过cytotox96non-radioactivecytotoxicity试剂盒(promega)检测培养基中乳酸脱氢酶ldh的释放以计算ctl对靶细胞的杀伤效率。
8.李斯特菌(listeriamonocytogenes)感染实验
新鲜培养的李斯特菌离心后重悬在pbs中,通过od200计算细菌浓度,然后以2×104cfu的剂量尾静脉注射到8-10周小鼠体内,7天后,将小鼠安乐死,取脾脏分离其t细胞,流式检测t细胞表面标志物和胞内细胞因子的表达水平。
9.小鼠b16黑色素瘤模型
b16f10黑色素瘤细胞用胰酶消化后,pbs洗3次后过40μm滤网,计数用pbs稀释至2×106/ml,然后皮下注射(s.c.)到8-10周雄鼠背部左侧(100μl体积),从第10天开始,游标卡尺测量肿瘤大小,每两天测一次,肿瘤大小=长度×宽度。当肿瘤其最长轴超过20mm时,将小鼠安乐死,并记录死亡时间点。
10.小鼠黑色素瘤t细胞过继治疗
表达鸡卵清蛋白ovalbumin的b16f10-ova黑色素瘤细胞(ref)(可参考文献:yangjetal.,kuper-typeimmunologicalsynapsecharacteristicsdonotpredictanti-braintumorcytolytict-cellfunctioninvivo.procnatlacadsciusa.2010.197(10):4716-21;获zhoupetal.,invivodiscoveryofimmunotherapytargetsinthetumourmicroenvironment.nature.2014,506(7486):52-7获得)用胰酶消化后,pbs洗3次后过40μm滤网,计数用pbs稀释至2×106/ml,然后皮下注射(s.c.)到8-10周雄鼠背部左侧(100μl)。在注射肿瘤细胞后第10天,将成瘤且肿瘤大小一致的小鼠随机分成3组,以尾静脉注射(i.v.)的方式分别注射200μlpbs,野生型ot-ictl和acat1基因敲除的ot-ictl(1.5×106),3天后开始测量肿瘤大小,每两天测一次。当肿瘤其最长轴超过20mm时,将小鼠安乐死,并记录死亡时间点。
acat1基因敲除的ot-i小鼠的获得:cd4cre小鼠与acat1flox/flox小鼠交配获得cd4cre-acat1flox/flox,然后与otitcr转基因小鼠交配,最终获得ot-i-cd4cre-acat1flox/flox小鼠和相应的对照小鼠ot-i-e-acat1flox/flox小鼠。
ctl的诱导方法是:取野生型或acat1基因敲除的oti小鼠脾脏,分别用10nm的ova257-264(n4)肽段刺激,并提供10ng/mlil-2,刺激2天后,在第3天换无n4肽段的培养基(含10ng/mlil-2)继续培养2天即可获得成熟的ctl。
11.avasimibe,α-pd-1抗体治疗小鼠黑色素瘤
b16f10黑色素瘤细胞用胰酶消化后,pbs洗3次后过40μm滤网,计数用pbs稀释至2×106/ml,然后皮下注射(s.c.)到8-10周雄鼠背部左侧(100μl),在注射肿瘤细胞后第10天,将成瘤且肿瘤大小一致的小鼠随机分成4组,以腹腔注射(i.p.)或者灌胃(i.g.)对小鼠进行治疗,avasimibe剂量为15mg/kg,每两天一次;α-pd-1抗体(j43,bioxcell)剂量为200μg/次,每三天一次;在注射肿瘤第12天开始测量肿瘤大小,每两天测一次。当肿瘤其最长轴超过20mm时,将小鼠安乐死,并记录死亡时间点。
12.小鼠llc肺癌模型
llc(lewislungcarcinoma)肺癌细胞用胰酶消化后,pbs洗3次后过40μm滤网,计数用pbs稀释至107/ml,然后尾静脉注射(i.v.)到8-10周雄鼠体内(200μl体积)。在注射肿瘤细胞 后第11天,将荷瘤小鼠随机分成2组,以腹腔注射(i.p.)的方式给小鼠注射avasimibe,剂量为15mg/kg,3天注射一次,连续给药9次。在注射肿瘤细胞后7周,取部分小鼠的肺脏,对肿瘤斑点进行计数,以评估肿瘤治疗效果,同时记录剩余小鼠的死亡时间点。
13.超高分辨率随机光学重构显微镜storm(super-resolutionstochasticalopticalreconstructionmicroscopy)检测细胞质膜上tcr(抗原受体)的分布。
超高分辨率随机光学重构显微镜storm成像在nikonn-storm成像系统上进行,该系统配有eclipseti-e电动相差显微镜,apochromat100倍tirf油镜和emccd。荧光染料选用alexa647,通过647nm连续可见光激光器(200mw)和450nm二极管激光器激发荧光染料。成像时tirf角度参数在3900-4000,以保证样品成像深度在1μm左右。
为了分析tcr在质膜上的成簇情况,对图片中tcr微簇的位置信息用ripley’skfunction和matlab分析,l(r)-r值代表在一定半径(r)内分子聚集的概率,而l(r)-r最大值对应的r即分析选定区域内tcr微簇的半径。
14.全内反射荧光显微成像tirfm(totalinternalreflectionfluorescencemicroscopy,)方法动态检测t细胞免疫突触形成过程。
dopc(1,2-dioleoyl-sn-glycero-3-phosphocholine)与生物素标记的dope(1,2-dioleoyl-sn-glycero-3-phosphoethanolamine-cap-biotin)以25:1的摩尔比混合,超声形成脂质体。使用no.1.5h厚度玻璃底的细胞培养皿,食人鱼酸液处理玻璃底表面并用双蒸水清洗干净。用浓度0.1mm的生物素标记的脂质体孵育玻片20分钟。pbs充分清洗后,用链霉亲和素(streptavidin)孵育30分钟。pbs充分清洗后,用生物素标记的小鼠cd3ε抗体(bionylatedα-mcd3ε,145-2c11)孵育30分钟。pbs充分清洗后,用1%酪蛋白封闭20分钟。pbs充分清洗,平面脂双分子层准备完毕。
α-mtcrβ抗体(biolegend)进行荧光染料标记(alexafluor568nhsester,lifetechnologies),经脱盐柱脱盐后使用papain蛋白酶酶切(piercefabmicropreparationkit,thermoscientific),最后经proteina柱分离(proteinaplusspincolumn,thermoscientific)得到alexa568-α-mtcrβ-fab。
新鲜分离的小鼠脾脏淋巴细胞用alexa568-α-mtcrβ-fab和fitc-α-mcd8a(ebioscience)冰上染色,pbs清洗2次。重悬的细胞加入如上所述的铺有平面脂双分子层的培养皿,置于37℃加热台,以3秒每帧的速度拍摄,进行活细胞全内反射荧光显微镜成像。或者重悬的细胞加入上文所述铺有平面脂双分子层的培养皿,置于37℃培养箱,刺激一定时间后用4%pfa固定,全内反射荧光显微镜成像。fitc阳性的cd8t细胞用imageproplussoftware(mediacybernetics)、imagej(nih)和matlab(mathworks)软件经行数据分析。
15.mts方法检测肿瘤细胞活率。
b16f10细胞(5×103)重悬于100μl含有1μmavasimibe或dmso对照的培养基中。37℃培养24、48、或72小时。加入20μlmts试剂(promega),孵育1-3小时后,测量490nm吸光度。490nm处的吸光值与培养中的活细胞数成正比。avasimibe对细胞活性的影响通过以dmso处理的细胞为对照组进行归一化处理得到,设定dmso处理组的细胞活性为1。
16.数据统计分析
除在图释中特别注明外,本文所有数据统计都是用graphpadprism(graphpadsoftware,inc.)进行统计分析,分析方法采用two-tailedunpairedstudent’st-test;*p<0.05,**p<0.01,***p<0.001,ns:无显著差异(nosignificantdifference)。
17.t细胞特异性敲除acat1小鼠的构建及acat1ckocd8t、acat1ckocd4t细胞的获得
将acat1flox/flox小鼠与cd4cre小鼠交配,获得的小鼠经pcr及westernblot检测表达量验证为t细胞特异性敲除acat1小鼠(cd4cre-acat1flox/flox,简称acat1cko)。
acat1ckocd8t细胞的获得:采用cd8磁珠分选得到(分选试剂盒来自stemcell)
acat1ckocd4t细胞的获得:采用cd4磁珠分选得到(分选试剂盒来自stemcell)
18.acat2基因敲除小鼠的来源及acat2-/-cd8t细胞的获得
acat2基因敲除小鼠(acat2-/-)来自于中科院生物化学与细胞生物学研究所李伯良研究组,最初由robertv.farese,jr构建(参考文献:buhmankketal.,resistencetodiet-inducedhypercholesterolemiaandgallstoneformationinacat2-deficientmice.natmed.2000,6(12):1341-7).
acat2-/-
19.cd8t细胞活化方法
通过磁珠分选得到的新鲜t细胞,重悬于rpmi1640完全培养基中,α-cd3(5μg/ml)和α-cd28
实施例1抑制胆固醇酯化可以增强cd8t细胞的效应功能
试验方法:磁珠分选得到的细胞重悬于rpmi1640完全培养基中,加入相应浓度的抑制剂,37度co2培养箱中培养处理6小时,然后rpmi1640完全培养基清洗3次,最后重悬于rpmi1640完全培养基中并转移到铺有激活抗体a-cd3和a-cd28的孔板中,37度co2培养箱中培养刺激20小时,然后加入brefeldina(5ug/ml)继续培养4小时,抑制细胞因子的分泌。培养结束后收集细胞,进行cd8抗体表面标记,然后用4%多聚甲醛室温固定10分钟,0.1%triton-x100对细胞膜打孔后加抗granzymeb,ifnγ,tnfα抗体标记细胞内相应蛋白,最后通过流式检测检测cd8阳性细胞中相应蛋白如granzymeb,ifnγ和tnfα的表达水平。
本实施例的目的是研究胆固醇代谢与cd8t细胞功能的相关性。实验通过一系列抑制剂抑制胆固醇代谢相关通路,然后检测cd8t细胞的功能是否发生相应的改变。实验结果表明,细胞胆固醇合成抑制剂lovastatin和细胞胆固醇的转运抑制剂u18666a都显著抑制cd8t细胞颗粒酶b(granzymeb,gzmb)的释放以及细胞因子如ifnγ和tnfα的表达,且抑制效果呈剂量效应(图1.a,b)。通过cp113,818抑制酰基辅酶a:胆固醇酰基转移酶acat1和acat2的活性,则明显促进cd8t细胞的效应功能(图1.c)。如前所述,在cd8t细胞中acat1的转录水平约是acat2的20倍,选取acat1的特异性抑制剂k604处理cd8t细胞,实验结果表明,k604处理同样增强cd8t相比的效应功能(图1.d)。表明通过抑制acat1的功能则增强cd8t细胞的效应功能,因此acat1可能是一个增强cd8t细胞功能的靶点,以应用于临床治疗如肿瘤免疫治疗中。
实施例2t细胞特异性敲除acat1增强cd8t细胞免疫应答反应。
本实施例的目的是为了验证acat1在cd8t细胞中的功能。通过将acat1flox/flox小鼠与cd4cre小鼠交配,获得t细胞特异性敲除acat1小鼠(cd4cre-acat1flox/flox,简称acat1cko)和相应的野生型对照小鼠(acat1flox/flox)。
间接体内试验方法:磁珠分选得到的cd8t细胞重悬于rpmi1640完全培养基中,加入相应浓度的抑制剂,37度co2培养箱中培养处理6小时,然后rpmi1640完全培养基清洗3次,最后重悬于rpmi1640完全培养基中并转移到铺有激活抗体α-cd3和α-cd28的孔板中,37度co2培养箱中培养刺激20小时,然后加入brefeldina(5μg/ml)继续培养4小时,抑制细胞因子的分泌。培养结束后收集细胞,进行cd8抗体表面标记,然后用4%多聚甲醛室温 固定10分钟,0.1%triton-x100对细胞膜打孔后加抗granzymeb,ifnγ,tnfα抗体标记细胞内相应蛋白,最后通过流式检测检测cd8阳性细胞中相应蛋白如granzymeb,ifnγ和tnfα的表达水平。
间接体内实验(exvivo)结果发现,cd8t细胞受到刺激活化后,acat1ckocd8t细胞的免疫应答能力增强,表现为更多的颗粒酶b(gzmb)的释放以及更多细胞因子ifnγ和tnfα的表达(图2.a,b,c)。
为了在体内研究中验证acat1在cd8t细胞中的功能,采用了李斯特菌(listeriamonocytogenes)感染模型进行验证。李斯特菌是一种细胞内繁殖的致病菌,cd8t细胞在响应李斯特菌感染后会高表达细胞因子ifnγ,并诱发后续的免疫应答反应以达到最终清除病原菌的作用。尾静脉注射李斯特菌诱发感染7天后,通过检测小鼠脾脏中cd8t细胞的响应情况,发现acat1ckocd8t细胞表达更多的ifnγ,同时cd8t细胞早期活化标志蛋白cd69的表达也呈显著升高(图2.d,e)。
实施例3acat1基因敲除促进cd8t细胞的增殖并减少凋亡
本实施例的目的是为了检测acat1对cd8t细胞增殖的影响。通过cfse标记实验,用α-cd3+α-cd28抗体刺激cd8细胞,进一步检测acat1对cd8t细胞增殖的影响,发现与野生型cd8t细胞相比,acat1ckocd8t细胞的增殖能力增强(图3.a)。同时通过annexinv和pi染色检测cd8t细胞激活后的凋亡,结果显示acat1ckocd8t细胞annexinv-pi-的活细胞所占比例相比较与野生型细胞的明显增多,而处于凋亡状态的细胞(annexinv+pi-和annexinv+pi+)所占比例则显著减少(图3.b,c)。
实施例4acat1基因敲除不会引发cd8t细胞对自身抗原产生反应和自身免疫
本实施例的目的是为了研究去除acat1功能后cd8t细胞获得增强的效应功能是否会使得cd8t细胞对自身抗原产生反应从而诱发自身免疫病。为了研究这一点,将acat1cko小鼠进一步与ot-itcr转基因小鼠(jaxmice)进行交配,获得ot-i背景的acat1特异性基因敲除小鼠(ot-iacat1cko)和相应的对照小鼠(ot-i)。ot-i转基因小鼠的绝大部分t细胞为ot-icd8t细胞,其tcr特异性识别h2kb递呈的ovabumin(ova257-264)抗原(简称n4),并产生相应的cd8t细胞免疫应答反应;同时ot-itcr除了识别其野生型抗原(n4)外,也可识别一系列的ova突变体(a2,t4,g4,r4),并产生相应的强弱免疫应答反应。试验发现,acat1缺陷除了能促进ot-icd8t细胞对强弱抗原的免疫应答反应,具体表现为 细胞因子ifnγ的分泌量增加以及对靶细胞的杀伤效应(图4.a-b)。但是acat1缺陷不会引起ot-icd8t细胞对自身抗原catnb(β-catenin片段,可以被h2kb呈递)以及类自身抗原r4产生免疫应答。这个结果表明acat1基因敲除不影响t细胞对抗原亲和力(affinity)识别能力。为进一步验证acat1基因敲除后小鼠自身免疫情况,试验检测了小鼠血清中细胞因子ifnγ和自身抗体抗双链dna抗体。结果显示,与对照小鼠相比,这两项指标没有任何改变(图4.c),表明acat1基因敲除并不引起自身免疫反应,进一步表明acat1作为肿瘤免疫治疗靶点的安全性。
实施例5利用三种黑色素瘤模型研究acat1基因敲除促进cd8t细胞的抗肿瘤活性
免疫治疗是当前治疗肿瘤的热点,而cd8t细胞对肿瘤细胞的杀伤能力直接关系到肿瘤免疫治疗的效果。为了验证acat1敲除对cd8t细胞的抗肿瘤能力的影响,本实施例首先建立了皮下黑色素瘤模型,在acat1cko小鼠和野生型小鼠中皮下注射b16f10黑色素瘤细胞诱导黑色素瘤,实验发现acat1cko小鼠黑色素瘤的进程被显著延缓,表现为肿瘤生长更慢,小鼠的生存率和生存期更长(图5.a,b)。对荷瘤小鼠的t细胞的表型进行分析,发现在acat1cko小鼠中,肿瘤浸润的cd8t细胞活性更强,表现为acat1cko小鼠肿瘤浸润cd8t细胞中,cd44高表达的效应细胞更多,表达颗粒酶b和细胞因子ifnγ和tnfα的比例也更高;而且acat1cko小鼠肿瘤浸润cd8t细胞的数量、cd8/cd4细胞的比例也要高于野生型、细胞增殖的标志物ki-67的表达水平也更高(图5.c,d)。免疫检测点受体如pd-1和ctla-4目前是肿瘤免疫治疗的热门靶点,实验也检测了肿瘤浸润的cd8t细胞表面pd-1和ctla-4的表达水平,发现其在acat1cko和野生型小鼠中没有明显差异(图5.e);同时实验也检测了肿瘤中cd4t细胞中treg细胞(cd4+foxp3+)的比例,发现acat1敲除并不改变treg细胞在cd4t细胞中的比例(图5.f)。以上结果表明acat1敲除使cd8t细胞的抗肿瘤效应功能增强。
为了进一步验证cd8t细胞在该肿瘤模型中的应答反应受acat1的调控,实验在皮下注射b16f10黑色素瘤细胞后第7天,将acat1cko和野生型小鼠的引流淋巴结(draininglymphnode)取出,分析其中t细胞的表型。实验发现acat1cko小鼠引流淋巴结中的cd8t细胞cd44水平和细胞因子ifnγ的表达上升(图5.g),而且cd8t细胞的数量以及cd8/cd4的比率也显著升高(图5.h),表明acat1缺陷促进cd8t细胞的初始免疫应答反应。
相比较与皮下实体瘤,转移型肿瘤的进程更为复杂,其治疗更为艰难。为进一步检测acat1缺陷是否影响cd8t细胞对转移瘤的免疫应答反应,实验建立了黑色素瘤肺转移小鼠 模型,向acat1cko和野生型小鼠尾静脉注射b16f10黑色素瘤细胞,然后检测肺脏中黑色素瘤的发展进程。实验发现在acat1cko小鼠中,与野生型对照小鼠相比,其肺脏肿瘤数量明显减少,而且小鼠的生存率和生存期更长(图5.i-k)。通过苏木精-伊红(h&e)对肺脏组织进行染色,发现acat1基因敲除后,黑色素瘤在肺脏中的浸润明显减弱(图5.l)。对肺脏t细胞的表型进行分析,也发现acat1cko小鼠cd8t细胞中cd44高表达的效应细胞更多,表达颗粒酶b和细胞因子ifnγ和tnfα的比例也更高(图5.m)。这些结果表明acat1缺陷增强cd8t细胞在非转移和转移型肿瘤中的抗肿瘤免疫应答效应。
由于acat1cko中所有的t细胞都缺失acat1,为了验证acat1基因敲除是对肿瘤浸润的cd8t细胞而非cd4t细胞的功能的影响而获得更强抗肿瘤作用,在野生型c57小鼠皮下注射b16f10-ova黑色素瘤细胞,该细胞表达ovalbumin,可以被黑色素瘤细胞的h2kb递呈在细胞表面,从而被ot-icd8t细胞识别。在野生型小鼠成功诱导黑色素瘤后,在注射肿瘤后第10天以尾静脉注射的方式,将来自acat1cko小鼠和野生型小鼠的ot-ictl注射到荷瘤野生型小鼠体内,然后监测肿瘤生长并记录小鼠的生存情况(图5.n),结果表明,注射了acat1ckoot-ictl的实验组肿瘤生长比注射了野生型ot-ictl的对照组更慢,而且小鼠的生存时间更长(图5.o,p),进一步表明acat1特异性敲除的cd8t细胞有更好的抗肿瘤作用。
实施例6acat1基因敲除促进cd8t细胞细胞质膜上t细胞抗原受体tcr的微簇形成并增强tcr信号通路的活化。
本实施例研究了acat1敲除对tcr的信号转导的影响。实验通过α-cd3加α-cd28抗体激活acat1ckocd8t细胞,检测tcr和其下游信号分子的活化情况。实验发现,acat1敲除明显促进tcr磷酸化和tcr近端活化信号的增强,表现为cd3ζ、zap70和lat的磷酸化明显增强,同时tcr的下游通路信号分子如erk1/2的磷酸化也显著升高(图6.a)。实验采用了超高分辨率随机光学重构显微成像技术(super-resolutionstochasticalopticalreconstructionmicroscopy,storm)对cd8t细胞质膜表面的tcr微簇进行分析。结果显示,acat1基因敲除不改变cd8t细胞质膜上tcr的表达水平(图6.b),但是能明显促进tcr微簇的形成:acat1ckocd8t细胞的tcr微簇比野生型cd8t细胞的更大。由于tcr微簇的形成受tcr活化信号的影响,t细胞活化后其tcr微簇会明显增大,因此实验进一步分析了活化后tcr微簇的形成情况。结果表明,cd8t细胞活化后其tcr微簇增大,而且活化的acat1ckocd8t细胞的tcr微簇比活化的野生型cd8t细胞的更大(图6.c-e)。这 些结果表明acat1基因敲除后cd8t细胞tcr微簇的增大,从而使得tcr及其下游信号通路活化增强。
实施例7acat1基因敲除促进cd8t细胞免疫突触(immunologicalsynapse,is)的形成
t细胞在识别抗原后,与靶细胞在细胞-细胞接触面形成免疫突触结构(immunologicalsynapse),免疫突触的形成有助于维持信号体(signalsome)的稳定,以保证t细胞的充分活化并产生相应的免疫应答反应。对于起细胞杀伤作用的cd8t细胞,免疫突触的形成不仅有助于稳定signalsome,还能通过这个突触结构向靶细胞释放颗粒酶等,增强其对靶细胞的杀伤能力。本实验研究了acat1敲除的cd8t细胞对免疫突触形成的影响。实验进一步通过活细胞全内反射荧光显微镜技术(totalinternalreflectionfluorescencemicroscopy,tirfm),实时跟踪检测免疫突触的形成过程,实验发现acat1ckocd8t细胞能更有效地形成免疫突触结构,表现为tcr所在的csmac结构形成更快,而且收敛更好(图7.a-b)。对免疫突触形成过程中tcr微簇的分子动态行为进行分析,结果表明acat1ckocd8t细胞的免疫突触中可运动的tcr微簇占全部的tcr微簇的比例更高,且向心移动速度更快,有助于免疫突触的进一步稳定(图7.c-e)。
实施例8acat1基因敲除不影响cd4t细胞的免疫应答反应
cd4辅助t细胞在机体应对外来病原的免疫应答中也起着关键作用,为了进一步研究acat1基因敲除是否影响cd4t细胞的功能,本实施例首先检测了cd4t细胞在活化前后细胞质膜胆固醇水平的变化。通过filipiniii标记以及成像实验,结果发现acat1cko
实施例9acat抑制剂avasimibe增强cd8t细胞的抗肿瘤功能
本实施例目的是进一步验证acat1抑制剂在肿瘤免疫治疗中的应用。acat1作为用作治疗动脉粥样硬化的靶点,目前已有一系列小分子药物在进行动物和临床实验。avasimibe是其中一种,目前多次临床实验已经验证了avasimibe在的安全性。因此选用avasimibe,验证acat1作为肿瘤免疫治疗靶点的可能性。体外实验表明,avasimibe与其他acat抑制剂如cp113,818和k604一样,可以促进cd8t细胞颗粒酶b的释放和细胞因子ifnγ和tnfα的表达(图9.a)。体外杀伤实验也表明avasimibe增强ctl的靶细胞杀伤能力,且呈剂量效应(图9.b)。实验进一步在小鼠黑色素瘤模型中验证avasimibe的作用,通过对黑色素瘤荷瘤野生型小鼠进行腹腔注射给药(15mg/kg)处理,与对照小鼠相比,avasimibe给药的小鼠肿瘤生长减慢,小鼠的生存时间也显著延长(图9.d-f)。为了验证avasimibe不是通过直接抑制肿瘤细胞的生长,在体外实验中用avasimibe处理b16f10黑色素瘤细胞,发现avasimibe处理不影响b16f10细胞的活性(图9.c)。对小鼠肿瘤浸润的免疫细胞进行分析发现,avasimibe给药的小鼠中:其肿瘤浸润的cd8t细胞活性更高,表现为cd8t细胞表面活化标记cd44的表达比例更高,而且表达颗粒酶b,细胞因子ifnγ和tnfα的细胞比例也更高。对小鼠肿瘤浸润的t细胞进行计数,发现avasimibe给药组的肿瘤浸润cd8t细胞数量更多,且cd8/cd4比率更高。另外avasimibe给药组肿瘤浸润cd8t细胞中的细胞增殖标记物ki-67的表达水平也更高(图9.g-h)。考虑到肿瘤微环境的免疫抑制效应,实验也检测了cd8t细胞上的免疫抑制受体pd-1和ctla-4的表达水平,发现avasimibe给药并未改变这些免疫检测点受体的表达(图9.i)。
肿瘤微环境中还存在有一些抑制型的免疫细胞如treg(regulatorytcell)和mdsc(myeloid-derivedsuppressorcell),这些细胞通过抑制cd8t细胞等肿瘤杀伤细胞的活性,在肿瘤的发展进程中起着关键的作用。因此实验进一步检测了肿瘤组织中treg和mdsc的比例,avasimibe给药后,treg(cd4+foxp3+)细胞在cd4t细胞中的比例没有明显改变,而mdsc(gr1+cd11b+cd45+)在cd45+免疫细胞中的比例有较轻微的降低(图9.j,k),考虑到avasimibe给药组的肿瘤组织中cd8t细胞的数量明显上升,mdsc在cd45+细胞中 的比例降低可能是由于cd8t细胞在cd45+细胞中的比例上升所致(图9.h)。这些证据表明,acat抑制剂avasimibe可以通过上调cd8t细胞杀伤性效应而在肿瘤治疗中起作用。
实施例10avasimibe通过抑制acat1促进cd8t细胞的抗肿瘤活性
本实施例的目的是验证avasimibe是否是通过抑制acat1发挥其肿瘤免疫能力。为了验证这一点,在体外用avasimibe对cd8t细胞进行处理,检测其细胞质膜胆固醇水平的变化。通过filipiniii对细胞进行染色,发现avasimibe处理后,cd8t细胞质膜游离胆固醇水平明显上升(图10.a,b)。通过storm对cd8t细胞表面tcr的定位进行分析发现,avasimibe处理促进tcr微簇的形成(图10.c-e);通过tirfm对t细胞活化过程中免疫突触的形成进行分析,也表明avasimibe处理促进cd8t细胞免疫突触的形成(图10.f,g)。进一步通过western-blotting方法检测avasimibe处理后tcr信号通路的活化情况,结果也表明avasimibe处理增强tcr信号通路的活化(图10.h)。这些结果与acat1敲除的cd8t细胞的表现一致。同时,为进一步在动物体内验证该机制,实验从avasimibe给药的荷瘤小鼠的肿瘤中分离肿瘤浸润的cd8t细胞,通过storm对肿瘤浸润的cd8t细胞上tcr的分布进行成像分析,发现avasimibe处理(于rpmi1640完全培养基中加药后,37℃co2培养箱中培养处理6小时,处理完之后用培养基或pbs离心清洗3次)后,肿瘤浸润的cd8t细胞表面tcr微簇更大(图10.i-k)。这些证据表明avasimibe确实是通过抑制acat1促进cd8t细胞的活化,从而增强其抗肿瘤活性。
实施例11acat2基因敲除不影响cd8t细胞的免疫应答反应
由于avasimibe能抑制acat1和acat2,虽然acat2在cd8t细胞中的表达水平很低,为进一步排除avasimibe通过抑制acat2增强cd8t细胞的功能,从acat2基因敲除小鼠中分离cd8t细胞,用cd3和cd28抗体刺激激活,检测细胞因子ifnγ,tnfα和颗粒酶b,结果显示acat2基因敲除后cd8t细胞的免疫反应没有明显改变,表明acat2并不影响cd8的效应功能如细胞因子的分泌(图11)。
实施例12acat1基因敲除促进ctl细胞定向释放细胞毒颗粒
ctl对靶细胞进行直接杀伤时,首先需要与靶细胞接触并形成免疫突触结构。在这个过程中,ctl细胞会发生极化,包含颗粒酶在内的细胞毒颗粒(granule)会移动到免疫突触处并向靶细胞定向释放颗粒酶,进而诱导靶细胞的程序性死亡。通过三维共聚焦荧光显微镜技 术(3-dconfocalfluorescencemicroscopy)对ctl细胞中细胞毒颗粒的分布进行成像和三维重构,然后计算ctl中距离免疫突触2μm范围内的细胞毒颗粒体积。
试验方法:
1.成颗粒过程检测
ctl细胞用alexa568-α-mtcrβ-fab和apc-α-mcd8a(ebioscience)冰上染色,pbs清洗2次。重悬的细胞加入如上所述的铺有平面脂双分子层的培养皿,置于37℃培养箱,刺激一定时间后用4%pfa固定,0.1%tritonx-100穿孔。4℃胞内染色过夜,标记细胞毒颗粒表面蛋白cd107a(又名lamp-1,抗体克隆号1d4b)。α-mcd107a提前用alexafluor488nhsester(lifetechnologies)进行荧光染料标记。pbs充分清洗后三维共聚焦荧光显微镜成像。免疫突触附近2μm距离内的细胞毒颗粒体积用imaris软件经行数据分析。
2.脱颗粒检测
el-4细胞与ova257-264肽段37度孵育30分钟,作为递呈抗原的靶细胞。ot-ictl与递呈抗原的el-4细胞以1:1比例混合,同时加入1μg/mlalexa488-α-cd107a抗体和2μmmonensin。在37度co2培养箱分别培养1、2或4小时后,取出细胞,用pbs洗两次然后在冰上流式染色,以pe-cy7-α-cd8a标记cd8t细胞,最后通过流式细胞术检测ctl(cd8+)细胞表面和内吞的cd107a水平。
结果显示,acat1基因敲除后,ctl细胞免疫突触近端的细胞毒颗粒明显增多(图12.a)。由于颗粒酶释放过程中,形成毒颗粒囊泡表面的cd107a分子并未与颗粒酶一同进入靶细胞中,而是留在ctl细胞质膜表面,然后通过内吞的形式回到胞内重新参与细胞毒颗粒囊泡的组装,这个过程为脱颗粒过程。因此也可以通过检测脱颗粒水平来评估ctl对靶细胞释放毒颗粒的能力。通过流式细胞术检测细胞质膜上和内吞的cd107a的水平,发现acat1基因敲除会增加ctl的脱颗粒能力。这些证据表明acat1基因敲除促进ctl细胞向靶细胞定向释放细胞毒颗粒的能力。
实施例13acat抑制剂增强人pbmc中cd8+t细胞的效应功能
本试验的目的是验证acat1作为药物靶点在临床上使用的潜在价值,在人cd8t细胞中分别用acat抑制剂avasimibe和cp113,818抑制acat的活性,然后通过抗体交联的方式激活cd8t细胞,通过流式细胞术检测cd8t细胞细胞因子ifnγ和tnfα的表达。
试验方法:通过ficoll从健康志愿者体内获得的外周血中分离pbmc,然后用5μg/mlpha刺激获得cd8+杀伤性t细胞。3天后换成不含pha的培养液继续培养24小时,以降低本 底信号。再使用相应浓度的avasimibe或cp113,818孵育处理12小时,细胞换液并通过铺板刺激的方式用5μg/mlα-cd3+5μg/mlα-cd28抗体刺激24小时,在最后4小时加入5μg/mlbrefeldina以阻断细胞因子的分泌,最后通过胞内染色和流式细胞术检测cd8+t细胞中细胞因子ifnγ和tnfα的表达。双尾非配对t-test用于差异显著性分析。
试验结果:acat抑制剂cp113,818和avasimibe均能促进cd8t细胞细胞因子的表达,且具剂量效应,表明acat1作为增强cd8t细胞效应功能的靶点同样适用于人的cd8t细胞(图13)。
实施例14avasimibe在小鼠肺癌模型中的功效
本实施例的目的为进一步验证acat1作为肿瘤免疫治疗靶点的有效性。实验建立了小鼠llc(lewislungcarcinoma)肺癌模型,检测llc在野生型小鼠和acat1基因敲除小鼠中肺癌发展进程,结果发现t细胞中acat1基因敲除显著抑制肿瘤的生长,荷瘤小鼠的生存期也明显长于对照的野生型小鼠(图14.a-c)。为了验证acat1抑制剂avasimibe对llc肺癌的治疗效果,进一步对造模成功的小鼠进行avasimibe给药,结果发现avasimibe在治疗小鼠肺癌上也有一定的疗效,表现为肿瘤细胞数量较对照组少,小鼠的生存时间延长(图14d-g)。
实施例15avasimibe与α-pd-1联合治疗小鼠黑色素瘤的功效
目前肿瘤免疫治疗方法中,α-pd-1和α-ctla-4抗体治疗取得较好的疗效,但由于肿瘤微环境的复杂性以及肿瘤细胞的异质性,因此针对多个靶点的联合治疗方法正成为目前肿瘤免疫治疗的热点。本实施例的目的是验证acat1作为肿瘤免疫治疗靶点在联合治疗中的功效。实验在小鼠黑色素瘤模型中,结合α-pd-1抗体治疗和avasimibe治疗,检测肿瘤的发展进程。试验动物共40只,分成4组,每组10只。结果表明avasimibe在与α-pd-1的联合治疗中取得更好的疗效,小鼠肿瘤的生长显著减慢,同时小鼠的生存时间明显延长(图15.a-c)。通过对肿瘤浸润t细胞进行分析发现,avasimibe治疗后,无论是pd-1高表达还是低表达的cd8t细胞,其效应均明显增强,表明avasimibe对cd8t细胞效应的增强与pd-1的表达无关。为进一步检测抗pd-1抗体治疗是否影响到acat1通路,通过实时定量pcr方法检测了肿瘤浸润cd8t细胞acat1相关基因的表达,比较了抗pd-1抗体治疗与对照组基因表达水平的差异发现,抗pd-1抗体治疗并不改变acat1相关基因如acat1,acat2和酯化胆固醇水解酶nceh的表达,而t细胞细胞因子ifnγ的表达水平明显上升。
实施例16avasimibe与dacarbazine(达卡巴嗪)联合治疗小鼠黑色素瘤的功效
本实施例的目的是为了验证acat1作为免疫治疗靶点在与化疗药联合用药中的效果。化疗是目前治疗肿瘤的有效手段之一,dacarbazine是目前fda批准用于治疗转移型黑色素瘤的化疗药。本实施例在小鼠黑色素瘤模型中,给小鼠dacarbazine和avasimibe联合用药,结果表明显著抑制小鼠黑色素瘤的生长,而联合用药明显增强avasimibe的抗肿瘤效果(图16)。
试验动物分成4组,每组9-13只,具体见图16b,c,n值即小鼠数量,经统计分析,组之间的差异显著性即p值见图16b,c。
以上的实施例是为了说明本发明公开的实施方案,并不能理解为对本发明的限制。此外,本文所列出的各种修改以及发明中方法、组合物的变化,在不脱离本发明的范围和精神的前提下对本领域内的技术人员来说是显而易见的。虽然已结合本发明的多种具体优选实施例对本发明进行了具体的描述,但应当理解,本发明不应仅限于这些具体实施例。事实上,各种如上所述的对本领域内的技术人员来说显而易见的修改来获取发明都应包括在本发明的范围内。
- 还没有人留言评论。精彩留言会获得点赞!