氨基金刚烷单硝酸酯类化合物在制备预防和治疗疾病药物中的应用的制作方法
本发明属于药物技术领域,涉及药物的新用途,特别涉及氨基金刚烷单硝酸酯类化合物在预防和治疗青光眼、血管性痴呆、蛛网膜下腔出血和肺动脉高血压疾病中的应用。
背景技术:
(一)青光眼及其药物治疗
青光眼(Glaucoma)是指眼内压间断或持续升高的一种眼病。持续的高眼压可以给眼球各部分组织和视功能带来损害,如不及时治疗,视野可以全部丧失而至失明。青光眼是导致人类失明的三大致盲眼病之一,总人群发病率为1%,45岁以后为2%。
眼内压升高被认为是青光眼疾病发生发展的重要危险因素之一,也是目前可以干预的因素。至今青光眼的治疗还是基于降低眼压。近年来研究发现,除了眼压升高,在青光眼中多种刺激因素影响了细胞内环境稳定,而且神经元对刺激因素的抵抗力也决定了其内在易感性。有证据显示当视网膜神经节细胞暴露在青光眼性压力刺激下,导致其出现一系列相关联的细胞下游通路活动,包括线粒体功能异常,蛋白水解级联反应,内质网压力和氧化应激等。因此除了降低眼内压外,保护视神经细胞亦尤为重要。
传统的降眼压药物有β-肾上腺素能拮抗剂、α-肾上腺素受体激动剂、缩瞳剂和碳酸酐酶抑制剂、前列腺素类似物。作用机制包括如下3方面:增加小梁网途径的房水引流、减少睫状体的房水产生、增加葡萄膜巩膜途径的房水引流。
β-肾上腺素能拮抗剂:本类药物通过阻断肾上腺素和去甲肾上腺素与β-受体的结合,使睫状体上皮细胞中环磷酸腺苷(cAMP)水平降低,减少房水的生成,从而降低眼压。在减少房水生成的同时,也可在一定程度上减少房水通过小梁网的外流量。不良反应多见于心血管系统和呼吸系统,禁用于较严重心血管系统疾病和呼吸系统疾病者。目前临床上使用的β-阻滞剂主要有5种:倍他洛尔(Betaxolol)为选择性β1受体阻滞剂,具有一定的钙通道阻滞功能,可以改善因视网膜缺血造成的神经节细胞的调亡。也有研究发现它可以一定程度上保护神经节细胞免于因谷氨酸水平升高造成的损害。噻吗洛尔(timolol)、左布诺洛尔(Levobunolol,Betagan)、卡替洛尔(Carteolol)、美替洛尔(Metipranolol)都是非选择性β-阻滞剂。长期使用噻吗洛尔患者视网膜血管管径相对增加,视神经纤维层显著增厚,视杯显著缩小并伴有视盘颜色恢复。
α-肾上腺素受体激动剂肾上腺素:其对α和β受体均有兴奋作用,降压作用机制是增加房水排出,也能部分地减少房水生成。肾上腺素可引起一过性结膜血管收缩,随后出现反跳性血管舒张及严重的红眼症状,导致结膜色素沉着。其他不良反应包括口干、疲倦和抑郁等。
碳酸酐酶抑制剂:包括多佐胺(dorzolamide)和布林佐胺(brinzolamide,Azopt派立明),通过减少房水的分泌而降低眼压。局部用药比全身给药副作用少,但降眼压效果不及口服制剂。
前列腺素衍生物:包括拉坦前列腺素(Latanoprost)、比马前列腺(Bimatoprost)、曲伏前列腺素(Travoprost)、乌诺前列腺素(Unoprostone)和贝美前列腺素(lumegen)等。主要通过增加葡萄膜巩膜途径房水外流而降低眼压,少数药物尚有增加小梁网房水外流的功能,如贝美前列腺素。单用此类药物的降眼压效果比单用其他类药物要好。此外,因为这类药物与其它的抗青光眼类药物的作用机制不同,可与其他抗青光眼类药物产生协同作用。另外,这类药物的副作用较少,常见的副作用为结膜充血,睫毛增长和虹膜色素增多等,该类药物已成为开角性青光眼的一线用药。
胆碱能受体激动剂:又称拟副交感神经药物或缩瞳剂,主要用于临床的是毛果芸香碱。降压机制在原发性开角型青光眼主要是收缩睫状体纵行肌牵拉巩膜突和小梁网,使小梁网网眼张开促进房水外流,可降低眼压约20%~30%;在原发性闭角型青光眼主要是收缩瞳孔括约肌,产生缩瞳作用,拉紧虹膜,使堆积在前房角周边的虹膜离开前房角前避,开放房角。这类药物全身副作用较少,比其他抗青光眼药物便宜。缺点是瞳孔缩小、近视加深、前葡萄膜炎、视力下降等。
目前尚无视神经保护药物批准上市。老年痴呆药物memantine被认为具有视神经细胞保护作用,曾开展过III期临床而宣告失败。然而,兼有降低眼压和视神经保护药物对青光眼治疗无疑具有优势,此类药物国内外尚无上市报道。
(二)血管性痴呆及其药物治疗
血管性痴呆(Vascular Dementia,VaD或VD)是一组由脑血管疾病导致的智能及认知功能障碍综合征,是老年性痴呆的常见病因之一。痴呆患者中约30%的患者为VD,是继阿尔茨海默病后发病率最高的认知障碍性疾病(O'Brien and Thomas,2015)。在65岁以上的人群中VD的发病率为1%-4%,每5.3年患病风险增加1倍,预计到2050年痴呆患者将达到3500万。然而VD治疗缺乏有效药物,原先用于治疗VD的药物如胆碱酯酶抑制剂、降脂药物或神经营养药物经过多项大规模临床试验发现均不能显著改善VD的症状(Erkinjuntti,et al.,2002;Black,et al.,2003;Auchus,et al.,2007)。
目前研究认为,VD的发病机理主要与其局部脑血流量降低和神经细胞损伤有关。在多种神经系统疾病和血管性痴呆患者中,内皮细胞eNOS失耦联、表达减少以及内皮细胞氧化应激损伤(Miller,et al.,2010)等原因导致脑组织局部血液NO含量明显降低(Corzo,et al.,2007),血管紧张度增加,局部脑血流灌注不足,引起血脑屏障损害、神经细胞氧化应激、钙超载、炎性反应等病理生理变化,最终导致神经细胞功能网乱和认知障碍(Marshall,2012;Malkki,2015)。增加NO可望改善脑组织血液供应,延缓VD的病理进程。值得注意的是大量外源性NO释放,可导致全身血管扩张,血压下降,脑血流减少(Evgenov,et al.,2006)。这也是硝酸甘油、硝普钠等药物不能用于VD治疗的主要原因。
NMDA受体在调节神经元的存活,调节神经元的树突、轴突结构发育及参与突触可塑性的形成中起到极其重要的作用,是学习和记忆过程中一类至关重要的受体(Lopez,et al.,2015;Zhang,et al.,2015)。研究发现在缺血、阿尔兹海默病等病理条件下,NMDA受体过度激活可引起氧化应激和钙超载导致神经元细胞损伤或死亡,引起机体学习记忆和认知功能障碍(Wroge,et al.,2012),抑制NMDA受体活性可有效的保护神经元细胞损伤。事实上,NMDA受体可逆性抑制剂美金刚(Memantine)因其能够保护神经细胞损伤,临床研究已证明部分小血管性VD患者的认知功能得到明显改善。虽然美金刚由于其临床疗效受益较小,尚不能满足临床需求(Orgogozo,et al.,2002;Wilcock,et al.,2002),但为VD治疗提供了新的思路。
综上所述,NO含量不足引起的局部脑血流量降低和NMDA受体激活在VD的发病中起到极其重要的作用,增加局部脑组织中的NO含量和抑制NMDA受体活性有望延缓或逆转VD的病理进程,从而为VD的防治提供有效的策略。
(三)蛛网膜下腔出血及其药物治疗
蛛网膜下腔出血(Subarachnoid Hemorrhage,SAH)是指脑底部或脑表面血管破裂后,血液流入蛛网膜下腔引起相应临床症状的一种脑损伤。血液进入蛛网膜下腔,通过围绕在脑和脊髓周围的脑脊液迅速播散,刺激脑膜引起脑膜刺激征。颅内容量增加引起颅内压升高,甚至脑疝。在脑室和脑底凝固的血液可阻塞脑脊液循环通路,使其吸收和回流受阻引起梗阻性脑积水,或引起蛛网膜粘连,后交通动脉瘤的扩张或破裂出血可压迫邻近的动眼神经,产生不同程度的动眼神经麻痹。血细胞释放的血管活性物质可引起血管痉挛,严重者发生脑梗死。在过去的数十年来,血管痉挛和动脉瘤破裂再出血一直被认为是高死亡率和高致残率的一个主要因素。脑血管痉挛(CVS)是SAH后一个危险的病理生理状态。此时脑血管收缩,受累动脉的脑供血区域血流减少。CVS往往提示预后不好。NO是强效的内源性血管扩张剂,研究表明SAH时血管中NO可能减少,而血管收缩剂内皮素-1(ET-1)增加,NO与ET-1平衡失调,导致CVS。但多中心临床试验研究表明,蛛网膜下腔出血后的早期脑损伤是致死、致残的主要原因。SAH脑损伤的分子机制主要有:钙离子通道开放、自由基的产生、炎症反应、细胞凋亡及坏死等多种机制。目前临床上SAH的治疗手段十分有限,仅有一般处理和对症治疗、降低颅内压、防止再出血。对于早期脑损伤,尚缺乏有效的治疗策略。
目前SAH及其CVS的药物治疗主要有:
1、脑池内溶栓:在手术清除凝血块前向蛛网膜下池中注入溶栓剂,如rt-PA,进行脑池内溶栓治疗。
2、抑制血管平滑肌收缩:
(1)钙通道阻滞剂:临床研究表明,在动脉瘤破裂后21天内给予钙通道阻滞剂尼莫地平可以改善病人预后。早期曾认为尼莫地平可能会预防CVS,但并不能降低CVS的发生率,人们认为尼莫地平的作用主要在于改善微循环和神经保护作用。尼莫地平的预防痉挛的作用是肯定的,但在治疗已经出现症状的CVS的作用仍然不尽如人意。另外一种钙通道阻滞剂尼卡地平可以降低症状性及血管照影证实的CVS的发生率,但并不能改善预后。
尽管钙通道阻滞剂对预防CVS的发生可能有用,但也不积极提倡,另外,这些药物往往同时引起血压下降,因此建议在有效循环血量充足的前提下使用,宜微量泵输入并密切监测血压变化,最好能保证血压偏高状态。
(2)内皮素-1(ET-1)拮抗剂:克拉生坦,一种选择性ETA受体拮抗剂,抑制CVS的机制可能是其竞争性拮抗了ET-1对ETA受体的激动作用。一项双盲、随机临床试验研究结果表明克拉生坦可降低严重CVS的发生率,迟发性缺血性神经功能损害及CT可见的新发梗死形成,但是研究显示死亡率并未降低。
(3)提高NO生物利用率:在灵长类的初步实验研究结果表面,注入硝普钠后释放生成的NO可预防CVS。最新一篇报道指出,对已发CVS的病人行脑室内硝普钠注射,可以改善患者预后。目前硝普钠治疗SAH血管痉挛的临床试验正在进行中。
3、已发CVS的治疗:传统的3-H疗法,包括升压、扩容和血液稀释治疗。应用升压及扩容的药物仍然是可以迅速逆转CVS相关神经功能损害的最为有效的方法,有报道称有效率为70%。有人指出,对于颅底脑膜瘤术后出现的CVS,3-H疗法最为有效。
(四)肺动脉高血压及其药物治疗
肺动脉高血压(Pulmonary Arterial Hypertension,PAH)是肺脏血压升高的一种病症。任何使通过肺脏的血流受阻的疾病,都可引起本病。肺动脉高血压的症状包括原发病的症状及肺动脉高压引起的症状。肺动脉高血压本身症状是非特异的,轻度肺动脉高血压可无症状,随病情发展可有以下表现劳力性呼吸困难,乏力,晕厥,心绞痛或胸痛,咯血,声音嘶哑等。肺动脉高血压属于罕见疾病,中国大约有100-200万患者,75%左右的患者年龄在20-40岁,美国大约有25,000名患者。目前没有治疗肺动脉高血压的有效药物。
肺动脉高血压病的药物治疗主要包括抗凝治疗和扩血管治疗。抗凝治疗主要针对肺栓塞所致的肺动脉高血压,及时正确使用抗凝治疗可逆转肺动脉高压。扩血管治疗目的是使患者肺动脉压下降,心排血量增加,缓解症状,增强体力。理想的肺血管扩张药应是选择性的松弛肺血管平滑肌并能解除支气管痉挛,改善通气提高动脉血氧分压(PaO2)。但目前临床应用的扩血管药物均对体循环有较强的作用,因而影响动脉血压,甚至使PaO2下降,故在确定长期应用血管扩张药以前最好行心导管检查,体循环血压无变化或下降不足以引起副作用,才可长期服用。
目前使用的扩血管药物包括:
1、直接扩张肺血管平滑肌的药物,常用的药物有肼屈嗪、硝普钠、硝酸甘油和长效硝酸酯制剂。
(1)肼屈嗪,能直接松弛平滑肌,减低外周阻力,减轻心脏后负荷,心排血量增加。其优点是口服与注射效果几乎相同,长期服用者效果更好,对心脏扩大、二尖瓣关闭不全者用药后射血分数增加,二尖瓣反流减少,运动后引起增高的肺毛细血管楔压降低。慢性肺心病患者服药后不仅心排出量增加,动静脉氧压差减少,平均肺动脉压下降。
(2)硝普钠,是一种强效、短效、速效、低毒的血管扩张药,使动脉和静脉松弛扩张,体循环和肺循环阻力下降,增加心肌灌注及供氧。其缺点是对体循环影响较大,易引起低血压。为避免血压过低,应从小剂量开始,先以15μg/min静脉滴注,无效时每5~10min增加1次,每次增加5~10μg/min,一般剂量为25~250μg/min,最高剂量300μg/min。因对体动脉压下降比肺动脉压下降明显,作用时间短,必须静脉给药,故限制了临床应用。
(3)硝酸甘油,是平滑肌强有力的扩张药,对静脉作用明显,肺血管床扩张,肺动脉压下降。用法为舌下含化,0.3mg/次,根据病情也可静脉滴注,对伴有冠心病或高血压的肺动脉高压效果好。
2、α受体阻滞药,常用药物有酚妥拉明、妥拉唑啉、酚苄明等,可选择性阻滞α受体,使血管扩张,血压下降,肺动脉及外周血管阻力降低。
3、β受体兴奋药,常用药物如异丙肾上腺素、特布他林、多巴酚丁胺等。主要作用是兴奋心肌,增加心输出量,支气管解痉,扩张血管作用较差,故对于支气管哮喘或喘息型支气管炎所致肺动脉高压作用较好。
4、钙拮抗药,常用药物有硝苯地平(硝苯吡啶)、地尔硫卓(硫氮卓酮)、维拉帕米、尼卡地平等,该类药物能阻滞血管平滑肌细胞膜的Ca2+通道而松弛血管平滑肌,从而降低肺血管阻力及肺动脉高压,还可松弛支气管平滑肌,降低气道阻力,改善通气功能,故对缺氧性肺动脉高压效果更佳。
5、血管紧张素转换酶抑制剂,常用药物有卡托普利、依那普利等。通过血管紧张素转换酶的抑制降低其活性,阻断肾上腺素-血管紧张素-醛固酮系统,使血管紧张素Ⅱ与醛固酮生成减少,周围血管扩张,阻力减低,长期服用不产生耐药性。
6、前列腺素,常用药物有前列地尔(前列腺素E1)、E2(PGF2),依前列醇(epoprostenol前列环素)是一种强烈的外周血管扩张剂,从而降低外周血管阻力。这类药物还有抗血小板聚集作用,可使肺总血管阻力和肺小动脉阻力降低,肺动脉压降低。
7、一氧化氮吸入治疗。近年来一氧化氮(NO)与肺动脉高压的关系认识不断深化,为肺动脉高压治疗提供了新的手段。NO即内皮性舒张因子(endothelium-derived relaxing factor,EDRF),主要产生于血管内皮细胞,具有极强的亲脂性,易通过细胞膜。当进入平滑肌细胞膜后激活鸟苷酸活化酶,使cGMP升高,从而肺血管扩张,肺动脉压下降。吸入NO同样可达到肺血管扩张作用。
8、内皮素受体拮抗剂。内皮素-1被认为与包括肺动脉高压在内的多种血管性疾病的发病机制有关。内皮素-1产生之后通过旁分泌的方式作用于G蛋白偶联的受体-内皮素受体A(ETA)和内皮素受体B(ETB),但是这两种受体所起的作用却完全相反。ETA存在肺血管平滑肌细胞上,介导肺血管收缩和血管平滑肌细胞增生。ETB主要存在内皮细胞上,它能通过释放NO、前列环素(PGI2)和其他内皮依赖性血管扩张剂等促进血管的舒张。
多项研究发现肺血管内皮细胞也有NMDA受体表达。另有研究表明肺动脉高压下,肺组织内谷氨酸浓度升高,导致肺血管损伤和血管重构,因此MNDA受体拮抗剂memantine也可能对肺动脉高血压具有治疗作用。
氨基金刚烷及其衍生物有多种生物活性,在医药领域中有着广泛的应用。金刚烷胺(Amantadine)广泛用于治疗流感和帕金森病(Parkinson’s disease,PD)(Schwab et al.,J.Am.Med.Assoc.1969,208:1168)。金刚乙胺(1-氨基乙基金刚烷,Rimantadine)是目前临床上广泛应用的预防和治疗流感药物。美金刚(1,3-二甲基金刚烷胺,Memantine)是目前美国FDA批准的唯一用于治疗中度至重度阿尔兹海默症(Alzheimer’s disease,AD)的NMDA受体拮抗剂。NMDA受体是中枢神经系统内一类重要的兴奋性氨基酸离子型谷氨酸受体的一个亚型,是学习和记忆过程中一类重要的受体。NMDA受体通路被打开后能非选择性的允许一些阳离子,如Ca2+、K+和Na+等进入细胞,这些离子特别是钙离子的进入能引起一系列的生化反应,最终导致神经毒性,引起神经元凋亡。美金刚是NMDA受体开放通道的一种非竞争性拮抗剂,它能与离子通道内的结合位点结合,阻断离子内流,起到神经保护作用。美金刚对NMDA受体的结合是可逆的,并且具有适中的解离速率,既能保证其发挥药理作用,又能确保其不会在通道内累积,影响正常的生理功能(Lipton et al.,Journal of 20neurochemistry.2006,97:1611-1626)。同时美金刚对NMDA受体的拮抗作用有很强的电压依赖性,只有在神经元去极化时才能与受体结合,因而能阻断病理条件下神经元持续去极化时NMDA受体的活化,却不阻断正常生理条件下NMDA受体活化(Wenk et al.,CNS drug reviews.2003,9(3):275-308;McKeage.,Drugs&aging.2010,27(2):177-179)。这种保护机制对其他的中枢神经系统疾病如脑中风、PD、ALS等的治疗也有重要意义,因而,它对这些疾病的治疗也有良好的前景。
一氧化氮(NO)在体内也具有多种生物活性,它起着信号分子的作用。一氧化氮分子能穿透细胞壁进入平滑肌细胞,使其松弛,扩张血管,降低血压。同时也能进入血小板细胞,降低其活性,从而抑制其凝集和向血管内皮的粘附,预防血栓形成,防止动脉粥样硬化。NO是一种自由基气体,带有一个未配对电子,体内极不稳定,非常容易与自由基反应,从而能降低自由基数量。NO与各种自由基都具有较强的反应能力,能有效的降低自由基数量,但其在体内的合成需要一氧化氮合酶(NOS)的参与。正常情况下,NOS的活性都比较低,需要硝基类分子或者皂苷类物质激活。在小分子药物上引入NO释放基团,能够增加体内NO含量,具有显著的疗效,如硝酸甘油。此外,如果小分子药物具有一定的靶向性,将NO带到效应部位,一方面将增加其疗效,另一方面将减少NO在外周扩张血管、降低血压的副作用。
技术实现要素:
本发明的目的在于公开一种氨基金刚烷单硝酸酯类化合物作为药物的新用途,尤其是所述化合物在制备药物用于预防和治疗青光眼、血管性痴呆、蛛网膜下腔出血和肺动脉高血压疾病中的应用。
所述氨基金刚烷单硝酸酯类化合物为具有通式(Ι)结构的化合物及其在药学上可接受的盐:
其中,R为直链或支链烷基,n≥1。
在一些具体的实施方式中,所述烷基可为含有多至10个碳原子,例如为C1-C6烷基;并且n所代表的碳原子数可为0-6。
根据具体的实施方式,通式(Ι)所述的氨基金刚烷单硝酸酯类化合物可以具有下面的结构式:
本发明的氨基金刚烷单硝酸酯类化合物可用于制备药物,用于预防和治疗青光眼、血管性痴呆、蛛网膜下腔出血和肺动脉高血压等疾病。
所述氨基金刚烷单硝酸酯类化合物在制备药物的应用中,可以单独或与其它药物联合使用。
所述氨基金刚烷单硝酸酯类化合物制备药物时可与任何可用的载体混合或溶解,如经皮肤、粘膜、胃肠内和胃肠外给药的药用载体,所述药物能够以常规制剂的形式使用,如片剂、颗粒剂、针剂、粉剂、胶囊剂、悬浮剂。所述药物的制备中所使用的药用载体包括药用赋形剂和添加剂,包括无毒的可相容的填料、粘合剂、崩解剂、缓冲剂、防腐剂、抗氧化剂、润滑剂、矫味剂、增稠剂、着色剂、乳化剂或稳定剂。所述药物可按各种制剂的常规工艺制备。
本发明的效果和益处主要是在动物实验上对氨基金刚烷单硝酸酯类化合物的药效进行大量实验的基础上发现的。
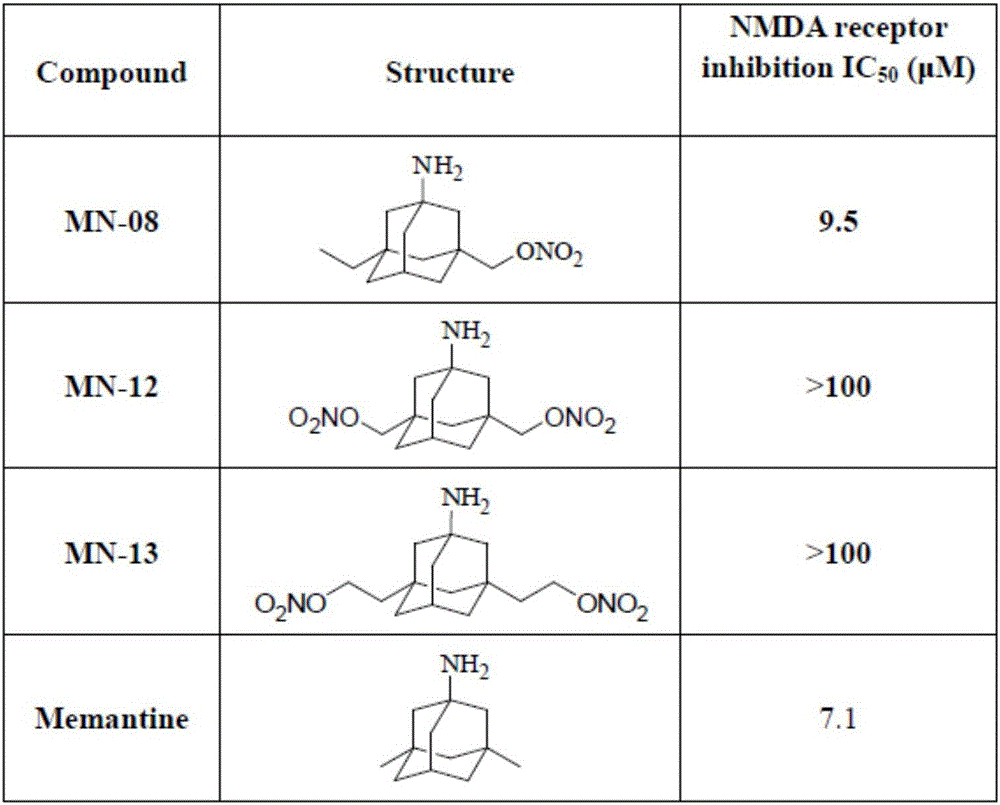
氨基金刚烷单硝酸酯类化合物在预防和治疗青光眼中的应用。体外细胞实验发现氨基金刚烷单硝酸酯类化合物对谷氨酸诱导的神经细胞具有显著的保护作用,进一步的膜片钳实验发现氨基金刚烷硝酸酯类化合物能够不同程度的抑制NMDA通道活性,充分表明氨基金刚烷单硝酸酯类化合物神经细胞保护作用与抑制谷氨酸介导的NMDA受体活性有关。同时有大量研究表明在青光眼患者中谷氨酸浓度显著增加,抑制谷氨酸介导的NMDA受体通道活性的阻断剂美金刚已经在青光眼大鼠和猴子模型中证明可以保护视神经节细胞,甚至在部分患者中可以改善患者的视野缺损,其神经节细胞保护作用得到肯定。氨基金刚烷单硝酸酯类化合物如MN-08在小鼠青光眼模型中发现对大鼠视神经节细胞具有显著的保护作用,药效与等摩尔浓度的阳性对照药美金刚作用相当。值得注意的是,氨基金刚烷单硝酸酯类化合物含有的硝酸酯功能基团可以释放NO。大量研究表明NO可以通过NO/cGMP信号通路,作用于眼睛的睫状体、小梁网状机构以及Schlemm’s管,促进房水留出,降低眼内压。氨基金刚烷硝酸酯类化合物如MN-08能够显著降低兔子急性青光眼模型眼内压,而阳性对照药NMDA受体阻断剂美金刚无降眼压作用。
实验发现,氨基金刚烷单硝酸酯类化合物如MN-08可通过释放NO降低眼内压(图3,9)同时又能通过抑制NMDA受体离子通道活性保护神经细胞损伤(图1,2,图8),可用于预防和治疗青光眼。
实验还发现,氨基金刚烷单硝酸酯类化合物如MN-08释放NO可以显著降低急性青光眼兔子的眼内压(图9),但对体循环无明显影响(图6),克服了硝酸酯类化合物降低外周血压的弊端。
实验还发现,氨基金刚烷单硝酸酯类化合物如MN-08对大鼠神经节细胞的保护作用与等摩尔浓度的美金刚药效相当(图8),但MN-08降眼压作用显著优于美金刚(图9)。
氨基金刚烷单硝酸酯类化合物在预防和治疗血管性痴呆中的应用。体外细胞实验已经发现氨基金刚烷单硝酸酯类化合物对神经细胞具有明显的保护作用,并且能够扩张大鼠大脑中动脉,其细胞保护作用机理与结合NMDA受体阻断谷氨酸介导的细胞毒性有关,后者作用机理与结合NMDA受体局部释放NO舒张血管作用有关。进一步研究发现,氨基金刚烷单硝酸酯类化合物如MN-08能轻微升高正常大鼠脑血流,但是能够显著增加血管痴呆模型大鼠的脑血流量,且对外周血压有一定的升高作用;特别注意的是,在大鼠血管痴呆模型中,氨基金刚烷单硝酸酯类化合物如MN-08可以显著改善模型大鼠学习记忆和运动功能,其药效是临床治疗药物美金刚药效的2倍以上;药代研究发现,MN-08可以通过大鼠血脑屏障,脑组织中药物浓度是外周血液药物浓度的9倍。
实验发现,氨基金刚烷单硝酸酯类化合物如MN-08可以通过血脑屏障,脑组织药物浓度是血药浓度的9倍(图15)。
实验还发现,氨基金刚烷单硝酸酯类化合物如MN-08可以显著的增加血管痴呆大鼠的脑血流量,可用于血管痴呆的预防和治疗(图7,10)。
实验还发现,氨基金刚烷单硝酸酯类化合物如MN-08在血管痴呆大鼠模型中可以显著改善血管痴呆模型大鼠学习记忆、认知功能和运动能力,其药效是美金刚的2倍以上,氨基金刚烷单硝酸酯类化合物如MN-08在血管痴呆模型中较美金刚具有更好的药效优势(图12,13)。
进一步,我们还发现,氨基金刚烷硝酸酯类化合物MN-08既能通过扩张脑血管增加脑血流,同时还能轻微升高外周血压(图4,5,6),与此形成鲜明对比的是,美金刚和尼莫地平均降低外周血压(图6),MN-08的这一特性有利于血管痴呆的治疗。
氨基金刚烷单硝酸酯类化合物在预防和治疗蛛网膜下腔出血中的应用。SAH主要治疗手段是早期的止血和治疗CVS导致的迟发性缺血性脑损伤。尼莫地平是临床上唯一使用的预防CVS的药物,但是由于尼莫地平高剂量会导致外周压降低,限制了临床的广泛使用。本研究发现,氨基金刚烷单硝酸酯类化合物如MN-08可以通过血脑屏障,具有扩血管作用,特别是对SAH诱导的CVS具有很好的扩血管作用,且氨基金刚烷单硝酸酯类化合物如MN-08对外周血压有一定的升高作用。此外,氨基金刚烷单硝酸酯类化合物如MN-08还可以通过结合NMDA受体,抑制谷氨酸诱导的神经细胞损伤,具有双重作用机理。
实验发现,氨基金刚烷单硝酸酯类化合物如MN-08可以改善蛛网膜出血大鼠神经行为学功能缺损,降低脑出血量,扩张痉挛脑血管,药效优于等摩尔浓度的美金刚以及临床常用药尼莫地平,可用于蛛网膜下腔出血的治疗(图12,13,14)。
通过实验,我们发现氨基金刚烷单硝酸酯类化合物如MN-08不仅可以通过靶向结合NMDA受体释放NO扩张痉挛脑血管,同时还能通过抑制NMDA受体减少谷氨酸诱导的神经细胞损伤。与尼莫地平和美金刚降低外周血压作用不同,氨基金刚烷单硝酸酯类化合物如MN-08轻微升高外周血压,具有独特药理作用(图6,14)。
传统硝酸酯类化合物主要扩张外周血管,减少脑血流供应,不利于蛛网膜下腔出血的治疗。氨基金刚烷单硝酸酯类化合物如MN-08可靶向与NMDA受体结合,局部释放NO,可以在不降低外周血压的同时扩张脑血管,与传统硝酸酯类化合物相比具有独特的作用机理。
氨基金刚烷单硝酸酯类化合物在预防和治疗肺动脉高血压中的应用。通过对化合物的组织分布研究,我们发现氨基金刚烷硝酸酯类化合物在肺组织中聚集,高达28-29%。有研究表明肺血管内皮细胞有NMDA受体表达,因此化合物MN-08在肺组织中聚集,可能与结合到肺血管NMDA受体有关,在肺血管内释放NO,扩张肺血管。这些特性不仅使氨基金刚烷硝酸酯可以在肺组织中达到有效治疗浓度,还避免了NO在全身释放,使其对体循环的影响较小,与其它传统的扩血管药物比较安全性更高。动物实验结果证明含有一个硝酸酯的氨基金刚烷硝酸酯类化合物通过结合到肺血管上面的NMDA受体,释放NO,扩张血管平滑肌,从而降低肺动脉高压模型大鼠右心室压力,减少右心室肥厚。含有两个硝酸酯的氨基金刚烷硝酸酯类化合物因其与NMDA受体结合能力较弱,故对肺动脉高压模型大鼠的疗效比的氨基金刚烷单硝酸酯类化合物疗效差。
本研究首次发现氨基金刚烷硝酸酯类化合物如MN-08能够在肺内大量聚集(图15),这对治疗肺动脉高血压有利。
实验发现,氨基金刚烷硝酸酯类化合物如MN-08在肺动脉高血压动物模型中疗效显著,能明显降低右心室收缩压和右心室肥厚,疗效优于临床应用的PDE5抑制剂西地那非(Sildenafil)(图16)。
实验还发现,氨基金刚烷单硝酸酯类化合物如MN-08疗效明显高于氨基金刚烷双硝酸酯类化合物如MN-12,因为MN-08与NMDA受体的亲和力明显强于MN-12(图2)。MN-08既能通过结合NMDA受体而抑制NMDA受体的活性,又能释放NO扩张肺血管。所以,我们发现氨基金刚烷单硝酸酯类化合物如MN-08疗效更好,可以应用于预防和治疗肺动脉高血压。
附图说明
下面结合附图和实施例对本发明进一步说明。
图1、氨基金刚烷单硝酸酯类化合物对小脑颗粒细胞的保护作用。
图2、氨基金刚烷硝酸酯类化合物对NMDA受体的抑制。
图3、大鼠给予MN-08后血浆中NO的时间浓度曲线。
图4、MN-08对大鼠大脑中动脉的舒张作用。MN-08对氯化钾预收缩的大脑中动脉具有显著的扩张作用。
图5、MN-08对脑血管的舒张作用与其结合NMDA受体有关。MN-08单独应用,具有显著的扩血管活性。当用NMDA受体拮抗剂MK-801(MK-801没有扩血管活性)完全阻断NMDA受体后,MN-08不再与NMDA受体结合,扩血管能力显著降低。
图6、MN-08对外周血压和心率的影响。(A-D),MN-08(A)具有轻微升高外周血压的作用,而Memantine(B)和Nimodipine(C)具有降低外周血压的作用,生理盐水(D)对外周血压无影响;(E-G),MN-08(E)具有轻微的降低心率的作用,Memantine(E)和Nimodipine(F)对心率的降低作用更为明显,生理盐水(G)对心率无影响。
图7、MN-08对局部脑血流量的影响。MN-08(A)具有轻微的升高脑血流量的作用;而Nimodipine(B)具有明显升高脑血流量的作用;Memantine(C)对脑血流量的轻微降低的作用;生理盐水(D)对局部脑血流量无影响。
图8、MN-08对大鼠急性青光眼模型视网膜节细胞保护作用。MN-08静脉注射给药,一天两次,连续4天。假手术组:N=4;模型组:N=3;MN-08组(12.5mg/kg):N=5;Memantine(10mg/kg)组:N=3。MN-08能够减少青光眼大鼠视网膜节细胞凋亡,提高节细胞存活率。
图9、MN-08显著降低新西兰兔急性青光眼模型的眼内压。MN-08静脉注射给药。模型组:N=3;MN-08(6.5mg/kg)组:N=4;Memantine(5mg/kg)组:N=3。MN-08显著降低新西兰兔急性青光眼模型的眼内压。
图10、MN-08对血管性痴呆模型大鼠颞叶皮层血流的影响。模型大鼠给予MN-08后,大鼠颞叶皮层血流有不同程度的升高。
图11、MN-08对血管性痴呆模型大鼠在旷场系统中自主运动和新物体识别系统中学习记忆认知能力的影响。(A)模型大鼠给予MN-08(6.25、12.5mg/kg)后,大鼠在旷场中的移动总距离相对于模型组显著升高。(B)模型大鼠给予MN-08(12.5mg/kg)后,大鼠的移动速率显著升高。(C)MN-08对血管性痴呆模型大鼠对新旧物体识别能力的影响。模型大鼠给予MN-08(6.25、12.5mg/kg)后,大鼠对新物体识别指数相对于模型组显著升高。
图12、MN-08显著改善蛛网膜下腔出血模型大鼠的行为学。第一天造模后的3h和6h静脉注射给予不同浓度MN-08,从第二天到第七天,每天两次(上午九点,下午4点)静脉给予MN-08。在造模后3h,第1天、第3天、第5天、第7天对其行为学进行评分。MN-08显著改善蛛网膜下腔出血量模型大鼠行为学。
图13、大脑中动脉穿刺后,血液弥漫蛛网膜下腔,MN-08降低大鼠蛛网膜下腔出血量。
图14、MN-08改善蛛网膜下腔出血模型大鼠脑血管(基底动脉)的痉挛状态。蛛网膜下腔出血大鼠基底动脉内径周长减小,血管壁增厚。MN-08能够有效的改善蛛网膜下腔出血大鼠血管痉挛。
图15、MN-08在大鼠体内的组织分布。MN-08在能够在组织中分布广泛,尤其在肺组织中分布较多。
图16、MN-08显著降低肺动脉高血压模型大鼠的右心室收缩压,减少右心室肥厚。大鼠用野百合碱(MCT)造模后,从第12天到第28天,每天两次静脉注射MN-08,第29天测量右心室收缩压,取材计算右心室肥厚指标。(A)MN-08显著降低肺动脉高血压模型大鼠的右心室收缩压,并能降低肺动脉高血压模型大鼠的死亡率;(B)MN-08显著降低肺动脉高血压模型大鼠的右心室和(RV)左心室与室间隔(LV+S)重量比;(C)MN-08显著降低肺动脉高血压模型大鼠的右心室和体重比。正常对照组:N=8;模型组:N=11;MN-08组:N=9;MN-12组:N=8;Memantine组:N=8;Sildenafil组:N=9。
具体实施方式
下面给出的实施例中对本发明的内容进行了详细的描述。然而应当理解,这些具体的实施例只是用来进行说明,而不是对本发明的范围进行限制。
实施例1、氨基金刚烷硝酸酯类化合物对小脑颗粒细胞的保护作用。
原代分离的新生大鼠小脑颗粒细胞以1.2×105/孔接种在96孔板中,使用含10%FBS+25mM KCl+2mM Glutamine+1%双抗的BME培养基培养。24h后加入终浓度为10μM的阿糖胞苷,抑制神经胶质细胞的增殖。从第4天起,每隔4天加入终浓度为5mM的葡萄糖,用以补充细胞的能量代谢及水分蒸发,放于细胞培养箱(37℃,5%CO2)中培养10天。用200μM谷氨酸诱导原代小脑颗粒细胞兴奋性毒性损伤,分为正常对照组、谷氨酸组、不同氨基金刚烷硝酸酯化合物预处理组、美金刚预处理对照组。按实验分组加入不同浓度化合物MN-04、MN-05、MN-06、MN-07、MN-08、MN-09以及美金刚(memantine)预保护2h后,加入200μM的谷氨酸诱导细胞损伤24h,然后加入MTT继续培养4h,吸走上清后每孔加入150μL DMSO溶解,震荡混匀后使用酶标仪在570nm波长条件下测定吸光值,计算细胞存活率。细胞存活率(%)=不同处理组吸光度/正常对照组吸光度×100%。
实施例2、氨基金刚烷硝酸酯类化合物对NMDA受体的抑制。
用膜片钳技术研究氨基金刚烷硝酸酯类化合物在稳定转染人NR1和NR2A的HEK293细胞对NMDA受体的抑制活性。我们利用全细胞膜片钳技术记录NMDA受体通道电流的变化。HEK293细胞钳制电压设为-70mV,加入各种浓度待测化合物和L-glutamate溶液刺激NMDA通道开放,测定各化合物对L-glutamate诱导电流升高的抑制作用,然后并计算出各化合物对NMDA通道的半数抑制浓度常数IC50。
实施例3、大鼠静脉给予MN-08后血浆中一氧化氮的时间浓度曲线。
采用体重250±20g SD大鼠8只,随机分成两组,每组各4只。尾静脉注射MN-08(25mg/kg)或ISDN(3mg/kg),分别于给药后0h、0.25h,0.5h、1h、2h、4h颈静脉取血法取400μL左右血液(以EDTA-K2抗凝),并以3000r/min离心10min取上清液,于-20℃保存血浆样品待测。根据碧云天的总一氧化氮检测试剂盒说明书测定血浆中的NO含量。
实施例4、MN-08对大鼠大脑中动脉的舒张作用。
取成年大鼠,颈椎脱臼,断头,迅速将脑组织取出,剥离大脑中动脉,剪成2~3mm血管环,血管环标准化,检测其内皮完整性,去除内皮不完整的血管环。60mM KCl对血管环预收缩,待收缩达到平台期后,分别加入不同浓度的MN-08和阳性对照药,监测30min血管张力变化,观察并计算30min内血管舒张曲线及最大舒张百分比。
实施例5、MN-08对脑血管的舒张作用与其结合NMDA受体有关。
取成年大鼠,颈椎脱臼,断头,迅速将脑组织取出,剥离大脑中动脉,剪成2~3mm血管环,血管环标准化,检测其内皮完整性,在内皮完整的血管环上,MK-801(10μM)孵育20min,等体积的ddH2O做空白对照,再用U46619(1μM)对血管环进行与收缩,待收缩达到平台期后,加入MN-08(30μM),监测20min血管张力变化,观察并计算20min内血管舒张曲线。比较使用NMDA受体阻断剂和未使用阻断剂的条件下,MN-08血管舒张作用的影响,从而分析MN-08血管舒张作用与NMDA的关系。
实施例6、MN-08对正常大鼠外周血压、心率和局部脑血流量的影响。
雄性SD大鼠21只,体重范围为280-320g,购买于广东省实验动物中心(SCXK(粤)2013-0002)。给药组(MN-08,Nimodipine,Memantine)每组6只,生理盐水对照组3只。实验方法:大鼠在2.5%异氟烷麻醉下,用PE50管进行股动脉插管,用于外周血压和心率的测量。股动脉插管手术完成后,将PE50管与换能器连接(MLT844,AD Instruments,Australia),在1%异氟烷下维持麻醉,平衡稳定30min开始采集血压和心率数据(PowerLab,AD Instruments,Australia),用激光多普勒血流仪监测脑局部血流量(PF5001,PeriMed,Sweden),基础值采集20min完成后,利用微量连续给药泵通过尾静脉连续注射MN-08(12.5mg/kg),Nimodipine(0.1mg/kg),Memantine(10mg/kg)和Saline(3ml/kg)30min,给药完成后继续监测20min。
实施例7、MN-08对急性青光眼大鼠视网膜节细胞的保护作用。
雄性SD大鼠,体重范围为250-300g,购买于广东省医学实验动物中心(合格证:44007200028940)。实验分为4组,Sham,Model,MN-08和Memantine,每组5只大鼠。采用前房灌注生理盐水诱导大鼠急性青光眼模型,可造成90~100mmHg高眼压,加压持续60min。在术后3h,6h以及术后day2-day4每天两次尾静脉注射化合物及阳性对照药。造模给药4天后,大鼠戊巴比妥钠麻醉实施安乐死。取眼球,4%多聚甲醛固定30min,剥离视网膜进行视神经节细胞染色。视网膜用4%多聚甲醛固定30min,PBS清洗3次,每次10min。加入500μL封闭液,1h后,吸去封闭液,加入300μL以1:200稀释的Brn3抗体稀释液,置于4℃环境下2天。吸出抗体稀释液,PBS清洗3次,每次10min。加入300μL以1:1000稀释的驴抗羊488抗体稀释液,常温避光1h。吸出抗体稀释液,PBS清洗3次,每次10min后,封片,拍照,计算节细胞存活率。
实施例8、MN-08显著降低短暂性青光眼新西兰兔眼压。
雄性新西兰兔,体重范围为1.5~2kg,购买于广东省医学实验动物中心(合格证:44411600002408)。实验分为3组,模型组,MN-08和Memantine,每组4只新西兰兔。采用新西兰兔玻璃体注射高渗生理盐水(5%,0.1ml)诱导新西兰兔短暂性青光眼模型,注射高渗生理盐水前测试新西兰兔的眼压(0min),注射高渗生理盐水后立即测压眼压(1min),剔除眼压低于70mmHg新西兰兔,确定模型成功后,立即给药。然后在10min、30min、60min、90min、120min、150min和180min测试眼压,各个时间点测3次,平均值为该点眼压。
实施例9、MN-08对血管性痴呆模型大鼠颞叶皮层血流量的影响。
雄性SD大鼠,体重250~300g。饲养条件:动物饲养于暨南大学实验动物中心SPF级实验动物中心,按照SPF大鼠饲养要求进行饲养。动物随机分为7组:分别为空白组(11只)、模型组(12只)、MN-08 6.25mg/kg剂量组(8只)、MN-08 12.5mg/kg剂量组(9只)、MN-08 25mg/kg剂量组(5只)、Memantine组(12只)。SD大鼠在双侧颈总动脉结扎造模后,将MN-08(6.25、12.5、25mg/kg)尾静脉给药,每天2次,连续7天,在造模后14、28、42天使用激光多普勒血流仪检测大鼠颞叶皮层血流值。使用小动物气体麻醉系统将大鼠麻醉(麻醉剂异氟烷),沿大鼠头部正中切口,充分暴露右侧顶骨,在大鼠前囟旁开5mm,后2mm点处用颅钻钻直径为1mm小凹槽,使用激光多普勒血流仪测量该点血流值,即为颞叶血流值。测量后将皮层缝合,伤口处擦拭碘酊,将大鼠放回笼中。
实施例10、MN-08对血管性痴呆模型大鼠在旷场实验中运动总距离和运动速率的影响。
各组大鼠在按照以上方法进行造模和给药,造模后14、28、42天采用旷场系统检测大鼠造模后在一定时间内运动总距离和运动速率的影响。在安静环境中进行旷场实验,将动物放入箱内底面中心,同时进行摄像和计时,设定每只大鼠观测时间为5分钟。更换动物时,清洗方箱内壁及底面,以免上次动物余留的信息(如动物的大、小便、气味)影响下次测试结果。根据旷场实验软件记录的大鼠运动轨迹,系统分析得到大鼠的运动总距离和运动速度等。
实施例11、MN-08对血管性痴呆模型大鼠新物体识别的影响。
各组大鼠在按照以上方法进行造模和给药,造模后14、28、42天采用新物体识别系统检测大鼠造模后对新旧物体识别能力的影响。新物体识别实验在长宽高分别50cm的正方体开放场中进行,以距左上角和右上角15cm的两个点作为放置新旧物体的位置,以点为圆心,5cm为半径的两个区域分别命名为区域1(熟悉期放置相同物体,测试期放置新物体)和区域2。实验包括三个阶段:适应期、熟悉期和测试期。在适应期将大鼠依次放入没有任何物体的实验装置中,使其自由探索,适应进行实验的环境,以尽量减少动物进行实验时的应激性。熟悉期时在实验装置底板的放入两个完全相同的物体,将大鼠以背对两个物体的方式放入实验装置中,10min后将动物取出放回动物饲养笼中。间隔1h,进行测试期实验,将两个完全相同的物体中的一个换成另一个不同物体,摄像机捕捉5min内大鼠头部运动路线,记录大鼠进入区域1和区域2范围内的时间和识别新物体的潜伏期作为评价大鼠识别记忆能力的参考指标。实验动物对新奇物体的偏爱可以用“辨别指数”这一指标进行量化,“辨别指数”一般用D表示,是由测试期实验时动物对新奇物体的探索时间和对熟悉物体的探索时间计算得到的,具体的计算公式为:D=(区域1-区域2)/(区域1+区域2)。
实施例12、MN-08对蛛网膜下腔出血模型大鼠行为学影响。
雄性SD大鼠,体重范围为280g-350g,购买于广东省医学实验动物中心(合格证:44007200025302)。实验分为5组,Sham,Model,MN-08(3mg/kg),MN-08(6mg/kg),MN-08(12mg/kg),Memantine(10mg/kg),每组8只大鼠。采用线栓法诱导蛛网膜下腔出血(SAH)模型,在术后3h、6h以及术后day2-day7每天两次尾静脉注射化合物及阳性对照药,术后3h,24h,72h,5d和7d分别进行神经行为学评价。
实施例13、MN-08对蛛网膜下腔出血模型大鼠出血严重性评分的影响。
造模给药7d后,实验终点,大鼠采用戊巴比妥实施麻醉安乐死,完整的取出整个脑组织(包括小脑和脑干),拍照,然后参考文献把脑组织图片分为6部分,每部分按照下述方法进行SAH严重性评分,总分为18分。0分:未见蛛网膜下腔出血;1分:有少量出血;2分:适度出血,但是血管仍可清晰可辨;3分:严重出血,血管无法辨别。其中,0-7分为轻度出血;8-12分为中度出血;13-18分为重度出血。
实施例14、MN-08对SAH大鼠血管痉挛的改善作用。
造模给药7d后,大鼠戊巴比妥钠麻醉实施安乐死,脑组织拍照,4%多聚甲醛固定,脱水,石蜡包埋后进行病理学切片,对基底动脉进行HE染色,分析计算基底动脉周长和厚度。石蜡-HE染色过程如下:1)二甲苯脱蜡透明:每次5min,各2次;2)酒精梯度洗脱:100%酒(5min);100%酒精(2min);95%酒精(2min);95%酒精(2min);3)洗片蒸馏水:去离子水,1min;4)苏木素染色15min,37℃;5)洗片:水洗玻片30s;6)分化:1%盐酸酒精分化3s;7)洗片:流水冲洗10-20min(12min),此步骤为促蓝;8)伊红染色:0.5%伊红染色15min,37℃,着色困难,每100mL染液中加入1-2滴冰醋酸,易着色,不易脱色;9)酒精水化:70%,80%,95%,100%,100%,100%酒精各脱水30s,30s,30s,1min,3min,3min;10)透片:二甲苯透明2次,每次3min;11)封片:中性树脂封片,拍照观察。分析计算基底动脉周长和厚度。
实施例15、MN-08大鼠体内的组织分布。
雄性SD大鼠,体重范围为250-280g,购买于广东省实验动物中心(SCXK(粤)2013-0002)。实验分成6组(5min,15min,30min,60min,90min,120min)每组3只。大鼠禁食12h后,通过尾静脉注射MN-08(27mg/kg),分别于5min,15min,30min,60min,90min和120min麻醉处死并取出心,肝,脾,肺,肾,胃,脑和血液,在血液样品中加入肝素钠抗凝,在4500rpm下离心10min得到血浆样品。各组织样品通过生物样品处理方法后,进行HPLC分析。组织样品用生理盐水清洗血丝,用滤纸吸干水分并称重(AL204,Mettler-Toledo,USA)剪碎,按照重量体积比1:2(g/mL)加入生理盐水,匀浆后取200mL匀浆液于1.5mL离心管中,加入100mL甲醇(含有内标物MN-12),加入200mL乙腈,混匀涡旋2min,于10000rpm离心10min,取上层液过滤膜,取20mL进HPLC分析。谱条件:色谱柱:Agilent ZORBAX EclipseC18柱子(250×4mm,5mm);保护柱:广州颖禾(10×4.6mm,5mm);流动相:甲醇-0.025M磷酸氢二钾水溶液(70:30);流速1mL/min;检测波长216nm;柱温室温。
实施例16、MN-08对肺动脉高血压模型大鼠的疗效。
雄性SD大鼠53只,体重范围为180-230g,购买于广东省实验动物中心(SCXK(粤)2013-0002)。大鼠随机分为6组(正常对照组(8只)、模型组(11只)、MN-08组(9只)、MN-12组(8只)、Memantine组(8只)和Sildenafil组(9只)。大鼠的肺动脉高压模型使用皮下注射野百合碱(50mg/kg,s.c.)造模(第1天),大鼠正常饲养11天,在第12天开始给药治疗,正常对照组(Saling,1ml/animal,iv,bid),模型组(Saling,1ml/animal,iv,bid),MN-08组(12.5mg/kg,iv,bid),MN-12组(15mg/kg,iv,bid),Memantine组(10mg/kg,iv,bid)和Sildenafil组(10mg/kg,iv,bid)。治疗周期为第12-28天,在第29测量右心室压并取出心脏组织。大鼠利用乌拉坦麻醉(1.2g/kg),用充满肝素钠的PE50管连接换能器(MLT844,AD Instrument,Australia),对大鼠进行右心室插管,测量右心室压(PowerLab,AD Instruments,Australia)。将大鼠放血处死后,去除心脏组织,将右心室和(RV)左心室与室间隔(LV+S)分离开,于滤纸上吸干水分后分别称量右心室,左心室+室间隔的重量。
- 还没有人留言评论。精彩留言会获得点赞!