一种缺血性脑卒中靶向的红细胞膜仿生智能药物载体及其制备方法与流程
本发明涉及医药技术领域,具体涉及一种缺血性脑卒中靶向的红细胞膜仿生智能药物载体及其制备方法。
背景技术:
脑卒中是一种高致死、高致残、高复发的神经系统疾病,被列为人类仅次于心血管疾病和恶性肿瘤的第三大杀手。临床上大约87%的脑卒中属于缺血性脑卒中。所以,对缺血性脑卒中的药物治疗研究具有重大的临床意义。研究表明:相较于正常生理条件,机体在脑卒中的病理条件下,可在脑缺血病灶部位高水平持续性的产生高水平活性氧(ROS),以过量的ROS为释药开关从而设计智能递药系统具有很大的应用前景。NR2B9C是一种目前极有临床前景的治疗缺血性脑卒中的多肽,它由针对NMDA受体亚型NR2B羧基端的9个氨基酸残基组成,可特异性的与PSD-95结合,解除NMDAR/PSD-95偶联,阻断引起神经兴奋性毒性的下游信号传导,但不影响NMDA受体的正常生理功能。
由于NR2B9C为亲水性极强的小分子多肽,常见的胶束、纳米粒等核-壳型结构的载体对其包封率和载药量都不理想。聚合物泡囊是由两亲性嵌段聚合物构成的具有封闭双层结构的药物递送载体,内部具有良好的亲水环境,对亲水性药物具有很理想的包封作用。前期工作中,我们将NR2B9C包封于由具有ROS响应特性的两亲性嵌段聚合物(PHB-Dextran)在为载体材料构成的纳米囊泡(NP),由于该纳米囊泡极易响应于ROS介导的降解作用,可使其在脑缺血病灶部位速释药物同时减少在非病灶区释放,从而更加有效的速释药物。然而,作为外来物质,高分子纳米材料进入人体循环系统时,难免诱发机体排异反应。纳米粒表面修饰神经节苷酯,聚乙二醇等虽能一定程度上减缓机体网状内皮系统的清除,仍然难以解决该问题。近年来,来源于自体的红细胞膜(RBC membrane)仿生载体系统备受瞩目。红细胞(RBC)是血液中数量最多且寿命最长的细胞,其红细胞膜具有不可比拟的生物相容性、可降解性,避免网状内皮系统的吞噬作用,而且具有长循环寿命。因此我们采用红细胞膜包裹纳米囊泡的联合体系(RBC-NP),构建红细胞膜仿生的脑卒中智能递药系统。此体系由作为内核的纳米囊泡和外层的红细胞膜构成,这种联合体系能同时发挥两种载体的各自优势。
未经靶向修饰的红细胞膜仿生载体(RBC-NP)虽具有一定的被动靶向特性,但其靶向效率低,特别是在治疗脑卒中时,理想的脑缺血靶向递药系统须将治疗性药物在脑内进一步靶向富集于病灶部位,增加脑内病灶部位的药物浓度,提高疗效,并降低对脑正常生理功能的影响。脑缺血归巢肽SHp(CLEVSRKNC)是近期科学家经噬菌体展示技术筛选出来具有向脑缺血区特异性归巢能力的多肽。研究表明:同位素131-I标记的缺血归巢肽SHp可以选择性分布在缺血一侧脑组织,而非缺血侧或正常脑组织中同位素信号低于检测限。因此以脑缺血归巢肽SHp作为缺血性脑卒中靶向递药系统的靶向功能多肽,具有非常大的应用潜力。
技术实现要素:
本发明的目的是,鉴于高分子纳米材料在人体循环系统中的缺陷以及脑卒中递药系统的靶向性低,提供一种缺血性脑卒中靶向的红细胞膜仿生智能药物载体及其制备方法。
本发明的目的通过以下技术方案实现:缺血性脑卒中靶向的红细胞膜仿生智能药物载体是由作为内核的纳米囊泡、外层的红细胞膜以及细胞膜表面修饰的脑缺血归巢肽SHp构成,作为内核的纳米囊泡和外层的红细胞膜通过超声技术实现包裹融合。该仿生载体由作为内核包封NR2B9C的纳米囊泡、外层的红细胞膜以及细胞膜表面修饰的脑缺血归巢肽SHp构成。该载体是由以疏水性硼酸酯接枝于亲水葡聚糖骨架形成的两亲性嵌段共聚物(PHB-Dextran)为载体材料制备的纳米囊泡,该纳米囊泡用于包载神经保护剂NR2B9C;纳米囊泡具有规整的球形外观,平均粒径在120-220nm。
上述葡聚糖重均分子量为10000~25000,所述硼酸酯为4-羟甲基苯硼酸频哪醇酯(PBAP)、4-羟甲基苯硼酸中的一种或多种。
所述硼酸酯与葡聚糖的接枝率为30±5%。
所述NR2B9C的氨基酸序列为KLSSIESDV。
所述红细胞膜为健康雄性SD大鼠全血,经低渗提取法破膜释放内含物,得到空白红细胞膜,再超声处理得到的均匀的纳米级红细胞膜载体(RBC Vesicles)。
所述SHp肽为SHp、聚乙二醇-磷脂复合物两部分通过共价连接而成的线性嵌段共聚物,其摩尔比为1:1~5:1;
所述的SHp的氨基酸序列为CLEVSRKNC;
所述聚乙二醇-磷脂复合物使用的聚乙二醇为甲氧基聚乙二醇,其重均分子量为400~5000,磷脂复合物为马来酰亚胺-甲氧基聚乙二醇-磷脂酰乙醇胺;
所述磷脂酰乙醇胺为二硬脂酰基磷脂酰乙醇胺、二棕榈酰基磷脂酰乙醇胺、二油酰基磷脂酰乙醇胺、二芥酰基磷脂酰乙醇胺、二肉豆蔻酰基磷脂酰乙醇胺、二月桂酰磷脂酰乙醇胺、1-棕榈酰基-2-油酰基磷脂酰乙醇胺中的一种或多种。
所述纳米囊泡的制备方法包括以下步骤:以疏水性硼酸酯接枝于亲水葡聚糖骨架形成的两亲性嵌段共聚物PHB-Dextran为载体材料制备,将一定量PHB-Dextran溶于甲酰胺与甲醇的混合溶剂作为有机相,将适量NR2B9C溶于0.2M Tris-HCl缓冲液,加入到上述有机相后分散到0.5%泊洛沙姆188水溶液中,继续搅拌1-2h,然后透析除去有机溶剂,最后过0.45μm的微孔滤膜即得纳米囊泡。
所述细胞膜表面修饰脑缺血归巢肽SHp包括以下步骤:将SHp-PEG2000-DSPE与红细胞膜室温孵育1h,然后等渗PBS(pH7.4)离心洗涤除去未修饰上的SHp-PEG2000-DSPE。
所述纳米囊泡和红细胞膜的包裹融合包括以下步骤:先将提取的红细胞膜(RBC Membrane)或者修饰脑缺血归巢肽的红细胞膜(SHp-RBC Membrane)经超声波细胞破碎仪冰浴超声处理,经0.45μm微孔滤膜过滤即得纳米级红细胞膜载体(RBC Vesicles or SHp-RBC Vesicles)。然后纳米囊泡(NP)与红细胞膜载体按照1:1~1:5的比例混合,水浴超声,高速离心除去多余的RBC Vesicles,去离子水重新分散,经0.45μm微孔滤膜过滤即得红细胞膜包裹纳米囊泡的联合体系(RBC-NP or SHp-RBC-NP)。
所述红细胞膜低渗提取法包括以下步骤:取新鲜血液于3000rpm离心,得到红细胞,等渗PBS(pH7.4)洗涤,离心后,弃上清,重复三次;然后加低渗Tric-HCl(pH7.4)缓冲液与红细胞混合,4℃静置1-2h;再离心洗涤,弃上清(重复3~5次)至无肉眼可见的红细胞为止。最后获得白色红细胞膜样品置4℃保存。
所述SHp与马来酰亚胺-聚乙二醇-磷脂复合物的共价连接包括以下步骤:取一定量Mal-PEG2000-DSPE(马来酰亚胺-聚乙二醇(分子量2000)-磷脂复合物),溶于DMF(N,N-二甲基甲酰胺),另取适量SHp(CLEVSRKNC),溶于磷酸盐缓冲液(pH 7.0)中;将两者按顺序逐滴加入到10ml磷酸盐缓冲液(pH 7.0),氮气保护,磁力搅拌过夜,得初产物,继而将通过透析除去过量的SHp;冷冻干燥后,得SHp-PEG2000-DSPE。所述的SHp的氨基酸序列为CLEVSRKNC。所述SHp肽为SHp、马来酰亚胺-聚乙二醇-磷脂复合物两部分通过共价连接而成的线性嵌段共聚物,其摩尔比为1:1~5:1。
有益效果:
本发明构建的缺血性脑卒中靶向的红细胞膜仿生智能药物载体,因外层包裹的红细胞膜,具有良好的生物相容性、可降解性,避免网状内皮系统的吞噬作用,而且具有长循环特性。同时内层的纳米囊泡具有封闭双层结构,对亲水性药物NR2B9C具有很好的包封作用。该载体具有无可比拟的生物相容性、延长在体内的循环时间等特点,又能主动靶向于缺血性脑卒中的病灶部位,同时以ROS为智能释药开关,响应病灶部位ROS介导的降解作用,使药物在脑缺血病灶部位速释,最大程度提高疗效,降低毒副作用。
附图说明:
图1为本发明SHp-PEG2000-DSPE的核磁共振图谱(A为Malemine-PEGPEG2000-DSPE氢谱图,下图B为(SHp-PEG2000-DSPE氢谱图)
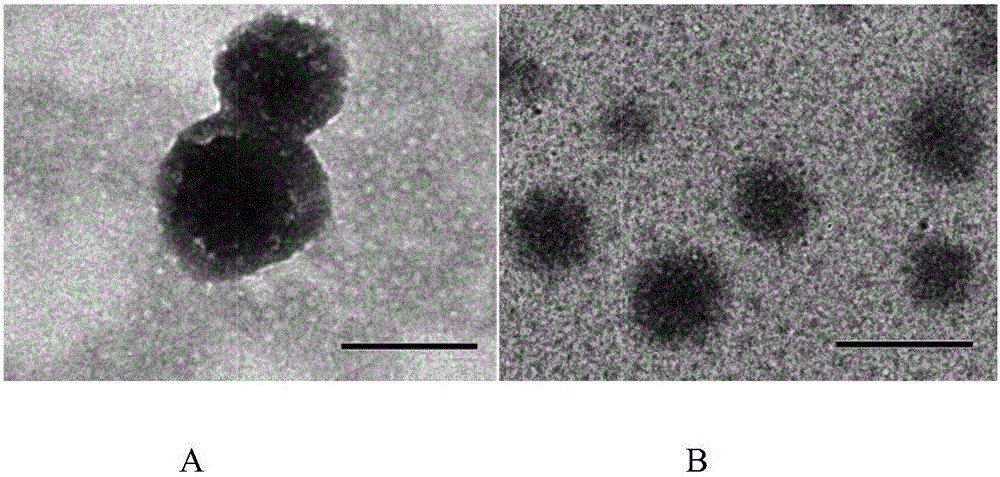
图2为本发明红细胞膜仿生智能药物载体的透射电镜图(左图A为RBC-NP,右图B为NP,scar bar:200nm)
图3为本发明红细胞膜仿生智能药物载体的A粒径及B电位变化图。
图4为本发明红细胞膜仿生智能药物载体的体外释放图。
图5为本发明红细胞膜仿生智能药物载体的大鼠体内药动学图。
图6为本发明红细胞膜仿生智能药物载体的大鼠脑组织分布图。NR2B9C,NP/NR2B9C,RBC-NP/NR2B9C和SHp-RBC-NP/NR2B9C,分别给药后6h(左图)或24h(右图)水合氯醛麻醉,断头处死,冰冻切片,将脑切片平铺于黑色背景纸板,置于活体成像仪下扫描(Ex/Em,550/590nm)NR2B9C,NP/NR2B9C,RBC-NP/NR2B9C和SHp-RBC-NP/NR2B9C在离体脑组织切片中的分布,并拍片记录,见图6。纵向的五个切片图是脑组织不同相应位置的分布。
具体实施方式:
下面结合具体实施例和附图对本发明作进一步的阐述,具体实施例是在本发明的优选条件下进行。所述方法如无特别说明均为常规方法,所述原材料如无特别说明均能从公开商业途径而得。
实施例1
纳米囊泡的制备与表征;
采用自组装法制备,称取10mg PHB-Dextran溶于甲酰胺与甲醇的混合溶剂(V:V=1:1)作为有机相,称取1mg NR2B9C溶于0.2M Tris-HCl缓冲液,与有机相混合后逐滴分散到不断搅拌(500rpm,37℃)的10ml 0.5%泊洛沙姆188水溶液中,继续搅拌1-2h,透析(截留分子量50kDa,透析介质为纯水)24h后,过0.45μm微孔滤膜即得纳米囊泡载体(NP/NR2B9C),用透射电镜表征其形态见图2右。图中显示透射电镜下观察该纳米囊泡载体具有规整的球形外观,大小均匀,粒径在165nm左右。激光粒度仪测定纳米囊泡粒径及zeta电位结果见图3。
实施例2
SHp-PEG2000-DSPE的制备与表征;
取Mal-PEG2000-DSPE(马来酰亚胺-聚乙二醇2000-磷脂复合物)10mg,溶于1ml N,N-二甲基甲酰胺,另取SHp10mg,溶于1ml磷酸盐缓冲液(pH 7.0)中。将两者按顺序逐滴加入到10ml磷酸盐缓冲液(pH 7.0),氮气保护,磁力搅拌过夜,得初产物。继而将产物通过透析(截留分子量3KDa)除去过量的SHp。冷冻干燥后,得SHp-PEG2000-DSPE。核磁共振仪检测其核磁图谱,参见图1,其中A为Mal-PEG2000-DSPE的核磁图谱,B为SHp-PEG2000-DSPE的核磁图谱,由图可看出,A图显示出在6.7ppm处有马来酰亚胺特征峰,而B图中该峰消失,显示Mal-PEG2000-DSPE中的马来酰亚胺基团已经与SHp反应,SHp-PEG2000-DSPE制备成功。
实施例3
红细胞膜的提取及脑缺血归巢肽SHp的修饰;
采用低渗提取法提取,将血液收集在含有抗凝剂的容器中,为避免膜上含有或吸附的蛋白酶使膜蛋白发生变化,以下操作应在4℃低温下进行。取大鼠新鲜血液于冷冻离心机离心5000r/min,10min,弃上清及沉淀在红细胞表层的绒毛状沉淀层。用相当于红细胞压积3倍的预冷PBS(pH7.4)洗涤3次(4℃,5000r/min,15min)。加预冷的0.01mol/L Tric-HCl(pH7.4)与红细胞(V:V=40:1)混合,4℃放置1-2h。再以9000r/min离心15min,弃上清(重复3~5次)至无肉眼可见的红细胞为止。最后获得白色红细胞膜样品,加0.01mol/L PBS(pH7.4)置4℃保存备用。将SHp-PEG2000-DSPE与提取的红细胞膜室温孵育1h,然后用等渗PBS(pH7.4)离心洗涤(4℃,12000r/min,15min)除去未修饰上的SHp-PEG2000-DSPE。
实施例4
缺血性脑卒中靶向的红细胞膜仿生智能药物载体的制备;
先将提取的红细胞膜(RBC Membrane)或者修饰脑缺血归巢肽的红细胞膜(SHp-RBC Membrane)经超声波细胞破碎仪冰浴超声(47.5W,15min),经0.45μm微孔滤膜过滤即得纳米级红细胞膜载体(RBC Vesicles or SHp-RBC Vesicles)。然后纳米囊泡(NP)与红细胞膜载体按照体积比(5:2)比例混合,水浴超声5min(53kHz,100W),高速离心(4℃,12000r/min,30min)除去多余的RBC Vesicles,去离子水重新分散,经0.45μm微孔滤膜过滤即得缺血性脑卒中靶向的红细胞膜仿生智能药物载体(RBC-NP or SHp-RBC-NP)。用透射电镜表征其形态见图2左。图中可观察该仿生载体具有规整的球形外观,大小均匀,粒径在200nm左右。细微观察可见其内核165nm左右,表面覆盖的一层约30nm厚度的脂质层。激光粒度仪测定该仿生载体的粒径及zeta电位结果见图3。
实施例5
红细胞膜仿生智能药物载体的体外释放;
包载罗丹明标记的NR2B9C(Rhodamine-NR2B9C)的红细胞膜仿生智能药物载体制备方式同上。采用超滤离心法考察NP、RBC-NP和SHp-RBC-NP的释药行为,用1mM H2O2来模拟ROS水平升高的脑缺血病灶部位的微环境。释放介质分别为pH7.4的PBS磷酸盐缓冲液和含有1mM H2O2的PBS磷酸盐缓冲液。于37℃恒温水浴,160rpm振荡进行释放实验,平行操作3份。分别于0,0.5,1,2,4,8h时间点定时吸取介质0.5mL,同时补充等量恒温的新鲜释放介质。取出的介质经0.45μm微孔滤膜过滤,置于超滤离心管(MWCO=30000Da)中并以3500rpm 5min超滤离心,下层清夜稀释适当倍数后,荧光分光光度计(EX:460nm,EM:525nm)测定并计算出累积释放百分率。由图4可知,有H2O2存在的条件下,NP、RBC-NP和SHp-RBC-NP释药迅速,4h时的累计释药量已达到50%。而PBS存在下的释放趋势趋于平缓,4h时各组的累计释药量仅为15%左右。从上述结果可知,在H2O2存在条件下的累积释放率显著高于无H2O2存在的PBS组,验证了我们制备的红细胞膜仿生智能药物载体释药行为的ROS响应特性,这将有利于其进入脑组织后,在缺血细胞中ROS刺激下响应,迅速释放出药物,修复已经濒临死亡的神经元。
实施例6
红细胞膜仿生智能药物载体的大鼠体内药动学;
包载罗丹明标记的NR2B9C的红细胞膜仿生智能药物载体制备方式同上。健康雄性SD大鼠9只,随机分为3组,分别尾静脉注射给药剂量为0.4mg/kg的Free NR2B9C,NP/NR2B9C,RBC-NP/NR2B9C,SHp-RBC-NP/NR2B9C,于给药后5,10,15,30min和1,2,4,8,24,48h分别眼眶采血0.5mL,12000rpm离心10min血浆分离后,保存在肝素化离心管中,-20℃冻存。采用蛋白沉淀法进行血浆样品的处理。血浆样品200μL与600μL冰冻甲醇溶液12000rpm离心30min沉淀蛋白。离心后,吸取600μL上清液真空干燥,200μL去离子水复溶,用荧光分光光度计(EX:460nm,EM:525nm)进行含量测量。由图5可知,给药后各处方直接进入血液循环不存在吸收过程,血药浓度持续降低,而RBC-NP/NR2B9C和SHp-RBC-NP/NR2B9C组的血药浓度下降趋势与NR2B9C和NP/NR2B9C组相比,可见明显减缓。由上述结果可知,我们制备的红细胞膜仿生智能药物载体可一定程度上避免网状内皮系统的吞噬作用,延长了药物在体内的滞留时间,具有明显的长循环作用。
实施例7
红细胞膜仿生智能药物载体的大鼠脑组织分布
包载罗丹明标记的NR2B9C的红细胞膜仿生智能药物载体制备方式同上。将MCAO手术后的SD大鼠分别尾静脉注射400μg/kg的NR2B9C,NP/NR2B9C,RBC-NP/NR2B9C和SHp-RBC-NP/NR2B9C,于给药后6h或24h水合氯醛麻醉,心室灌注生理盐水15min,断头处死,冰冻切片,厚度5μm,用PBS漂洗后,将脑切片平铺于黑色背景纸板,置于活体成像仪下扫描(Ex/Em,550/590nm)NR2B9C,NP/NR2B9C,RBC-NP/NR2B9C和SHp-RBC-NP/NR2B9C在离体脑组织切片中的分布,并拍片记录,见图6。从图中脑组织中的荧光分布可以看出,RBC-NP/NR2B9C和SHp-RBC-NP/NR2B9C经MCAO大鼠尾静脉注射后6h或24h,其脑中的荧光强度均强于未经红细胞膜包裹的NR2B9C,和NP/NR2B9C组,此结果再次说明我们制备的红细胞膜仿生智能药物载体具有长循环的寿命。其中SHp-RBC-NP/NR2B9C组与同时间点其它组相比,可见有较高的荧光集中在脑缺血部位。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种基于图像信息的缺血性脑卒中治疗监测系统的制作方法
- miR-106b-5p及其检测引物和其反义核苷酸序列在诊断、治疗缺血性脑卒中领域中的应用
- 一种辅助诊断急性缺血性脑卒中的早期生物标志物及其基因芯片和实时荧光定量pcr评 ...的制作方法
- 瓜蒌桂枝汤在制备治疗缺血性脑卒中后遗症药物中的应用
- 一种治疗髓海不足型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 一种用于治疗缺血性脑卒中的药物组合物的制作方法
- 用于治疗和预防脑卒中或缺血、阿尔茨海默病和帕金森病和肌萎缩性侧索硬化的甾族硝酮的制作方法
- 一种治疗脾肾两虚型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 缺血性脑卒中诊断标记物的制作方法
- 缺血性脑卒中miRNA标记物的制作方法
- 一种基于图像信息的缺血性脑卒中治疗监测系统的制作方法
- miR-106b-5p及其检测引物和其反义核苷酸序列在诊断、治疗缺血性脑卒中领域中的应用
- 一种辅助诊断急性缺血性脑卒中的早期生物标志物及其基因芯片和实时荧光定量pcr评 ...的制作方法
- 瓜蒌桂枝汤在制备治疗缺血性脑卒中后遗症药物中的应用
- 一种治疗髓海不足型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 一种用于治疗缺血性脑卒中的药物组合物的制作方法
- 用于治疗和预防脑卒中或缺血、阿尔茨海默病和帕金森病和肌萎缩性侧索硬化的甾族硝酮的制作方法
- 一种治疗脾肾两虚型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 缺血性脑卒中诊断标记物的制作方法
- 缺血性脑卒中miRNA标记物的制作方法
- 一种基于图像信息的缺血性脑卒中治疗监测系统的制作方法
- miR-106b-5p及其检测引物和其反义核苷酸序列在诊断、治疗缺血性脑卒中领域中的应用
- 一种辅助诊断急性缺血性脑卒中的早期生物标志物及其基因芯片和实时荧光定量pcr评 ...的制作方法
- 瓜蒌桂枝汤在制备治疗缺血性脑卒中后遗症药物中的应用
- 一种治疗髓海不足型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 一种用于治疗缺血性脑卒中的药物组合物的制作方法
- 用于治疗和预防脑卒中或缺血、阿尔茨海默病和帕金森病和肌萎缩性侧索硬化的甾族硝酮的制作方法
- 一种治疗脾肾两虚型缺血性脑卒中后血管性痴呆的中药组合物的制作方法
- 缺血性脑卒中诊断标记物的制作方法
- 缺血性脑卒中miRNA标记物的制作方法
- 一种用于缺血性脑卒中后神经再生的药物组合物及其应用的制作方法与工艺
- 一种与抗血小板药物氯吡格雷治疗缺血性脑卒中相关的SNP标志物及其应用的制作方法与工艺
- Nur77在制备改善缺血性脑卒中预后药物中的应用的制作方法与工艺
- 一种缺血性脑卒中治疗药物的制作方法与工艺
- 反式肉桂醛制备治疗缺血性脑卒中的药物的用途的制作方法与工艺
- LINC01094在诊治缺血性脑卒中的应用的制造方法与工艺
- 一种检测缺血性脑卒中的生物标志物及其应用的制造方法与工艺
- 与缺血性脑卒中组织特异性结合的HGG多肽及其应用的制造方法与工艺
- 一种检测缺血性脑卒中的分子标志物及其用途的制造方法与工艺
- 肉苁蓉多糖制备治疗缺血性脑卒中的药物的用途的制造方法与工艺