含有氨氯地平、氯沙坦和瑞舒伐他汀的药物复合制剂的制作方法
本发明涉及一种含有氨氯地平、氯沙坦和瑞舒伐他汀的口服药物组合物和复合制剂,该药物组合物和复合制剂呈现改善的溶出度、稳定性和生物利用度。
背景技术:
约90至95%的高血压病例被归类为原发性高血压,其原因不明。与高血压有关的危险因素包括心理和环境因素如饮酒、吸烟、衰老、缺乏锻炼、肥胖、饮食中盐分过多、压力等。此外,当父母都患有高血压时,他们的后代就有高血压的可能性,因此,遗传因素也被认为是高血压的一个重要原因。
由于在治疗高血压时需要长期服用药物,不同机制的药物组合在治疗效果上比单独的药物有优势。此外,联合治疗减少单个药物的剂量,从而减少由于长期服用单个药物而可能产生的副作用。在一般情况下,通常用于治疗高血压的药物分为利尿剂、交感神经阻断剂和血管扩张剂;血管扩张剂进一步分类为血管紧张素转换酶(ACE)抑制剂、血管紧张素II受体阻滞剂和钙通道阻滞剂。
同时,高脂血症是由于血液中脂类水平过高引起血管上的斑块的一种失调,伴随炎症,最终成为心血管疾病。在最近几年中,血液中的脂类异常被定义为血脂异常。
在治疗高脂血症时,非药物疗法如饮食、生活方式的变化和保持理想的体重与药物结合使用。他汀类药物抑制胆固醇的合成,降低血浆低密度脂蛋白胆固醇水平和甘油三酯水平。
氨氯地平是3-乙基-5-甲基-2-(2-氨乙氧甲基)-4-(2-氯苯基)-6-甲基-1,4-二氢-3,5-吡啶二羧酸(3-ethyl-5-methyl-2-(2-aminoethoxy-methyl)-4-(2-chlorophenyl)-6-methyl-1,4-dihydro-3,5-pyridine dicarboxylate)的通用名称。氨氯地平阻断钙通道,可用于治疗心绞痛、高血压和充血性心力衰竭等心血管疾病。
氯沙坦是2-丁基-4-氯-1-[{2'-(1H-四唑-5-基)[1,1'-联苯]-4-基}甲基]-1H-咪唑-5-甲醇(2-butyl-4-chloro-1-[{2'-(1H-tetrazol-5-yl)[1,1'-biphenyl]-4-yl}methyl]-1H-imidazole-5-methanol)的通用名称,在美国专利第5608075号、5138069号和5153197号中被披露。通过阻断血管收缩的血管紧张素II及其受体的相互作用,氯沙坦主要用于治疗高血压、心力衰竭、缺血性外周循环障碍、心肌缺血(心绞痛)、糖尿病神经病变和青光眼,并预防急性心肌梗死后心力衰竭的发生。
氨氯地平和氯沙坦的复合制剂在预防和治疗高血压和心血管疾病方面比单个药物更有优势。此外,这种剂型减少单个药物的剂量,从而减少副作用并改善药物依从性。
瑞舒伐他汀是(E)-7-[4-(4-氟苯基)-6-异丙基-2-[甲基(甲磺酰)氨基]嘧啶-5-基]-(3R,5S)-3,5-二羟基庚-6-烯酸((E)-7-[4-(4-fluorophenyl)-6-isopropyl-2-[methyl(methylsulfonyl)amino]pyrimidin-5-yl]-(3R,5S)-3,5-dihydroxyhep-6-enoic acid)的通用名称。瑞舒伐他汀用于治疗高胆固醇血症、高脂血症和动脉粥样硬化。
高血压和高脂血症的共同发生率约为49%,而联合使用Amosartan和他汀类药物约占心血管疾病药物治疗的30%。为了更有效地治疗心血管疾病,对含有氨氯地平、氯沙坦和瑞舒伐他汀等的复合制剂的需求越来越大。然而,由于这种制剂设计的复杂性和活性成分之间的相互作用导致溶解性和稳定性恶化的可能性,很难使其商业化。
本发明人为了解决传统制剂的问题进行了深入的研究,发现具有特定粒径的瑞舒伐他汀具有良好的溶出度曲线和生物利用度,从而完成了本发明。
技术实现要素:
因此,本发明的目的是提供一种含有氨氯地平、氯沙坦和瑞舒伐他汀的口服药物组合物和复合制剂,该药物组合物和复合制剂具有优异的生物利用度、稳定性和含量均匀性。
本发明的另一个目的是提供一种制备含有氨氯地平、氯沙坦和瑞舒伐他汀的复合制剂的方法。
根据本发明的一个方面,提供预防或治疗心血管疾病药物组合物,它包括氨氯地平或其药学上可接受的盐、瑞舒伐他汀或其药学上可接受的盐和氯沙坦或其药学上可接受的盐,其中,所述瑞舒伐他汀或其药学上可接受的盐的粒径(D90)为50μm或更小。
根据本发明的另一方面,还提供了用于预防或治疗心血管疾病的药物复合制剂,它包括第一混合物部分,该部分包括氨氯地平或其药学上可接受的盐、瑞舒伐他汀或其药学上可接受的盐和药学上可接受的添加剂;和第二混合物部分,该部分包括氯沙坦或其药学上可接受的盐及药学上可接受的添加剂,其中所述第一和第二混合物部分物理上相互分离,所述瑞舒伐他汀或其药学上可接受的盐的粒径(D90)为50μm或更小。
根据本发明的另一个方面,提供了一种用于预防或治疗心血管疾病的药物复合制剂的制备方法,该方法包括步骤:a)将氨氯地平或其药学上可接受的盐、瑞舒伐他汀或其药学上可接受的盐和药学上可接受的添加剂进行混合;和b)将氯沙坦或其药学上可接受的盐和药学上可接受的添加剂进行混合,其中所述瑞舒伐他汀或其药学上可接受的盐的粒径(D90)为50μm或更小。
本发明的另一个方面,提供了一种用于预防或治疗心血管疾病的双层片的制备方法,该方法包括步骤:a)将氨氯地平或其药学上可接受的盐、瑞舒伐他汀或其药学上可接受的盐和药学上可接受的添加剂进行混合;b)将氯沙坦或其药学上可接受的盐和药学上可接受的添加剂进行混合形成混合物,然后将混合物制成颗粒;c)将步骤a)制备的混合物部分和步骤b)制备的混合物部分进行压片获得双层片,其中所述瑞舒伐他汀或其药学上可接受的盐的粒径(D90)为50μm或更小。
与现有技术相比,本发明的有益效果如下:
根据本发明的实施例,含有氨氯地平、氯沙坦和瑞舒伐他汀的药物组合物和复合制剂可有效地用于预防或治疗心血管疾病。特别是所述药物组合物和复合制剂具有优异的溶出度、生物利用度、稳定性和含量均匀性。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为实施例1至3、比较实施例1至3的片剂中瑞舒伐他汀的溶出度变化图;
图2为实施例1至3、比较实施例1至3的片剂中氨氯地平的溶出度变化图;
图3为实施例1至3、比较实施例1至3的片剂中氯沙坦的溶出度变化图;
图4为实施例1、实施例4至10的片剂中瑞舒伐他汀的溶出度变化图;
图5为实施例1和比较实施例1的片剂中瑞舒伐他汀的生物利用度变化图。
具体实施方式
根据本发明的一个方面,提供预防或治疗心血管疾病的药物组合物,它包括氨氯地平或其药学上可接受的盐、瑞舒伐他汀或其药学上可接受的盐和氯沙坦或其药学上可接受的盐,其中,所述瑞舒伐他汀或其药学上可接受的盐的粒径(D90)为50μm或更小。
本发明的药物组合物由于瑞舒伐他汀或其药学上可接受的盐具有特定粒径范围而呈现更高的溶出度、生物利用度等。具体来说,瑞舒伐他汀或其药学上可接受的盐约的粒径(D90)为50μm或更小。在本发明的一个实施例中,瑞舒伐他汀或其药学上可接受的盐的粒径(D90)为约25μm或更小,更优选地,为约10μm或更小。在一个实施例中,瑞舒伐他汀或药学上可接受的盐的粒径(D90)可能是50μm、47.2μm,45μm、40μm、35μm、30μm、25μm、22.5μm、20μm、15μm、10μm、8.7μm、5μm、4μm、3μm、2μm、1μm、0.8μm、0.5μm或0.1μm。作为本发明的一个实施例,瑞舒伐他汀或药学上可接受的盐的粒径(D90)可以是约0.8μm到约50μm,或约0.8μm到约25μm,或约0.8μm到约10μm。瑞舒伐他汀或药学上可接受的盐的粒径(D90)为约0.8μm或更大时,更容易制备组合物。在这里,粒子的大小依据颗粒的最长直径,D90意味着基于累计百分比,包含在第90百分位的颗粒平均直径。瑞伐他汀可通过湿法或干法粉碎,例如使用气流粉碎机、流能粉碎机、微粉磨机等,但不限于此。采用上述粉碎方法,可使瑞舒伐他汀的粒径变小。
作为本发明的一个实施例,当组合物按照USP桨法在水里进行溶出试验时,在溶出试验开始后30分钟测定的瑞舒伐他汀的溶出度可以是85%或更高。更优选地,该组合物在水中使用USP桨法进行溶出试验时,在溶出试验开始后15分钟测定的瑞舒伐他汀的溶出度为85%或更高。具体来说,溶出度可根据USP桨法在30~40℃温度下测定,更确切来说,在35~38℃下测定,桨转速为50~100rpm,更确定地说是70~80rpm。根据本发明的一个实施例,溶出度可在37℃的温度、桨转速为75rpm条件下测定。
此外,本发明的组合物包括瑞舒伐他汀、氨氯地平和瑞舒伐他汀作为活性成分,可以作为口服药物制剂用于预防或治疗心血管疾病。
根据本发明的一个方面,提供了用于预防或治疗心血管疾病的药物复合制剂,它包括第一混合物部分,该部分包括氨氯地平或其药学上可接受的盐、瑞舒伐他汀或其药学上可接受的盐和药学上可接受的添加剂;和第二混合物部分,该部分包括氯沙坦或其药学上可接受的盐及药学上可接受的添加剂,其中所述第一和第二混合物部分物理上相互分离,所述瑞舒伐他汀或其药学上可接受的盐的粒径(D90)为50μm或更小。
本发明的复合制剂包括第一和第二混合物部分,它们彼此物理上相互分离,即氨氯地平和瑞舒伐他汀与氯沙坦隔离保存。由此可以防止成分之间的相互作用,从而显示出改善的稳定性。
在本发明的一个实施例中,复合制剂是胶囊或双层片,它包括第一层,该层包括氨氯地平或其药学上可接受的盐、瑞舒伐他汀或其药学上可接受的盐和药学上可接受的添加剂;和第二层,该层包括氯沙坦或其药学上可接受的盐和药学上可接受的添加剂。除了双层片外,在其他本发明的实施例中,所述复合制剂可以用各种形式制备,其中第一混合物部分和第二混合物部分物理上相互分离(例如,核壳结构)。
在一个实施例中,瑞舒伐他汀或其药学上可接受的盐的粒径(D90)可以是50μm、47.2μm、45μm、40μm、35μm、30μm、25μm、22.5μm、20μm、15μm、10μm、8.7μm、5μm、4μm、3μm、2μm、1μm、0.8μm、0.5μm或0.1μm。此外,瑞舒伐他汀或其药学上可接受的盐的粒径(D90)可以是约50μm或更小,约0.8μm到约50μm,约0.8μm到25μm,或约0.8μm到约10μm。
本发明的组合物或复合制剂在第一混合物部分(或第一层)中包括氨氯地平或其药学上可接受的盐。本发明中的氨氯地平的药学上可接受的盐,用含有药学上可接受的阴离子的酸来制备,它可形成无毒的酸加成盐,如氯化氢、溴化氢、硫酸盐、磷酸盐、醋酸盐、苹果酸盐、富马酸盐、乳酸盐、酒石酸盐、柠檬酸盐、葡萄糖酸盐、苯磺酸盐或樟脑磺酸盐。优选地,氨氯地平的药学上可接受的盐,可以是苯磺酸氨氯地平或樟脑磺酸氨氯地平。此外,本发明的氨氯地平包括外消旋混合物和(S)-氨氯地平。氨氯地平或其药学上可接受的盐日服用剂量可以为约5至10mg的氨氯地平。
本发明的组合物或复合制剂在第一混合物部分(或第一层)中包括瑞舒伐他汀或其药学上可接受的盐。瑞舒伐他汀的药学上可接受的盐的例子可以包括聚阳离子的无机盐,优选地是瑞舒伐他汀钙,但不限于此。瑞舒伐他汀或其药学上可接受的盐日服用剂量可以为约5至20mg的瑞舒伐他汀。
本发明的组合物或复合制剂在第二混合物部分(或第二层)中包括氯沙坦或其药学上可接受的盐。氯沙坦的药学上可接受的盐的例子可以包括氯沙坦钾,但不限于此。氯沙坦或其药学上可接受的盐日服用剂量可以为约50至100mg的氯沙坦。
本发明的组合物或复合制剂中,氨氯地平或其药学上可接受的盐、瑞舒伐他汀或其药学上可接受的盐和氯沙坦或其药学上可接受的盐可以按照1:0.3~4:5~20的重量比混合,优选地,可以按照1:1~4:10~20的重量比混合,但不限于此。
在本发明的组合物或复合制剂中,在第一混合物部分或第一层和第二混合物部分或第二层中使用的药学上可接受的添加剂可以是药学上可接受的载体或赋形剂。在药学上可接受的载体或赋形剂的例子包括乳糖(乳糖水合物)、微晶纤维素、甘露醇、柠檬酸钠、磷酸钙、甘氨酸和淀粉、崩解剂(如交联聚维酮、共聚维酮、交联羧甲基纤维素钠、羧甲基淀粉钠、淀粉、预胶化淀粉和复合硅酸盐)和粘结剂(如聚乙烯吡咯烷酮、羟丙基甲基纤维素(HPMC)、羟丙基纤维素(HPC)、蔗糖、明胶和阿拉伯胶)。
在一个实施例中,本发明的组合物或复合制剂在第一混合物部分或第一层中含有乳糖水合物和微晶纤维素作为添加剂。乳糖水合物可占第一混合物部分或第一层的总重量的40~60重量%。微晶纤维素可占第一混合物部分或第一层的总重量的15~35重量%。在另一个实施例中,乳糖水合物和微晶纤维素在第一混合物部分或第一层中可按照1:0.2~1:0.9的所述比例范围内使用。
当在所述范围内使用乳糖水合作为水溶性添加剂时,乳糖水合物可形成促进活性成分溶解的亲水通道,从而使成分快速溶解。尤其是,当含有40重量%或更多的乳糖水合物可以提高溶出度。如果乳糖水合物的量超过所述范围,则完全溶解乳糖水合物所需的时间延长,从而减缓活性成分的溶解。如果在所述范围内使用微结晶纤维素,压片过程变得容易。然而,小于所述范围的量可能导致压片过程中产生一些困难,而过量可能会导致剂型的尺寸过大。因此,在所述范围内使用乳糖水合物和微晶纤维素可显著提高氨氯地平、瑞舒伐他汀和氯沙坦的溶出度。
在一个实施例中,本发明的组合物或复合制剂在第一混合物部分或第一层中可以包含交联聚维酮、交联羧甲基纤维素钠、羧甲基淀粉钠、淀粉、预胶化淀粉或其组合作为崩解剂。在一个实施例中,本发明的组合物或复合制剂在第一混合物部分或第一层中可以包含交联聚维酮、交联羧甲基纤维素钠、羧甲基淀粉钠或其组合作为崩解剂。崩解剂可以占第一混合物部分或第一层的总重量的3~10重量%。如果在所述范围内使用崩解剂,可使溶出度提高,相关物质的产生减少,并且在热应激条件下随着时间经过可保证足够的稳定性。
在本发明的复合制剂中,第一混合物部分可以以湿颗粒或干颗粒部分的形式存在。
在一个实施例中,本发明的复合制剂的第二混合物部分或第二层可以用传统的造粒方法制备如压实造粒后压片。在另一实施例中,第二混合物部分可以用辊压工艺制备成颗粒的形式。根据本发明的试验结果,当制备复合制剂是通过对简单混合的第一混合物部分和压实造粒制备的第二混合物部分进行压片制备双层片时,复合制剂呈现出改善的氨氯地平、瑞舒伐他汀和氯沙坦的溶出度,同时,氨氯地平、瑞舒伐他汀呈现良好的溶出度曲线。
同时,本发明还提供了用于预防或治疗心血管疾病的固定剂量的复合剂型,它包括第一混合物部分,该部分包括氨氯地平或其药学上可接受的盐、瑞舒伐他汀或其药学上可接受的盐和药学上可接受的添加剂;和第二混合物部分,该部分包括氯沙坦或其药学上可接受的盐及药学上可接受的添加剂,其中所述第一和第二混合物部分物理上相互分离,所述瑞舒伐他汀或其药学上可接受的盐的粒径(D90)为50μm或更小。
在固定剂量复合剂型的一个实施例中,氨氯地平或其药学上可接受的盐的量,转化为氨氯地平自由基形式的量为5~10mg。在固定剂量复合剂型的一个实施例中,瑞舒伐他汀或其药学上可接受的盐,转化为瑞舒伐他汀自由酸形式的量为5~20mg。此外,在固定剂量复合剂型的一个实施例中,氯沙坦或其药学上可接受的盐,转化为氯沙坦酸形式的量为50~100mg。
根据本发明的一个实施例,当所述复合制剂根据USP浆法在水中以约75rpm浆速进行溶出试验时,在30分钟后测定的瑞舒伐他汀的溶出度可以是85%或更高。
此外,本发明提供了一种用于预防或治疗心血管疾病的药物复合制剂的制备方法,该方法包括步骤:a)将氨氯地平或其药学上可接受的盐、瑞舒伐他汀或其药学上可接受的盐和药学上可接受的添加剂进行混合;和b)将氯沙坦或其药学上可接受的盐和药学上可接受的添加剂进行混合,其中所述瑞舒伐他汀或其药学上可接受的盐的粒径(D90)为50μm或更小。
所述方法还包括混合含有氨氯地平、瑞舒伐他汀的混合物部分和含有氯沙坦的混合物部分的步骤,其中两个部分物理上相互分离。
在一个实施例中,本发明提供了一种用于预防或治疗心血管疾病的双层片的制备方法,该方法包括步骤:a)将氨氯地平或其药学上可接受的盐、瑞舒伐他汀或其药学上可接受的盐和药学上可接受的添加剂进行混合;b)将氯沙坦或其药学上可接受的盐和药学上可接受的添加剂进行混合形成混合物,然后将混合物制成颗粒;c)将步骤a)制备的混合物部分和步骤b)制备的混合物部分进行压片获得双层片,其中所述瑞舒伐他汀或其药学上可接受的盐的粒径(D90)为50μm或更小。
在本发明中,心血管疾病是选自心绞痛、高血压、动脉痉挛、心律失常、心脏肥大、脑梗塞、充血性心力衰竭和心肌梗死组合的群。
下面将通过以下实施例更具体地描述本发明。然而,这些实施例仅用于说明目的,而本发明并不限于此。
实施例1:含有微粉化瑞舒伐他汀的药物组合物的制备
瑞舒伐他汀钙粉通过气流粉碎机粉碎,制备具有22.5μm粒径(D90)的微粉化的瑞舒伐他汀钙。根据下表1显示的组成成分,将樟脑磺酸氨氯地平、微粉化的瑞舒伐他汀钙、乳糖水合物、微晶纤维素、交联聚维酮进行混合,过30目筛,加入硬脂酸镁,最后用搅拌机混合,获得含有氨氯地平、瑞舒伐他汀的混合物部分。
同时,将氯沙坦钾、微晶纤维素、交联聚维酮进行混合,并过30目筛。然后,把筛粉用辊式压实机(辊式压实机wp200,alexanderwerk)用至少20kN的压紧力以2到10rpm的辊速度压实,使其形成片状颗粒。得到的颗粒用粉碎机(Fitz Mill;BAS 06,菲茨帕特里克,美国)粉碎,过20目筛,加入硬脂酸镁,最后用搅拌机混合,获得含有氯沙坦的颗粒部分。
随后,通过压片机(Kilian Synthesis 700,德国)制备复合双层片,它包括含有氨氯地平、瑞舒伐他汀的混合物部分(第一层;上层)和含有氯沙坦的颗粒部分(第二层;底层)。
表1
实施例2和3和比较实施例1至3:制备含有不同粒径的瑞舒伐他汀的药物组合物
如下表2所示,使用不同粒径的瑞舒伐他汀重复实施例1的步骤,获得复合双层片。
表2
实施例4至10:制备上层中含有不同量的崩解剂的药物组合物
如下表3所示,根据上层的总重量使用不同量的崩解剂来重复实施例1的步骤,获得复合双层片。所述实施例中,瑞舒伐他汀的粒径(D90)采用22.5μm。
表3
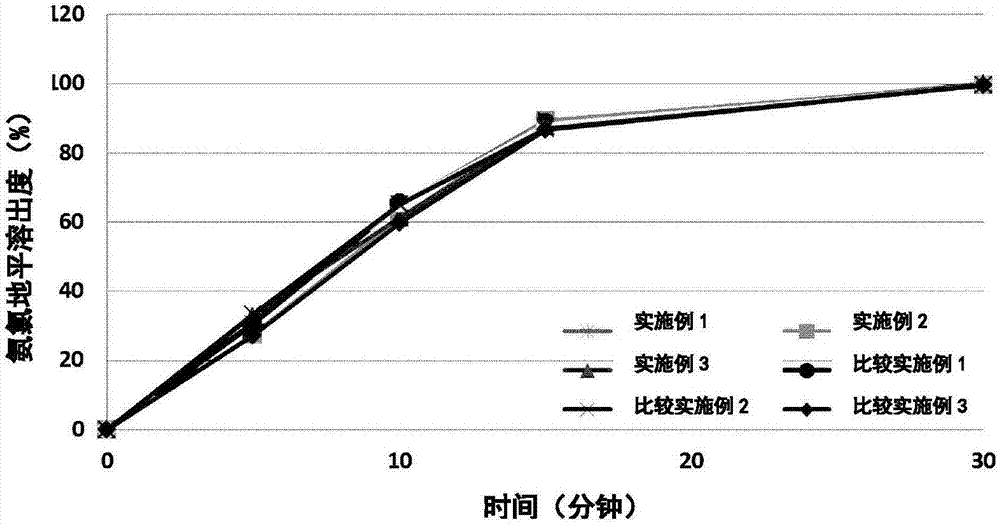
试验例1:根据瑞舒伐他汀的不同粒径(D90),口服复合制剂溶出度的变化
对实施例1至3、比较实施例1至3制备的片剂,分别在以下条件下进行药物溶出试验,以此测定随时间变化瑞舒伐他汀、氨氯地平和氯沙坦的溶出度变化。
-试验条件-
溶解介质:水900mL
仪器:USP浆法,75rpm
温度:37℃
溶解时间:5、10、15和30分钟
-分析条件-
柱:用于液相色谱法的、填满3μm十八烷基硅烷化硅胶的不锈钢柱(内径:约4.6mm,长度:15cm)
流动相:*6mM的己烷磺酸钠/0.05%(v/v)磷酸:乙腈(60:40,v/v)
(*6mM己烷磺酸钠/0.05%(v/v)磷酸:1.24g的己烷磺酸钠水合物添加到1L烧瓶,再仔细添加0.5mL的磷酸。加入纯净水,彻底搅拌均匀。)
检测器:紫外分光光度计(254nm处的吸光度)
流量:1.3mL/分钟
注射体积:10μL
柱温:45℃
-验收标准-
30分钟时,溶出度为85%或更高
溶出试验结果见图1~图3。如图2和图3所示,瑞舒伐他汀的粒径(D90)大小的差异没有影响氨氯地平与氯沙坦的溶出率。两种物质溶出度均符合验收标准。
与此同时,如图1所示,根据瑞舒伐他汀粒径(D90)大小,瑞舒伐他汀的溶出度表现出显著的差异。实施例1~3中制备的含有微粉化瑞舒伐他汀的片剂,初期显示出快速的溶出度,并且符合验收标准。但是,比较实施例1~3制备的含有较大粒径的瑞舒伐他汀的片剂,初期显示出相对低的溶出度,且不符合验收标准。
以上结果表明,溶出度可以通过把瑞舒伐他汀粒径(D90)调整到一定范围来改进。
试验例2:口服复方合制剂含量均匀度试验
为了评价根据不同瑞舒伐他汀的粒径,组合物的含量均匀度的变化,进行了韩国药典的含量均匀度测试。
对实施例1~3、比较实施例1~3中制备的片剂,进行了韩国药典的一般测试中描述的含量均匀度试验。含量根据试验例1中的高效液相色谱法(HPLC)计算接受值来确定。结果如表4。
表4
如上面表4所示,实施例1~3中制备的、含有粒径为(D90)50μm或更小的瑞舒伐他汀的片剂,与比较实施例1~3中制备的、含有粒径大于(D90)50μm的瑞舒伐他汀的片剂相比,前者接受值显著改善。这个结果表明,一定粒径范围的瑞舒伐他汀可用于制备具有改善的混合均匀性和含量均匀性的制剂。
试验例3:根据上层的崩解剂的不同用量,口服复合制剂溶出度的变化
对实施例1和实施例4~10中制备的片剂,用与试验例1相同的条件,对瑞舒伐他汀的溶出度随着时间变化进行了测定。结果如图4。如图4所示,实施例4和5的片剂在初期溶出度相对较低,不符合验收标准。然而,实施例1和实施例6至10的片剂在初期表现出快速溶解,并且符合验收标准。
试验例4:在上层含有不同含量崩解剂的口服复方制剂在热应激贮存条件下的稳定性试验
对实施例1和实施例4至10中制备的片剂,在热应激贮存条件下进行稳定性试验,通过分析瑞舒伐他汀衍生的相关物质的含量变化来评价片剂的稳定性。结果见表5。
-稳定性试验室条件(热应力条件)-
(1)温度和湿度:50℃±2℃
(2)样本:储存在高密度聚乙烯瓶中
(3)测试时间:初始和储存28天后
-分析条件-
柱:用于液相色谱法的、填满5μm十八烷基硅烷化硅胶的不锈钢柱(内径:约4.6mm,长度:25cm)
流动相:*6mM的己烷磺酸钠/0.05%(v/v)磷酸:乙腈(6:4,v/v)
检测器:紫外分光光度计(239nm处的吸光度)
流量:1.0mL/分钟
注射体积:10μL
柱温:45℃
表5
如表5所示,实施例1和实施例6~8的片剂在热应激条件下表现出很高的稳定性,同时产生少量的氨氯地平、瑞舒伐他汀和氯沙坦相关物质。另一方面,实施例9和10的片剂产生的氨氯地平和瑞舒伐他汀相关物质,比实施例1的片剂多5~8倍。
同时,与实施例1和实施例6至8的片剂相比,崩解剂含量较小的实施例4和5的片剂产生的相关物质接近或低于实施例1。该结果表明,以上层总重量为基准,当片剂中的崩解剂用量大于10重量%时,在热应激条件下,随着时间的推移,保证足够的稳定性是很困难的。
试验例5:瑞舒伐他汀的生物利用度评价
用实施例1和比较实施例1制备的组合物,对比格犬进行生物利用度评价。试验通过对六只比格犬进行随机交叉研究来进行。结果如表6和图5所示。图5描述了瑞舒伐他汀血浆浓度(ng/mL)的算术平均值对时间(HR)的线性表。
表6
如表6和图5所示,含有粒径为(D90)22.5μm的瑞舒伐他汀的组合物(实施例1中制备)与含有粒径为(D90)60μm的瑞舒伐他汀的组合物(比较实施例1中制备)相比,其生物利用度更高。该结果与改善的溶解性能有关,如图1所示。因此,该结果表明微粉化的瑞舒伐他汀可以提高其溶出度,并最终提高其生物利用度。
- 还没有人留言评论。精彩留言会获得点赞!