一种干细胞制剂及其制备方法和应用与流程
本发明涉及生物治疗领域,特别涉及一种干细胞制剂及其制备方法和应用。
背景技术:
黄斑区是视网膜的一个重要区域,位于眼后极部,主要与精细视觉及色觉等视功能有关。一旦黄斑区出现病变,常常出现视力下降、眼前黑影或视物变形。黄斑病变通常有两种类型。一种是干性黄斑病变,一种是湿性黄斑病变。湿性黄斑变性占总发病率的10%,是由于视网膜下有异常的血管生长,新生血管破裂出血,并引起疤痕组织生长,使视力突然下降,会迅速严重地影响患者的中心视力,甚至导致中心视力丧失。湿性黄斑病变的主要症状表现为:中央视力快速减弱,视物变形,纸上字句弯曲,视觉中央出现黑影或模糊区域。目前对于黄斑病变的治疗常常采用中医或临床手术等方法,但是该类方法仅能起到延缓病情,而不能起到根治的作用。此外,现有治疗方法复发率高,长期致盲率高。
目前,越来越多的研究者将骨髓间充质干细胞(BMSCs)应用于视网膜病变(ROP)的治疗。BMSCs治疗ROP的机制表现如下:1.细胞迁移聚集到损伤区域,当视网膜血管损伤后,BMSCS会产生大量的生长因子,如血管内皮生长因子、血小板衍生因子和细胞间黏附因子等,在改善血管形成微环境方面起到重要作用;2.细胞移植参与修复:①被移植的干细胞向病变组织迁移、增殖、融合而补充已经受损的神经节细胞,并与宿主的神经细胞形成紧密的的突触联系,重建神经通路,完善相应功能;②通过自分泌及旁分泌的功能,发挥其移植后神经保护及营养作用;③免疫调节作用及下调炎症反应,在一定程度上抑制相关炎性因子对视网膜血管细胞及神经组织的损伤,且减低了临床移植后相关并发症的发生概率。因此,研发一种对黄斑性病变具有良好疗效的干细胞制剂是本领域技术人员亟待解决的技术问题。
技术实现要素:
有鉴于此,本发明公开了一种干细胞制剂及其制备方法和应用,所述干细胞制剂对黄斑性病变有良好的疗效。
本发明公开了一种干细胞制剂,包括:间充质干细胞、神经样细胞和白蛋白。
作为优选,所述神经样细胞由所述骨髓干细胞诱导分化而来。
作为优选,所述间充质干细胞为第二代至第五代的间充质干细胞。
作为优选,所述间充质干细胞的含量为1×106~5×106个/mL。
作为优选,所述神经样细胞的含量为1×106~5×106个/mL。
作为优选,所述白蛋白的含量为2~15%。
本发明还公开了所述干细胞制剂的制备方法,包括以下步骤:
a1)将所述白蛋白和生理盐水混合,配制白蛋白悬液;
a2)采用步骤a1)制备得到的白蛋白制剂重悬所述骨髓间充质干细胞,得到骨髓间充质干细胞制剂;
a3)采用步骤a2)制备得到的骨髓间充质干细胞制剂重悬所述神经样细胞,得到所述干细胞制剂。
作为优选,所述白蛋白制剂的浓度为2~15%。
作为优选,所述间充质干细胞按照以下步骤获得:
(1)将骨髓进行离心分离,得到原代间充质干细胞;
(2)重悬所述原代间充质干细胞,进行培养;
(3)换液除去未贴壁细胞,加入培养基继续对所述原代间充质干细胞进行培养;
(4)对培养的细胞进行消化,得到间充质干细胞。
作为优选,所述神经样细胞由所述间充质干细胞通过诱导分化得到。
作为优选,本发明还公开了所述的干细胞制剂或根据所述的制备方法制得的干细胞制剂在治疗黄斑性病变中的应用。
综上所述,本发明公开了一种干细胞制剂及其制备方法和应用,该干细胞制剂包括骨髓间充质干细胞、神经样细胞和白蛋白。通过将骨髓间充质干细胞联合由骨髓间充质干细胞诱导分化而成的神经样细胞进行视网膜下腔移植,能够避免血液流动而造成外泌体的损失。此外,骨髓间充质干细胞可以分泌多种细胞因子直接参与损伤组织的修复,增强未损伤组织的抵抗能力,缩短组织修复时间。与此同时,神经样细胞可直接参与神经损伤组织的替代修复,缩短了分化的时间,大大减少治愈期限。因此,治疗效果明显,且不出现不可逆的眼盲。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例或现有技术描述中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据提供的附图获得其他的附图。
图1为本发明实施例中原代培养的骨髓间充质干细胞的光学显微镜图;
图2A为本发明实施例中骨髓间充质干细胞的对照管流式检测结果图;
图2B为本发明实施例中骨髓间充质干细胞的样品管流式检测结果图;
图3为本发明实施例中神经样细胞的荧光显微镜图。
具体实施方式
本发明公开了一种干细胞制剂及其制备方法和应用,该干细胞制剂能够避免血液流动而造成外泌体的损失,增强未损伤组织的抵抗能力,缩短修复时间,对黄斑性病变具有良好的疗效。本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文所述的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
下面结合实施例,进一步阐述本发明。
实施例1制备骨髓间充质干细胞及神经样细胞的诱导分化
1、骨髓间充质干细胞的原代培养
取收集好的骨髓,在超净台中采用Ficoll密度梯度离心方法,分离出骨髓间充质干细胞;用DMEM+10%FBS完全培养基重悬后接种至15cm规格的平皿中,转移至5%CO2、37℃的环境中培养。
培养48h后换液,补充新的完全培养基继续培养,获得可传代的原代细胞;
2、骨髓间充质干细胞的传代培养
1)取可传代的P0代细胞,弃掉皿内原培养液,加入10mL PBS缓冲液轻轻冲洗细胞生长面,弃去洗液;
2)加入2mL0.25%胰蛋白酶,左右摇晃平皿使胰酶均匀覆盖于皿底,在显微镜下观察可见细胞间隙增大,胞质回缩,当长梭形细胞变圆变亮时,立即加入10倍体积的完全培养基终止消化;
3)用移液枪反复吹打,直至细胞全部脱落成单细胞悬液,将悬液转移至离心管中,1500rpm室温离心5min;
4)弃上清,加入DMEM+10%FBS完全培养基重悬细胞,细胞密度调至1×105cells,置于37℃、5%二氧化碳和饱和湿度的细胞培养箱中培养;
5)待细胞生长至融合时,重复步骤2),获得本实施例所用的第二代至第五代骨髓间充质干细胞。图1A为第二代骨髓间充质干细胞放大40倍的显微镜图,图1B为第二代骨髓间充质干细胞放大100倍的显微镜图。
3、骨髓间充质干细胞的鉴定
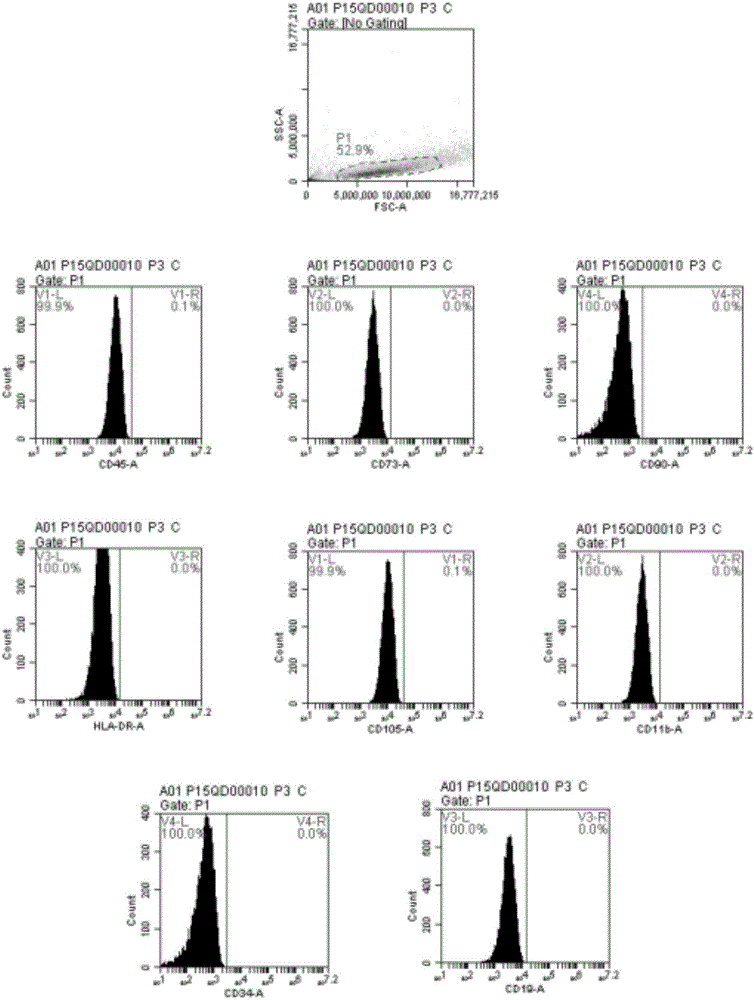
收集传代培养的骨髓间充质干细胞P3代细胞3×106cell,均分至三个EP管中,加入10%FBS+PBS吹打均匀后,1500rpm离心5min,弃上清。清洗2次后,每管细胞加入10%FBS+PBS各200uL,分别标记为对照管(C)、样品管1(S1)、样品管2(S2)。其中C管不添加任何东西,S1管添加CD45、CD73、CD90、HLA-DR;S2管添加CD105、CD11b、CD19、CD34;吹打均匀后,避光4℃孵育20min,孵育完加入10%FBS+PBS吹打均匀后,1500rpm离心5min后,弃上清。清洗2次后,用70um的滤网过滤,上流式仪检测表面抗原。流式结果如图2所示,图2A为对照管(C)的流式检测结果,图2B为样品管1(S1)和样品管2(S2)的流式检测结果。
根据2006年ISCT颁布的《间充质干细胞鉴定的最低标准》,CD73、CD90、CD105三种表面抗原的表达不低于95.0%;CD34、CD45、CD11b、CD19、HLA-DR的表达不高于2.0%。图2A是骨髓间充质干细胞8种抗原相应的同型对照,图2B是8种抗原的表达情况:CD73、CD90、CD105表达高于95.0%;HLA-DR、CD45、CD19、CD34、CD11b表达低于2.0%,符合干细胞的表面抗原特征,说明了骨髓干细胞并没有出现分化的现象,仍维持着干细胞的特点。
4、骨髓间充质干细胞诱导分化形成神经样细胞
观察骨髓间充质干细胞,待细胞密度达70%左右时收集细胞于两个15mL离心管,离心,PBS洗一遍,加入适量的含有碱性成纤维生长因子的预诱导培养液重悬沉淀,将细胞接种于放置了无菌玻片的细胞培养皿内进行细胞爬片,于5%CO2、37℃的环境中培养;
24h后吸去预诱导培养基,以PBS漂洗2次后,添加含有二甲基亚砜和丁羟茴香醚的诱导培养液,转移至5%CO2,37℃的环境中培养;
24h后吸去诱导培养基,以PBS洗两遍后,添加含25ng/mL神经生长因子(NGF)的完全培养基;对照组更换新的间充质干细胞培养基,连续培养12天,并每隔一天向培养基中添加适量神经生长因子(NGF),使其维持25ng/mL的终浓度。
对神经样细胞的鉴定步骤如下:
待神经球直径约80μm撤去完全培养基,改用不含碱性成纤维细胞生长因子的培养基,并加入体积分数为10%的胎牛血清,调整细胞浓度以5×108×L-1接种于含有多聚赖氨酸包被的无菌玻片的24孔板中,每孔接种细胞悬液2mL,然后向每孔中加入200μLβ-TubulinⅢ单克隆抗体,将培养板送回培养箱继续培养4d,中途不进行换液,密切观察单细胞及神经球的形态学变化及分化情况。在诱导分化的第1天进行抗β-TubulinⅢ染色。诱导分化4d后免疫荧光染色进行分化表型的鉴定,并设置对照组,加入TRITC标记的山羊抗兔IgG二抗,中性树胶封固,荧光显微镜下观察并拍照。
对神经样细胞进行抗β-TubulinⅢ染色,发现染色结果呈阳性,如图3所示。对照组均不显色。用NIH ImageJ软件对图像作进一步分析处理,将β-TubulinⅢ荧光染色呈阳性的图片融合、叠加,见β-TubulinⅢ复合多重荧光染色呈阳性。细胞胞体呈梭形或椭圆形,细胞胞体缩小向核靠拢,突起呈双极或多极状,细长的突起交织成网,在空间中形成立体神经环式联系。
β-TubulinⅢ是原始神经上皮中所表达的最早的神经元标志物之一,是神经元的结构蛋白,其作为神经元特有标志物,被广泛应用于神经生物学研究。从图片可知,培养的细胞均表达β-TubulinⅢ蛋白,说明了培养的细胞是神经样细胞。
实施例2干细胞制剂的制备
将白蛋白与生理盐水混合,配制得到浓度为5%的白蛋白悬液;
收集实施例1制备的第二代到第五代任意一代的骨髓间充质干细胞,用生理盐水清洗2遍,用白蛋白悬液重悬收集的骨髓间充质干细胞,将骨髓间充质干细胞的含量调整至3×106cells,获得骨髓间充质干细胞制剂,置于4℃环境中保存备用;
用骨髓间充质干细胞重悬神经样细胞,并将神经样细胞的含量调整至3×106cells,制得干细胞制剂。
实施例3干细胞制剂的制备
将白蛋白与生理盐水混合,配制得到浓度为2%的白蛋白悬液;
收集实施例1制备的第二代至第五代的骨髓间充质干细胞,用生理盐水清洗2遍,用白蛋白悬液重悬收集的骨髓间充质干细胞,将骨髓间充质干细胞的密度调整至1×106cells,获得骨髓间充质干细胞制剂,置于4℃环境中保存备用;
用骨髓间充质干细胞重悬神经样细胞,并将神经样细胞的密度调整至1×106cells,制得干细胞制剂。
实施例4干细胞制剂的制备
将白蛋白与生理盐水混合,配制得到浓度为15%的白蛋白悬液;
收集实施例1制备的第二代至第五代的骨髓间充质干细胞,用生理盐水清洗2遍,用白蛋白悬液重悬收集的骨髓间充质干细胞,将骨髓间充质干细胞的密度调整至5×106cells,获得骨髓间充质干细胞制剂,置于4℃环境中保存备用;
用骨髓间充质干细胞重悬神经样细胞,并将神经样细胞的密度调整至5×106cells,制得干细胞制剂。
实施例5动物试验
1、动物:选取湿性黄斑病变的大鼠模型,体重相近,不分雌雄,共40只。造模方法为将大鼠麻醉后往视网膜下腔注射基质胶。
2、试验分组:将湿性黄斑病变的大鼠均分为4组,每组各10只,分组如表1所示;每组制剂的移植体积均为50uL,2周后进行检测。
3、采用3D Topcon OCT-1000进行检查,检查参数为:扫描深度6.0mm×6.0mm,扫描长度随病变范围而调整,扫描方式为垂直或水平线形扫描。试验结果见表1。
表1试验分组及试验结果
从结果可知,使用实施例2~5制备的干细胞制剂进行回注,可以对湿性黄斑病变的取得较为明显的改善作用,治愈率为75.0%~95.0%。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!