用于治疗丙型肝炎的两种抗病毒剂的组合的制作方法
本申请要求2013年3月14日申请的美国临时申请号61/783,376的权益,所述申请以其整体通过引用并入本文。
技术领域
本发明涉及用于丙型肝炎病毒(HCV)的不含干扰素且不含利巴韦林的治疗。
背景技术:
HCV是属于黄病毒科(Flaviviridae family)中丙型肝炎病毒属(Hepacivirus genus)的RNA病毒。包膜的HCV病毒体含有正链RNA基因组,其在单一不间断的开放阅读框中编码所有已知的病毒特异性蛋白。开放阅读框包含约9500个核苷酸,且编码约3000个氨基酸的单一大多蛋白。所述多蛋白包含核心蛋白,包膜蛋白E1和E2,膜结合蛋白p7,和非结构蛋白NS2、NS3、NS4A、NS4B、NS5A和NS5B。
慢性HCV感染与进行性肝脏病理包括肝硬化和肝细胞癌相关。慢性丙型肝炎可以用聚乙二醇干扰素-α与利巴韦林的组合治疗。功效和耐受性的很大限制仍然存在,因为许多使用者受副作用之苦,且病毒从体内的消除经常是不完全的。因此,需要新疗法来治疗HCV感染。
技术实现要素:
本发明的一个方面的特征在于用于治疗需要此类治疗的主体中的HCV感染的方法。所述方法包括向所述主体施用至少两种直接作用的抗病毒剂(DAA)持续不超过12周的持续时间,或持续本文公开的另一持续时间。所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。优选地,治疗的持续时间为12周。治疗的持续时间也可以是,例如,不超过8周。优选地,两种或更多种DAA以有效在主体中提供持续病毒学反应(SVR)或实现有效性的另一期望量度的量施用。所述主体在治疗方案过程中不施用利巴韦林。所述主体在治疗方案过程中也不施用干扰素。换言之,所述方法排除向所述主体施用干扰素或利巴韦林,从而避免与干扰素和利巴韦林相关的副作用。
本发明的另一个方面的特征在于用于治疗具有HCV感染的主体群体的方法。所述方法包括向所述主体施用至少两种DAA持续不超过12周的持续时间。所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。优选地,所述至少两种DAA以一定量施用于所述主体,所述量在至少约70%群体,优选至少约80%群体,或更优选至少约90%群体中有效导致SVR或有效性的另一量度。
在本文所述的任何方法中,所述至少两种DAA包含(a)化合物1或其药学上可接受的盐,和(b)化合物2或其药学上可接受的盐。所述至少两种DAA还可以任选地包含另一种抗HCV剂。其他任选的抗HCV剂可以选自蛋白酶抑制剂、核苷或核苷酸聚合酶抑制剂、非核苷聚合酶抑制剂、NS3B抑制剂、NS4A抑制剂、NS5A抑制剂、NS5B抑制剂、亲环蛋白抑制剂或其组合。例如,在一些实施方案中,用于本发明的方法中的DAA包含(a)化合物1或其药学上可接受的盐和(b)化合物2或其药学上可接受的盐,或由其组成。对于另一个实例,用于本发明的方法中的DAA包含(a)化合物1或其药学上可接受的盐,(b)化合物2或其药学上可接受的盐,和(c)HCV聚合酶抑制剂,或由其组成,其中所述HCV聚合酶抑制剂可以是核苷酸或核苷聚合酶抑制剂或非核苷或非核苷酸聚合酶抑制剂。
其他任选的抗HCV剂的非限制性实例包括PSI-7977(索非布韦)、PSI-938、BMS-790052 (daclatasvir)、BMS-650032 (asunaprevir)、BMS-791325、GS-5885 (ledipasvir)、GS-9451 (tegobuvir)、GS-9190、GS-9256、BI-201335、BI-27127、特拉匹韦、VX-222、TMC-435 (simepravir)、MK-5172、MK-7009 (vaniprevir)、丹诺普韦、R7128 (mericitabine)及其组合。
在本文所述的任何方法中,所述DAA可以任何有效的给药方案和/或频率施用;例如,它们可以各自每日施用。每种DAA可以单独或组合施用,且每种DAA可以每日一次、每日两次或每日三次施用。优选地,化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)每日施用一次。
优选地,化合物1(或其药学上可接受的盐)以100 mg至600 mg每日施用一次,且化合物2(或其药学上可接受的盐)以50至500 mg每日施用一次。更优选地,化合物1(或其药学上可接受的盐)以200 mg至600 mg每日施用一次,且化合物2(或其药学上可接受的盐)以100至500 mg每日施用一次。高度优选地,化合物1(或其药学上可接受的盐)以400 mg至600 mg每日施用一次,且化合物2(或其药学上可接受的盐)以100至500 mg每日施用一次。例如,化合物1(或其药学上可接受的盐)可以400 mg每日施用一次,且化合物2(或其药学上可接受的盐)以120 mg每日施用一次。再例如,化合物1(或其药学上可接受的盐)可以400 mg每日施用一次,且化合物2(或其药学上可接受的盐)可以240 mg每日施用一次。
在又另一个方面,本发明的特征在于化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)的组合,其用于治疗HCV感染。所述治疗包括向感染HCV的主体施用DAA。治疗方案的持续时间为不超过十二周(例如,持续时间为12周;或持续时间为11、10、9、8、7、6、5、4或3周)。优选地,治疗方案的持续时间为十二周。治疗的持续时间也可以持续,例如,不超过八周(例如,持续时间为8周;或持续时间为7、6、5、4或3周)。所述治疗不包括施用干扰素或利巴韦林。化合物1(或其盐)和化合物2(或其盐)可以同时或相继施用。优选地,化合物1(或其盐)和化合物2(或其盐)可以每日施用一次。作为一个非限制性实例,所治疗的患者感染HCV基因型1,诸如基因型1a或1b。作为另一个非限制性实例,所述患者感染HCV基因型2。作为另一个非限制性实例,所述患者感染HCV基因型3。作为另一个非限制性实例,所述患者感染HCV基因型4。作为另一个非限制性实例,所述患者感染HCV基因型5。作为另一个非限制性实例,所述患者感染HCV基因型6。作为又另一个非限制性实例,所述患者是未经HCV治疗(HCV-treatment naïve)的患者、经历HCV治疗的患者、干扰素无反应者(non-responder)(例如,无效反应者(null responder))、或者不是用于干扰素治疗的候选者。如本申请中所使用,干扰素无反应患者包括部分干扰素反应者和干扰素反弹患者。对于未经治疗的患者、部分反应患者、反应复发(即反弹)患者和无效反应患者的定义,参见GUIDANCE FOR INDUSTRY – CHRONIC HEPATITIS C VIRUS INFECTION: DEVELOPING DIRECT-ACTING ANTIVIRAL AGENTS FOR TREATMENT (FDA,2010年9月,指南草案)。干扰素无反应患者还包括无效反应患者。在本发明的该方面的一个实例中,所述治疗持续12周,且所治疗的主体是感染HCV基因型1的未经治疗的患者(naïve patient)。在另一个实例中,所述治疗持续11周,且所治疗的主体是感染HCV基因型1的未经治疗的患者。在又另一个实例中,所述治疗持续10周,且所治疗的主体是感染HCV基因型1的未经治疗的患者。在又另一个实例中,所述治疗持续9周,且所治疗的主体是感染HCV基因型1的未经治疗的患者。在又另一个实例中,所述治疗持续8周,且所治疗的主体是感染HCV基因型1的未经治疗的患者。在又另一个实例中,所述治疗持续12周,且所治疗的主体是感染HCV基因型3的未经治疗的患者。在另一个实例中,所述治疗持续11周,且所治疗的主体是感染HCV基因型3的未经治疗的患者。在又另一个实例中,所述治疗持续10周,且所治疗的主体是感染HCV基因型3的未经治疗的患者。在又另一个实例中,所述治疗持续9周,且所治疗的主体是感染HCV基因型3的未经治疗的患者。在又另一个实例中,所述治疗持续8周,且所治疗的主体是感染HCV基因型3的未经治疗的患者。在又另一个实例中,所述治疗持续12周,且所治疗的主体是感染HCV基因型1的无反应者(例如,无效反应者)。在另一个实例中,所述治疗持续11周,且所治疗的主体是感染HCV基因型1的无反应者(例如,无效反应者)。在又另一个实例中,所述治疗持续10周,且所治疗的主体是感染HCV基因型1的无反应者(例如,无效反应者)。在又另一个实例中,所述治疗持续9周,且所治疗的主体是感染HCV基因型1的无反应者(例如,无效反应者)。在又另一个实例中,所述治疗持续8周,且所治疗的主体是感染HCV基因型1的无反应者(例如,无效反应者)。在又另一个实例中,所述治疗持续12周,且所治疗的主体是感染HCV基因型3的无反应者(例如,无效反应者)。在另一个实例中,所述治疗持续11周,且所治疗的主体是感染HCV基因型3的无反应者(例如,无效反应者)。在又另一个实例中,所述治疗持续10周,且所治疗的主体是感染HCV基因型3的无反应者(例如,无效反应者)。在又另一个实例中,所述治疗持续9周,且所治疗的主体是感染HCV基因型3的无反应者(例如,无效反应者)。在又另一个实例中,所述治疗持续8周,且所治疗的主体是感染HCV基因型3的无反应者(例如,无效反应者)。
本发明的治疗方案通常构成完整的治疗方案,即预期没有后续的含有干扰素的方案。因此,本文所述的治疗或使用通常不包括任何后续的含有干扰素的治疗。优选地,本文所述的治疗或使用不包括任何后续的含有利巴韦林的治疗。
本发明的其他特征、目标和优点在以下详述中是显而易见的。然而,应当理解,所述详述,尽管表明了本发明的优选实施方案,但只是通过举例说明而非限制性的方式给出。在本发明范围内的各种变化和改变对于本领域技术人员从所述详述来看将变得显而易见。
附图说明
提供附图用于举例说明而非限制。
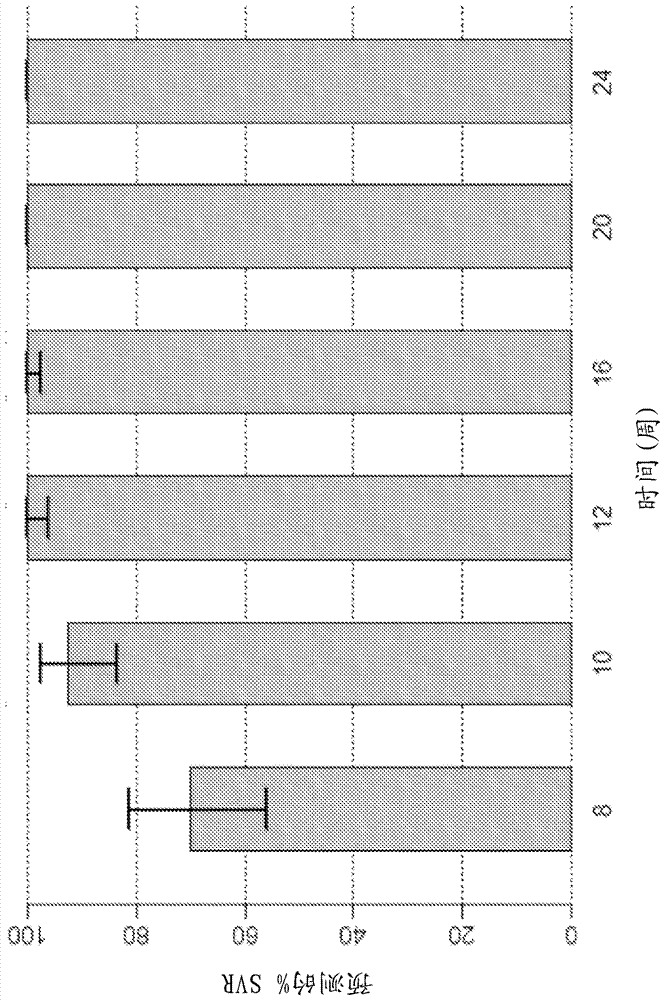
图1显示包括使用化合物1(400 mg,每天一次)和化合物2(120 mg,每天一次)以治疗基因型1未经治疗(naïve)主体的不含干扰素/利巴韦林的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。
图2说明包括使用化合物1(400 mg,每天一次)和化合物2(60 mg,每天一次)以治疗基因型1未经治疗主体的不含干扰素/利巴韦林的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。
图3描述包括使用化合物1(600 mg,每天一次)和化合物2(480 mg,每天一次)以治疗基因型1未经治疗主体的不含干扰素/利巴韦林的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。
图4显示包括使用化合物1(400 mg,每天一次)和化合物2(120 mg,每天一次)以治疗基因型3未经治疗主体的不含干扰素/利巴韦林的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。
图5说明包括使用化合物1(400 mg,每天一次)和化合物2(60 mg,每天一次)以治疗基因型3未经治疗主体的不含干扰素/利巴韦林的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。
图6显示包括使用化合物1(600 mg,每天一次)和化合物2(480 mg,每天一次)以治疗基因型3未经治疗主体的不含干扰素/利巴韦林的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。
图7描述化合物1和化合物2的组合对体外HCV抑制的协同作用。
具体实施方式
本发明的方法包括将化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)施用于有需要的主体。化合物1具有以下结构:
化合物1
化合物1是一种有效的HCV蛋白酶抑制剂,且描述于美国专利申请公开号2012/0070416。
化合物2具有以下结构:
化合物2
化合物2是一种有效的NS5A抑制剂,且描述于美国专利申请公开号2012/0220562。
目前用于治疗HCV的护理标准(SOC)包括干扰素,例如聚乙二醇化干扰素(例如,聚乙二醇化干扰素α-2a或聚乙二醇化干扰素α-2b,诸如Roche的PEGASYS,或Schering-Plough的PEG-INTRON),和抗病毒药物利巴韦林(例如,Roche的COPEGUS,Schering-Plough的REBETOL或者Three Rivers Pharmaceuticals的RIBASPHERE)的疗程。取决于丙型肝炎病毒基因型,治疗经常持续24-48周。其他干扰素包括但不限于,干扰素-α-2a(例如,Roche的Roferon-A),干扰素-α-2b(例如,Schering-Plough的Intron-A),和干扰素alfacon-1(复合干扰素(consensus interferon))(例如,Valeant的Infergen)。
基于干扰素/利巴韦林的治疗可能需要体力,且在一些情况下可以导致临时残疾。相当比例的患者将经历一系列副作用,范围从“流感样”综合征(最常见,在每周注射干扰素后经历几天)到严重的不良事件,包括贫血症、心血管事件和精神问题诸如自杀或自杀意念。后者由患者经历的一般生理应激所恶化。利巴韦林也具有许多副作用,包括贫血、高药量负担(high pill burden)(例如,每天5-6粒,分开BID)和育龄妇女中的致畸性限制使用。
本发明的方法提供HCV感染的有效治疗,而无需使用干扰素或利巴韦林,且持续更短的时间段,例如但不限于,不超过十二周、或者不超过十一周、或者不超过十周、或者不超过九周、或者不超过八周、或者不超过七周、或者不超过六周、或者不超过五周、或者不超过四个周、或者不超过三周的治疗持续时间。
在一个方面,本发明的特征在于用于治疗主体中的HCV感染的方法,其包括在干扰素和利巴韦林不存在的情况下向所述主体施用至少两种DAA,持续不超过十二周或者不超过八周的持续时间。换言之,所述方法排除干扰素和利巴韦林。所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐),其可以共同施用,或者以相同或不同的给药频率分开或独立地施用。优选地,所述至少两种DAA每日施用一次。它们也可以,例如,每日施用两次或每日施用三次。
各种量度可用于表达本发明的方法的有效性。一种此类量度是SVR,其,如本文所使用,意指病毒在治疗结束时和治疗结束后持续至少8周检测不到(SVR8);优选地,病毒在治疗结束时和治疗结束后持续至少12周检测不到(SVR12);更优选地,病毒在治疗结束时和治疗结束后持续至少16周检测不到(SVR16);且高度优选地,病毒在治疗结束时和治疗结束后持续至少24周检测不到(SVR24)。SVR24经常被认为是治愈的功能定义;且治疗后少于24周时的高SVR率(例如,SVR8或SVR12)可以预测高SVR24率。
在一些实施方案中,本发明的治疗方案包括治疗具有HCV感染的主体(例如,未经治疗的主体)群体,且所述方案包括向所述主体施用至少两种DAA持续不超过12周的持续时间,或持续本文公开的另一持续时间,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐),且以一定量施用于所述主体,所述量在至少约70%群体、或者至少约75%群体、或者至少约80%群体、或者至少约85%群体、或者至少约90%群体、或者至少约95%群体、或者约100%群体中有效提供SVR(例如,SVR12或SVR24)。在一些实施方案中,本发明的治疗方案包括治疗具有HCV感染的经历IFN的主体(例如,干扰素无反应者)群体,且所述方法包括向所述主体施用至少两种DAA持续不超过12周的持续时间,或持续本文公开的另一持续时间,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐),且以一定量施用于所述主体,所述量在至少约50%群体、或者至少约55%群体、或者至少约60%群体、或者至少约65%群体、或者至少约70%群体、或者至少约75%群体、或者至少约80%群体、或者至少约85%群体、或者至少约90%群体、或者至少约95%群体、或者约100%群体中有效提供SVR(例如,SVR12或SVR24)。
意料之外的是,使用化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)的组合且持续不超过12周的持续时间的不含干扰素且不含利巴韦林的治疗可以实现显著SVR。
因此,在一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续8周,且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。
在另一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续7周,且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。
在又另一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续6周,且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。
在又另一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续5周,且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。
在又另一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续4周,且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。
在又另一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续3周,且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。
在又另一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续24周,且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。
在又另一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续13至23周(例如,治疗的持续时间选自13、14、15、16、17、18、19、20、21、22或23周),且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。
在又另一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续12周,且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。如本申请中所使用,HCV聚合酶抑制剂可以是核苷聚合酶抑制剂、核苷酸聚合酶抑制剂、非核苷聚合酶抑制剂或非核苷酸聚合酶抑制剂。
在又另一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续11周,且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。
在又另一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续10周,且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。
在又另一个方面,本发明的特征在于治疗HCV感染的方法,其包括向有需要的患者施用有效量的至少两种DAA的组合,其中所述至少两种DAA包含化合物1(或其药学上可接受的盐)和化合物2(或其药学上可接受的盐)。所述治疗持续9周,且不包括施用任何干扰素或利巴韦林。所述DAA可以相同或不同的给药频率来施用。所治疗的患者可以是未经治疗的患者;经历治疗的患者,包括,但不限于,复发者、干扰素部分反应者、干扰素无反应者或无效反应者;或不能使用干扰素的患者。所述患者可以感染,例如但不限于,HCV基因型1,诸如HCV基因型1a或HCV基因型1b;或HCV基因型2或3;或HCV基因型4、5或6。根据该技术方面的治疗还可以针对其他HCV基因型是有效的。所述DAA可以约相同时间或不同时间施用。除了化合物1(或其盐)和化合物2(或其盐)以外,所述至少两种DAA还可以包括一种或多种选自,例如,HCV蛋白酶抑制剂、HCV聚合酶抑制剂或HCV NS5A抑制剂的额外DAA。此类额外DAA的非限制性实例包括PSI-7977、PSI-938、TMC-435、BMS-790052、BMS-650032、GS-5885、GS-9190、GS-9451、BI-201335、BI-207127、特拉匹韦、VX-222、mericitabine和丹诺普韦。
在本文所述的每个方面、实施方案、实施例或方法中,化合物1(或其药学上可接受的盐)可以,例如但不限于,以100 mg至600 mg每日施用一次,且化合物2(或其药学上可接受的盐)可以,例如但不限于,以50至500 mg每日施用一次。更优选地,化合物1(或其药学上可接受的盐)以200 mg至600 mg每日施用一次,且化合物2(或其药学上可接受的盐)以100至500 mg每日施用一次。高度优选地,化合物1(或其药学上可接受的盐)以400 mg至600 mg每日施用一次,且化合物2(或其药学上可接受的盐)以100至500 mg每日施用一次。优选地,化合物1(或其药学上可接受的盐)可以400 mg每日施用一次,且化合物2(或其药学上可接受的盐)以120 mg每日施用一次。还优选地,化合物1(或其药学上可接受的盐)可以400 mg每日施用一次,且化合物2(或其药学上可接受的盐)可以240 mg每日施用一次。
本发明的方法可用于治疗未经治疗的患者或经历治疗的患者。经历治疗的患者包括干扰素无反应者(例如,无效反应者)、部分反应者和复发者。本发明的方法也可用于治疗不是干扰素治疗的候选者的患者。不是干扰素治疗的候选者的患者包括,但不限于以下组中的一者或多者:不耐受干扰素的患者、拒绝接受干扰素治疗的患者、具有使之排除接受干扰素的医疗状况的患者和通过接受干扰素具有副作用或感染的增加风险的患者。
在本文所述的任何方法中,除了化合物1(或其盐)和化合物2(或其盐)以外,治疗方案中可以任选使用一种或多种额外DAA。这些额外DAA可以是HCV蛋白酶抑制剂、HCV核苷或核苷酸聚合酶抑制剂、HCV非核苷聚合酶抑制剂、HCV NS3B抑制剂、HCV NS4A抑制剂、HCV NS5A抑制剂、HCV NS5B抑制剂、HCV进入抑制剂、亲环蛋白抑制剂或其组合。
用于该目的的优选的HCV蛋白酶抑制剂包括,但不限于,特拉匹韦(telaprevir)(Vertex)、博赛泼维(boceprevir)(Merck)、BI-201335 (Boehringer Ingelheim)、GS-9451 (Gilead)和BMS-650032 (BMS)。其他合适的蛋白酶抑制剂包括,但不限于,ACH-1095 (Achillion)、ACH-1625 (Achillion)、ACH-2684 (Achillion)、AVL-181 (Avila)、AVL-192 (Avila)、BMS-650032 (BMS)、丹诺普韦(RG7227/ITMN-191,Roche)、GS-9132 (Gilead)、GS-9256 (Gilead)、IDX-136 (Idenix)、IDX-316 (Idenix)、IDX-320 (Idenix)、MK-5172 (Merck)、narlaprevir (Schering-Plough Corp)、PHX-1766 (Phenomix)、TMC-435 (Tibotec)、vaniprevir (MK-7009, Merck)、VBY708 (Virobay)、VX-500 (Vertex)、VX-813 (Vertex)、VX-985 (Vertex)、或其组合。
优选的用于本发明中使用的非核苷HCV聚合酶抑制剂包括,但不限于,GS-9190 (Gilead)、BI-207127 (Boehringer Ingelheim)、和VX-222 (VCH-222) (Vertex & ViraChem)。优选的核苷酸HCV聚合酶抑制剂包括,但不限于,PSI-7977 (Gilead)和PSI-938 (Gilead)。合适的HCV聚合酶抑制剂的其他合适且非限制性的实例包括ANA-598 (Anadys)、BI-207127 (Boehringer Ingelheim)、BILB-1941 (Boehringer Ingelheim)、BMS-791325 (BMS)、非利布韦(filibuvir)、GL59728 (Glaxo)、GL60667 (Glaxo)、GS-9669 (Gilead)、IDX-375 (Idenix)、MK-3281 (Merck)、tegobuvir、TMC-647055 (Tibotec)、VCH-759 (Vertex & ViraChem)、VCH-916 (ViraChem)、VX-759 (Vertex)、GS-6620 (Gilead)、IDX-102 (Idenix)、IDX-184 (Idenix)、INX-189 (Inhibitex)、MK-0608 (Merck)、RG7128 (Roche)、TMC64912 (Medivir)、GSK625433 (GlaxoSmithKline)、BCX-4678 (BioCryst)、ALS-2200 (Alios BioPharma/Vertex)、ALS-2158 (Alios BioPharma/Vertex)或其组合。聚合酶抑制剂可以是核苷或核苷酸聚合酶抑制剂,诸如GS-6620 (Gilead)、IDX-102 (Idenix)、IDX-184 (Idenix)、INX-189 (Inhibitex)、MK-0608 (Merck)、PSI-7977 (Gilead)、PSI-938 (Gilead)、RG7128 (Roche)、TMC64912 (Medivir)、ALS-2200 (Alios BioPharma/Vertex)、ALS-2158 (Alios BioPharma/Vertex)或其组合。聚合酶抑制剂也可以是非核苷聚合酶抑制剂,诸如PF-00868554 (Pfizer)、ANA-598 (Anadys)、BI-207127 (Boehringer Ingelheim)、BILB-1941 (Boehringer Ingelheim)、BMS-791325 (BMS)、非利布韦(filibuvir)、GL59728 (Glaxo)、GL60667 (Glaxo)、GS-9669 (Gilead)、IDX-375 (Idenix)、MK-3281 (Merck)、tegobuvir (Gilead)、TMC-647055 (Tibotec)、VCH-759 (Vertex & ViraChem)、VCH-916 (ViraChem)、VX-222 (VCH-222) (Vertex & ViraChem)、VX-759 (Vertex)或其组合。
优选的NS5A抑制剂包括,但不限于,BMS-790052 (BMS) 和GS-5885 (Gilead)。合适的NS5A抑制剂的非限制性实例包括GSK62336805 (GlaxoSmithKline)、ACH-2928 (Achillion)、AZD2836 (Astra-Zeneca)、AZD7295 (Astra-Zeneca)、BMS-790052 (BMS)、BMS-824393 (BMS)、GS-5885 (Gilead)、PPI-1301 (Presidio)、PPI-461 (Presidio) A-831 (Arrow Therapeutics)、A-689 (Arrow Therapeutics)或其组合。
合适的亲环蛋白抑制剂的非限制性实例包括alisporovir (Novartis & Debiopharm)、NM-811 (Novartis)、SCY-635 (Scynexis)或其组合。
合适的HCV进入抑制剂的非限制性实例包括ITX-4520 (iTherx)、ITX-5061 (iTherx)或其组合。
适于包括于本发明的方法中的其他DAA剂的具体实例,包括,但不限于,AP-H005、A-831 (Arrow Therapeutics) (NS5A抑制剂)、A-689 (Arrow Therapeutics) (NS5A抑制剂)、INX08189 (Inhibitex) (聚合酶抑制剂)、ITMN-191 (Intermune/Roche) (NS3/4A 蛋白酶抑制剂)、VBY-376 (蛋白酶抑制剂) (Virobay)、ACH-1625 (Achillion, 蛋白酶抑制剂)、IDX136 (Idenix, 蛋白酶抑制剂)、IDX316 (Idenix, 蛋白酶抑制剂)、VX-813 (Vertex)、SCH 900518 (Schering-Plough)、TMC-435 (Tibotec)、ITMN-191 (Intermune, Roche)、MK-7009 (Merck)、IDX-PI (Novartis)、R7128 (Roche)、PF-868554 (Pfizer) (非核苷聚合酶抑制剂)、PF-4878691 (Pfizer)、IDX-184 (Idenix)、IDX-375 (Idenix, NS5B 聚合酶抑制剂)、PPI-461 (Presidio)、BILB-1941 (Boehringer Ingelheim)、GS-9190 (Gilead)、BMS-790052 (BMS)、CTS-1027 (Conatus)、GS-9620 (Gilead)、PF-4878691 (Pfizer)、RO5303253 (Roche)、ALS-2200 (Alios BioPharma/Vertex)、ALS-2158 (Alios BioPharma/Vertex)、GSK62336805 (GlaxoSmithKline)或其任何组合。
下面提供了这些任选HCV抑制剂中一些的化学结构:
特拉匹韦
BI-201335
TMC-435 (TMC-435350)
Vaniprevir, MK-7009
BMS-650032 (Asunaprevir)
丹诺普韦
MK-5172
ANA-598 (Setrobuvir)
GS-333126 (GS-9190或tegobuvir)
GS-9451
Mericitabine (R-4048或RG7128)
IDX-184
非利布韦 (PF-00868554)
PSI-7977
BMS-790052 (daclatasvir)
Daclatasvir 二盐酸盐
BIT-225
PSI-352938
INX-189
GS-9256
GS-5885
本文所述的任何HCV抑制剂或DAA当其用于治疗性处理或药物制剂中时涵盖其合适的盐形式。
在一些实施方案中,本发明的特征在于用于治疗感染HCV基因型1(诸如1a或1b)的患者的方法。所述方法包括向此类患者施用至少2种DAA的组合持续不超过12周(例如,持续时间为12周),诸如不超过8周(例如,持续时间为8周),其中所述治疗不包括施用干扰素或利巴韦林,且所述至少2种DAA包含化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)。化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)可以治疗有效量施用,以便在完成治疗后提供SVR (例如,SVR12或SVR24)。所述患者可以是未经治疗的患者或经历治疗的患者。治疗持续时间可以为不超过12周,包括但不限于,不超过11周,不超过10周,不超过9周,但优选不超过8周,不超过7周,不超过6周,不超过5周,不超过4周,或不超过3周,例如,持续时间为12周,或持续时间为8周。
在一些实施方案中,本发明的特征在于用于治疗具有HCV基因型2或3感染的患者的方法。所述方法包括向此类患者施用至少2种DAA的组合持续不超过12周(例如,持续时间为12周),诸如不超过8周(例如,持续时间为8周),其中所述治疗不包括施用干扰素或利巴韦林,且所述至少2种DAA包含化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)。化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)可以治疗有效量施用,以便在完成治疗后提供SVR (例如,SVR12或SVR24)。所述患者可以是未经治疗的患者或经历治疗的患者。治疗持续时间可以为不超过12周,包括但不限于,不超过11周,不超过10周,不超过9周,但优选不超过8周,不超过7周,不超过6周,不超过5周,不超过4周,或不超过3周,例如,持续时间为12周,或持续时间为8周。
在一些实施方案中,本发明的特征在于用于治疗具有HCV基因型2感染的患者的方法。所述方法包括向此类患者施用至少2种DAA的组合持续不超过12周(例如,持续时间为12周),诸如不超过8周(例如,持续时间为8周),其中所述治疗不包括施用干扰素或利巴韦林,且所述至少2种DAA包含化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)。化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)可以治疗有效量施用,以便在完成治疗后提供SVR (例如,SVR12或SVR24)。所述患者可以是未经治疗的患者或经历治疗的患者。治疗持续时间可以为不超过12周,包括但不限于,不超过11周,不超过10周,不超过9周,但优选不超过8周,不超过7周,不超过6周,不超过5周,不超过4周,或不超过3周,例如,持续时间为12周,或持续时间为8周。
在一些实施方案中,本发明的特征在于用于治疗具有HCV基因型3感染的患者的方法。所述方法包括向此类患者施用至少2种DAA的组合持续不超过12周(例如,持续时间为12周),诸如不超过8周(例如,持续时间为8周),其中所述治疗不包括施用干扰素或利巴韦林,且所述至少2种DAA包含化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)。化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)可以治疗有效量施用,以便在完成治疗后提供SVR (例如,SVR12或SVR24)。所述患者可以是未经治疗的患者或经历治疗的患者。治疗持续时间可以为不超过12周,包括但不限于,不超过11周,不超过10周,不超过9周,但优选不超过8周,不超过7周,不超过6周,不超过5周,不超过4周,或不超过3周,例如,持续时间为12周,或持续时间为8周。
在一些实施方案中,本发明的特征在于用于治疗具有HCV基因型4感染的患者的方法。所述方法包括向此类患者施用至少2种DAA的组合持续不超过12周(例如,持续时间为12周),诸如不超过8周(例如,持续时间为8周),其中所述治疗不包括施用干扰素或利巴韦林,且所述至少2种DAA包含化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)。化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)可以治疗有效量施用,以便在完成治疗后提供SVR (例如,SVR12或SVR24)。所述患者可以是未经治疗的患者或经历治疗的患者。治疗持续时间可以为不超过12周,包括但不限于,不超过11周,不超过10周,不超过9周,但优选不超过8周,不超过7周,不超过6周,不超过5周,不超过4周,或不超过3周,例如,持续时间为12周,或持续时间为8周。
在一些实施方案中,本发明的特征在于用于治疗具有HCV基因型5感染的患者的方法。所述方法包括向此类患者施用至少2种DAA的组合持续不超过12周(例如,持续时间为12周),诸如不超过8周(例如,持续时间为8周),其中所述治疗不包括施用干扰素或利巴韦林,且所述至少2种DAA包含化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)。化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)可以治疗有效量施用,以便在完成治疗后提供SVR (例如,SVR12或SVR24)。所述患者可以是未经治疗的患者或经历治疗的患者。治疗持续时间可以为不超过12周,包括但不限于,不超过11周,不超过10周,不超过9周,但优选不超过8周,不超过7周,不超过6周,不超过5周,不超过4周,或不超过3周,例如,持续时间为12周,或持续时间为8周。
在一些实施方案中,本发明的特征在于用于治疗具有HCV基因型6感染的患者的方法。所述方法包括向此类患者施用至少2种DAA的组合持续不超过12周(例如,持续时间为12周),诸如不超过8周(例如,持续时间为8周),其中所述治疗不包括施用干扰素或利巴韦林,且所述至少2种DAA包含化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)。化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)可以治疗有效量施用,以便在完成治疗后提供SVR (例如,SVR12或SVR24)。所述患者可以是未经治疗的患者或经历治疗的患者。治疗持续时间可以为不超过12周,包括但不限于,不超过11周,不超过10周,不超过9周,但优选不超过8周,不超过7周,不超过6周,不超过5周,不超过4周,或不超过3周,例如,持续时间为12周,或持续时间为8周。
应当理解,对于任何具体患者的特定剂量水平将取决于多种因素,包括采用的具体化合物的活性,年龄,体重,总体健康,性别,膳食,施用时间,施用途径,排泄速率,药物组合,和经受治疗的疾病的严重度。
在本文所述的任何方法中,化合物1(或其药学上可接受的盐)和化合物2(其药学上可接受的盐)可以共同配制在单一剂型中。合适剂型的非限制性实例包括液体或固体剂型。优选地,将化合物1和化合物2配制在单一固体剂型中,其中至少一种DAA呈无定形形式,或高度优选地分子分散于基质中,所述基质包含药学上可接受的水溶性聚合物和药学上可接受的表面活性剂。其他DAA也可以呈无定形形式或分子分散于基质中,或配制为不同形式(例如,晶体形式)。更优选地,两种DAA中的每种呈无定形形式,或者高度优选地,分子分散于基质中,所述基质包含药学上可接受的水溶性聚合物和药学上可接受的表面活性剂。
在本文所述的任何方法中,所治疗的患者可以是未经治疗的患者。
在本文所述的任何方法中,所治疗的患者可以是干扰素无反应者。
在本文所述的任何方法中,所治疗的患者可以是干扰素无效反应者。
在本文所述的任何方法中,所治疗的患者可以无肝硬化。
在本文所述的任何方法中,所治疗的患者可以是肝硬化患者。
在本文所述的任何方法中,所治疗的患者可以是具有代偿性肝硬化的患者。
应当理解的是,上述实施方案和以下实施例通过举例说明而非限制性的方式给出。本发明范围内的各种变化和改变对于本领域技术人员从本说明书来看将变得显而易见。
实施例1. 不含干扰素的DAA联合疗法的临床建模
包括化合物1和化合物2的施用的治疗方案使用2012年10月19日申请且题为“Methods for Treating HCV”的美国专利申请公开号2013/0102526(其以其整体通过引用并入本文)中描述的临床模型进行评估。这些治疗方案包括化合物1和化合物2的施用,但不包括干扰素或利巴韦林的施用。
图1显示由使用化合物1(400 mg,每天一次)和化合物2(120 mg,每天一次)以治疗基因型1未经治疗(naïve)主体组成的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。评价不同的治疗持续时间。12-周治疗的预测SVR率为约95%。如本申请的所有图中所使用,各SVR百分比柱顶部的垂直条代表90% SVR置信区间,且x轴(“时间(周)”)表明各治疗方案的持续时间。
图2说明由使用化合物1(400 mg,每天一次)和化合物2(60 mg,每天一次)以治疗基因型1未经治疗主体组成的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。评价不同的治疗持续时间。12-周治疗的预测SVR率为约85-90%。
图3显示由使用化合物1(600 mg,每天一次)和化合物2(480 mg,每天一次)以治疗基因型1未经治疗主体组成的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。评价不同的治疗持续时间。12-周治疗的预测SVR率为约100%。
图4描述由使用化合物1(400 mg,每天一次)和化合物2(120 mg,每天一次)以治疗基因型3未经治疗主体组成的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。评价不同的治疗持续时间。12-周治疗的预测SVR率为约95%。
图5说明由使用化合物1(400 mg,每天一次)和化合物2(60 mg,每天一次)以治疗基因型3未经治疗主体组成的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。评价不同的治疗持续时间。12-周治疗的预测SVR率为约85-90%。
图6显示由使用化合物1(600 mg,每天一次)和化合物2(480 mg,每天一次)以治疗基因型3未经治疗主体组成的2-DAA方案的预测中值SVR百分比和90% SVR置信区间。评价不同的治疗持续时间。12-周治疗的预测SVR率为约100%。
实施例2. 体外化合物1和化合物2的组合
图7显示化合物1和化合物2的组合表现出对HCV抑制的显著协同效应,如HCV GT 1b Con-1复制细胞中所测试。结果使用Prichard和Shipman模型(Prichard等人. Antiviral Research 14:181-205 (1990))产生。
化合物1抑制含有来自GT 1a、1b、2a、3a、4a或6a的NS3基因的HCV稳定亚基因组复制子的复制,其中EC50值范围为0.85至2.8 nM。值得注意的是,化合物1针对含有GT3a蛋白酶的复制子是有效力的,其中EC50值为1.6 nM。化合物1保留其针对赋予针对其他HCV蛋白酶抑制剂(Pis)的抗性的在NS3氨基酸位置155和168处的常见GT1a和1b变体的活性。GT1a和1b亚基因组复制子细胞中的抗性集落选择研究将GT1a中的A156T和GT1b中的A156V鉴定为最常见变体,所述变体分别赋予对化合物1的1400倍和1800倍降低的敏感性。然而,这些变体的体外复制能力仅为其相应野生型复制子的1.5%和9.2%。在含有GT3a NS3蛋白酶的复制子中,化合物1在超过其EC50值≥ 100倍的浓度下选择非常少集落。在该选择后存活的集落含有单独的A156G、或与Y56H共选择的Q168R,其分别赋予对化合物1的1500倍或1100倍的敏感性损失。
表2. HCV亚基因组稳定复制子细胞培养测定中化合物1的抗病毒活性
a.0%人血浆测定含有5%胎牛血清
b.独立重复的数目。
表3. HCV亚基因组稳定复制子细胞培养测定中化合物1的抗病毒活性
a.0%人血浆测定含有5%胎牛血清
b.独立重复的数目。
当针对常见的HCV基因型1 NS3抗性相关变体(诸如GT 1a (H77)中的V36M、R155K、D168A和D168V,或GT 1b (Con-1)中的T54A、R155K、D168V和V170A)进行测试时,化合物1显示的抑制活性几乎等于针对野生型HCV复制子的抑制活性。化合物1还显示在体外具有针对许多NS5A抑制剂和NS5B抑制剂抗性相关变体(例如,GT 1a中的M28T、M28V、Q30D、Q30R、Y93C、Y93H、Y93N、L31V+Y93H、C316Y、M414T、Y448C、Y448H、S556G 和S559G,和GT 1b中的L28T、Y93H、S282T、C316Y、Y448H 和S556G)的有效活性。
本发明的前述描述提供了举例说明和描述,但并不意在穷举或将本发明限制到所公开的精确方案。改变和变化鉴于上述教导是可能的,或者可以从本发明的实施中获得。因此,应当指出,本发明的范围由权利要求及其等同方案所限定。
- 还没有人留言评论。精彩留言会获得点赞!