一种制备光催化剂氧化铜的方法与流程
本发明属于光催化领域,涉及一种无机光催化剂的制备方法。
背景技术:
随着社会的不断进步和发展,人类对于自然资源的利用与开发已远远超出地球所能承受的范围。工厂排放标准不达标,乱排乱放,造成“三废”(废水、废气、废渣)问题严重,人们日常生活中对资源的浪费以及汽车尾气的排放,这些问题的恶化已经严重影响到人们的正常生活,比如雾霾天气。所以处理环境污染问题是目前亟待解决的一大难题。
1976年,Carey等对光催化氧化降解水中污染物进行了开创性的研究,使光催化氧化降解技术应用在环境保护领域内,在世界范围内掀起了研究半导体光催化氧化技术的热潮。
纳米氧化铜在许多方面都具有很大的用途,当普通氧化铜粉体的粒径大小达到纳米级别时,其粒径变小,表面原子所占的比例就越大即比表面积大,吸附能力也变得越强,化学反应活性也变得更高,所以纳米氧化铜材料将具有更加独特的功能,更加普遍的应用。氧化铜作为无机催化剂材料,其合成及应用具有更加广阔的前景。
随着对半导体催化剂的探究技术日益成熟,制备纳米氧化铜催化剂的方法也更为完善。目前,主要有室温固相反应法、沉淀法(其中沉淀法包括直接沉淀法、均匀沉淀法、络合沉淀法和沉淀转换法)、水热法、醇热法、微乳液法、喷雾热解法、激光蒸凝法、微波沸腾回流法、电化学法等,上述方法均处理在实验室阶段,制备步骤繁琐,对生产设备的要求高,难以实现工业化生产,使得氧化铜的使用受到阻碍。
因此,亟需开发一种易于控制制备条件,适于工业化生产氧化铜粉末的方法。
技术实现要素:
为了解决上述问题,本发明人进行了锐意研究,结果发现:以铜盐为原料,在熔盐介质中煅烧铜盐,铜盐分解后生成的氧化铜立即分散于熔盐介质中,除去熔盐介质即可制得氧化铜粉末,从而完成了本发明。
本发明的目的在于提供一种制备光催化剂氧化铜的方法,其特征在于,该方法在熔盐介质中煅烧铜盐,制得光催化剂氧化铜粉末。
附图说明
图1示出实施例1~5制得样品的XRD谱及氧化铜的标准XRD谱;
图2示出实施例1~5制得样品的红外光谱;
图3示出实施例1~5制得样品的紫外-可见漫反射光谱;
图4示出实施例1~5制得样品的紫外-可见光谱;
图5在不同时间的紫外-可见光谱;
图6示出实施例1~5制得样品的紫外光催化活性;
图7示出清除剂对实施例2制得样品的影响;
图8示出本发明方法制得的光催化剂的光催化原理示意图。
具体实施方式
下面通过对本发明进行详细说明,本发明的特点和优点将随着这些说明而变得更为清楚、明确。
以下详述本发明。
目前,工业上生产氧化铜粉末通常使用以下几种方法:
(一)铜粉氧化法
(二)硝酸铜热分散法
(三)碳酸铜热分解法
(四)铜比或铜粉硝化法
(五)电导水溶解法
上述几种方法制得的氧化铜粉末通常存在粒径不均匀、颗粒的比表面积小、晶型不稳定、纯度低等难以克服的缺点。
根据本发明,提供一种制备光催化剂氧化铜的方法,该方法在熔盐介质中煅烧铜盐。
在本发明中,所述熔盐是指熔融状态的盐,或者为熔融状态的盐的组合物,优选为熔融状态的盐的组合物。
在本发明中,用于制备熔盐的盐为活泼金属盐,优选为第一主族元素形成的盐,更优选为锂盐、钠盐、钾盐等中的一种或多种,进一步优选为锂盐。
在本发明中,锂盐选自氯化锂、硝酸锂、硫酸锂、碳酸锂中的一种或多种,优选为氯化锂和硝酸锂中的一种或多种,更优选为氯化锂和硝酸锂的组合物。
在本发明中,钠盐选自氯化钠、硝酸钠、硫酸钠、碳酸钠中的一种或多种,优选为氯化钠和硝酸钠中的一种或多种,更优选为氯化钠和硝酸钠的组合物。
在本发明中,钾盐选自氯化钾、硝酸钾、硫酸钾、碳酸钾中的一种或多种,优选为氯化钾和硝酸钾中的一种或多种,更优选为氯化钾和硝酸钾的组合物。
在本发明中,用于制备熔盐的盐为氯化锂和硝酸锂的组合物,优选地,氯化锂与硝酸锂的摩尔量之比为(0.05~0.3):(0.95~0.7),优选为(0.08~0.25):(0.92~0.75),更优选为(0.10~0.20):(0.90~0.80),如0.12:0.88,其中,氯化锂的摩尔量以其分子的摩尔量计,硝酸锂的摩尔量以其分子的摩尔量计。
本发明人发现,当氯化锂与硝酸锂按照上述摩尔量之比进行组合时,得到的组合物能够在较低温度下形成熔融状态传热介质,从而通过对流和扩散提供更快传质过程,使铜盐能够在熔盐中充分分散,更快地吸收热量,从而提高铜盐分解反应的速率,并且获得更好的结晶度和产品形貌。
本发明人还发现,本发明中使用的用于制备熔盐的盐在水中都具有较大溶解度,当反应结束后,能够通过水洗的方法除去所用的盐,从而得到纯净的氧化铜产品。
在本发明中,所述铜盐选自硫酸铜及其水合物、碳酸铜及其水合物和硝酸铜及其水合物,优选为硫酸铜及其水合物,如五水硫酸铜。
在本发明中,所述铜盐优选为五水合硫酸铜,五水合硫酸铜中结晶水已经达到饱和,不能再结合结晶水或自由水,而且,其中的结晶水在常温常压条件下也不易失去,因此,使用五水合硫酸铜能够较为容易地确定其摩尔用量,此外,五水合硫酸铜价格低廉,来源广泛,因而,本发明优选使用五水合硫酸铜作为反应原料。
本发明人发现,上述铜盐能够分散在所述熔盐中,而且在所述熔盐形成的体系中分解温度低,随着反应地不断进行,体系中有固体产物生成。
在本发明一种优选的实施方式中,所述方法包括以下步骤:
步骤1,混合铜盐和制备熔盐的盐,并进行煅烧;
步骤2,冷却步骤1的反应体系,洗涤,干燥。
在本发明步骤1中,铜盐与制备熔盐的盐的摩尔量之比为(0.01~0.5):1,优选为(0.03~0.3):1,如0.05:1,其中,铜盐的摩尔量以其分子的摩尔量计,制备熔盐的盐的摩尔量以其分子的摩尔量计。
本发明人发现,当铜盐与制备熔盐的盐的摩尔量之比大于0.5:1时,铜盐在熔盐中的分散性差,热传质效果差,制得的产物结晶度差,颗粒大小不均匀,而且包杂有未充分反应的硫酸铜;当铜盐与制备熔盐的盐的摩尔量之比小于0.05:1时,铜盐在其中分散速度快,分散程度好,但熔盐用量过大,氧化铜的产率低。
在本发明步骤1中,煅烧的温度为200℃~900℃,优选为250℃~880℃,如280℃,410℃,550℃,750℃和850℃,本发明人发现,随着煅烧温度的升高,制得产品在XRD谱上的特征峰的尖锐程度先增加后降低,在410℃下制得的产物的特征峰最为尖锐,这表明410℃时制得的产物晶体结构最佳。
在本发明中,煅烧的时间为1~10小时,优选为2~8小时,如3小时,本发明人发现,当煅烧时间小于1小时时,铜盐反应不充分,体系中有大量未反应的铜盐剩余;而当煅烧时间达到10小时后,体系中铜盐已经充分反应,不再生成产物,再继续增加反应时间会造成时间和能源的浪费。
当体系中铜盐与制备熔盐的盐的摩尔比为0.05:1时,反应时间达到3小时左右,体系中的铜盐基本反应完全。
在本发明中,反应底物铜盐能够溶解在熔盐体系中,与熔盐形成共熔融体,随着反应的不断进行,粉末状的氧化铜不断在体系中析出,当体系中不再有氧化铜析出,即反应结束后,停止反应。
在本发明步骤2中,将停止反应后的体系冷却,本发明对冷却的方法不做特别限定,可以使用现有技术中任意一种冷却熔盐的方法,本发明优选自然冷却。
在本发明步骤2中,将反应后的体系冷却至可操作的温度,如0℃~100℃,优选为10℃~90℃,更优选为20℃~70℃,如30℃,在上述温度下,便于操作人员对反应后的体系进行后处理。
在本发明步骤2中,随着冷却的进行,体系中的熔盐也随之凝结为固态,因此,体系呈现为一块固体,生成的氧化铜粉末分散在所述固体中,但是其中的用于制备熔盐的盐均是可溶于水的,而产物氧化铜是不溶于水的,因此,使用水对冷却后的体系进行洗涤,使可溶盐溶解,即可得到纯净的氧化铜粉末。
在本发明中,洗涤所述固体时使用的水为热水,优选热水的温度为30℃~100℃,更优选为40℃~95℃,进一步优选为50℃~90℃,如70℃~80℃。
本发明人发现,使用上述热水洗涤所述固体,其中可溶性盐的溶解速率大大加快,洗涤的效率大大的提高。
在本发明中,对洗涤的次数不做特别限定,以将氧化铜表面的杂质洗涤干净为优选。
用本发明方法制得的氧化铜粉末,其XRD谱图中,在2θ=35.7°、38.9°、49.0°附近均出现较为明显的氧化铜吸收峰。
用本发明方法制得的氧化铜粉末,具有较高的紫外光催化活性,在紫外光照射2h后,对甲基橙的降解率能够达到70%以上,甚至75%以上。
用本发明方法制得的氧化铜粉末为球形颗粒,其平均粒径约为20~40nm,粒径分布均匀,粒径分布为10~80nm,其纯度能够达到99%以上,比表面积约为100~200m2/g。
根据本发明提供的制备光催化剂氧化铜的方法,具有以下有益效果:
(1)该方法采用熔盐作为反应介质,能够生成粒度均匀,结晶度好的粉末状态的氧化铜,使该氧化铜粉末具有良好的光催化作用;
(2)该方法使用的原料来源广泛,价格低廉,生产成本低;
(3)该方法操作简单,制备条件温和,对生产设备的要求低,适于工业化规模生产;
(4)用该方法制得的氧化铜粉末在紫外光照射2h后,对甲基橙的降解率能够达到70%以上,甚至75%以上。
实施例
实施例1
准确称取五水合硫酸铜12.500g放于坩埚中,然后再称取30.340g硝酸锂和2.540g氯化锂(硝酸锂与氯化锂摩尔比为0.88:0.12),将三种样品在坩埚中充分混合均匀,混合物中五水合硫酸铜与硝酸锂、氯化锂的混合物的摩尔比为1:10;
充分混合以后,将盛有样品的坩埚放于箱式电阻炉中,将温度设置在280℃,在此温度下煅烧3h,3h后,将坩埚取出,冷却至室温,反应物会凝结成很硬的固体粉末,
将坩埚放于超声波清洗器中,向其中加入蒸馏水,使反应物脱离坩埚,将反应物与蒸馏水的混合溶液倒入烧杯中,用蒸馏水反复冲洗,除去过量的锂盐,经冲洗后的反应物放于恒温干燥箱中,温度设置在70℃,干燥12h,即得氧化铜产物。
氧化铜粉末为球形颗粒,其平均粒径约为30nm,粒径分布均匀,粒径分布为20~50nm,其纯度为99%,比表面积约为130m2/g。
实施例2~5
实施例2~5所用方法与实施例1相似,区别仅在于步骤2中所用温度分别为410℃、550℃、750℃、850℃。
实施例2~5制得的氧化铜粉末均为球形颗粒,其平均粒径约为20~40nm,粒径分布均匀,粒径分布为10~40nm,其纯度为99.9%,比表面积约为120~150m2/g。
对比例
对比例1~5
对比例1~5所用方法与实施例1~5相似,区别仅在于步骤1中仅用五水合硫酸铜,而不用硝酸锂和氯化锂。
制得产物在紫外光照射2h后,其光催化降解甲基橙的降解率依次分别为30%、35%、33%、36%和32%。
制得的氧化铜粉末为无定型粉末,其平均粒径约为1μm,粒径分布为20nm~2μm,其纯度为95%,比表面积为50m2/g。
实验例
实验例1样品的XRD分析
本实验例所用样品由实施例1~5制得。
检测方法:X射线衍射光谱(XRD)采用日本岛津公司X射线衍射仪(XRD-7000)进行测定并分析各催化剂粉体的晶相结构。
仪器参数:Cu-Kα辐射,管电压36KV,管电流20mA,步宽0.01,波长1.5406,扫描范围10-70°,扫描速度8deg/min,结果如图1所示,其中,
曲线1表示实施例1制得样品;
曲线2表示实施例2制得样品;
曲线3表示实施例3制得样品;
曲线4表示实施例4制得样品;
曲线5表示实施例5制得样品;
曲线6表示氧化铜的标准图谱;
由图1可知:氧化铜XRD标准图谱(2θ=32.6°峰对应氧化铜(110)晶面;2θ=35.7°峰对应氧化铜(002)晶面;2θ=38.9°峰对应氧化铜(111)晶面;2θ=49.0°峰对应氧化铜(202)晶面;2θ=53.6°峰对应氧化铜(020)晶面;2θ=58.5°氧化铜(202)晶面;2θ=61.7°峰对应氧化铜(113);2θ=66.2°峰对应氧化铜(311)晶面;2θ=68.4°峰对应氧化铜(220)晶面作对比可得,在2θ=35.7°、38.9°、49.0°附近均出现较为明显的吸收峰,这种尖锐的吸收峰是纳米氧化铜的特征峰,说明制得的氧化铜样品其结晶性能较好。
在谱图中也没有出现氧化亚铜、碳酸铜等的杂质衍射峰,说明制得的样品没有杂质,纯度高。
从谱图中可以看出衍射峰有出现宽化的现象,说明制得的产物晶粒尺寸非常细小。
在280℃制得的样品,由于温度未达到反应所要求的温度,所以其XRD衍射吸收峰均不太明显。
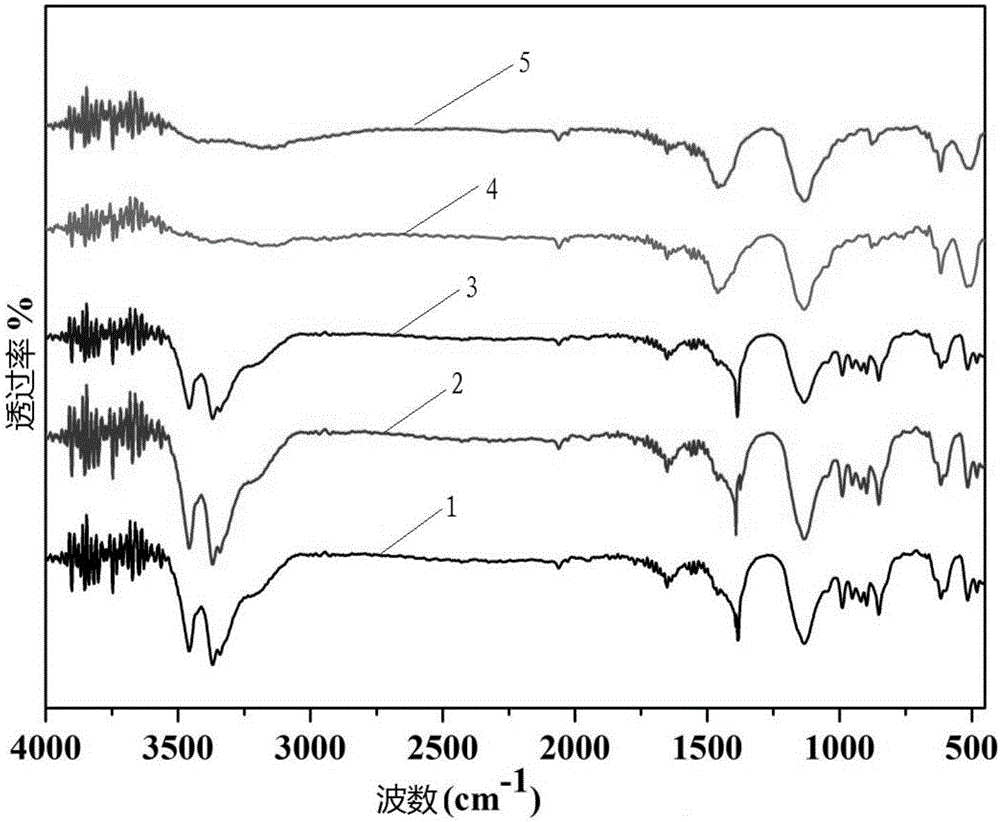
实验例2样品的红外光谱分析
红外光谱是用来测量样品在受到连续变化频率的红外光照射时,分子吸收某些频率的辐射,并由其振动运动或弯曲运动引起偶极矩的变化,引起能级从基态到激发态的跃迁,从而形成分子吸收光谱。
本实验例所用样品由实施例1~5制得。
操作方法:取少量上述样品(粉末),分别加入少量的溴化钾粉末,再研磨至混合均匀,压成薄片,再用傅里叶变换红外光谱仪对催化剂进行红外光谱表征,结果如图2示,其中,
曲线1表示实施例1制得样品;
曲线2表示实施例2制得样品;
曲线3表示实施例3制得样品;
曲线4表示实施例4制得样品;
曲线5表示实施例5制得样品。
图2显示了不同温度下制得的氧化铜催化剂红外光谱图,在图2中可以看到:
在280℃、410℃、510℃下制得的样品在3300cm-1附近有较为明显的吸收峰,水分子会在此范围内存在吸收峰,这种吸收峰的出现可能是由于在压片过程中,有水蒸气混入或者溴化钾中含有微量的水分,另外,在3500cm-1-3200cm-1之间也存在明显的吸收峰,这可能是由于氧化铜样品中存在水分子,水分子之间形成氢键的原因所导致的,
在750℃、850℃下没有3500cm-1-3200cm-1之间的吸收峰,可能是由于在反应过程中温度过高很难有水蒸气混入,在2500cm-1-2000cm-1附近均出现一不太明显的吸收峰,CO2的特征吸收峰会出现在2300cm-1附近,所以出现这种吸收峰的原因是由于在压片过程中混入了少量的CO2。
在1750cm-1-1350cm-1范围内存在的吸收峰是由于碳碳双键、碳氧双键、碳氮双键及硝基等的伸缩振动引起的。在1350cm-1-650cm-1区域内,存在吸收峰的原因是由于有C-O的伸缩振动和C-C的骨架振动,还有力常数较小的弯曲振动产生的吸收峰,因此在这段区间内光谱图相对比较复杂。
从谱图中可以看出,在500cm-1附近也会出现明显的吸收峰,这是样品氧化铜中Cu-O的特征吸收峰,说明制得的样品为氧化铜。
实验例3样品的紫外-可见漫反射光谱分析
本实验例所用样品由实施例1~5制得。
操作方法:利用紫外-可见漫反射光谱仪对各催化剂样品进行表征,测试波长200-700nm。应尽可能用玻片将样品压得致密,以保持样品表面的平整,结果如图3所示。
图3中所标注的a、b、c、d、e分别代表反应温度在280℃、410℃、510℃、750℃、850℃条件下所制得的样品氧化铜对光的吸收能力的强弱。
从图3中可以看出在410℃制得的样品对光的吸收能力较强。在300nm以后,样品氧化铜对光的吸收能力大大增加。
实验例4样品的紫外-可见光谱分析
本实验例所用样品由实施例1~5制得。
用电子天平分别准确称量280℃、410℃、550℃、750℃、850℃制得的氧化铜样品0.050g置于石英管中,并编号1、2、3、4、5,分别向各石英管中加入40mL浓度为5mg·L-1的甲基橙溶液,最后向每个石英管中加入一个磁子。将准备好的石英管放入光化学反应仪中,保证每个石英管内的磁子都转动起来,暗处理半个小时,然后取样,放入高速离心机内离心20分钟,得到一组经暗反应后的样品。然后把汞灯光源打开,进行紫外光照射降解实验,每40分钟取样一次并在高速离心机内离心20分钟,总共取样3次。最后利用双光束紫外-可见分光光度计分别测出各光催化剂的紫外光谱。
如图4所示,图4中表示的是不同温度下制得的氧化铜样品对甲基橙催化降解的能力,从图4中可知温度在410℃条件下制得的样品其催化性能最好,实验结果与氧化铜催化剂在光反应中所得结论吻合较好。
实验例5样品在不同时间内紫外-可见光谱分析
本实验例所用样品由实施例2制得。
本实验例所用方法与实验例4相似,区别在于所用样品为实施例2制得,取样时间间隔为40min,即0min、40min、80min和120min时分别取样,结果如图5所示。
从图5中可以看出随着光照时间的延长,样品催化剂对甲基橙的降解能力不断增大,增大到一定数值,其降解能力逐渐降低,而且没有新的峰出现,吸光度数值的逐渐减小主要是因为光催化降解反应。
实验例6样品的紫外光催化活性分析
本实验例所用样品由实施例1~5制得。
分别准确称量上述样品各0.050g于石英管中,并编号1、2、3、4、5,依次向石英管中加入40mL浓度为5.0mg·L-1的甲基橙溶液,然后向石英管中各加入一个小磁子。
将准备好的石英管中放入光化学反应仪中,打开搅拌保证每个磁子充分转动起来,在不断搅拌下,暗反应进行30分钟,然后取样,在高速离心机中离心20分钟,利用紫外-可见分光光度计测其吸光度A0。取样后打开光源,进行光照,光照处理2h后,取样离心20分钟,测其吸光度At,由公式W(%)=(A0-At)/A0×100%计算其降解率,根据所得降解率绘制出不同催化剂样品的紫外活性图,如图6所示,其中a~e分别表示实施例1~5制得样品的紫外活性曲线。
从图6中可以看出在410℃下制得的样品催化剂其紫外光催化活性最好,当用紫外光照射2h,其光催化降解甲基橙的降解率达到75.7%。
从图6中可以看出随着反应温度的增加,所制得的样品光催化性能也不断增加,当反应温度增加到410℃时样品氧化铜的催化性能达到最大值,然后随着温度增加其催化活性开始逐渐降低,温度与光催化活性曲线大致成抛物线曲线。
这与液相紫外实验测定结果大致相同。
实验例7清除剂对样品光催化活性的影响
以实施例2制得的样品为测试对象。
本实验以甲基橙为模型化合物,通过引入各种自由基清除剂,研究410℃条件下制得氧化铜催化剂的光催化机制。添加异丙醇(IPA)起到抑制体系降解过程中·OH产生的作用,添加草酸铵(AO)起到抑制体系降解过程中h+产生的作用,添加对苯醌(BQ)起到抑制体系降解过程中·O2-产生的作用,添加过氧化氢酶(CAT)起到抑制体系降解过程中H2O2产生的作用。
用电子天平分别准确称量6份410℃条件下制得的氧化铜样品0.050g,将样品放在石英管中,并编号1、2、3、4、5、6,依次向石英管中分别加入40mL浓度为5.00mg·L-1的甲基橙溶液。1号石英管作为空白对照,然后向2号石英试管中加入3.800μL过氧化氢酶,向3号石英管中加入5.000μL异丙醇,向4号石英管中加入0.004g草酸铵,向5号石英管中加入0.004g对苯醌,向6号石英管中加入0.004g硝酸钠,最后向各管中放入一个小磁子。将准备好的石英管放入光化学反应仪中,打开搅拌,使磁子在石英管中充分转动起来,在不断搅拌下,暗反应进行30分钟,取样后放到高速离心机中进行离心,然后利用紫外-可见分光光度计测其吸光度A0,打开光源,光照处理2h后,取样、离心,测其吸光度At,利用公式W(%)=(A0-At)/A0×100%计算降解率,绘制成图,如图7所示。
在图7中,no表示不加清除剂,IPA表示异丙醇,AO表示草酸铵,BQ表示对苯醌,CAT表示过氧化氢酶。
由图7可以看出,在其他的条件不变的情况下,
(1)与不添加清除剂相比较,加入清除剂后,催化剂的活性均有所降低;
(2)在其他条件相同的情况下,草酸铵(AO)的加入对催化剂紫外光催化活性的影响最大,说明在紫外光照射下光催化降解甲基橙的过程中·OH是最主要的活性物种;
(3)加入异丙醇(IPA)、过氧化氢酶(CAT)后,催化剂的活性均有较为明显的降低,异丙醇(IPA)的加入使得催化剂的活性降得最低。也就是说·OH、H2O2在光催化降解过程中起明显作用,尤其是·OH在光催化过程中起最主要作用。
不受任何理论束缚,本发明人认为,用本发明方法制备而得的光催化剂,其光催化原理如图8所示。
在反应体系中,催化剂在光照的作用下产生空穴(h+),空穴与甲基橙溶液里的OH-、H2O等物质反应生成高活性的自由基·OH;加入的草酸铵(AO)会抑制光生电子的活性,加入的异丙醇(IPA)会抑制高活性自由基·OH的活性,因此加入草酸铵(AO)和异丙醇(IPA)会抑制催化剂对甲基橙的降解活性。半导体光催化剂表面上吸附的氧气是光生电子的主要捕获剂,氧气在这里作为氧化剂,氧气与光生电子发生反应生成·O2-,·O2-与氢离子结合生成HO2·,HO2·经过一系列反应可生成H2O2,生成的H2O2再与·O2-经过反应可生成高活性自由基·OH。加入的对苯醌(BQ)会抑制·O2-的活性,加入的过氧化氢酶(CAT)会抑制H2O2生成,从而使高活性的·OH生成受阻。通过加入的自由基清除剂可以得出结论,在其他条件都相同的情况下,在紫外光照射下光催化降解甲基橙的过程中,·OH、H2O2是主要的活性物种,尤其是·OH在光催化过程中起最主要作用。
CuO+hν(UV)→e-cb+h+vb (1)
e-cb+O2→·O2- (2)
e-cb+·O2-+2H+→H2O2 (3)
2e-cb+2H+→H2 (4)
h+vb+OH-→·OH (5)
MO+·OH→products (6)
MO+·O2-→products (7)
MO+H2O2→products (8)
MO+h+vb→products (9)
以上结合具体实施方式和范例性实例对本发明进行了详细说明,不过这些说明并不能理解为对本发明的限制。本领域技术人员理解,在不偏离本发明精神和范围的情况下,可以对本发明技术方案及其实施方式进行多种等价替换、修饰或改进,这些均落入本发明的范围内。本发明的保护范围以所附权利要求为准。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种电极催化材料的制备方法及其在葡萄糖燃料电池中的应用与流程
- 一种负载型Bi2MoO6/Cu(OH)2/石墨烯光催化剂的制备方法与流程
- 一种高效产氢的球状纳米ZnO/ZnCr2O4复合光催化剂的制备方法与流程
- 一种铬酸银/溴化银复合光催化剂的制备方法与流程
- 一种MoS2纳米片复合TiO2纳米片的光催化剂的制备方法与流程
- 一种CdS量子点/Bi2MoO6/石墨烯复合型光催化剂的制备方法与流程
- 一种Cu/ZnO光催化剂的制备方法与流程
- CQDs/TNS和SiQDs/TNS复合光催化剂的制备方法与流程
- 能够有效降解染料废水的Bi2S3/SnS2/Bi2O3三元复合光催化剂的制备方法与制造工艺
- 羟基锡酸钴/石墨烯复合光催化剂的制备方法及其应用与制造工艺