含有萘基取代的不对称苊二亚胺镍配合物及其制备方法与应用与流程
本发明属于配合催化领域,具体涉及一种含有萘基取代的不对称苊二亚胺镍的配合物及其制备方法与应用。
背景技术:
聚烯烃主要包括聚乙烯,聚丙烯和聚1-丁烯等,其中聚乙烯树脂(PE)是通用合成树脂中产量最大的品种,并且由于其优良的材料性能,被广泛的应用于工业、农业、军事、医疗卫生、日常生活等许多领域。由于聚乙烯产业的巨大经济利益、社会效益和众多国际专利的层层覆盖,致使我国在高性能聚乙烯新材料生产中处于非常被动的局面。我国聚乙烯工业仍然存在着一些矛盾和缺点,聚乙烯产品表现出结构性过剩以及结构性短缺的不足。在所有聚乙烯的生产工艺中,催化剂都是至关重要的因素。因此,研究开发具有创新性的高性能聚乙烯催化剂已经成为目前我国科研人员的责任和现实任务。
镍金属配合物催化乙烯齐聚(SHOP工艺)是上世纪八十年代后过渡金属催化乙烯反应中具有划时代意义的贡献,基于α-烯烃的大规模生产,极大地推进了化工业的发展。其结构如下式一所示(Angew.Chem.,Int.Ed.Engl.1978,17,466–467;Angew.Chem.,Int.Ed.Engl.1983,22,503;J.Chem.Soc.,Chem.Commun.1994,2203–2204):
1995年,Brookhart研究组首次报道了一类新型的α-二亚胺镍、钯配合物,并将其用于催化乙烯聚合(J.Am.Chem.Soc.1995,117,6414–6415),获得了高分子量、高支化聚乙烯,掀起了过渡金属镍配合物催化烯烃的研究热潮,相应的结构式如下式二所示。
我们课题组在过去数年里一直致力于乙烯齐聚、聚合催化剂的开发和催化工艺的研究,开发了多类镍金属配合物的乙烯齐聚和聚合催化剂。设计的单、双核吡啶亚胺镍配合物进行乙烯聚合催化时获得了支化高分子量聚乙烯,相应的结构式如下式三所示,核磁研究证实支化链为丁基(J.Organomet.Chem.,2005,690,1570–1580和J.Organomet.Chem.,2005,690,1739–1749),该特性可以用来合成新型聚乙烯树脂。
我们报道的喹啉胺镍化合物在常压下就能表现出极高的催化活性,催化乙烯齐聚活性高达1.2×107g·mol–1·h–1atm-1(Chin.Chem.Lett.2001,12,691-692),相应的结构式如下式四所示。
另外,我们设计的2-苯并咪唑-1,10-菲啰啉镍配合物可以催化乙烯齐聚,活性达到1.27×107g·mol–1·h–1(Eur.J.Inorg.Chem.2007,3816–3826),其相应的结构式如下式五所示。
我们组在致力于乙烯齐聚和聚合催化剂和催化工艺的研究中开发了多类镍配合物催化剂专利:中国专利ZL 00 1 21033.5,申请日2000年7月17日,授权公告日2003.1.8;中国专利申请号01118455.8,申请日2001年5月31日;中国专利ZL 01 1 20214.9,申请日:2001年7月6日,授权公告日2004.7.7;中国专利申请号01120554.7,申请日2001年7月20日;中国专利ZL 02 1 18523.9,申请日2002年4月26日,授权公告日2004.12.22;中国专利ZL 02 1 23213.X,申请日2002年6月12日,授权公告日2003.11.19;中国专利申请号03137727.0,申请日2003年6月23;中国专利申请号03148378.X,申请日2003年7月2日;中国专利申请号03154463.0,申请日2003年10月8日;中国专利申请号200410086284.7申请日2004年10月29日;中国专利申请号200410081711.2申请日2004年12月30日;中国专利申请号200710119281.2申请日2007年7月19日。
后过渡金属烯烃聚合催化剂在过去十年来的研究结果中,显示出了比茂金属催化剂更好的性能(合成简单、成本低和稳定性好),这类催化剂的优点还在于可以通过调节配体的结构来达到对催化活性以及聚合物性能的控制。
技术实现要素:
本发明的目的是提供一种含有萘基取代的不对称苊二亚胺镍配合物及其制备方法与应用。
本发明所提供的含有萘基取代的不对称苊二亚胺镍配合物,其结构通式如式I所示:
所述式I中,R1为二(苯基)甲基或二(对氟苯基)甲基;R2为氢、二(苯基)甲基或二(对氟苯基)甲基;R3为碳原子数为1-3的烷基;R4为氢或甲基;X为溴或氯。
更优选的,本发明所述镍金属配合物选自如下任意一种配合物:
C1:R1=CHPh2;R2=H;R3=Me;R4=H;X为Br。
C2:R1=CHPh2;R2=H;R3=Et;R4=H;X为Br。
C3:R1=CHPh2;R2=H;R3=i-Pr;R4=H;X为Br。
C4:R1=CHPh2;R2=H;R3=Me;R4=Me;X为Br。
C5:R1=CHPh2;R2=H;R3=Et;R4=Me;X为Br。
C6:R1=R2=CHPh2;R3=Me;R4=H;X为Br。
C7:R1=R2=CHPh2;R3=Et;R4=H;X为Br。
C8:R1=R2=CHPh2;R3=i-Pr;R4=H;X为Br。
C9:R1=R2=CHPh2;R3=Me;R4=Me;X为Br。
C10:R1=R2=CHPh2;R3=Et;R4=Me;X为Br。
C11:R1=CH(PhF)2;R2=H;R3=Me;R4=H;X为Br。
C12:R1=CH(PhF)2;R2=H;R3=Et;R4=H;X为Br。
C13:R1=CH(PhF)2;R2=H;R3=i-Pr;R4=H;X为Br。
C14:R1=CH(PhF)2;R2=H;R3=Me;R4=Me;X为Br。
C15:R1=CH(PhF)2;R2=H;R3=Et;R4=Me;X为Br。
C16:R1=R2=CH(PhF)2;R3=Me;R4=H;X为Br。
C17:R1=R2=CH(PhF)2;R3=Et;R4=H;X为Br。
C18:R1=R2=CH(PhF)2;R3=i-Pr;R4=H;X为Br。
C19:R1=R2=CH(PhF)2;R3=Me;R4=Me;X为Br。
C20:R1=R2=CH(PhF)2;R3=Et;R4=Me;X为Br。
C21:R1=R2=CH(PhF)2;R3=Me;R4=H;X为Cl。
其中,Ph代表苯基;Me代表甲基;Et代表乙基;i-Pr代表异丙基。
本发明所提供的制备上述式I所示化合物的方法,包括如下步骤:在无氧条件下,使式V所示配体化合物与(DME)NiBr2或NiCl2·6H2O在有机溶剂中进行反应,得到式I所示化合物的溶液;
其中,式V中的R1、R2、R3和R4的定义同式I。
上述方法中,所述式V所示配体化合物与(DME)NiBr2或NiCl2·6H2O的摩尔比为(1.2-1):(1-1.2),具体为1.1:1。
所述(DME)NiBr2为(乙二醇二甲醚)溴化镍。
所述有机溶剂为二氯甲烷。
所述反应的反应温度为室温,反应时间为8-24小时,具体为12小时。
上述方法中还包括向所述式I所示化合物的溶液中加入乙醚促使式I所示化合物沉淀,然后,过滤,乙醚洗涤,烘干的步骤。
本发明还提供了一种式V所示配体化合物,
其中,式V中的R1、R2、R3和R4的定义同式I。
本发明提供的制备所述式V所示配体化合物的方法,包括如下步骤:
1)在对甲苯磺酸催化下,使苊醌与式II所示化合物在有机溶剂中进行反应,得到式III所示化合物;
2)在对甲苯磺酸催化下,使步骤1)得到的式III所示化合物与式IV所示的化合物在有机溶剂中进行回流反应,得到式V所示的配体化合物;
其中,式II、式III和式IV中的R1、R2、R3和R4的定义同式I。
上述方法中,步骤1)中,所述苊醌和式II所示化合物的摩尔比为(1.5-1):(1-1.5),具体为1:1。
所述对甲苯磺酸的加入量为所述苊醌的0.5%-5%。
所述有机溶剂选自二氯甲烷和/或乙醇;优选二氯甲烷和乙醇的混合溶剂,两者的体积比为(10-30):(1-3),具体为20:1。
所述反应的反应温度为室温,反应时间为12-36小时,具体为24小时。
上述方法中,步骤2)中,所述式III所示化合物与式IV所示的化合物的摩尔比为(1.5-1):(1-1.5),具体为1:1.1。
所述对甲苯磺酸的加入量为所述式III的0.5%-5%。
所述有机溶剂为甲苯。
所述回流反应的反应温度为105℃-120℃,反应时间为6-10小时,优选为8-10小时。
为了得到纯化的式III所示化合物,步骤1)中还包括对式III所示化合物进行如下纯化的步骤:将步骤1)中得到的式III所示化合物溶于二氯甲烷中,硅胶柱进行柱层析,以石油醚和乙酸乙酯的混合溶剂为淋洗剂进行洗脱,通过薄层色谱检测洗脱流分,其中,混合溶剂中,石油醚和乙酸乙酯的体积比为(50-150):1,优选为80:1。
为了得到纯化的式V所示的配体化合物,步骤2)中还包括对得到的式V所示的配体化合物进行如下纯化的步骤:将步骤2)中得到的式V所示配体化合物溶于二氯甲烷中,硅胶柱进行柱层析,以石油醚和乙酸乙酯的混合溶剂为淋洗剂进行洗脱,通过薄层色谱检测洗脱流分,其中,混合溶剂中,石油醚和乙酸乙酯的体积比为(50-250):1,优选为200:1。
本发明所提供的式I所示金属配合物的应用是在制备乙烯聚合的催化剂中的应用。
另外,本发明还提供了一种用于乙烯聚合的催化剂组合物,该催化剂组合物由作为主催化剂的式I所示化合物和助催化剂(也即活化剂)组成;其中,所述助催化剂选自如下至少一种:铝氧烷、烷基铝和氯化烷基铝。
所述式I所示镍金属配合物中镍元素与所述铝氧烷中铝元素的摩尔比为1:(1000-3500),优选摩尔比为1:(1000-3000)。
所述式I所示镍金属配合物中镍元素与所述烷基铝中铝元素的摩尔比为1:(200-800),优选摩尔比为1:(300-800)。
所述式I所示镍金属配合物中镍元素与所述氯化烷基铝中铝元素的摩尔比为1:(200-800),优选摩尔比为1:(300-800)。
上述催化剂组合物中,所述铝氧烷选自如下至少一种:甲基铝氧烷(MAO)、三异丁基铝改性的甲基铝氧烷(MMAO)、乙基铝氧烷和异丁基铝氧烷,所述铝氧烷可通过各种常用的三烷基铝化合物的水解作用产生,如:MMAO可通过三甲基铝和较高级三烷基铝(如三异丁基铝)的水解作用产生。
所述烷基铝选自如下至少一种:三乙基铝、三甲基铝、三异丁基铝、三正己基铝和三正辛基铝。
所述氯化烷基铝选自如下至少一种:氯化二乙基铝、氯化二甲基铝、二氯化乙基铝和倍半铝(氯化二乙基铝:二氯化乙基铝=1:1混合物)。
本发明还提供了一种制备聚乙烯的方法,包括如下步骤:在以上述本发明所提供的催化剂组合物作为催化剂的条件下,催化乙烯进行聚合反应,反应完毕得到所述聚乙烯。
上述制备聚乙烯的方法中,所述聚合反应的温度为0-70℃,优选为20-70℃,更优选30℃或40℃。
所述聚合反应的时间为10-120分钟,优选为15-60分钟,更优选30分钟。
所述聚合反应在加压下进行的,所述加压的压力范围为1-10atm,优选5-10atm。
所述聚合反应在溶剂中进行,所述溶剂选自甲苯、二氯甲烷、四氢呋喃、己烷和环己烷中的至少一种,优选为甲苯和/或己烷,更优选甲苯。
本发明设计并合成了含有N^N配位基的不对称苊二亚胺配体及其镍配合物,其制备工艺简单、原料廉价,而且对催化乙烯聚合有非常高活性,不对称苊二亚胺配体结构均通过核磁、红外和元素分析的表征,镍配合物除了红外和元素分析的表征外,还用X-射线单晶衍射仪测定,证实了配合物C1、C4、C16的晶体结构。
本发明提供的金属镍配合物用于催化乙烯聚合反应时表现出了非常好的催化活性。在30℃,它们催化乙烯聚合的活性可达7.71×106g·mol-1(Ni)·h-1,得到的聚合物为高分子量低支化度的聚乙烯,具有广泛的工业应用前景。
附图说明
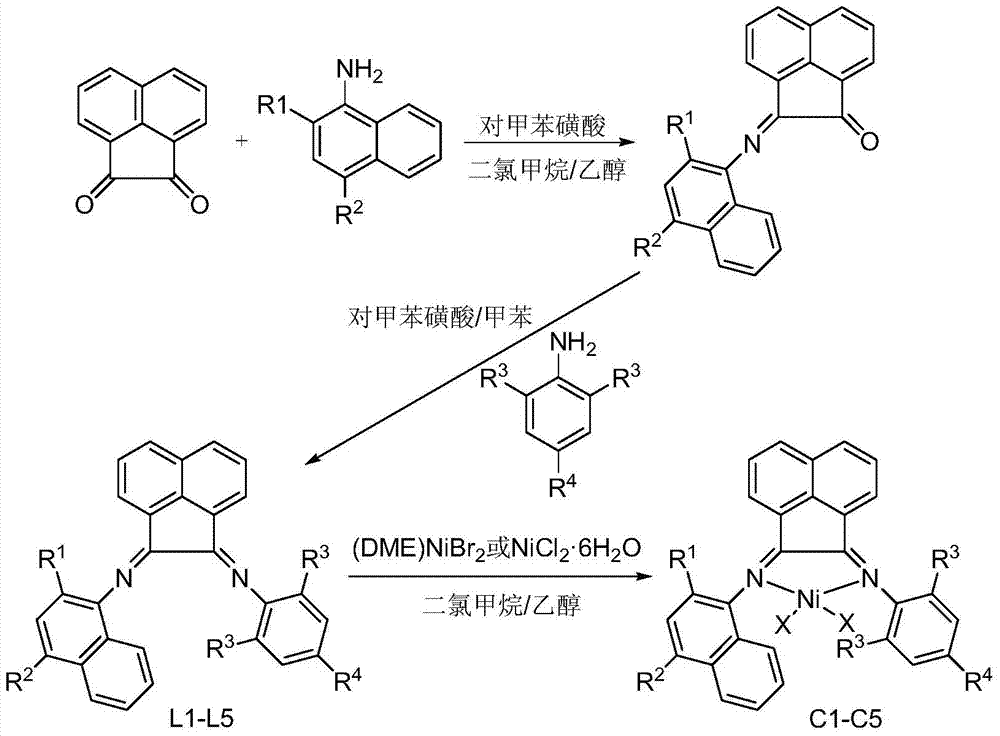
图1为式I所示金属镍配合物的制备流程图;
图2为配合物C1的晶体结构图;
图3为配合物C4的晶体结构图;
图4为配合物C16的晶体结构图。
具体实施方式
下面结合附图通过具体实施例对本发明的方法进行说明,但本发明并不局限于此。
下述实施例中所述实验方法,如无特殊说明,均为常规方法;所述试剂和材料,如无特殊说明,均可从商业途径获得。
下述实施例中所述浓度如无特别说明,均为质量百分浓度。下述乙烯聚合实施例中所得聚合物的分子量及分子量分布均为按照常规的GPC方法测定而得,熔点均为按照常规的DSC方法测定而得,聚合物的聚合活性均按照如下公式计算而得:聚合活性=聚合物产量/(催化剂用量·聚合时间)。
下述实施例中式I所示金属镍配合物的制备流程图如图1所示。
实施例1、制备2-二(苯基)甲基萘胺
1-萘胺(10g,63.84mmol),二(苯基)甲醇(8.84g,34.92mmol),无水ZnCl2(5g,36.68mmol)分别加入到圆底烧瓶中,油浴加热,控温在150℃左右。反应8h。停止加热冷却后加入DCM溶解,用硅藻土过滤,除去溶剂,剩余物用石油醚和乙酸乙酯的体积比为100:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得紫红色粉末2.66g,产率18.6%
结构确证数据如下:1H NMR(400MHz,CDCl3,TMS):δ7.80-7.89(m,2H),7.47-7.49(m,2H),7.29-7.39(m,8H),7.23(d,J=7.2Hz,5H),6.96(d,J=8.4Hz,1H),5.79(s,1H),3.98(s,2H)。
13C NMR(100MHz,CDCl3,TMS):δ142.8,139.2,133.3,129.7,128.7,128.6,128.1,126.8,125.5,125.1,123.8,122.9,120.5,118.2,52.5。
实施例2、制备1-[2-二(苯基)甲基萘亚胺基]苊酮
苊醌(0.73g,4mmol)和2-二(苯基)甲基萘胺(1.24g,4mmol)溶于适量乙醇和二氯甲烷的混合溶剂(两者体积比为20:1)中,加入对甲苯磺酸(0.015g,0.08mmol),室温搅拌24h。除去溶剂,剩余物用石油醚和乙酸乙酯的体积比为80:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得到红色粉末1.5g,产率53%。
结构确证数据如下:1H NMR(400MHz,CDCl3,TMS):δ7.90(d,J=8.0Hz,1H),7.82–7.76(m,2H),7.71(d,J=8.4Hz,1H),7.63(d,J=8.0Hz,1H),7.47(t,J=8.0Hz,2H),7.35–7.04(m,9H),6.99(d,J=8.0Hz,1H),6.85(t,J=8.0Hz,1H),6.47(t,J=7.6Hz,2H),5.54(s,1H)。
13C NMR(100MHz,CDCl3,TMS):δ165.2,163.3,148.9,145.1142.7,141.4,140.5,131.4,129.7,129.5,128.3,128.2,127.7,127.3,126.8,126.4,126.1,125.8,125.5,125.1,125.0,124.8,124.1,123.5,123.3,122.9,52.7。
实施例3、制备1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二甲基苯亚胺基)苊烯[L1]
1-[2-二(苯基)甲基萘亚胺基]苊酮(3.06g,6.46mmol)和2,6-二甲基苯胺(0.86g,7.10mmol)溶于100mL甲苯溶液中,加入对甲苯磺酸(0.03g,0.13mmol),加热回流,反应8h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.17g,产率:4.7%。熔点:160℃。
结构确证数据如下:FT-IR(KBr,cm-1):3054(w),2968(w),1663(w),1637(m),1592(s),1493(s),1372(s),1274(m),1152(w),1032(m),918(w),829(m),778(vs),745(vs),696(vs).1H NMR(400MHz,CDCl3,TMS):δ7.89(d,J=8.0Hz,1H),7.77–7.74(m,2H),7.69(d,J=8.4Hz,1H),7.60(d,J=8.0Hz,1H),7.44(t,J=8.0Hz,2H),7.33–7.09(m,11H),7.02(d,J=8.0Hz,1H),6.90(t,J=8.0Hz,1H),6.64(d,J=7.2Hz,1H),6.51(t,J=7.6Hz,2H),6.29(t,J=7.6Hz,1H),6.01(s,1H),5.73(d,J=7.2Hz,1H),2.34(s,3H),2.20(s,3H)。
13C NMR(100MHz,CDCl3,TMS):δ163.8,161.5,149.4,146.2,143.7,141.9,140.7,132.9,130.4,130.0,129.8,129.2,129.0,128.8,128.5,128.3,128.1,128.0,127.9,127.7,127.5,126.3,126.1,126.0,125.3,125.1,125.0,124.1,123.9,123.6,123.1,122.2,52.7,18.4,18.1。
元素分析:C43H32N2(576.73)理论值:C,89.55;H,5.59;N,4.86。实验值:C,89.15;H,5.66;N,4.65。
实施例4、制备1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二乙基苯亚胺基)苊烯[L2]
1-[2-二(苯基)甲基萘亚胺基]苊酮(3.06g,6.46mmol)和2,6-二乙基苯胺(1.01g,7.10mmol)溶于100mL甲苯溶液中,加入对甲苯磺酸(0.03g,0.13mmol),加热回流,反应8h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得橘黄色固体0.59g,产率:15.3%。熔点:206℃。
结构确证数据如下:FT-IR(KBr,cm-1):3054(w),2966(w),1665(w),1639(m),1592(w),1493(m),1375(s),1269(m),1149(w),1060(m),922(w),826(m),778(vs),743(vs),699(vs)。
1H NMR(400MHz,CDCl3,TMS):δ7.88(d,J=8.0Hz,1H),7.75–7.73(m,2H),7.69(d,J=8.8Hz,1H),7.60(d,J=8.4Hz,1H),7.43(t,J=7.2Hz,1H),7.31–7.15(m,11H),7.02(d,J=7.2Hz,2H),6.88(t,J=7.6Hz,1H),6.62(d,J=7.2Hz,1H),6.52(t,J=7.6Hz,2H),6.30(t,J=7.6Hz,1H),6.01(s,1H),5.70(d,J=7.2Hz,1H),2.84–2.74(m,1H),2.70–2.59(m,2H),2.52–2.42(m,1H),1.28(t,J=7.6Hz,3H),1.16(t,J=7.2Hz,3H).13C NMR(100MHz,CDCl3,TMS):δ163.8,161.5,148.5,146.2,143.8,141.9,140.7,132.9,131.0,130.8,130.4,130.0,129.8,129.2,128.9,128.7,128.5,128.3,128.1,127.7,127.5,126.5,126.3,126.1,126.0,125.4,124.3,124.1,123.9,123.6,123.1,122.7,52.6,25.0,24.7,14.6,14.0。
元素分析:C45H36N2(604.78)理论值:C,89.37;H,6.00;N,4.63。实验值:C,89.13;H,6.06;N,4.66。
实施例5、制备1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二异丙基苯亚胺基)苊烯[L3]
1-[2-二(苯基)甲基萘亚胺基]苊酮(3.06g,6.46mmol)和2,6-二异丙基苯胺(1.26g,7.10mmol)溶于100mL甲苯溶液中,加入对甲苯磺酸(0.03g,0.13mmol),加热回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得橘黄色固体1.00g,产率:25.0%。熔点:183℃。
结构确证数据如下:FT-IR(KBr,cm-1):2969(w),2903(w),1666(w),1639(m),1591(w),1491(s),1378(s),1249(s),1151(w),1060(m),922(w),827(m),778(vs),722(vs),698(vs).1H NMR(400MHz,CDCl3,TMS):δ7.88(d,J=8.4Hz,1H),7.75–7.72(m,2H),7.69(d,J=8.8Hz,1H),7.59(d,J=8.4Hz,1H),7.43(t,J=7.2Hz,1H),7.34–7.16(m,11H),7.01(d,J=7.6Hz,2H),6.87(t,J=7.6Hz,1H),6.57(d,J=7.2Hz,1H),6.51(t,J=7.2Hz,2H),6.29(t,J=7.2Hz,1H),6.01(s,1H),5.69(d,J=7.2Hz,1H),3.32–3.23(m,1H),3.10–3.02(m,1H),1.36(d,J=6.4Hz,3H),1.29(d,J=6.8Hz,3H),0.96(d,J=6.8Hz,3H)。
13C NMR(100MHz,CDCl3,TMS):δ163.9,161.8,147.3,146.3,143.8,141.8,140.8,135.8,135.6,132.9,130.4,130.0,129.8,129.1,128.9,128.7,128.5,128.3,128.1,128.0,127.8,127.5,126.3,126.2,126.0,125.4,124.6,124.1,123.8,123.6,123.1,123.0,52.6,28.8,28.7,24.0,23.8,23.7,23.4。
元素分析:C47H40N2(632.83)理论值:C,89.20;H,6.37;N,4.43。实验值:C,89.14;H,6.27;N,4.24。
实施例6、制备1-[2-二(苯基)甲基萘亚胺基]-2-(2,4,6-三甲基苯亚胺基)苊烯[L4]
1-[2-二(苯基)甲基萘亚胺基]苊酮(2.92g,6.16mmol)和2,4,6-三甲基苯胺(0.92g,6.78mmol)溶于100mL甲苯溶液中,加入对甲苯磺酸(0.02g,0.12mmol),加热回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.49g,产率:13.5%。熔点:137℃。
结构确证数据如下:FT-IR(KBr,cm-1):3056(w),2958(w),1655(m),1635(m),1594(s),1473(s),1446(s),1374(s),1274(s),1154(w),1055(m)921(w),832(m),783(vs),742(vs),697(vs).1H NMR(400MHz,CDCl3,TMS):δ7.88(d,J=8.4Hz,1H),7.77–7.73(m,2H),7.68(d,J=8.4Hz,1H),7.61(d,J=8.0Hz,1H),7.43(t,J=7.2Hz,1H),7.34–7.28(m,4H),7.22(d,J=7.2Hz,1H),7.16(d,J=7.6Hz,2H),7.01(d,J=8.8Hz,4H),6.89(t,J=8.0Hz,1H),6.70(d,J=7.2Hz,1H),6.50(t,J=7.6Hz,2H),6.29(t,J=7.2Hz,1H),6.00(s,1H),5.72(d,J=7.2Hz,1H),2.40(s,3H),2.29(s,3H),2.16(s,3H)。
13C NMR(100MHz,CDCl3,TMS):δ163.9,161.6,146.9,146.2,143.7,141.9,140.6,133.2,132.9,130.4,130.0,129.8,129.3,129.1,128.8,128.4,128.3,128.1,127.9,127.7,127.5,126.3,126.1,126.0,125.3,124.9,124.7,124.0,123.9,123.5,123.2,122.2,52.6,21.1,18.3,18.1。
元素分析:C44H34N2(590.75)理论值:C,89.46;H,5.80;N,4.74。实验值:C,89.23;H,6.17;N,4.53。
实施例7、制备1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二乙基-4-甲基苯亚胺基)苊烯[L5]
1-[2-二(苯基)甲基萘亚胺基]苊酮(2.92g,6.16mmol)和2,6-二乙基-4-甲基苯胺(1.11g,6.78mmol)溶于100mL甲苯溶液中,加入对甲苯磺酸(0.02g,0.12mmol),加热回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.75g,产率:19.7%。熔点:154℃。
结构确证数据如下:FT-IR(KBr,cm-1):3057(w),2964(m),1661(m),1639(m),1595(m),1491(m),1453(s),1373(s),1271(s),1155(m),1029(w),921(w),827(m),777(vs),743(vs),698(vs)。
1H NMR(400MHz,CDCl3,TMS):δ7.87(d,J=8.0Hz,1H),7.73(d,J=8.0Hz,2H),7.68(d,J=8.4Hz,1H),7.59(d,J=8.4Hz,1H),7.43(t,J=7.2Hz,1H),7.32–7.16(m,8H),7.07–7.01(m,4H),6.87(t,J=8.0Hz,1H),6.68(d,J=7.2Hz,1H),6.51(t,J=7.2Hz,2H),6.30(t,J=7.2Hz,1H),6.01(s,1H),5.70(d,J=7.2Hz,1H),2.79–2.70(m,1H),2.66–2.56(m,2H),2.48–2.39(m,4H),1.26(t,J=7.6Hz,3H),1.15(t,J=7.6Hz,3H).13CNMR(100MHz,CDCl3,TMS):δ163.8,161.7,146.3,146.0,143.8,141.8,140.6,133.4,130.8,130.6,129.9,129.7,129.3,128.7,128.4,128.1,128.0,127.7,127.5,127.4,126.3,126.1,126.0,125.3,124.0,123.9,123.5,123.1,122.7,52.6,25.0,24.7,21.4,14.7,14.1。
元素分析:C46H38N2(618.81)理论值:C,89.28;H,6.19;N,4.53。实验值:C,88.86;H,6.06;N,4.48。
实施例8、制备{1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二甲基苯亚胺基)苊}合溴化镍(II)[配合物C1]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.14g。产率:70.4%.
结构确证数据如下:FT-IR(KBr,cm-1):3056(w),2973(w),1644(w),1622(m),1599(s),1492(s),1376(m),1293(m),1151(w),1029(m),918(w),828(m),772(vs),744(vs),694(vs)。
元素分析:C43H32Br2N2Ni(795.23)理论值:C,64.94;H,4.06;N,3.52。实验值:C,64.82;H,3.95;N,3.81。
实施例9、制备{1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二乙基苯亚胺基)苊}合溴化镍(II)[配合物C2]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二乙基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到红色固体0.19g。产率:78.0%.
结构确证数据如下:FT-IR(KBr,cm-1):3057(w),2973(w),1648(w),1618(m),1581(s),1491(s),1374(s),1291(s),1154(w),1051(m),914(w),832(m),782(vs),733(vs),700(vs)。
元素分析:C45H36Br2N2Ni(823.28)理论值:C,65.65;H,4.41;N,3.40。实验值:C,65.55;H,4.53;N,3.43。
配合物C1的晶体结构图如图2所示。
实施例10、制备{1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二异丙基苯亚胺基)苊}合溴化镍(II)[配合物C3]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二异丙基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到红色固体0.18g。产率:72.0%.
结构确证数据如下:FT-IR(KBr,cm-1):2967(w),2901(w),1646(w),1620(m),1582(s),1493(s),1383(s),1293(s),1183(w),1052(m),957(w),830(m),775(vs),724(vs),698(vs)。
元素分析:C47H40Br2N2Ni(851.34)理论值:C,66.31;H,4.74;N,3.29。实验值:C,65.98;H,4.97;N,3.26。
实施例11、制备{1-[2-二(苯基)甲基萘亚胺基]-2-(2,4,6-三甲基苯亚胺基)苊}合溴化镍(II)[配合物C4]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-[2-二(苯基)甲基萘亚胺基]-2-(2,4,6-三甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.19g。产率:76.1%.
结构确证数据如下:FT-IR(KBr,cm-1):3058(w),2974(w),1647(m),1622(m),1583(s),1487(s),1373(s),1291(s),1154(m),1030(s),917(m),827(m),772(vs),749(vs),697(vs)。
元素分析:C44H34Br2N2Ni(809.26)理论值:C,65.30;H,4.23;N,3.46。实验值:C,65.45;H,4.49;N,3.48。
配合物C4的晶体结构图如图3所示。
实施例12、制备{1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二乙基-4-甲基苯亚胺基)苊}合溴化镍(II)[配合物C5]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-[2-二(苯基)甲基萘亚胺基]-2-(2,6-二乙基-4-甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.10g。产率:38.1%.
结构确证数据如下:FT-IR(KBr,cm-1):3057(w),2967(w),1647(w),1622(m),1582(s),1491(s),1452(s),1376(s),1294(s),1158(w),1031(m),961(w),828(m),774(vs),748(vs),700(vs)。
元素分析:C46H38Br2N2Ni(837.31)理论值:C,65.98;H,4.57;N,3.35。实验值:C,65.59;H,4.62;N,3.38。
实施例13、制备2,4-二[二(苯基)]甲基萘胺
1-萘胺(10g,63.84mmol),二(苯基)甲醇(8.84g,34.92mmol),无水ZnCl2(5g,36.68mmol)分别加入到圆底烧瓶中,油浴加热,控温在150℃左右。反应8h。停止加热冷却后加入DCM溶解,用硅藻土过滤,除去溶剂,剩余物用石油醚和乙酸乙酯的体积比为100:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得紫红色粉末1.38g,产率4.5%
结构确证数据如下:1H NMR(400MHz,CDCl3,TMS):δ7.82(d,J=8.8Hz,2H),7.46-7.38(m,3H),6.92-6.86(m,16H),6.84-6.80(m,4H),6.08(s,1H),6.01(s,2H),5.62(s,1H),4.13(s,2H)。
13C NMR(100MHz,CDCl3,TMS):δ163.1,162.7,160.9,160.7,139.7,138.5,138.4,132.2,130.7,130.4,129.5,127.0,126.4,123.9,121.7,115.8,115.6,115.3,51.4,51.1。
实施例14、制备1-{2,4-二[二(苯基)]甲基萘亚胺基}苊酮
苊醌(0.73g,4mmol)和2,4-二[二(苯基)]甲基萘胺(1.90g,4mmol)溶于适量乙醇和二氯甲烷的混合溶剂中,加入对甲苯磺酸(0.015g,0.08mmol),室温搅拌24h。除去溶剂,剩余物用石油醚和乙酸乙酯的体积比为80:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得到红色粉末1.3g,产率50.8%。
结构确证数据如下:1H NMR(400MHz,CDCl3,TMS):δ7.92(d,J=8.4Hz,1H),7.81(d,J=8.4Hz,2H),7.74(d,J=8.0Hz,1H),7.44–7.31(m,4H),7.22(t,J=8.2Hz,2H),7.05(t,J=8.6Hz,3H),7.02–6.93(m,7H),6.86–6.80(m,5H),6.64(d,J=7.2Hz,1H),6.49(s,1H),6.22(d,J=8.6Hz,2H),5.41(s,1H),5.39(s,1H)。
13C NMR(100MHz,CDCl3,TMS):δ164.8,162.9,161.3,140.7,138.8,129.7,128.2,127.8,127.4,126.3,123.9,51.8,50.8。
实施例15、制备1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二甲基苯亚胺基)苊烯[L6]
1-{2,4-二[二(苯基)]甲基萘亚胺基}苊酮(1.280g,2.00mmol)和2,6-二甲基苯胺(0.267g,2.20mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.008g,0.04mmol),加热回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为150:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.32g,产率:21.5%。
结构确证数据如下:FT-IR(KBr,cm-1):2867(w),2740(w),1881(w),1667(m),1635(m),1598(m),1511(vs),1245(vs),1156(s),1023(m),825(vs),771(vs),726(m).1HNMR(400MHz,CDCl3,TMS):δ7.97.94(d,J=8.4Hz,1H),7.83(d,J=8.4Hz,2H),7.73(d,J=8.0Hz,1H),7.43–7.29(m,4H),7.20(t,J=8.2Hz,2H),7.03(t,J=8.6Hz,3H),6.99–6.91(m,7H),6.88–6.82(m,5H),6.79(t,J=7.0Hz,2H),6.67(d,J=7.2Hz,1H),6.49(s,1H),6.24(s,1H),6.20(d,J=8.6Hz,2H),5.85(s,1H),5.79(d,J=7.2Hz,1H),2.28(s,3H),2.20(s,3H)。
13C NMR(100MHz,CDCl3,TMS):δ164.0,162.4,161.4,140.8,139.6,130.7,129.4,128.7,127.3,126.1,124.7,123.9,122.5,115.3,114.3,51.8,50.8,18.3,18.1。
元素分析:C56H42N2(742.95)理论值:C,90.53;H,5.70;N,3.77。实验值:C,90.42;H,6.12;N,3.81。
实施例16、制备1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二乙基苯亚胺基)苊烯[L7]
1-{2,4-二[二(苯基)]甲基萘亚胺基}苊酮(1.280g,2.00mmol)和2,6-二乙基苯胺(0.328g,2.20mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.008g,0.04mmol),加热回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为150:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.43g,产率:27.9%。
结构确证数据如下:FT-IR(KBr,cm-1):2963(w),2935(w),2873(w),1894(w),1663(m),1638(m),1604(m),1514(vs),1222(vs),1157(s),1019(m),828(vs),772(vs),734(m)。
1H NMR(400MHz,CDCl3,TMS):δ7.95(d,J=8.4Hz,1H),7.81(d,J=8.0Hz,2H),7.73(d,J=8.4Hz,1H),7.42(t,J=7.4Hz,1H),7.36–7.30(m,2H),7.27–7.20(m,2H),7.07(t,J=6.0Hz,2H),7.01(t,J=8.4Hz,2H),6.97–6.87(m,8H),6.85(t,J=6.2Hz,4H),6.73(t,J=6.6Hz,2H),6.65(d,J=7.2Hz,1H),6.48(s,1H),6.25(s,1H),6.19(t,J=8.2Hz,2H),5.84(s,1H),5.79(d,J=7.2Hz,1H),2.77–2.69(m,1H),2.67–2.56(m,2H),2.53–2.45(m,1H),1.27(t,J=7.2Hz,6H).13C NMR(100MHz,CDCl3,TMS):δ164.1,162.7,161.4,160.4,148.5,145.3,140.8,139.6,138.8,135.2,130.6,129.7,128.9,127.4,126.2,124.5,123.8,115.2,114.4,51.4,50.9,24.8,24.7,14.4,14.2。
元素分析:C58H46N2(771.00)理论值:C,90.35;H,6.01;N,3.63。实验值:C,90.12;H,5.98;N,4.03。
实施例17、制备1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二异丙基苯亚胺基)苊烯[L8]
1-{2,4-二[二(苯基)]甲基萘亚胺基}苊酮(1.280g,2.00mmol)和2,6-二异丙基苯胺(0.390g,2.20mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.008g,0.04mmol),加热回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为150:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.40g,产率:25.0%。
结构确证数据如下:FT-IR(KBr,cm-1):2944(w),2923(w),2866(w),1883(w),1665(m),1641(w),1600(m),1515(vs),1233(vs),1163(s),1028(w),833(s),772(vs),729(m)。
1H NMR(400MHz,CDCl3,TMS):δ7.96(d,J=8.4Hz,1H),7.81(d,J=6.0Hz,2H),7.73(d,J=8.4Hz,1H),7.42(t,J=7.4Hz,1H),7.35(t,J=7.4Hz,5H),7.11(t,J=6.4Hz,2H),7.03(t,J=8.4Hz,2H),6.98–6.81(m,11H),6.77(t,J=6.4Hz,2H),6.59(d,J=7.2Hz,1H),6.46(s,1H),6.25(s,1H),6.18(t,J=8.4Hz,2H),5.82(s,1H),5.75(d,J=7.2Hz,1H),3.22–3.14(m,1H),3.09–3.01(m,1H),1.36(d,J=6.8Hz,3H),1.29(d,J=6.8Hz,3H),1.15(d,J=6.8Hz,3H),0.99(d,J=6.8Hz,3H).
13C NMR(100MHz,CDCl3,TMS):δ164.1,162.7,162.4,161.8,161.4,160.5,160.3,147.2,145.1,140.5,139.7,135.2,130.4,130.1,128.6,128.3,126.5,125.8,124.6,124.3,123.7,123.2,115.2,114.7,51.2,50.7,28.6,28.4,23.7,23.5,23.3,23.1。
实施例18、制备1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,4,6-三甲基苯亚胺基)苊烯[L9]
1-{2,4-二[二(苯基)]甲基萘亚胺基}苊酮(1.280g,2.00mmol)和2,4,6-三甲基苯胺(0.297g,2.20mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.008g,0.04mmol),加热回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为150:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.39g,产率:25.8%。
结构确证数据如下:FT-IR(KBr,cm-1):2966(w),2931(w),2857(w),1896(w),1668(m),1636(m),1597(m),1509(vs),1229(vs),1164(s),1011(m),822(s),775(s),722(m)。
1H NMR(400MHz,CDCl3,TMS):δ7.87(d,J=8.4Hz,1H),7.74(d,J=8.4Hz,2H),7.65(d,J=8.0Hz,1H),7.32(t,J=6.2Hz,1H),7.25–7.19(m,2H),7.01(t,J=6.8Hz,2H),6.95–6.91(m,4H),6.89–6.83(m,7H),6.81–6.74(m,4H),6.69(t,J=6.8Hz,2H),6.65(d,J=7.2Hz,1H),6.37(s,1H),6.12(s,1H),6.09(t,J=8.4Hz,2H),5.76(s,1H),5.67(d,J=7.2Hz,1H),2.33(s,3H),2.17(s,3H),2.06(s,3H)。
13C NMR(100MHz,CDCl3,TMS):δ164.2,162.7,162.4,161.3,160.4,159.4,146.9,145.5,140.7,139.4,137.7,133.5,132.3,130.8,129.5,127.3,126.1,124.4,123.7,115.2,114.8,51.5,51.1,21.2,19.1,18.0。
元素分析:C57H44N2(756.97)理论值:C,90.44;H,5.86;N,3.70。实验值:C,90.17;H,5.87;N,3.32。
实施例19、制备1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二乙基-4-甲基苯亚胺基)苊烯[L10]
1-{2,4-二[二(苯基)]甲基萘亚胺基}苊酮(1.280g,2.00mmol)和2,6-二乙基-4-甲基苯胺(0.359g,2.20mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.008g,0.04mmol),加热回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为150:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.47g,产率:29.9%。
结构确证数据如下:FT-IR(KBr,cm-1):2959(w),2924(w),2861(w),1895(w),1661(m),1637(m),1607(m),1505(vs),1223(vs),1166(s),1017(w),831(vs),777(vs),732(m)。
1H NMR(400MHz,CDCl3,TMS):δ7.96(d,J=8.4Hz,1H),7.81(d,J=8.4Hz,2H),7.74(d,J=8.4Hz,1H),7.41–7.33(m,2H),7.34–7.25(m,1H),7.06–6.95(m,6H),6.91–6.85(m,7H),6.83–6.79(m,4H),6.77–6.73(m,2H),6.70(d,J=6.8Hz,1H),6.49(s,1H),6.23(s,1H),6.16(t,J=8.4Hz,2H),5.85(s,1H),5.72(d,J=6.8Hz,1H),2.76–2.65(m,2H),2.63–2.51(m,2H),2.46(s,3H),1.25(t,J=7.6Hz,3H),1.16(t,J=7.4Hz,3H)。
13C NMR(100MHz,CDCl3,TMS):δ164.3,163.0,161.4,160.6,146.1,140.5,138.6,135.6,133.8,131.1,130.5,129.6,127.8,124.2,115.8,114.7,51.6,51.0,25.3,24.7,21.7,14.5,14.0。
元素分析:C59H48N2(785.03)理论值:C,90.27;H,6.16;N,3.57。实验值:C,89.94;H,6.08;N,3.89。
实施例20、制备1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二甲基苯亚胺基)苊合溴化镍(II)[配合物C6]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.14g,产率:72.9%.
结构确证数据如下:FT-IR(KBr,cm-1):2932(w),2867(w),1886(w),1649(w),1624(m),1595(m),1498(vs),1227(vs),1136(s),1023(m),826(s),776(vs),745(m)。
元素分析:C56H42Br2N2Ni(961.45)理论值:C,69.96;H,4.40;N,2.91。实验值:C,69.57;H,3.97;N,2.83。
实施例21、制备1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二乙基苯亚胺基)苊合溴化镍(II)[配合物C7]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二乙基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.17g,产率:85.9%.
结构确证数据如下:FT-IR(KBr,cm-1):2956(w),2879(w),1904(w),1647(w),1622(m),1594(m),1502(vs),1233(vs),1145(s),1026(m),832(s),779(m),733(m)。
元素分析:C58H46Br2N2Ni(989.50)理论值:C,70.40;H,4.69;N,2.83。实验值:C,69.87;H,4.23;N,2.38。
实施例22、制备1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二异丙基苯亚胺基)苊合溴化镍(II)[配合物C8]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二异丙基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.18g,产率:88.7%.
结构确证数据如下:FT-IR(KBr,cm-1):2965(w),2907(w),2873(w),1888(w),1644(w),1621(m),1591(m),1504(vs),1221(s),1157(s),1016(w),825(s),772(s),729(w)。
元素分析:C60H50Br2N2Ni(1017.55)理论值:C,70.82;H,4.95;N,2.75。实验值:C,70.93;H,4.86;N,2.31。
实施例23、制备1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,4,6-三甲基苯亚胺基)苊合溴化镍(II)[配合物C9]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,4,6-三甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.12g,产率:61.5%.
结构确证数据如下:FT-IR(KBr,cm-1):2958(w),2911(w),2869(w),1900(w),1647(w),1624(m),1597(m),1511(vs),1230(vs),1148(s),1018(m),827(vs),777(s),723(w)。
元素分析:C57H44Br2N2Ni(975.47)理论值:C,70.18;H,4.55;N,2.87。实验值:C,70.02;H,4.37;N,3.12。
实施例24、制备1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二乙基-4-甲基苯亚胺基)苊合溴化镍(II)[配合物C10]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-{2,4-二[二(苯基)]甲基萘亚胺基}-2-(2,6-二乙基-4-甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.15g,产率:75.0%.
结构确证数据如下:FT-IR(KBr,cm-1):2974(w),2928(w),2881(w),1905(w),1645(w),1622(w),1599(m),1508(vs),1226(vs),1152(s),1016(w),829(s),774(m),727(w)。
元素分析:C59H48Br2N2Ni(1003.53)理论值:C,70.61;H,4.82;N,2.79。实验值:C,70.38;H,4.78;N,2.47。
实施例25、制备2-二(对氟苯基)甲基萘胺
1-萘胺(5g,34.92mmol),二(对氟苯基)甲醇(7.69g,34.92mmol),无水ZnCl2(2.5g,17.46mmol)分别加入到圆底烧瓶中,油浴加热,控温在150℃左右。反应8h。停止加热冷却后加入DCM溶解,用硅藻土过滤,除去溶剂,剩余物用石油醚和乙酸乙酯的体积比为150:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色油状物1.23g,产率24.8%。
结构确证数据如下:1H NMR(400MHz,CDCl3,TMS):δ7.77-7.75(m,2H),7.44-7.42(m,2H),7.22(d,J=8.4Hz,1H),7.09-6.96(m,2H),6.80(d,J=8.4Hz,1H),5.64(s,1H),4.07(s,2H)。
13C NMR(100MHz,CDCl3,TMS):δ162.9,162.7,160.6,160.3,139.7,138.2,137.1,131.3,130.5,130.1,126.1,125.1,124.2,121.4,115.7,115.3,115.1,50.3。
实施例26、制备1-[2-二(对氟苯基)甲基萘亚胺基]苊酮
苊醌(0.73g,4mmol)和2-二(对氟苯基)甲基萘胺(1.38g,4mmol)溶于适量乙醇和二氯甲烷的混合溶剂中,加入对甲苯磺酸(0.015g,0.08mmol),室温搅拌24h。除去溶剂,剩余物用石油醚和乙酸乙酯的体积比为80:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得到红色粉末0.7g,产率34%。
结构确证数据如下:1H NMR(400MHz,CDCl3,TMS):δ7.90(d,J=8.0Hz,1H),7.81–7.77(m,2H),7.73(d,J=8.4Hz,1H),7.65(d,J=8.0Hz,1H),7.39(t,J=8.0Hz,2H),7.34–7.09(m,7H),7.03(d,J=8.0Hz,1H),6.88(t,J=8.0Hz,1H),6.50(t,J=7.6Hz,2H),5.56(s,1H)。
13C NMR(100MHz,CDCl3,TMS):δ165.2,163.3,148.7,144.8,142.9,140.9,140.4,131.2,128.8,128.5,128.1,128.0,127.7,127.3,127.1,126.6,126.1,125.8,125.5,125.1,124.7,124.5,123.8,123.5,122.4,121.7,52.7。
实施例27、制备1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二甲基苯亚胺基)苊烯[L11]
1-[2-二(对氟苯基)甲基萘亚胺基]苊酮(1.019g,2.00mmol)和2,6-二甲基苯胺(0.267g,2.20mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.008g,0.04mmol),加热回流,反应8h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.16g,产率:13.1%。
结构确证数据如下:FT-IR(KBr,cm-1):3057(w),3041(w),2958(w),1663(m),1639(m),1592(s),1495(s),1376(m),1267(m),1158(w),1025(m),923(w),829(m),775(vs),746(s),697(vs)。
1H NMR(400MHz,CDCl3,TMS):δ7.86(d,J=8.0Hz,1H),7.75–7.73(m,2H),7.66(d,J=8.4Hz,1H),7.58(d,J=8.0Hz,1H),7.41(t,J=8.0Hz,2H),7.31–7.06(m,9H),7.00(d,J=8.0Hz,1H),6.88(t,J=8.0Hz,1H),6.61(d,J=7.2Hz,1H),6.49(t,J=7.6Hz,2H),6.26(t,J=7.6Hz,1H),6.00(s,1H),5.71(d,J=7.2Hz,1H),2.32(s,3H),2.20(s,3H)。
13C NMR(100MHz,CDCl3,TMS):δ163.9,161.4,149.7,145.8142.7,141.1,140.0,131.7,130.1,129.3,128.5,128.2,127.9,127.6,127.2,126.5,126.1,125.8,125.5,125.3,125.2,125.0,124.8,124.7,124.4,124.1,123.8,123.5,123.3,122.9,122.2,121.8,52.7,18.4,18.2。
元素分析:C43H30F2N2(612.71)理论值:C,84.29;H,4.94;N,4.57。实验值:C,84.31;H,4.78;N,4.65。
实施例28、制备1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二乙基苯亚胺基)苊烯[L12]
1-[2-二(对氟苯基)甲基萘亚胺基]苊酮(1.019g,2.00mmol)和2,6-二乙基苯胺(0.328g,2.20mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.008g,0.04mmol),加热至回流,反应8h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.17g,产率:13.3%。
结构确证数据如下:FT-IR(KBr,cm-1):3055(w),3043(w),2962(w),1665(m),1637(m),1594(m),1497(m),1375(s),1265(m),1151(w),1048(m),922(w),828(m),779(vs),745(s),696(vs)。
1H NMR(400MHz,CDCl3,TMS):δ7.85(d,J=8.0Hz,1H),7.74–7.71(m,2H),7.67(d,J=8.8Hz,1H),7.60(d,J=8.4Hz,1H),7.42(t,J=7.2Hz,1H),7.30–7.13(m,9H),7.01(d,J=7.2Hz,2H),6.88(t,J=7.6Hz,1H),6.61(d,J=7.2Hz,1H),6.50(t,J=7.6Hz,2H),6.24(t,J=7.6Hz,1H),5.94(s,1H),5.70(d,J=7.2Hz,1H),2.84–2.76(m,1H),2.70–2.61(m,2H),2.50–2.42(m,1H),1.26(t,J=7.6Hz,3H),1.15(t,J=7.2Hz,3H)。
13C NMR(100MHz,CDCl3,TMS):δ163.8,161.5,148.3,146.0,143.5,141.1,140.0,132.3,131.0,130.5,130.3,130.0,129.1,128.9,128.6,128.3,127.9,127.3,127.1,126.8,126.5,126.1,125.9,125.4,125.1,124.8,124.2,123.9,123.7,123.5,123.0,122.4,52.4,25.0,24.5,14.4,14.0。
元素分析:C45H34F2N2(640.76)理论值:C,84.35;H,5.35;N,4.37。实验值:C,84.29;H,5.41;N,4.64。
实施例29、制备1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二异丙基苯亚胺基)苊烯[L13]
1-[2-二(对氟苯基)甲基萘亚胺基]苊酮(1.019g,2.00mmol)和2,6-二异丙基苯胺(0.390g,2.20mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.008g,0.04mmol),加热至回流,反应8h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.19g,产率:14.2%。
结构确证数据如下:FT-IR(KBr,cm-1):3051(w),2969(w),2907(w),1666(w),1635(m),1591(m),1492(s),1377(s),1253(s),1155(w),1054(m),925(w),829(m),778(vs),732(s),698(vs)。
1H NMR(400MHz,CDCl3,TMS):δ7.86(d,J=8.4Hz,1H),7.75–7.71(m,2H),7.68(d,J=8.8Hz,1H),7.59(d,J=8.4Hz,1H),7.41(t,J=7.2Hz,1H),7.33–7.14(m,9H),7.00(d,J=7.6Hz,2H),6.85(t,J=7.6Hz,1H),6.54(d,J=7.2Hz,1H),6.51(t,J=7.2Hz,2H),6.27(t,J=7.2Hz,1H),5.97(s,1H),5.64(d,J=7.2Hz,1H),3.32–3.22(m,1H),3.11–3.03(m,1H),1.34(d,J=6.4Hz,3H),1.27(d,J=6.8Hz,3H),0.98(d,J=6.8Hz,3H)。
13C NMR(100MHz,CDCl3,TMS):δ163.9,161.8,147.1,146.4,143.6,141.4,140.1,135.2,135.0,132.5,130.1,129.6,129.2,129.0,128.5,128.3,128.0,127.8,127.4,127.1,126.8,126.5,126.2,126.1,125.9,125.2,124.3,124.1,123.5,123.2,123.0,122.9,52.5,28.7,28.6,24.2,23.8,23.6,23.4。
元素分析:C47H38F2N2(668.81)理论值:C,84.40;H,5.73;N,4.19。实验值:C,84.21;H,5.32;N,4.34。
实施例30、制备1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,4,6-三甲基苯亚胺基)苊烯[L14]
1-[2-二(对氟苯基)甲基萘亚胺基]苊酮(1.019g,2.00mmol)和2,4,6-三甲基苯胺(0.297g,2.20mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.008g,0.04mmol),加热回流,反应8h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.23g,产率:18.4%。
结构确证数据如下:FT-IR(KBr,cm-1):3056(w),2959(w),1661(m),1637(m),1596(m),1483(s),1446(s),1371(s),1272(s),1147(w),1045(m)921(w),833(m),785(vs),742(s),697(vs)。
1H NMR(400MHz,CDCl3,TMS):δ7.88(d,J=8.4Hz,1H),7.76–7.73(m,2H),7.67(d,J=8.4Hz,1H),7.61(d,J=8.0Hz,1H),7.42(t,J=7.2Hz,1H),7.33–7.26(m,4H),,7.01(d,J=8.8Hz,4H),6.90(t,J=8.0Hz,1H),6.71(d,J=7.2Hz,1H),6.52(t,J=7.6Hz,2H),6.28(t,J=7.2Hz,1H),6.03(s,1H),5.74(d,J=7.2Hz,1H),2.41(s,3H),2.30(s,3H),2.18(s,3H)。
13C NMR(100MHz,CDCl3,TMS):δ163.9,161.6,146.7,146.1,143.5,141.9,140.8,133.1,132.6,130.5,130.0,129.9,129.2,129.0,128.9,128.3,128.2,128.1,127.7,127.6,127.4,126.4,126.0,125.9,125.3,125.1,124.9,124.0,123.8,123.5,123.3,122.4,52.6,21.3,18.5,18.3。
元素分析:C44H32F2N2(626.74)理论值:C,84.32;H,5.15;N,4.47。实验值:C,84.28;H,5.45;N,4.08。
实施例31、制备1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二乙基-4-甲基苯亚胺基)苊烯[L15]
1-[2-二(对氟苯基)甲基萘亚胺基]苊酮(1.019g,2.00mmol)和2,6-二乙基-4-甲基苯胺(0.359g,2.20mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.008g,0.04mmol),加热回流,反应8h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.18g,产率:13.8%。
结构确证数据如下:FT-IR(KBr,cm-1):3055(w),2964(m),1665(m),1638(m),1592(m),1483(m),1457(s),1376(s),1266(s),1154(m),1036(w),924(w),827(m),777(vs),743(s),698(vs)。
1H NMR(400MHz,CDCl3,TMS):δ7.87(d,J=8.0Hz,1H),7.72(d,J=8.0Hz,2H),7.69(d,J=8.4Hz,1H),7.58(d,J=8.4Hz,1H),7.41(t,J=7.2Hz,1H),7.32–7.17(m,6H),7.05–7.00(m,4H),6.86(t,J=8.0Hz,1H),6.69(d,J=7.2Hz,1H),6.53(t,J=7.2Hz,2H),6.32(t,J=7.2Hz,1H),6.01(s,1H),5.73(d,J=7.2Hz,1H),2.77–2.70(m,1H),2.64–2.56(m,2H),2.49–2.38(m,4H),1.25(t,J=7.6Hz,3H),1.15(t,J=7.6Hz,3H)。
13C NMR(100MHz,CDCl3,TMS):δ163.8,161.7,146.1,145.9,143.6,141.5,140.8,133.7,131.2,130.5,129.8,129.7,129.4,128.8,128.3,128.1,128.0,127.9,127.4,127.3,126.5,126.2,126.0,125.4,124.1,124.0,123.6,123.3,122.8,52.6,25.2,24.9,21.3,14.7,14.3。
元素分析:C46H36F2N2(654.79)理论值:C,84.38;H,5.54;N,4.28。实验值:C,84.15;H,5.66;N,4.65。
实施例32、制备{1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二甲基苯亚胺基)苊}合溴化镍(II)[配合物C11]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.10g。产率:60.2%.
结构确证数据如下:FT-IR(KBr,cm-1):3058(w),3047(w),2976(w),1654(w),1623(m),1601(m),1487(s),1374(m),1298(m),1156(w),1033(m),917(w),824(m),772(vs),741(s),695(vs)。
元素分析:C43H30Br2F2N2Ni(831.21)理论值:C,62.13;H,3.64;N,3.37。实验值:C,62.02;H,3.95;N,3.51。
实施例33、制备{1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二乙基苯亚胺基)苊}合溴化镍(II)[配合物C12]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二乙基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.14g。产率:81.4%.
结构确证数据如下:FT-IR(KBr,cm-1):3055(w),2965(w),1649(w),1626(m),1592(m),1491(s),1378(s),1293(s),1154(w),1044(m),916(w),822(m),781(vs),740(s),693(vs)。
元素分析:C45H34Br2F2N2Ni(859.26)理论值:C,62.90;H,3.99;N,3.26。实验值:C,62.82;H,3.95;N,3.48。
实施例34、制备{1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二异丙基苯亚胺基)苊}合溴化镍(II)[配合物C13]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二异丙基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.16g。产率:90.4%.
结构确证数据如下:FT-IR(KBr,cm-1):3047(w),2961(w),2896(w),1646(w),1625(m),1589(m),1493(s),1385(s),1297(s),1176(w),1056(m),951(w),827(m),775(vs),736(m),698(vs)。
元素分析:C47H38Br2F2N2Ni(887.32)理论值:C,63.62;H,4.32;N,3.16。实验值:C,63.86;H,3.91;N,3.34。
实施例35、制备{1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,4,6-三甲基苯亚胺基)苊}合溴化镍(II)[配合物C14]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,4,6-三甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.14g。产率:82.8%.
结构确证数据如下:FT-IR(KBr,cm-1):3058(w),2985(w),1647(m),1619(m),1594(m),1485(s),1373(s),1294(s),1162(m),1048(s),937(m),834(m),782(vs),739(s),696(vs)。
元素分析:C44H32Br2F2N2Ni(845.24)理论值:C,62.52;H,3.82;N,3.31。实验值:C,62.28;H,3.45;N,3.67。
实施例36、制备{1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二乙基-4-甲基苯亚胺基)苊}合溴化镍(II)[配合物C15]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-[2-二(对氟苯基)甲基萘亚胺基]-2-(2,6-二乙基-4-甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.12g。产率:68.6%.
结构确证数据如下:FT-IR(KBr,cm-1):3055(w),2978(w),1644(w),1623(m),1592(m),1491(s),1438(s),1375(s),1298(s),1169(w),1046(m),945(w),828(m),775(vs),741(s),697(vs)。
元素分析:C46H36Br2F2N2Ni(873.29)理论值:C,63.27;H,4.16;N,3.21。实验值:C,63.52;H,3.95;N,3.04。
实施例37、制备2,4-二[二(对氟苯基)]甲基萘胺
1-萘胺(4.7g,32.88mmol),二(对氟苯基)甲醇(7.24g,32.88mmol),无水ZnCl2(2.3g,16.44mmol)分别加入到圆底烧瓶中,油浴加热,控温在150℃左右。反应8h。停止加热冷却后加入DCM溶解,用硅藻土过滤,除去溶剂,剩余物用石油醚和乙酸乙酯的体积比为150:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得橘黄色固体3.61g,产率20%,
结构确证数据如下:1H NMR(400MHz,CDCl3,TMS):δ7.82(d,J=8.8Hz,2H),7.46-7.38(m,3H),6.91-6.86(m,16H),6.08(s,1H),6.02(s,2H),5.56(s,1H),4.15(s,2H)。
13C NMR(100MHz,CDCl3,TMS):δ163.0,162.7,160.6,160.3,139.7,138.2,138.1,131.3,130.8,130.1,129.5,126.1,125.1,124.2,121.4,115.7,115.3,115.1,51.4,50.9。
实施例38、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}苊酮
苊醌(0.73g,4mmol)和2,4-二[二(对氟苯基)]甲基萘胺(2.19g,4mmol)溶于适量乙醇和二氯甲烷的混合溶剂中,加入对甲苯磺酸(0.015g,0.08mmol),室温搅拌24h。除去溶剂,剩余物用石油醚和乙酸乙酯的体积比为80:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得到红色粉末1.5g,产率53%。
结构确证数据如下:1H NMR(400MHz,CDCl3,TMS):δ8.12(t,J=8.8Hz,2H),7.93(d,J=8.4Hz,1H),7.85–7.77(m,2H),7.67(d,J=8.0Hz,1H),7.39(t,J=7.6Hz,1H),7.29–7.26(m,1H),7.06–7.00(m,5H),6.94–6.87(m,4H),6.80(d,J=7.2Hz,4H),6.67–6.64(m,2H),6.47(s,1H),6.20(s,1H),6.13(t,J=8.4Hz,2H),5.78(d,J=7.6Hz,1H),5.66(s,1H)。
13C NMR(100MHz,CDCl3,TMS):δ164.0,162.4,161.3,140.1,139.4,130.5,129.4,128.3,127.5,126.3,124.4,123.7,122.6,115.1,114.3,51.3,50.6。
实施例39、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二甲基苯亚胺基)苊烯[L16]
1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}苊酮(1.247g,1.78mmol)和2,6-二甲基苯胺(0.215g,1.78mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.007g,0.04mmol),加热至回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.21g,产率:13.8%。
结构确证数据如下:FT-IR(KBr,cm-1):2864(w),2730(w),1888(w),1669(m),1635(m),1600(s),1504(vs),1225(vs),1156(s),1017(m),821(vs),771(vs),723(m)。
1H NMR(400MHz,CDCl3,TMS):δ7.93(d,J=8.4Hz,1H),7.81(d,J=8.4Hz,2H),7.72(d,J=8.0Hz,1H),7.41–7.28(m,4H),7.20(t,J=8.2Hz,2H),7.00(t,J=8.6Hz,3H),6.96–6.89(m,5H),6.86–6.81(m,5H),6.76(t,J=7.0Hz,2H),6.65(d,J=7.2Hz,1H),6.47(s,1H),6.21(s,1H),6.17(d,J=8.6Hz,2H),5.83(s,1H),5.78(d,J=7.2Hz,1H),2.27(s,3H),2.18(s,3H)。
13C NMR(100MHz,CDCl3,TMS):δ164.0,162.4,161.3,140.5,139.4,130.5,129.1,128.3,127.1,126.0,124.5,123.7,122.4,115.1,114.3,51.4,50.8,18.2,18.0。
元素分析:C56H38F4N2(814.91)理论值:C,82.54;H,4.70;N,3.44。实验值:C,82.15;H,4.56;N,3.65。
实施例40、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二乙基苯亚胺基)苊烯[L17]
1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}苊酮(0.711g,1.00mmol)和2,6-二乙基苯胺(0.156g,1.10mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.004g,0.02mmol),加热至回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.30g,产率:35.9%。
结构确证数据如下:FT-IR(KBr,cm-1):2963(w),2927(w),2870(w),1890(w),1668(m),1636(m),1599(s),1504(vs),1224(vs),1157(s),1016(m),820(vs),772(vs),723(m)。
1H NMR(400MHz,CDCl3,TMS):δ7.93(d,J=8.4Hz,1H),7.80(d,J=8.0Hz,2H),7.71(d,J=8.4Hz,1H),7.39(t,J=7.4Hz,1H),7.34–7.29(m,2H),7.27–7.20(m,2H),7.07(t,J=6.0Hz,2H),7.01(t,J=8.4Hz,2H),6.97–6.87(m,6H),6.83(t,J=6.2Hz,4H),6.74(t,J=6.6Hz,2H),6.63(d,J=7.2Hz,1H),6.48(s,1H),6.22(s,1H),6.18(t,J=8.2Hz,2H),5.84(s,1H),5.76(d,J=7.2Hz,1H),2.77–2.68(m,1H),2.66–2.55(m,2H),2.50–2.40(m,1H),1.25(t,J=7.2Hz,6H)。
13C NMR(100MHz,CDCl3,TMS):δ164.1,162.7,161.2,160.3,148.2,145.2,140.5,139.5,138.6,135.1,130.6,129.4,128.8,127.1,126.2,124.3,123.6,115.2,114.3,51.4,50.8,24.8,24.6,14.4,14.1。
元素分析:C58H42F4N2(842.96)理论值:C,82.64;H,5.02;N,3.32。实验值:C,82.25;H,4.76;N,5.35。
实施例41、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二异丙基基苯亚胺基)苊烯[L18]
1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}苊酮(1.420g,2.00mmol)和2,6-二异丙基苯胺(0.370g,2.10mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.008g,0.04mmol),加热至回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.30g,产率:17.0%。
结构确证数据如下:FT-IR(KBr,cm-1):2925(w),2927(w),2866(w),1893(w),1675(m),1646(w),1600(m),1505(vs),1225(vs),1157(s),1016(w),822(s),772(vs),721(m)。
1H NMR(400MHz,CDCl3,TMS):δ7.94(d,J=8.4Hz,1H),7.80(d,J=6.0Hz,2H),7.71(d,J=8.4Hz,1H),7.40(t,J=7.4Hz,1H),7.32(t,J=7.4Hz,5H),7.09(t,J=6.4Hz,2H),7.02(t,J=8.4Hz,2H),6.96–6.80(m,9H),6.76(t,J=6.4Hz,2H),6.60(d,J=7.2Hz,1H),6.49(s,1H),6.23(s,1H),6.17(t,J=8.4Hz,2H),5.84(s,1H),5.74(d,J=7.2Hz,1H),3.23–3.16(m,1H),3.07–3.00(m,1H),1.34(d,J=6.8Hz,3H),1.28(d,J=6.8Hz,3H),1.13(d,J=6.8Hz,3H),0.97(d,J=6.8Hz,3H)。
13C NMR(100MHz,CDCl3,TMS):δ164.1,162.7,162.6,161.6,161.4,160.3,160.2,147.0,145.2,140.6,139.5,135.4,130.7,130.4,128.8,128.4,126.5,126.0,124.5,124.3,123.6,123.3,115.3,114.6,51.4,50.8,28.7,28.6,23.8,23.6,23.5,23.2。
元素分析:C60H46F4N2(871.01)理论值:C,82.74;H,5.32;N,3.22。实验值:C,82.45;H,4.96;N,3.35。
实施例42、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,4,6-三甲基苯亚胺基)苊烯[L19]
1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}苊酮(0.711g,1.00mmol)和2,4,6-三甲基苯胺(0.148g,1.10mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.004g,0.02mmol),加热至回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.17g,产率:21.0%。
结构确证数据如下:FT-IR(KBr,cm-1):2956(w),2920(w),2857(w),1889(w),1668(m),1636(m),1600(m),1504(vs),1224(vs),1157(s),1016(m),820(s),775(s),722(m)。
1H NMR(400MHz,CDCl3,TMS):δ7.85(d,J=8.4Hz,1H),7.73(d,J=8.4Hz,2H),7.64(d,J=8.0Hz,1H),7.29(t,J=6.2Hz,1H),7.23–7.18(m,2H),7.00(t,J=6.8Hz,2H),6.95–6.90(m,4H),6.88–6.81(m,5H),6.79–6.73(m,4H),6.69(t,J=6.8Hz,2H),6.64(d,J=7.2Hz,1H),6.39(s,1H),6.14(s,1H),6.08(t,J=8.4Hz,2H),5.76(s,1H),5.69(d,J=7.2Hz,1H),2.32(s,3H),2.16(s,3H),2.07(s,3H)。
13C NMR(100MHz,CDCl3,TMS):δ164.2,162.8,162.6,161.7,160.4,159.2,146.6,145.3,140.5,139.1,137.4,133.3,132.4,130.8,129.2,127.1,126.0,124.6,123.8,115.3,114.5,51.5,50.9,21.0,19.3,18.2。
元素分析:C57H40F4N2(828.93)理论值:C,82.59;H,4.86;N,3.38。实验值:C,82.45;H,4.96;N,3.35。
实施例43、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二乙基-4-甲基苯亚胺基)苊烯[L20]
1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}苊酮(0.711g,1.00mmol)和2,6-二乙基-4-甲基苯胺(0.179g,1.10mmol)溶于50mL甲苯溶液中,加入对甲苯磺酸(0.004g,0.02mmol),加热至回流,反应10h。除去溶剂甲苯,剩余物用石油醚和乙酸乙酯的体积比为200:1的混合溶剂进行硅胶柱层析。通过薄层硅胶板检测洗脱流分,除去溶剂得红色固体0.27g,产率:32.0%。
结构确证数据如下:FT-IR(KBr,cm-1):2963(w),2926(w),2867(w),1892(w),1660(m),1635(m),1598(m),1504(vs),1223(vs),1158(s),1016(w),821(vs),770(vs),722(m)。
1H NMR(400MHz,CDCl3,TMS):δ7.93(d,J=8.4Hz,1H),7.80(d,J=8.4Hz,2H),7.70(d,J=8.4Hz,1H),7.40–7.34(m,2H),7.32–7.25(m,1H),7.09–6.98(m,6H),6.95–6.89(m,5H),6.86–6.81(m,4H),6.78–6.74(m,2H),6.70(d,J=6.8Hz,1H),6.48(s,1H),6.21(s,1H),6.17(t,J=8.4Hz,2H),5.83(s,1H),5.74(d,J=6.8Hz,1H),2.73–2.64(m,2H),2.62–2.53(m,2H),2.44(s,3H),1.23(t,J=7.6Hz,3H),1.14(t,J=7.4Hz,3H)。
13C NMR(100MHz,CDCl3,TMS):δ164.3,163.0,161.6,160.4,146.0,140.7,138.9,135.3,133.7,131.0,130.7,129.2,127.4,124.5,115.3,114.7,51.7,51.0,25.0,24.8,21.4,14.7,14.1。
元素分析:C59H44F4N2(856.99)理论值:C,82.69;H,5.18;N,3.27。实验值:C,82.53;H,4.73;N,3.21。
实施例44、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二甲基苯亚胺基)苊]合溴化镍(II)[配合物C16]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.12g。产率:81.9%.
结构确证数据如下:FT-IR(KBr,cm-1):2800(w),2771(w),1889(w),1649(w),1622(m),1602(s),1507(vs),1227(vs),1155(s),1017(m),830(s),776(vs),737(m)。
元素分析:C56H38Br2F4N2Ni(1033.41)理论值:C,65.09;H,3.71;N,2.71。实验值:C,64.79;H,4.16;N,3.01。
配合物C16的晶体结构图如图4所示。
实施例45、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二乙基苯亚胺基)苊]合溴化镍(II)[配合物C17]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二乙基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.08g。产率:72.4%.
结构确证数据如下:FT-IR(KBr,cm-1):2974(w),2937(w),2876(w),1908(w),1647(w),1621(m),1600(s),1505(vs),1225(vs),1157(s),1016(m),835(s),776(m),723(m)。
元素分析:C58H42Br2F4N2Ni(1061.46)理论值:C,65.63;H,3.99;N,2.64。实验值:C,64.81;H,4.32;N,2.78。
实施例46、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二异丙基苯亚胺基)苊]合溴化镍(II)[配合物C18]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二异丙基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.15g。产率:92.6%.
结构确证数据如下:FT-IR(KBr,cm-1):2968(w),2930(w),2867(w),1889(w),1650(w),1621(m),1602(m),1505(vs),1227(s),1154(s),1018(w),827(s),772(s),723(w)。
元素分析:C60H46Br2F4N2Ni(1089.52)理论值:C,66.14;H,4.26;N,2.57。实验值:C,65.72;H,4.23;N,2.89。
实施例47、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,4,6-三甲基苯亚胺基)苊]合溴化镍(II)[配合物C19]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,4,6-三甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.03g。产率:31.7%.
结构确证数据如下:FT-IR(KBr,cm-1):2950(w),2913(w),2853(w),1900(w),1652(w),1624(m),1600(s),1503(vs),1220(vs),1157(s),1015(m),827(vs),777(s),713(w)。
元素分析:C57H40Br2F4N2Ni(1047.44)理论值:C,65.36;H,3.85;N,2.67。实验值:C,65.01;H,3.97;N,2.74。
实施例48、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二乙基-4-甲基苯亚胺基)苊]合溴化镍(II)[配合物C20]
室温下,按摩尔比1:1.1将(DME)NiBr2二氯甲烷溶液滴加到1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二乙基-4-甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.10g。产率:93.4%.
结构确证数据如下:FT-IR(KBr,cm-1):2971(w),2934(w),2874(w),1910(w),1647(w),1620(w),1599(m),1505(vs),1225(vs),1158(s),1015(w),828(s),777(m),717(w)。
元素分析:C59H44Br2F4N2Ni(1075.49)理论值:C,65.89;H,4.12;N,2.60。实验值:C,64.93;H,3.85;N,2.97。
实施例49、制备1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二甲基苯亚胺基)苊]合氯化镍(II)[配合物C21]
室温下,按摩尔比1:1.1将NiCl2·6H2O二氯甲烷溶液滴加到1-{2,4-二[二(对氟苯基)]甲基萘亚胺基}-2-(2,6-二甲基苯亚胺基)苊烯的二氯甲烷溶液中,在氮气保护下搅拌12h,加入乙醚有红色固体析出,过滤,乙醚洗涤,烘干,得到深红色固体0.15g。产率:80%.
结构确证数据如下:FT-IR(KBr,cm-1):2800(w),2773(w),1890(w),1647(w),1621(m),1602(s),1507(vs),1227(vs),1155(s),1017(m),830(s),776(vs),737(m)。
元素分析:C56H38Cl2F4N2Ni(944.51)理论值:C,71.21;H,4.06;N,2.97。实验值:C,71.32;H,4.18;N,3.06。
实施例50、利用配合物C3及Et2AlCl联合催化加压下的乙烯聚合:
a)加压下的乙烯聚合使用一台装备有机械搅拌桨和温度控制装置的300毫升不锈钢聚合釜。将聚合釜抽真空并加热到100℃,加热时间持续两小时。在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(30℃)。用甲苯冲洗釜三次,然后依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,0.5mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),以及剩余甲苯(使得甲苯总量为100毫升)。将聚合釜封闭,通乙烯并维持乙烯的压力恒定(10atm)。在聚合反应达到预先设定的时间(30min)后,将釜内的乙烯压力释放,向混合液中加入100mL乙醇,检验是否有聚乙烯生成。如果有聚乙烯生成,过滤洗涤后在60℃的烘箱中干燥至恒重,根据聚合物的产量计算聚合活性。聚合活性:2.96×106g·mol-1(Ni)·h-1,聚合物Mw=419kg·mol-1,Mw/Mn=2.4。
b)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,0.7mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.87×106g·mol-1(Ni)·h-1,聚合物Mw=402kg·mol-1,Mw/Mn=2.8。
c)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),以及剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.45×106g·mol-1(Ni)·h-1,聚合物Mw=335kg·mol-1,Mw/Mn=2.9。
d)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),以及剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:7.71×106g·mol-1(Ni)·h-1,聚合物Mw=329kg·mol-1,Mw/Mn=2.7。
e)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,1.2mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),以及剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:5.10×106g·mol-1(Ni)·h-1,聚合物Mw=278kg·mol-1,Mw/Mn=3.2。
f)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(20℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.83×106g·mol-1(Ni)·h-1,聚合物Mw=572kg·mol-1,Mw/Mn=2.5。
g)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(40℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:6.25×106g·mol-1(Ni)·h-1,聚合物Mw=257kg·mol-1,Mw/Mn=3.6。
h)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(50℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:5.39×106g·mol-1(Ni)·h-1,聚合物Mw=187kg·mol-1,Mw/Mn=2.6。
i)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(60℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.23×106g·mol-1(Ni)·h-1,聚合物Mw=135kg·mol-1,Mw/Mn=2.5。
j)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为15min。聚合活性:10.38×106g·mol-1(Ni)·h-1,聚合物Mw=274kg·mol-1,Mw/Mn=3.1。
k)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为45min。聚合活性:5.69×106g·mol-1(Ni)·h-1,聚合物Mw=330kg·mol-1,Mw/Mn=2.4。
l)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为60min。聚合活性:4.83×106g·mol-1(Ni)·h-1,聚合物Mw=333kg·mol-1,Mw/Mn=3.7。
m)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、乙烯压力为5atm。聚合活性:4.36×106g·mol-1(Ni)·h-1,聚合物Mw=238kg·mol-1,Mw/Mn=3.3。
实施例51、利用配合物C1及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C1)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.13×106g·mol-1(Ni)·h-1,聚合物Mw=209kg·mol-1,Mw/Mn=3.4。
实施例52、利用配合物C2及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C2)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.33×106g·mol-1(Ni)·h-1,聚合物Mw=263kg·mol-1,Mw/Mn=3.1。
实施例53、利用配合物C4及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C4)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.92×106g·mol-1(Ni)·h-1,聚合物Mw=334kg·mol-1,Mw/Mn=2.7。
实施例54、利用配合物C5及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C5)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:5.72×106g·mol-1(Ni)·h-1,聚合物Mw=429kg·mol-1,Mw/Mn=3.2。
实施例55、利用配合物C3及MAO联合催化加压下的乙烯聚合:
1)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,1.4mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.84×106g·mol-1(Ni)·h-1,聚合物Mw=559kg·mol-1,Mw/Mn=1.9。
2)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,2.1mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.49×106g·mol-1(Ni)·h-1,聚合物Mw=404kg·mol-1,Mw/Mn=3.3。
3)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:6.27×106g·mol-1(Ni)·h-1,聚合物Mw=497kg·mol-1,Mw/Mn=2.8。
4)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,3.4mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.47×106g·mol-1(Ni)·h-1,聚合物Mw=567kg·mol-1,Mw/Mn=2.4。
5)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,4.1mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.61×106g·mol-1(Ni)·h-1,聚合物Mw=579kg·mol-1,Mw/Mn=2.2。
6)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(20℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.62×106g·mol-1(Ni)·h-1,聚合物Mw=636kg·mol-1,Mw/Mn=2.8。
7)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(40℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:5.65×106g·mol-1(Ni)·h-1,聚合物Mw=426kg·mol-1,Mw/Mn=2.3。
8)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(50℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.72×106g·mol-1(Ni)·h-1,聚合物Mw=329kg·mol-1,Mw/Mn=2.1。
9)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(60℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.45×106g·mol-1(Ni)·h-1,聚合物Mw=281kg·mol-1,Mw/Mn=2.0。
10)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为15min。聚合活性:10.24×106g·mol-1(Ni)·h-1,聚合物Mw=465kg·mol-1,Mw/Mn=3.0。
11)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为45min。聚合活性:4.67×106g·mol-1(Ni)·h-1,聚合物Mw=548kg·mol-1,Mw/Mn=2.7。
12)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为60min。聚合活性:3.93×106g·mol-1(Ni)·h-1,聚合物Mw=571kg·mol-1,Mw/Mn=2.4。
13)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C3)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、乙烯压力为5atm。聚合活性:3.78×106g·mol-1(Ni)·h-1,聚合物Mw=489kg·mol-1,Mw/Mn=2.9。
实施例56、利用配合物C1及MAO联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C1)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.73×106g·mol-1(Ni)·h-1,聚合物Mw=315kg·mol-1,Mw/Mn=2.8。
实施例57、利用配合物C2及MAO联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C2)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:5.40×106g·mol-1(Ni)·h-1,聚合物Mw=436kg·mol-1,Mw/Mn=2.6。
实施例58、利用配合物C4及MAO联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C4)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.79×106g·mol-1(Ni)·h-1,聚合物Mw=351kg·mol-1,Mw/Mn=2.7。
实施例59、利用配合物C5及MAO联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C5)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:7.26×106g·mol-1(Ni)·h-1,聚合物Mw=454kg·mol-1,Mw/Mn=2.6。
实施例60、利用配合物C8及Et2AlCl联合催化加压下的乙烯聚合:
1)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.4mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:0.15×106g·mol-1(Ni)·h-1,聚合物Mw=302kg·mol-1,Mw/Mn=1.99。
2)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.5mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.31×106g·mol-1(Ni)·h-1,聚合物Mw=353kg·mol-1,Mw/Mn=1.84。
3)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.6mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.58×106g·mol-1(Ni)·h-1,聚合物Mw=378kg·mol-1,Mw/Mn=1.73。
4)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.19×106g·mol-1(Ni)·h-1,聚合物Mw=418kg·mol-1,Mw/Mn=1.70。
5)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.73×106g·mol-1(Ni)·h-1,聚合物Mw=345kg·mol-1,Mw/Mn=1.63。
6)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(20℃);2、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.45×106g·mol-1(Ni)·h-1,聚合物Mw=439kg·mol-1,Mw/Mn=1.53。
7)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(40℃);2、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.32×106g·mol-1(Ni)·h-1,聚合物Mw=334kg·mol-1,Mw/Mn=1.76。
8)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(50℃);2、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.12×106g·mol-1(Ni)·h-1,聚合物Mw=321kg·mol-1,Mw/Mn=1.56。
9)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(60℃);2、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:1.37×106g·mol-1(Ni)·h-1,聚合物Mw=298kg·mol-1,Mw/Mn=1.41。
10)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(70℃);2、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:0.42×106g·mol-1(Ni)·h-1,聚合物Mw=211kg·mol-1,Mw/Mn=1.20。
11)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为15min。聚合活性:6.87×106g·mol-1(Ni)·h-1,聚合物Mw=221kg·mol-1,Mw/Mn=1.66。
12)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为45min。聚合活性:3.65×106g·mol-1(Ni)·h-1,聚合物Mw=252kg·mol-1,Mw/Mn=1.78。
13)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为60min。聚合活性:3.34×106g·mol-1(Ni)·h-1,聚合物Mw=328kg·mol-1,Mw/Mn=1.82。
14)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C8)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、乙烯压力为5atm。聚合活性:3.12×106g·mol-1(Ni)·h-1,聚合物Mw=198kg·mol-1,Mw/Mn=1.63。
实施例61、利用配合物C6及Et2AlCl联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C6)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.43×106g·mol-1(Ni)·h-1,聚合物Mw=231kg·mol-1,Mw/Mn=1.58。
实施例62、利用配合物C7及Et2AlCl联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C7)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.72×106g·mol-1(Ni)·h-1,聚合物Mw=254kg·mol-1,Mw/Mn=1.67。
实施例63、利用配合物C9及Et2AlCl联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C9)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.13×106g·mol-1(Ni)·h-1,聚合物Mw=214kg·mol-1,Mw/Mn=1.85。
实施例64、利用配合物C10及Et2AlCl联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C10)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.29×106g·mol-1(Ni)·h-1,聚合物Mw=290kg·mol-1,Mw/Mn=1.49。
实施例65、利用配合物C13及Et2AlCl联合催化加压下的乙烯聚合:
1)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.4mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.15×106g·mol-1(Ni)·h-1,聚合物Mw=243kg·mol-1,Mw/Mn=2.3。
2)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.5mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.31×106g·mol-1(Ni)·h-1,聚合物Mw=269kg·mol-1,Mw/Mn=2.2。
3)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.6mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.54×106g·mol-1(Ni)·h-1,聚合物Mw=318kg·mol-1,Mw/Mn=2.0。
4)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:5.47×106g·mol-1(Ni)·h-1,聚合物Mw=323kg·mol-1,Mw/Mn=1.8。
5)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.57×106g·mol-1(Ni)·h-1,聚合物Mw=334kg·mol-1,Mw/Mn=1.6。
6)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(20℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.32×106g·mol-1(Ni)·h-1,聚合物Mw=363kg·mol-1,Mw/Mn=2.2。
7)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(40℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.79×106g·mol-1(Ni)·h-1,聚合物Mw=334kg·mol-1,Mw/Mn=2.0。
8)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(50℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.01×106g·mol-1(Ni)·h-1,聚合物Mw=311kg·mol-1,Mw/Mn=1.9。
9)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(60℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:1.28×106g·mol-1(Ni)·h-1,聚合物Mw=258kg·mol-1,Mw/Mn=1.9。
10)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(70℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:0.46×106g·mol-1(Ni)·h-1,聚合物Mw=198kg·mol-1,Mw/Mn=1.8。
11)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为15min。聚合活性:7.01×106g·mol-1(Ni)·h-1,聚合物Mw=246kg·mol-1,Mw/Mn=2.3。
12)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为45min。聚合活性:4.75×106g·mol-1(Ni)·h-1,聚合物Mw=283kg·mol-1,Mw/Mn=1.9。
13)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为60min。聚合活性:3.45×106g·mol-1(Ni)·h-1,聚合物Mw=330kg·mol-1,Mw/Mn=1.8。
14)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、乙烯压力为5atm。聚合活性:3.32×106g·mol-1(Ni)·h-1,聚合物Mw=220kg·mol-1,Mw/Mn=1.9。
实施例66、利用配合物C11及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C11)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.41×106g·mol-1(Ni)·h-1,聚合物Mw=231kg·mol-1,Mw/Mn=2.3。
实施例67、利用配合物C12及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C12)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.78×106g·mol-1(Ni)·h-1,聚合物Mw=269kg·mol-1,Mw/Mn=2.1。
实施例68、利用配合物C14及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C14)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.96×106g·mol-1(Ni)·h-1,聚合物Mw=224kg·mol-1,Mw/Mn=2.0。
实施例69、利用配合物C15及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C15)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.45×106g·mol-1(Ni)·h-1,聚合物Mw=276kg·mol-1,Mw/Mn=1.9
实施例70、利用配合物C13及MAO联合催化加压下的乙烯聚合:
1)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,1.4mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.34×106g·mol-1(Ni)·h-1,聚合物Mw=439kg·mol-1,Mw/Mn=3.0。
2)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,2.1mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.31×106g·mol-1(Ni)·h-1,聚合物Mw=404kg·mol-1,Mw/Mn=2.9。
3)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:5.27×106g·mol-1(Ni)·h-1,聚合物Mw=397kg·mol-1,Mw/Mn=2.8。
4)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,3.4mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.27×106g·mol-1(Ni)·h-1,聚合物Mw=367kg·mol-1,Mw/Mn=2.5。
5)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,4.1mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.81×106g·mol-1(Ni)·h-1,聚合物Mw=398kg·mol-1,Mw/Mn=2.3。
6)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(20℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.31×106g·mol-1(Ni)·h-1,聚合物Mw=533kg·mol-1,Mw/Mn=2.4。
7)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(40℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.34×106g·mol-1(Ni)·h-1,聚合物Mw=446kg·mol-1,Mw/Mn=2.3。
8)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(50℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.12×106g·mol-1(Ni)·h-1,聚合物Mw=425kg·mol-1,Mw/Mn=2.1。
9)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(60℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:1.87×106g·mol-1(Ni)·h-1,聚合物Mw=382kg·mol-1,Mw/Mn=2.0。
10)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(70℃);2、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:1.21×106g·mol-1(Ni)·h-1,聚合物Mw=312kg·mol-1,Mw/Mn=1.9。
11)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为15min。聚合活性:6.94×106g·mol-1(Ni)·h-1,聚合物Mw=356kg·mol-1,Mw/Mn=2.4。
12)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为45min。聚合活性:4.37×106g·mol-1(Ni)·h-1,聚合物Mw=518kg·mol-1,Mw/Mn=2.5。
13)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为60min。聚合活性:3.13×106g·mol-1(Ni)·h-1,聚合物Mw=543kg·mol-1,Mw/Mn=2.3。
14)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C13)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、乙烯压力为5atm。聚合活性:3.25×106g·mol-1(Ni)·h-1,聚合物Mw=359kg·mol-1,Mw/Mn=2.5。
实施例71、利用配合物C11及MAO联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C11)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.81×106g·mol-1(Ni)·h-1,聚合物Mw=376kg·mol-1,Mw/Mn=2.0。
实施例72、利用配合物C12及MAO联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C12)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.51×106g·mol-1(Ni)·h-1,聚合物Mw=334kg·mol-1,Mw/Mn=2.5。
实施例73、利用配合物C14及MAO联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C14)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.38×106g·mol-1(Ni)·h-1,聚合物Mw=359kg·mol-1,Mw/Mn=2.3。
实施例74、利用配合物C15及MAO联合催化加压下的乙烯聚合:
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有2μmol催化剂(C15)的甲苯溶液,2.7mL助催化剂(MAO,1.46mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:5.24×106g·mol-1(Ni)·h-1,聚合物Mw=371kg·mol-1,Mw/Mn=2.0。
实施例75、利用配合物C18及Et2AlCl联合催化加压下的乙烯聚合
1)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.5mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:0.18×106g·mol-1(Ni)·h-1,聚合物Mw=320kg·mol-1,Mw/Mn=1.99。
2)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.64mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.74×106g·mol-1(Ni)·h-1,聚合物Mw=363kg·mol-1,Mw/Mn=1.74。
3)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.8mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.85×106g·mol-1(Ni)·h-1,聚合物Mw=368kg·mol-1,Mw/Mn=1.73。
4)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.79×106g·mol-1(Ni)·h-1,聚合物Mw=373kg·mol-1,Mw/Mn=1.72。
5)基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,1.0mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.76×106g·mol-1(Ni)·h-1,聚合物Mw=480kg·mol-1,Mw/Mn=1.70。
6)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(20℃);2、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:0.73×106g·mol-1(Ni)·h-1,聚合物Mw=558kg·mol-1,Mw/Mn=1.48。
7)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(40℃);2、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:5.45×106g·mol-1(Ni)·h-1,聚合物Mw=211kg·mol-1,Mw/Mn=1.29。
8)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(50℃);2、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.58×106g·mol-1(Ni)·h-1,聚合物Mw=144kg·mol-1,Mw/Mn=1.67。
9)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(60℃);2、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:2.09×106g·mol-1(Ni)·h-1,聚合物Mw=86kg·mol-1,Mw/Mn=1.40。
10)基本同a),区别在于:1、在用乙烯预先置换釜内氮气的条件下,让聚合釜缓慢冷却至设想的聚合温度(70℃);2、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:1.01×106g·mol-1(Ni)·h-1,聚合物Mw=80kg·mol-1,Mw/Mn=1.31。
11)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为15min。聚合活性:6.69×106g·mol-1(Ni)·h-1,聚合物Mw=210kg·mol-1,Mw/Mn=1.66。
12)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为45min。聚合活性:4.30×106g·mol-1(Ni)·h-1,聚合物Mw=213kg·mol-1,Mw/Mn=1.89。
13)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、聚合反应达到预先设定的时间为60min。聚合活性:3.42×106g·mol-1(Ni)·h-1,聚合物Mw=230kg·mol-1,Mw/Mn=1.82。
14)基本同a),区别在于:1、向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C18)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL);2、乙烯压力为5atm。聚合活性:3.42×106g·mol-1(Ni)·h-1,聚合物Mw=158kg·mol-1,Mw/Mn=1.33。
实施例76、利用配合物C16及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C16)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.61×106g·mol-1(Ni)·h-1,聚合物Mw=96kg·mol-1,Mw/Mn=1.22。
实施例77、利用配合物C17及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C17)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:3.58×106g·mol-1(Ni)·h-1,聚合物Mw=217kg·mol-1,Mw/Mn=1.81。
实施例78、利用配合物C19及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C19)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.46×106g·mol-1(Ni)·h-1,聚合物Mw=92kg·mol-1,Mw/Mn=1.99。
实施例79、利用配合物C20及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C20)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:5.00×106g·mol-1(Ni)·h-1,聚合物Mw=217kg·mol-1,Mw/Mn=1.97。
实施例80、利用配合物C21及Et2AlCl联合催化加压下的乙烯聚合
基本同a),区别在于:向反应釜中依次加入50mL甲苯,20mL溶有1.5μmol催化剂(C21)的甲苯溶液,0.9mL助催化剂(Et2AlCl,1.17mol/L的甲苯溶液),剩余甲苯(使得甲苯总量为100mL)。根据聚合物的产量计算聚合活性。聚合活性:4.98×106g·mol-1(Ni)·h-1,聚合物Mw=239kg·mol-1,Mw/Mn=1.99。
- 还没有人留言评论。精彩留言会获得点赞!
- 低介电常数树脂基材用处理铜箔及使用该处理铜箔的覆铜层压板以及印刷配线板的制造方法与工艺
- 含有色酮结构的吡唑类N‐对溴苯基马来酰亚胺衍生物及其制备方法与应用与制造工艺
- 一种双吲哚马来酰亚胺生物碱HD‑ZWM288在制备抗肿瘤微管抑制剂药物的应用的制造方法与工艺
- 马来酰亚胺膜的制造方法与工艺
- 多孔性酰亚胺系树脂膜制造系统、隔膜、及多孔性酰亚胺系树脂膜制造方法与制造工艺
- 聚苯并噁嗪前体及其制备方法与制造工艺
- 含酰亚胺结构的环三磷腈无卤阻燃剂、制备方法及用途与制造工艺
- 开关型硫醇荧光标记试剂及其合成方法和应用与制造工艺
- 一种耐高温表面自润滑的聚酰胺酰亚胺绝缘漆的制造方法与工艺
- 一种耐高温表面自润滑的聚酰胺酰亚胺绝缘漆的制造方法与工艺
- 聚酯系树脂组合物及使用了该聚酯系树脂组合物的成型品的制作方法
- 聚酯系树脂组合物、该聚酯系组合物的制备方法及使用了该聚酯系树脂组合物的成型品的制作方法
- 经交联、热重排的聚(苯并*唑-共-酰亚胺),包含其的气体分离膜以及其制备方法
- 一种醇胺类金属螯合型粉末涂料交联剂的制作方法
- 酶交联型壳聚糖/聚乙烯亚胺接枝磁性明胶材料及其制备方法与应用
- 包含经交联、热重排的聚(苯并*唑-共-酰亚胺)的用于烟道气分离的膜以及其制备方法
- 一种实验室用生物质热解碳化反应装置的制造方法
- 猪真皮基质-氧化羧甲基壳聚糖-羟基磷灰石口腔修复材料及其制备方法
- 猪真皮基质-氧化羧甲基壳聚糖-羟基磷灰石口腔修复材料及其制备方法
- 一种膨胀型无卤电缆料的制作方法