编码杀虫蛋白的核苷酸序列及其应用的制作方法
本申请涉及植物基因工程及作物育种技术领域。具体地说,本申请涉及改造抗鳞翅目害虫的新基因及其应用。
背景技术:
苏云金芽胞杆菌(Bacillus thuringiensis)可以分泌毒蛋白,对鳞翅目、鞘翅目昆虫(比如小菜蛾)有很强的杀伤作用。人类很早就研究利用Bt菌来杀灭害虫,迄今有100多年的历史。随着分子生物学技术的发展和基因克隆、DNA操作等技术的出现,人类开始从Bt菌中克隆其毒蛋白基因到工程菌中,制作生物农药。
Bt毒素主要分为内毒素和外毒素。外毒素指细菌在生命活动过程中排出体外的代谢物,包括α-外毒素、β-外毒素、γ-外毒素、不稳定外毒素和水溶性外毒素等。内毒素又称δ-内毒素、晶体毒素或杀虫晶体蛋白伴胞晶体,由一种或多种杀虫晶体蛋白组成。内毒素在Bt对昆虫的致死过程中起主要作用。本申请涉及的cry1Ca基因编码的杀虫蛋白属于内毒素,即杀虫晶体蛋白。
许多Bt杀虫晶体蛋白的氨基酸序列存在不同程度的同源性。1989年,Hofte和Whiteley根据Bt杀虫晶体蛋白的杀虫谱和氨基酸序列的同源性,将当时发现的42个Bt基因分为五大类、十四个亚类(Hofte H and Whiteley HR,Microbio.Rev.,53:241-255)。其中,前四大类为晶体蛋白的基因家族cry,第五类为细胞溶解蛋白基因cyt。cry基因可划分为四群,即cryI为鳞翅目特异性,cryⅡ为鳞翅目和双翅目特异性,cryⅢ为鞘翅目特异性,cryIV为双翅目特异性。由于当时发现的基因数目少,彼此之间有明显的差异,因此各个基因的分类地位比较明确,从而使得Hofte和Whiteley的分类系统被广泛地接受和采用。本申请涉及的基因cry1C适用这个分类系统,属于鳞翅目特异性杀虫基因。
近年来,不断发现的杀虫晶体蛋白及其基因使得原先分类系统中的氨基酸序列与杀虫活性间产生了不协调性,而且随着新基因的发现,这种分类方法越来越不能满足这两个条件,使得分类难以确定。Crickmore等在1995年国际无脊椎动物病理学会年会(SIP)上提出了以杀虫晶体蛋白氨基酸序列的同源性为唯一依据区别Bt基因的新分类系统,现已被各国广泛采纳。具体来说,杀虫晶体蛋白氨基酸同源性在45%以下,为第一等级,用阿拉伯数字表示;同源性在45%~78%之间,为第二等级,用大写英文字母表示;同源性在78%~95%之间,为第三等级,用小写英文字母表示;同源性在95%以上,为第四等级,用阿拉伯数字表示。例如本申请涉及的cry1Ca5为第四等级。
Obukowics等学者在1986年将cryIA(b)基因经转座子Tn5介导引入到植物的假单孢杆菌中,使植物具有抗虫性,从而创造了第一代Bt转基因抗虫植物,这也是Bt毒蛋白基因使植物获得抗虫性的最早报道。真正的Bt毒蛋白转基因植物是第二代Bt抗虫植物,第一个成功的例子是由比利时的植物遗传系统公司在1987年6月报道的(Vaeck等,Nature,328:33-37,1987),他们用农杆菌介导法成功地将完整的cryIA(b)基因和3’、5’端缺失后只保留5’端编码毒蛋白核心区的不同长度的cryIA(b)基因导入烟草获得了抗烟草天蛾的转基因烟草植株。
技术实现要素:
在一方面,本申请提供了分离的核酸分子,其特征在于,所述核酸分子包含SEQ ID NO:1所示核苷酸序列,或其互补序列。本申请还提供了与SEQ ID NO:1具有至少70%同一性的序列。在一实施方案中,本申请提供了与该基因具有至少80%、85%、90%、95%、96%、97%、98%、99%、99.5%或99.9%序列同一性的序列。在一实施方案中,所述核酸分子包含SEQ ID NO:1所示核苷酸序列。在一实施方案中,所述核酸分子由SEQ ID NO:1所示核苷酸序列组成。
在又一方面,本申请涉及表达盒,其特征在于,包含上述分离的核酸分子。在一实施方案中,所述核酸分子与35S启动子和nos终止子可操作地连接。
在又一方面,本申请涉及表达载体,其包含上述表达盒。在一实施方案中,所述表达载体还包含PolyA序列和omega增强子。
在又一方面,本申请提供了宿主细胞,其特征在于,包含上述表达载体。在一实施方案中,所述宿主细胞为植物细胞或原核生物细胞。在一实施方案中,所述宿主细胞为大肠杆菌或农杆菌细胞。
在又一方面,本申请提供了产生转基因植物的方法,其特征在于,用上述表达载体或宿主细胞转化植物,得到转基因植物。在一实施方案中,所述植物为单子叶植物。在一实施方案中,所述植物选自:玉米、水稻、小麦、燕麦、大麦、青稞、粟、高粱和甘蔗。
在又一方面,本申请还涉及转基因植物,其包括稳定整合进其基因组的表达盒,其特征在于,所述表达盒包含编码抗鳞翅目害虫基因的核酸分子,所述核酸分子包含SEQ ID NO:1所示核苷酸序列或与SEQ ID NO:1具有至少70%序列同一性的核苷酸序列,或以上的互补序列。在一实施方案中,本申请提供了与该基因具有至少80%、85%、90%、95%、96%、97%、98%、99%、99.5%或99.9%序列同一性的序列。在一些实施方案中,所述核酸分子包含SEQ ID NO:1所示核苷酸序列或所述核酸分子由SEQ ID NO:1所示核苷酸序列组成。在一些实施方案中,所述植物为单子叶植物。在一些实施方案中,所述植物选自:玉米、水稻、小麦、燕麦、大麦、粟、高粱和甘蔗。在一实施方案中,本申请还涉及该植物的器官、组织、细胞及通过由所述植物产生的加工品,如食物、饲料等。
在又一方面,本申请提供了产生转基因种子的方法,其特征在于,从上述转基因植物产生转基因种子。本申请还提供了通过该方法产生的转基因种子。
在又一方面,本申请提供了控制鳞翅目害虫群体的方法,包括使所述鳞翅目害虫群体进食通过上述方法获得的转基因植物。在一实施方案中所述植物为单子叶植物。在一实施方案中,所述植物选自:玉米、水稻、小麦、燕麦、大麦、粟、高粱和甘蔗。在一实施方案中,所述植物为玉米。在一实施方案中,所述鳞翅目害虫为欧洲玉米螟(Pyrausta nubilalis)或亚洲玉米螟(Ostrinia furnacalis)。本申请还提 供了杀死鳞翅目害虫的方法,包括向所述鳞翅目害虫喂食杀虫有效量的通过上述方法获得的转基因植物。
在又一方面,本申请提供了减轻鳞翅目害虫对植物的伤害的方法,包括将表达载体稳定整合进植物的基因组,其特征在于,所述表达载体包含编码抗鳞翅目害虫基因的核酸分子,所述核酸分子包含SEQ ID NO:1所示核苷酸序列或与SEQ ID NO:1具有至少90%序列同一性的核苷酸序列,或以上的互补序列。在一实施方案中,所述核酸分子包含SEQ ID NO:1所示核苷酸序列。在一实施方案中,所述核酸分子由SEQ ID NO:1所示核苷酸序列组成。
在又一方面,本申请提供了筛选抗鳞翅目害虫基因的方法,其特征在于,包括以下步骤:
以杀虫蛋白氨基酸序列为模板,根据单子叶植物密码子偏好性改造获得G+C含量高、结构稳定的基因序列;
设计高效稳定表达基因的载体表达盒,构建表达载体;
用所述表达载体转化单子叶植物,获得转基因植物并鉴定转基因事件;
挑选低拷贝转基因植物事件,利用鳞翅目害虫进行杀虫活性生物测定。
在一实施方案中,该方法还包括对比不同抗虫基因的抗虫效果或验证改造后基因的抗虫效果。
在一实施方案中,所述杀虫蛋白由cry1Ca5编码。
本申请具有以下一种或多种优势:1、所提供的人工基因、含有该基因的表达盒、包含该基因的表达载体、包含所述基因的宿主细胞、用该基因转化的植物在植物育种方面有广泛的用途;2、本申请提供了控制鳞翅目害虫的方法;3、本申请为大规模培育抗虫性强的优良品系提供了基因基础和技术平台;4、本申请的方法可用于抗虫化学制剂的开发与应用。
附图说明
图1为单子叶植物密码子使用偏好性归纳图
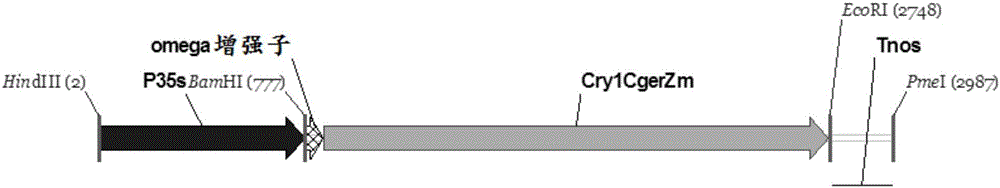
图2为载体P35s-cry1CgerZm-Tnos区域示意图,其长度为2990bp,P35s为35S启动子,T-nos为nos终止子。
图3为实时PCR检测示例示意图:内参基因标识玉米内参IVR(单拷贝)扩增曲线,目标基因标识cry1CgerZm基因扩增曲线,骨架标识ORI片段扩增曲线
具体实施方式
除非另有所指,核酸以5’至3’方向从左向右书写;氨基酸序列以氨基至羧基方向从左向右书写。氨基酸在本文可以用其通常所知的三字母符号或IUPAC-IUB生物化学命名委员会推荐的单字母符号来表示。同样地,可以用通常接受的单字母码表示核苷酸。
数字范围包括限定该范围的数字。
如本文所用,“核酸”包括涉及单链或双链形式的脱氧核糖核苷酸或核糖核苷酸多聚物,并且除非另有限制,包括具有天然核苷酸基本性质的已知类似物(例如,肽核酸),所述类似物以与天然存在的核苷酸类似的方式与单链核酸杂交。
如本文所用,术语“编码”或“所编码的”用于特定核酸的上下文时,指该核酸包含指导该核苷酸序列翻译成特定蛋白的必需信息。使用密码子表示编码蛋白的信息。如本文所用,涉及特定多核苷酸或其所编码的蛋白的“全长序列”指具有天然(非合成)内源序列的整个核酸序列或整个氨基酸序列。全长多核苷酸编码该特定蛋白的全长、催化活性形式。
本文可互换地使用术语“多肽”、“肽”和“蛋白”,以指氨基酸残基的多聚物。该术语用于氨基酸多聚物,其中一个或多个氨基酸残基是相应天然存在的氨基酸的人工化学类似物。该术语还用于天然存在的氨基酸多聚物。
本文可互换地使用术语“残基”或“氨基酸残基”或“氨基酸”,以指被并入蛋白、多肽或肽(统称“蛋白”)的氨基酸。氨基酸可以是天然存在的氨基酸,并且除非另有限制,可以包括天然氨基酸的已知类似物,所述类似物可以以与天然存在的氨基酸相似的方式起作用。
如本文所用,可以互换地使用术语“分离的”和“纯化的”,以涉及核酸或多肽或其生物学活性部分,其基本上或本质上不含如在其天然存在的环境中所发现的通常伴随或反应于该核酸或多肽的组分。因而,用重组技术产生分离的或纯化的核酸或多肽时,分离的或纯化的核酸或多肽基本上不含其它细胞物质或培养基,或者化学合成分离的或纯化的核酸或多肽时,基本上不含化学前体或其它化学品。
“分离的”核酸通常不含在该核酸所衍生自的生物体的基因组DNA中天然侧翼于该核酸(即位于该核酸5’和3’端的序列)的序列(诸如,例如编码蛋白的序列)。例如,在各种实施方案中,所分离的核酸可以包含在该核酸所衍生自的细胞的基因组DNA中天然侧翼于该核酸的少于约5kb、4kb、3kb、2kb、1kb、0.5kb或0.1kb的核苷酸序列。
贯穿申请文件,将词语“包括”、“包含”或其变体理解成提示包含所称元素、整数或步骤,或者元素、整数或步骤的组,而非排除任何其它元素、整数或步骤,或者元素、整数或步骤的组。
如本文所用,术语“影响虫害”指对任何发育阶段的昆虫进食、生长和/或行为的有影响的改变,包括但不限于杀灭昆虫、延迟生长、阻碍生殖能力、拒食素活性等等。
如本文所用,术语“杀虫活性”是指生物体或物质(诸如,例如蛋白)的活性,其测量可以通过但不限于害虫死亡率、害虫体重减少、害虫驱避性以及进食和暴露适当长时间后害虫的其它行为和物理变化。因而,具有杀虫活性的生物体或物质不利地影响至少一种可测量的害虫健康参数。例如,“杀虫蛋白”是自身显示或与其它蛋白组合显示杀虫活性的蛋白。
如本文所用,术语“杀虫有效量”指存在于害虫环境的具有杀虫活性的物质或生物体的量。类似地,当害虫是昆虫时,“杀昆虫有效量”可以用于指“杀虫有效量”。
应理解如本文所用,术语“转基因的”包括基因型已通过异源核酸的存在而被改变的任何细胞、细胞系、愈伤组织、组织、植物部分或者植物,包括最初如此改变的那些转基因,以及通过有性杂交或无性 繁殖从所述最初的转基因产生的那些。如本文所用,术语“转基因的”不包括借助常规植物育种方法或者借助天然发生的事件对基因组(染色体或染色体外)的改变,所述天然发生的事件诸如随机异花受精、非重组病毒感染、非重组细菌转化、非重组转座或者自发突变。
“受试植物”或“受试植物细胞”是指遗传改造已经生效的植物或植物细胞,或者如此改造的植物或细胞的子代细胞,该子代细胞包含所述改造。“对照”或“对照植物”或“对照植物细胞”提供用于测量受试植物或植物细胞表型改变的参考点。
对照植物或植物细胞可以包括,例如:(a)野生型植物或细胞,即与遗传改造起始材料具有相同基因型的植物或细胞,所述遗传改造产生受试植物或细胞;(b)与所述起始材料具有相同基因型但已用空构建体(即用对目的性状无已知效果的构建体,诸如包含标志物基因的构建体)转化的植物或植物细胞;(c)是受试植物或植物细胞的非转化分离子的植物或植物细胞;(d)与所述受试植物或植物细胞在遗传上一致但未暴露于会诱导目的基因表达的条件或刺激物的植物或植物细胞;或(e)受试植物或植物细胞自身,其处于目的基因不被表达的条件下。
本领域技术人员会容易地认同,诸如位点特异性诱变和随机诱变、聚合酶链式反应方法和蛋白工程化技术的分子生物学领域的进步提供了广泛的适当的工具和操作步骤,以用于改造或者工程化农业上感兴趣的蛋白的氨基酸序列和潜在的基因序列。
在一些实施方案中,可以对本申请的核苷酸序列进行改变,以进行保守氨基酸替换。保守氨基酸替换的原则和实例在下文中进一步描述。在某些实施方案中,可以依照图1中公开的单子叶密码子偏好性对本申请的核苷酸序列进行不改变氨基酸序列的替换,例如可以用单子叶植物偏好的密码子替换编码同一氨基酸序列的密码子,而不改变该核苷酸序列所编码的氨基酸序列。
本申请还涉及对SEQ ID NO:1进一步优化所得的核苷酸序列。该方法的更多细节描述于Murray等人(1989)Nucleic Acids Res.17:477-498。优化核苷酸序列可用于提高杀虫蛋白在植物中的表达,所述植物例如单子叶植物,例如禾本科植物,例如玉米(Zea mays)。 如本文所用,术语“突变核苷酸序列”或“突变”或“诱变的核苷酸序列”指经诱变或改变而包含一个或多个核苷酸残基(例如碱基对)的核苷酸序列,所述核苷酸残基不存在于相应的野生型序列中。
在一些实施方案中,以编码同一氨基酸序列的不同密码子替换本申请中的部分核苷酸序列,从而在改变核苷酸序列的同时不改变其编码的氨基酸序列。保守变体包括由于遗传密码子简并性而编码实施方案的杀虫多肽中的一种的氨基酸序列的那些序列。在一些实施方案中,根据单子叶植物偏好密码子替换本申请中的部分核苷酸序列。
在一些实施方案中,突变体核苷酸序列还包括衍生的核苷酸序列,诸如使用例如位点定向诱变而产生的仍编码实施方案的杀虫蛋白的那些,诸如突变体毒素。在一些实施方案中,突变体核苷酸序列包括一个或多个核酸残基的添加、缺失或替换。在一些实施方案中,这样的添加、移除或替换可以导致相应的氨基酸残基的添加、移除或替换。一般来讲,实施方案的特定核苷酸序列的变体将与该特定核苷酸序列具有至少约70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的序列一致性。通过下文所述的序列比对程序确定序列一致性。实施方案的突变体核苷酸序列与本申请的序列的差异可以少至1-15个核苷酸、少至1-10个(例如6-10个),少至5个,少至4、3、2或甚至1个核苷酸。
在一些实施方案中,突变体核苷酸序列可以编码具有改良的或降低的杀昆虫活性的突变体蛋白。这样的杀虫活性相对天然蛋白可以是不同的或者是改良的,或者它可以是不变的,只要保留了杀虫活性。突变体蛋白包括衍生自天然蛋白的多肽,所述衍生是通过缺失(所谓的截短)天然蛋白N末端和/或C末端的一个或多个氨基酸或将一个或多个氨基酸添加至所述天然蛋白的N末端和/或C末端;在天然蛋白的一个或多个位点缺失或添加一个或多个氨基酸;或者在天然蛋白的一个或多个位点取代一个或多个氨基酸。
实施方案包括的突变体蛋白具有生物学活性,即它们继续具有天然蛋白的所需的生物学活性,所述活性即本文所述的杀虫活性。所述变体可以得自例如基因多态性或人类的操作。本领域技术人员会理解, 只要所编码多肽保留杀虫活性,任何有用的突变可以被添加至实施方案的序列。在一些实施方案中,突变体蛋白的氨基酸序列将与本申请的蛋白的氨基酸序列具有至少约60%、65%、70%、75%、80%、85%、86%、87%、88%、89%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%或更高的序列一致性。在一些实施方案中,突变体蛋白与本申请的蛋白的差异可以少至1-15个氨基酸残基、少至1-10个(例如6-10个),少至5个,少至4、3、2或甚至1个氨基酸残基。
在一些实施方案中,也可以突变序列,以致所编码多肽对蛋白酶的蛋白水解消化具有抗性。突变可以保护该多肽免于蛋白酶降解,所述保护例如是通过从不同区域移除诸如推定的丝氨酸蛋白酶位点和弹性蛋白酶识别位点的推定的蛋白水解位点。可以移除或改造这些推定位点的一些或全部,以致原始位点位置的蛋白水解被降低。可以通过比较突变体多肽和野生型毒素或者通过比较氨基酸序列各不相同的突变体毒素,来评价蛋白水解的变化。蛋白水解位点和推定的蛋白水解位点包括但不限于以下序列:胰蛋白酶切割位点、糜蛋白酶位点和胰蛋白酶位点。只要所述多肽的杀虫活性被提高,可以通过添加或缺失任意数目和种类的氨基酸残基来改造这些位点。因而,相对于天然序列或背景序列,由包含突变的核苷酸序列编码的多肽将包含至少一个氨基酸改变或添加,或者2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、32、35、38、40、45、47、50、60、70、80、90、100、110、120、130、140、150、160、170、180、190、200、210、220、230、240、250、260、270、280、290、300或更多个氨基酸改变或添加。
本领域技术人员会认识到氨基酸添加和/或取代通常基于氨基酸侧链取代基的相对相似性,例如,所述取代基的疏水性、电荷、大小等等。具有各种前述所考虑性质的示例性氨基酸取代基团为本领域技术人员所公知,并且包括精氨酸与赖氨酸;谷氨酸和天门冬氨酸;丝氨酸和苏氨酸;谷氨酰胺和天冬酰胺;以及缬氨酸、亮氨酸和异亮氨酸。关于不影响目的蛋白生物学活性的适当氨基酸取代的指南可以在Dayhoff等人(1978)Atlas of Protein Sequence and Structure(蛋白序列 和结构图集)(Natl.Biomed.Res.Found.,Washington,D.C)(通过引用并入本文)的模型中找到。可以进行诸如将一个氨基酸换作具有相似性质的另一个氨基酸的保守性取代。
当在进行取代、缺失或插入前,难以预测其确切效果时,本领域技术人员将理解所述效果将通过诸如昆虫进食分析的常规筛选分析来评价。参见,例如,通过引用并入本文的Marrone等人(1985)J.Econ.Entomol.78:290-293和Czapla and Lang(1990)J.Econ.Entomol.83:2480-2485。
在一些实施方案中,可以在实施方案的核苷酸序列和其它已知的Cry核苷酸序列的对应部分之间重组全长编码序列、编码目的结构域的序列基序或者实施方案的核苷酸序列的任意片段,从而获得具有改良性质的新基因。
受到关注的性质包括但不限于每单位杀虫蛋白的杀虫活性、蛋白稳定性、对非靶物种、特别是对人类、家畜以及表达实施方案的杀虫多肽的植物和微生物的毒性。实施方案不受特定重排策略的限制,重排可以仅涉及本文所公开的核苷酸序列,或者可以另外涉及重排本领域已知的其它核苷酸序列。DNA重排策略为本领域所已知。
序列一致性的鉴定包括杂交技术。例如,将已知核苷酸序列的全部或部分用作与其它相应核苷酸序列选择性杂交的探针,所述其它相应核苷酸序列存在于来自所选生物体的已克隆基因组DNA片段或cDNA片段群(即基因组文库或cDNA文库)。所述杂交探针可以是基因组DNA片段、cDNA片段、RNA片段或其它寡核苷酸,并且可以用诸如32P的可检测基团或其它可检测标志物来标记。因而,例如,可以通过标记基于实施方案序列的合成寡核苷酸制备杂交探针。制备杂交探针和构建cDNA及基因组文库的方法通常为本领域已知。
在一些实施方案中,可以将本文公开的完整序列或者其一个或多个部分用作能够与对应序列和信使RNA特异性杂交的探针。为在各种条件下完成特异性杂交,所述探针包含独特于实施方案序列并且通常长至少约10或20个核苷酸的序列。可以使用所述探针,以通过PCR从所选生物体扩增相应的Cry序列。可以使用该技术,以从所需生物 体分离其它编码序列,或将该技术用作诊断分析,以确定生物体是否存在编码序列。杂交技术包括杂交筛选所接种的DNA文库。
可以在严紧条件下进行所述序列的杂交。如本文所用,术语“严紧条件”或“严紧杂交条件”表示如下条件,即在该条件下,相对于与其它序列杂交,探针将以可检测的更大程度(例如,背景的至少2倍、5倍或10倍)与其靶序列杂交。严紧条件是序列依赖性的并且在不同环境中有所不同。通过控制杂交严紧性和/或控制清洗条件,可以鉴定与所述探针100%互补的靶序列(同源探针法)。可选择地,可以调节严紧条件,以允许一些序列错配,以便检测较低的相似度(异源探针法)。通常,探针长度少于约1000或500个核苷酸。
通常,严紧条件是如下的条件,即在该条件中,盐浓度为pH 7.0至8.3下,少于约1.5M Na离子,通常约0.01M至1.0M Na离子浓度(或其它盐),并且温度条件为:当用于短探针时(例如10到50个核苷酸),至少约30℃;当用于长探针时(例如大于50个核苷酸),至少约60℃。还可以通过添加诸如甲酰胺的去稳定剂来实现严紧条件。示例性的低严紧条件包括37℃下使用30%至35%的甲酰胺缓冲液、1M NaCl、1%SDS(十二烷基硫酸钠)杂交,50℃至55℃下在1×至2×SSC(20×SSC=3.0M NaCl/0.3M柠檬酸三钠)中清洗。示例性的中度严紧条件包括37℃下在40%至45%甲酰胺、1.0M NaCl、1%SDS中杂交,55℃至60℃下在0.5×至1×SSC中清洗。示例性的高严紧条件包括37℃下在50%甲酰胺、1M NaCl、1%SDS中杂交,60℃至65℃下在0.1×SSC中最后清洗至少约20分钟。任选地,清洗缓冲液可以包含约0.1%至约1%SDS。杂交持续时间通常少于约24小时,通常为约4小时至约12小时。
特异性通常依赖杂交后的清洗,关键因素在于最后清洗溶液的离子强度和温度。DNA-DNA杂合体的Tm(热力学熔点)可以近似自Meinkoth and Wahl(1984)Anal.Biochem.138:267-284的公式:Tm=81.5℃+16.6(log M)+0.41(%GC)-0.61(%甲酰胺)-500/L;其中M是一价阳离子的克分子浓度,%GC是DNA中鸟苷和胞嘧啶核苷酸的百分数,“甲酰胺%”是杂交溶液的甲酰胺百分数,而L是杂合体的碱 基对长度。Tm是(确定的离子强度和pH下)50%的互补靶序列与完全匹配的探针杂交时的温度。通常将清洗至少进行至达到平衡,并且达到低的杂交背景水平,诸如进行2小时、1小时或30分钟。
每1%的错配对应使Tm降低约1℃;因而,可以调节Tm、杂交和/或清洗条件,从而与所需一致性的序列杂交。例如,如果需要≥90%一致性的序列,可以将Tm降低10℃。通常,将严紧条件选择为比确定离子强度和pH下的特异序列及其互补序列的Tm低约5℃。然而,在非常严紧的条件下,可以在比所述Tm低1℃、2℃、3℃或4℃下进行杂交和/或清洗;在中度严紧条件下,可以在比所述Tm低6℃、7℃、8℃、9℃或10℃下进行杂交和/或清洗;在低严紧条件下,可以在比所述Tm低11℃、12℃、13℃、14℃、15℃或20℃下进行杂交和/或清洗。
在一些实施方案中,还包括核苷酸序列及其编码的氨基酸序列的片段。如本文所用,术语“片段”指实施方案的多核苷酸的核苷酸序列的一部分或者多肽的氨基酸序列的一部分。核苷酸序列的片段可以编码蛋白片段,所述蛋白片段保留天然或相应全长蛋白的生物学活性,并因而具有杀虫活性。突变体蛋白包括天然蛋白的生物活性片段,其包含保留天然蛋白生物学活性,即具有杀虫活性的足够数目的连续氨基酸残基。
本领域已知Bt毒素的杀虫活性通常通过各种蛋白酶在昆虫肠内对所述肽的切割被活化。因为肽在昆虫肠内不总是以全效切割,所以全长毒素的片段相对于全长毒素自身可以具有增强的杀虫活性。在一些实施方案中,还可以通过截短天然或全长序列来提高多肽的杀虫活性。
因而,在一些实施方案中,本申请涉及全长杀虫多肽的截短形式或片段。在一些实施方案中,所述多肽片段、变异体和突变中的一些将相对于其衍生自的天然存在的杀昆虫多肽的活性,具有增强的杀虫活性。在一些实施方案中,所述多肽片段、变异体和突变中的一些将相对于其衍生自的天然存在的杀昆虫多肽的活性,具有减弱的杀虫活性。
编码实施方案的杀虫蛋白生物学活性部分的实施方案的核苷酸序列片段将编码至少15、25、30、50、100、200、300、400、500或600个连续的氨基酸,或者编码多达实施方案的杀虫多肽中存在的全部数量的氨基酸。作为实施方案核苷酸序列片段的核酸包括至少16、20、50、75、100、150、200、250、300、350、400、450、500、600、700、800、1,000、1,200、1,400、1,600或1,800个核苷酸,或者多达本文公开的核苷酸序列中所存在数量的核苷酸。特定实施方案涉及衍生自(例如产生自)实施方案的第一核酸的片段,其中所述片段编码以杀虫活性为特征的截短的毒素。实施方案的多核苷酸片段所编码的截短的多肽的特征在于等价或改良的杀虫活性,所述等价或改良是相对于该片段衍生自的第一核酸所编码的相应全长多肽的活性。所涉及的是实施方案的该核酸片段可以在天然或相应全长编码序列的3’端被截短。核酸片段还可以在天然或相应全长编码序列的5’和3’端均被截短。
本申请涉及表达盒,其特征在于,包含上述分离的核酸分子。本申请不限定表达盒中具体使用的启动子和终止子,只要其适于在植物中表达即可。在一实施方案中,所述核酸分子与35S启动子和nos终止子可操作地连接。
本申请还涉及表达载体,其包含上述分离的核酸分子。在一些实施方案中,表达载体包含上述表达盒。在一些实施方案中,所述表达载体还包含PolyA序列和omega增强子。在一些实施方案中,表达载体还包含可以用于检测所述表达载体在细胞中表达情况的其他表达盒。
一些实施方案还包括转化的微生物,例如农杆菌或大肠杆菌。所述转化使用至少一种实施方案的核酸、包含所述核酸的表达盒或者包含所述表达盒的载体。在一些实施方案中,所述微生物是依靠植物增殖的微生物。
一些实施方案还包括转化的植物细胞或转基因植物,其包含至少一种实施方案的核苷酸序列。在一些实施方案中,使用表达载体转化植物,所述表达载体包含至少一种实施方案的核苷酸序列以及与其可操作地连接的在植物细胞中驱动表达的启动子。转化的植物细胞和转 基因植物表示基因组内包含异源多核苷酸的植物细胞或植物。一般来说,所述异源多核苷酸在转化的植物细胞或转基因植物的基因组内稳定地整合,以致将所述多核苷酸传递给后代。可以将所述异源多核苷酸单独地或作为表达载体的一部分整合进基因组。
在一些实施方案中,本申请涉及的植物为单子叶植物;任选地,所述植物选自:玉米、水稻、小麦、燕麦、大麦、青稞、粟、高粱和甘蔗。
在一些实施方案中,本申请涉及的植物包括植物细胞、植物原生质体、可以再生出植物的植物细胞组织培养物、植物愈伤组织、植物团块和植物细胞,其为完整的植物或者植物的部分,诸如胚胎,花粉,胚珠,种子,叶,花,枝,果实,果仁,穗,穗轴,壳,秸秆,根,根尖,花药等等。本申请还包括源于本申请的转基因植物或其子代、并因而至少部分地包含本申请的核苷酸序列的植物细胞、原生质体、组织、愈伤组织、胚胎以及花、茎、果实、叶以及根。
虽然实施方案不依赖特定生物学机制来增加植物对植物害虫的抗性,但是实施方案的核苷酸序列在植物中的表达可以导致产生实施方案的杀虫蛋白以及提高所述植物对植物害虫的抗性。实施方案的植物可以用于农业上影响虫害的方法。某些实施方案提供转化的农作物植物,其可以用于影响该植物的虫害的方法,所述虫害诸如鳞翅目害虫。
鳞翅目害虫包括但不限于夜蛾科(Noctuidae)的害虫:秋粘虫(Spodoptera frugiperda)、甜菜夜蛾(Spodoptera exigua)、斜纹夜蛾(Spodoptera litura)、蓓带夜蛾(Mamestra configurata)、甘蓝夜蛾(Mamestra brassicae)、黑切根虫(Agrotis ipsilon)、西部切根虫(Agrotis orthogonia)、黄地老虎(Agrotis segetum),木棉虫(Alabama argillacea)、粉纹夜蛾(Trichoplusia ni)、大豆夜蛾(Pseudoplusia includens)、黎豆夜蛾(Anticarsia gemmatalis)、苜蓿绿夜蛾(Hypena scabra)、烟芽夜蛾(Heliothis virescens)、一星粘虫(Pseudaletia unipuncta)、粗皮夜蛾(Athetis mindara)、暗缘地老虎(Euxoa messoria)、埃及金刚钻(Earias insulana)、翠纹金刚钻(Earias vittella)、美洲棉铃虫(Helicoverpa armigera)、谷实夜蛾(Helicoverpa zea);螟蛾科(Pyralidae)的害虫:欧 洲玉米螟(Ostrinia nubilalis)、亚洲玉米螟(Ostrinia furnacalis)、脐橙螟(Amyelois transitella)、地中海粉螟(Anagasta kuehniella)、干果斑螟(Cadra cautella)、二化螟(Chilo suppressalis)、斑禾草螟(Chilo partellus)、米蛾(Corcyra cephalonica)、玉米根结网毛虫(Crambus caliginosellus)、蓝草结网毛虫(Crambus teterrellus)、稻纵卷叶野螟(Cnaphalocrocis medinalis)、葡萄卷叶虫(Desmia funeralis)、甜瓜绢野螟(Diaphania hyalinata)、西南玉米螟(Diatraea grandiosella)、小蔗螟(Diatraea saccharalis)、墨西哥稻螟(Eoreuma loftini)、烟草粉螟(Ephestia elutella)、蜡螟(Galleria mellonella)、水稻切叶野螟(Herpetogramma licarsisalis)、向日葵斑螟(Homoeosoma electellum)、南美玉米苗斑螟(Elasmopalpus lignosellus)、小蜡螟(Achroia grisella)、草地螟(Loxostege sticticalis)、豆野螟(Maruca testulalis)、印度谷螟(Plodia interpunctella)、三化螟(Scirpophaga incertulas)、温室螟(Udea rubigalis);以及卷蛾科(Tortricidae)的害虫:黑头长翅卷蛾(Acleris variana)、果树黄卷蛾(Archips argyrospila)、欧洲卷叶蛾(Archips rosana)、桔带卷蛾(Argyrotaenia citrana)、玫瑰色卷蛾(Choristoneura rosaceana);以及其他:棉褐带卷蛾(Adoxophyes orana)、条纹向日葵螟(Cochylis hospes)、榛小卷蛾(Cydia latiferreana)、苹果蠹蛾(Cydia.pomonella)、杂色卷叶蛾(Platynota flavedana)、荷兰石竹小卷蛾(Platynota stultana)、欧洲葡萄花翅小卷叶蛾(Lobesia botrana)、苹白小卷蛾(Spilonota ocellana)、葡萄果实蛀虫(Endopiza viteana)、女贞细卷蛾(Eupoecilia ambiguella)、巴西苹果卷叶蛾(Bonagota salubricola)、梨小食心虫(Grapholita molesta)和向日葵芽蛾(Suleima helianthana)等。
鳞翅目的所选其它农艺害虫包括但不限于:秋星尺蠖(Alsophila pometaria)、棉潜蛾(Bucculatrix thurberiella)、苜蓿黄蝶(Colias eurytheme)、胡桃黄蝶(Datana integerrima)、白尺蠖(Ennomos subsignaria)、菩提尺蠖(Erannis tiliaria)、黄毒蛾(Euproctis chrysorrhoea)、黑拟蛉蛾(Harrisina americana)、美国白蛾(Hyphantria cunea)、番茄蠹蛾(Keiferia lycopersicella)、二尾蛱蝶(Lambdina fiscellaria fiscellaria)、西部铁杉尺蠖(Lambdina fiscellaria lugubrosa)、 柳毒蛾(Leucoma salicis)、舞毒蛾(Lymantria dispar)、番茄天蛾(Manduca quinquemaculata)、烟草天蛾(Manduca sexta)、冬尺蠖(Operophtera brumata)、春尺蠖(Paleacrita vernata)、大凤蝶(Papilio cresphontes)、加州株虫(Phryganidia californica)、柑橘潜叶蛾(Phyllocnistis citrella)、斑幕潜叶蛾(Phyllonorycter blancardella)、大菜粉蝶(Pieris brassicae)、小菜粉蝶(Pieris rapae)、暗脉菜粉蝶(Pieris napi)、小菜蛾(Plutella xylostella)、棉红铃虫(Pectinophora gossypiella)、杂食尺蠖(Sabulodes aegrotata)、麦蛾(Sitotroga cerealella)、松异舟蛾(Thaumetopoea pityocampa)、袋衣蛾(Tineola bisselliella)、番茄斑潜蝇(Tuta absoluta)和苹果巢蛾(Yponomeuta padella)。
实施例
实施例1合成的cry1CgerZM编码序列及其特征分析
以编码苏云金芽孢杆菌杀虫晶体蛋白的基因cry1Ca5为模板,根据单子叶植物密码子偏好性(单子叶植物密码子使用偏好性如图1所示),改造获得基因cry1CgerZM序列,如序列SEQ ID NO:1所示。改造合成的cry1CgerZM基因具有如下特点:密码子偏好指数(CAI)达86%;G+C含量达60.13%;去除了11个限制性酶作用位点和13个顺式作用元件;去除了重复序列。
对cry1Ca5进行改造的具体步骤包括:去除其3’端128个氨基酸编码序列,保留5’端630个氨基酸序列;利用氨基酸序列反推其编码核苷酸序列,根据单子叶植物密码子偏好性优选使用单子叶植物基因密码子高频使用序列,得到初步改造序列;对初步改造序列中常用的限制性内切酶作用位点、富含AT的位点以及其他有可能形成不稳定二级结构的序列进行氨基酸序列保守的密码子替换以避免产生上述位点,最终获得改造序列。
实施例2载体构建
为提高基因转录本在植物细胞中的表达水平,设计载体表达盒,载体P35s-cry1CgerZm-Tnos区域如图2所示,包含cry1CgerZM基因 的表达盒还包括如下元件:35S启动子、PolyA序列结构、omega增强子和T-nos终止子。根据SEQ ID NO:1所示的序列,人工合成cry1CgerZm基因,同时从pCambia3300载体上PCR扩增bar基因,同时为其两端添加BamHI和SacI位点。构建到同一遗传转化载体pZHZH25025中。
载体pZHZH25025的具体构建过程为:将PCR得到的bar基因片段用BamHI和SacI酶切,将PU130载体(该载体为pCambia3300的衍生载体,其构建过程是:pCambia3300经XhoI和HindIII酶切处理,用玉米泛素启动子Pubi取代P35s-bar部分得到PU130)用BglII和SacI酶切,连接后得到骨架载体Pubi-bar-T35spolyA;PCR扩增35S启动子并在其两端分别添加HindIII和BamHI酶切位点,PCR扩增nos终止子并在其两端添加EcoRI和PmeI酶切位点;人工合成cry1CgerZm基因片段,5’端添加增强子元件omega增强子,另添加酶切位点5’-HindIII-BamHI和EcoRI-PmeI-3’,将该基因克隆到合成公司提供的克隆载体pUC57simple上形成中间载体pUC57-cry1CgerZm;分别用HindIII和BamHI切割P35S片段和中间载体pUC57-cry1CgerZm,连接后得到中间载体P35S-cry1CgerZm;再分别使用EcoRI和PmeI切割nos和中间载体P35S-cry1CgerZm,连接后得到中间载体P35S-cry1CgerZm-Tnos。使用HindIII和PmeI双酶切骨架载体Pubi-bar-T35spolyA以及中间载体P35S-cry1CgerZm-Tnos。连接上述处理后的骨架片段和插入片段P35S-cry1CgerZm-Tnos,构建得到pZHZH25025载体。
实施例3转基因玉米的获得
根据申请人在审的申请公布号为CN104745622A的专利申请所描述的方法,将重组pZHZH25025载体通过农杆菌介导的遗传转化方法导入到中国种子集团有限公司提供的玉米自交系祥249中,得到转基因抗虫玉米。
具体地,将转化载体pZHZH25025通过电击法转入农杆菌(Agrobacterium tumefaciens)EHA105中。将玉米自交系祥249的新鲜 剥取的自交授粉后10天的幼胚(大小为1.0-2.0mm)放入含有悬浮液的2ml塑料离心管中。吸去悬浮液后,加入农杆菌菌液,侵染5min,倒入共培养基上,并用移液器吸去表面多余的农杆菌菌液,于23℃黑暗共培养3天。共培养后,将幼胚转移到休息培养基中,于28℃黑暗培养6天后,放至含适当浓度双丙胺膦的筛选培养基上,筛选培养2个周期,每个周期为2周。将抗性愈伤组织转移至分化培养基I中,25℃,5000lx,光照培养1周。再将愈伤组织转移至分化培养基II中,光照培养2周;将分化出的小苗转移至生根培养基上,25℃,5000lx,光照培养至生根;将小苗转入小盆中生长,同时取样用于分子检测。
实施例4转基因玉米的分子检测
T0代转化苗的分子检测包括阳性、拷贝数和骨架检测。采用天根试剂盒Tiagen DP320对玉米基因组DNA进行抽提。实时PCR反应体系如下表所示,内参基因IVR的正向(F)和反向引物(R)如下所示;目标基因cry1CgerZm的正向和反向引物如下所示;骨架片段ORI的正向和反向引物如下所示。
玉米内参IVR(单拷贝)引物序列:
F-ACTAGGCATCCAAGGCGAACG
R-AGTGCGAGAAGAACGAGTGTCC
目标基因cry1CgerZm引物序列:
F-CGACATTTCCCTCTCCCTGGTTC
R-AGGTTAGCGATAGCAGCGTTCC
骨架片段ORI引物序列:
F-AACAAGACGAACTCCAATTCACTG
R-TGTTGATTGTAACGATGACAGAGC
表1 实时PCR反应体系
PCR反应在ABI 7900上进行,反应程序为:95℃预变性10分钟;30个以下循环:95℃变性10秒,60℃复性与延伸55秒,检测示例示意图如图3所示。
实时PCR反应完成后,根据仪器生成的内参基因和目标基因的平均Ct(扩增循环数)值和推算公式RQ=2-ΔCt,计算对应样本的RQ值。内参基因IVR为玉米单拷贝基因。根据RQ值,可以计算出目的基因的相对拷贝数。具体依据为:单拷贝RQ值为0.5左右,双拷贝RQ值为1.0左右。
检测结果如表2所示,选择RQ值在0.1-1.0范围内的材料,即外源基因低拷贝插入玉米基因组的材料进行后续实验。
表2 T0代转基因玉米实时PCR检测结果
实施例5转基因玉米抗虫性鉴定
采用离体倒二叶鉴定法对转基因玉米抗虫性进行鉴定:当玉米长到6-7叶时,剪取倒二叶叶端部分,放入直径9cm的培养皿中,皿底 以1300μL蒸馏水打湿滤纸以保持高湿。每皿中接亚洲玉米螟(Ostrinia furnacalis)初孵幼虫10头,并用透气性较好的医用胶布封口。每株3个重复,以未转基因的自交系作对照。温度28℃、湿度75%、光照(L):黑暗(D)=14:10条件下培养。4天后检查每皿的死虫头数,并计算幼虫死亡率及校正死亡率。
校正死亡率(%)=(处理死亡率-对照死亡率)/(1-对照死亡率)
取两个含有不同版本的对照cry1C基因的T0代抗虫基因低拷贝(1-2个拷贝)插入的转基因玉米材料作为对照植物与本申请的转cry1CgerZm基因的玉米做抗虫鉴定对比实验。这两种版本cry1C基因分别是:cry1C*(CN 1483823A)和cry1C(US 6043415)。为消除载体元件对于基因表达的影响因素,实验所用的三个转化载体,除抗虫基因不同,载体其他元件一致,对照植物的转化步骤及生长条件也与转化植物相同。对照植物的制备参照实施例2和3的步骤。
实验室生物测定结果如表3所示,单子叶植物密码子偏好性优化的cry1CgerZm基因的杀虫效果最好,平均矫正死亡率为63%,供试的10个T0代转化事件中有1个达100%的矫正死亡率,而cry1C*和cry1Cger两个基因的转化事件均无达100%的矫正死亡率,且平均矫正死亡率均低于cry1CgerZm基因的转化事件,分别为32%和41%。方差分析显示,3个版本cry1C基因转化事件玉米螟的矫正死亡率达显著差异(p=0.02,<0.05)。
表3 不同版本cry1C基因转化载体的T0代转化事件的抗虫鉴定
虽然,上文中已经用一般性说明及具体实施方案对本申请作了详尽的描述,但在本申请基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本申请精神的基础上所做的这些修改或改进,均属于本申请要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!