一种植物磷转运蛋白ZmPHT1;7及其编码基因和应用的制作方法
本发明涉及一种植物磷转运蛋白ZmPHT1;7及其编码基因和应用。
背景技术:
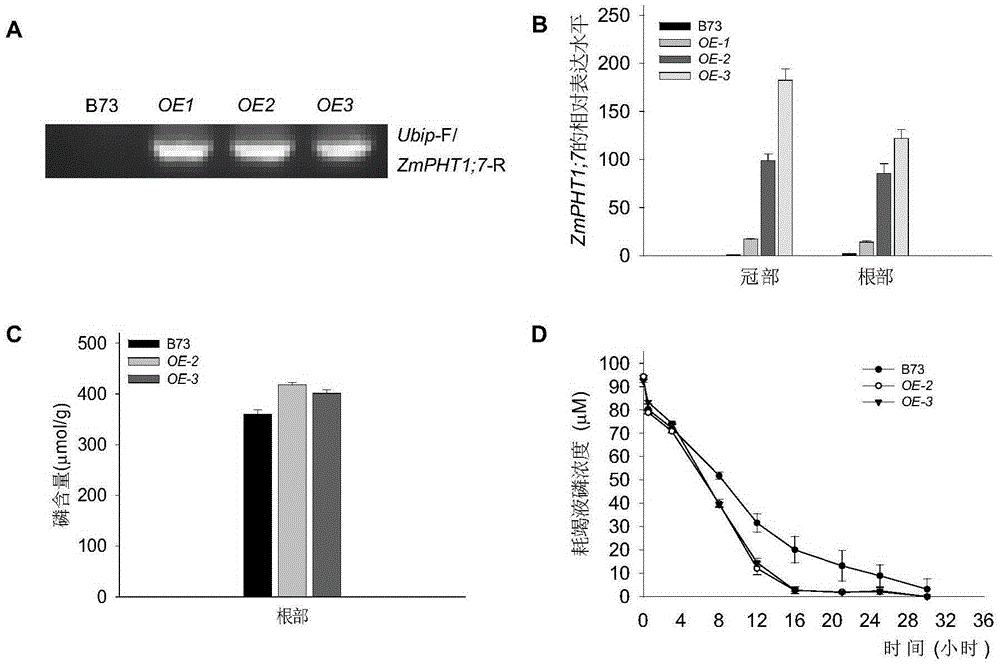
:磷是植物生长必需的大量元素之一,参与植物的细胞构成、生长发育、物质代谢和能量代谢等。植物细胞中的磷浓度一般维持在mM水平,而土壤溶液中有效磷的浓度极低,一般低于10μM,植物/作物经常面临低磷胁迫,土壤缺磷成为农业生产的重要限制因素。磷肥施入土壤后,无机磷容易被土壤中的重金属等固定,成为不容易被植物/作物吸收的磷,造成磷肥的当季利用效率低,一般为10%-25%。另外,大量施用磷肥会造成环境污染。玉米是禾本科草本植物,学名玉蜀黍,俗称棒子、玉茭、苞米、苞谷。中国各地都有种植,尤以东北、华北和西南各省较多。玉米是粗粮中的保健佳品,食用玉米对人体健康颇为有利。玉米在我国粮食安全中起着极其重要的作用,是重要的饲料作物,又是食品、化工、燃料、医药等行业的重要原料。据统计,中国2012年玉米产销量仅次于美国,2012年中国玉米产量200000千吨,消费201000千吨,说明玉米是重要的粮食作物。磷对玉米的生长发育、籽粒产量和质量有重要作用。磷素充足时,玉米早熟,籽粒色泽和品质好,产量高。玉米幼苗期缺磷,会导致玉米生长缓慢,硝态氮积累,蛋白质合成受阻,叶片呈现紫红色。雌雄穗分化时缺磷,则果穗发育受阻,穗顶绕缩,易形成空秆。授粉期缺磷,则授粉不良,果穗卷曲,导致缺行、缺粒或秃尖,品质下降。提高玉米的磷吸收和转移速率将有助于提高玉米对磷肥的利用效率,减少磷肥的施用,减少环境污染。技术实现要素:本发明的目的是提供一种植物磷转运蛋白ZmPHT1;7及其编码基因和应用。本发明提供的蛋白质,命名为ZmPHT1;7蛋白,获自玉米自交系B73,是如下(a)或(b):(a)由序列表中序列1所示的氨基酸序列组成的蛋白质;(b)将序列1的氨基酸序列经过一个或几个氨基酸残基的取代和/或缺失和/或添加且与植物磷转运相关的由序列1衍生的蛋白质。为了使(a)中的蛋白质便于纯化,可在由序列表中序列1所示的氨基酸序列组成的蛋白质的氨基末端或羧基末端连接上如表1所示的标签。表1标签的序列标签残基序列Poly-Arg5-6(通常为5个)RRRRRPoly-His2-10(通常为6个)HHHHHHFLAG8DYKDDDDKStrep-tagII8WSHPQFEKc-myc10EQKLISEEDL上述(b)中的蛋白质可人工合成,也可先合成其编码基因,再进行生物表达得到。上述(b)中的蛋白质的编码基因可通过将序列表中序列2所示的DNA序列中缺失一个或几个氨基酸残基的密码子,和/或进行一个或几个碱基对的错义突变,和/或在其5′端和/或3′端连上表1所示的标签的编码序列得到。编码ZmPHT1;7蛋白的基因也属于本发明的保护范围,将其命名为ZmPHT1;7基因。所述ZmPHT1;7基因为如下1)或2)或3)的DNA分子:1)编码区如序列表中序列2所示的DNA分子;2)在严格条件下与1)限定的DNA序列杂交且编码植物磷转运相关蛋白的DNA分子;3)与1)或2)限定的DNA序列具有90%以上同源性且编码植物磷转运相关蛋白的DNA分子。上述严格条件可为在6×SSC、0.5%SDS的溶液中,在65℃下杂交,然后用2×SSC、0.1%SDS和1×SSC、0.1%SDS各洗膜一次。含有ZmPHT1;7基因的重组表达载体、表达盒、转基因细胞系或重组菌均属于本发明的保护范围。可用现有的植物表达载体构建含有ZmPHT1;7基因的重组表达载体。所述植物表达载体包括双元农杆菌载体和可用于植物微弹轰击的载体等。所述植物表达载体还可包含外源基因的3’端非翻译区域,即包含聚腺苷酸信号和任何其它参与mRNA加工或基因表达的DNA片段。所述聚腺苷酸信号可引导聚腺苷酸加入到mRNA前体的3’端。使用ZmPHT1;7基因构建重组表达载体时,在其转录起始核苷酸前可加上任何一种增强型启动子或组成型启动子,它们可单独使用或与其它的植物启动子结合使用;此外,使用ZmPHT1;7基因构建重组表达载体时,还可使用增强子,包括翻译增强子或转录增强子,但必需与编码序列的阅读框相同,以保证整个序列的正确翻译。所述翻译控制信号和起始密码子的来源是广泛的,可以是天然的,也可以是合成的。翻译起始区域可以来自转录起始区域或结构基因。为了便于对转基因植物细胞或植物进行鉴定及筛选,可对所用植物表达载体进行加工,如加入可在植物中表达的编码可产生颜色变化的酶 或发光化合物的基因、具有抗性的抗生素标记物或是抗化学试剂标记基因等。从转基因植物的安全性考虑,可不加任何选择性标记基因,直接以逆境筛选转化植株。所述重组表达载体具体可为将ZmPHT1;7基因插入pSuper1300载体的多克隆位点(例如HindⅢ和SpeI酶切位点之间)得到的重组质粒。所述重组表达载体具体可为将ZmPHT1;7基因插入载体pCXUN的多克隆位点(例如XcmI酶切位点)得到的重组质粒。本发明还保护ZmPHT1;7蛋白的应用,为如下(c1)至(c7)中的至少一种:(c1)调控植物的磷含量;(c2)促进植物的磷含量增加;(c3)调控植物的磷吸收速率;(c4)促进植物的磷吸收速率增加;(c5)调控植物生长;(c6)促进植物生长;(c7)促进植物中的磷元素从老叶向新叶转移。以上任一所述植物为单子叶植物或双子叶植物。所述双子叶植物具体可为拟南芥,例如瓦斯莱拟南芥。所述单子叶植物具体可为玉米,例如玉米自交系B73。本发明还保护一种培育转基因植物的方法,是将ZmPHT1;7基因导入目的植物中,得到转基因植物;所述转基因植物满足如下(d1)至(d5)中的至少一种表型:(d1)磷含量高于所述目的植物;(d2)磷吸收速率高于所述目的植物;(d3)磷转移速率高于所述目的植物;(d4)生物量高于所述目的植物;(d5)生长能力高于所述目的植物。所述ZmPHT1;7基因具体可通过所述重组表达载体导入所述目的植物。所述方法中,所述重组表达载体可通过使用Ti质粒、Ri质粒、植物病毒载体、直接DNA转化、显微注射、电导、农杆菌介导等常规生物学方法转化植物细胞或组织,并将转化的植物组织培育成植株。所述ZmPHT1;7基因具体可通过所述重组质粒导入所述目的植物中。所述目的植物为单子叶植物或双子叶植物。所述双子叶植物具体可为拟南芥,例如瓦斯莱拟南芥。所述单子叶植物具体可为玉米,例如玉米自交系B73。本发明还保护ZmPHT1;7蛋白、ZmPHT1;7基因、所述重组表达载体、表达盒、转基因细胞系或重组菌或以上任一所述所述方法在育种中的应用。所述育种具体可为培育磷高效植物。所述磷高效为磷吸收速率高和/或磷转移速率高。所述植物为单子叶植 物或双子叶植物。所述双子叶植物具体可为拟南芥,例如瓦斯莱拟南芥。所述单子叶植物具体可为玉米,例如玉米自交系B73。本发明提供了玉米中参与植物磷吸收和磷转运的蛋白和基因,对于进一步阐明植物磷营养的分子机理并通过基因工程的技术手段培育磷营养高效的作物新品种具有重要的理论意义和实践意义。附图说明图1为实施例2的结果。图2为实施例3的步骤四中ZmPHT1;7插入鉴定、ZmPHT1;7基因表达鉴定、根部磷含量检测和磷吸收指标检测的结果。图3为实施例3的步骤四中低磷胁迫条件下,ZmPHT1;7玉米过量表达材料的表型和生理指标测定的结果。具体实施方式以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为自常规生化试剂商店购买得到的。以下实施例中的定量试验,均设置三次重复实验,结果取平均值。pSuper1300载体:参考文献:Shietal.EthylenesignalingnegativelyregulatesfreezingtolerancebyrepressingexpressionofCBFandtype-AARRgenesinArabidopsis.PlantCell2012,24:2578-2595。农杆菌菌株GV3101:参考文献:Leeetal.,AgrobacteriumtumefacienspromotestumorinductionbymodulatingpathogendefenseinArabidopsisthaliana.PlantCell2009,21:2948-2962。拟南芥pht1;1Δ4Δ突变体(即文献中的pht1;1Δ4Δmutant):参考文献:Shinetal.,PhosphatetransportinArabidopsis:Pht1;1andPht1;4playamajorroleinphosphateacquisitionfrombothlow-andhigh-phosphateenvironments.PlantJournal2004,39:629-642。实施例中的野生型拟南芥(WT)为瓦斯莱(Wassilewskija)拟南芥。农杆菌EHA105:参考文献:Nyabogaetal.,Agrobacterium-mediatedgenetictransformationofyam(Dioscorearotundata):animportanttoolforfunctionalstudyofgenesandcropimprovement.FrontiersinPlantScience.2014,5:463。玉米自交系B73(即文献中的MaizeB73):参考文献:Weietal,ThePhysicalandGeneticFrameworkoftheMaizeB73Genome.PlosGenetics2009,5: e1000715。MS培养基(Pi浓度为1.25mM)的制备方法:将1650mgNH4NO3、1900mgKNO3、370mgMgSO4·7H2O、170mgKH2PO4、440mgCaCl2·2H2O、22.3mgMnSO4·4H2O、0.83mgKI、0.025mgCuSO4·5H2O、6.25mgH3BO5、0.025mgCoCl·6H2O、8.65mgZnSO4·7H2O、0.25mgNa2MoO4·2H2O、27.8mgFeSO4·7H2O和37.3mgNa2-EDTA溶于水并定容至1L。固体培养基中,每升加入8g琼脂粉。LP培养基(低磷培养基,Pi浓度为10μM)的制备方法:改变KH2PO4的加入量,使得Pi浓度为10μM,其它同MS培养基。固体培养基中,每升加入8g琼脂粉。Hogaland营养液(LiangandLi,Differencesincluster-rootformationandcarboxylateexudationinLupinusalbusL.underdifferentnutrientdeficiencies.PlantandSoil2003,248:221–227):溶剂为水;溶质及其浓度如下:K2SO40.75mM,KH2PO40.25mM,KCl0.1mM,MgSO40.65mM,Ca(NO3)22mM,FeNaEDTA0.1mM,H3BO31μM,MnSO41μM,ZnSO41μM,CuSO44μM,(NH4)6Mo2O45μM。低磷营养液:改变KH2PO4的加入量,使得磷浓度为2.5μM,其它同Hogaland营养液。实施例1、ZmPHT1;7蛋白及其编码基因的发现一、ZmPHT1;7蛋白及其编码基因的克隆TRizol(Invitrogen)法提取玉米B73幼苗的总RNA(100-200mg),经甲醛变性RNA琼脂糖凝胶电泳检查RNA的完整性。按照SUPERSCRIPTII的使用说明合成单链cDNA。将合成的单链cDNA稀释10倍并作为模板DNA,采用Primer1和Primer2组成的引物对进行PCR反应。Primer1:5'-tataagcttATGGCGCGCGGGGGAGA-3';Primer2:5'-gctctagaCTACACCATCTGGGTCTCCGAC-3'。PCR体系(50μL):10μL5×PhusionHFBuffer,4μL2.5mMdNTPmix,2.5μLPrimer1(10μM),2.5μLPrimer2(10μM),1μL模板DNA,1.5μLDMSO,0.5μLPhusionDNAPolymerase(2U/μL),余量为水。PCR程序:98℃预变性3min;98℃15s,63℃30s,72℃1min20s,35个循环;72℃延伸10min。回收约1620bp的PCR产物,连接到pMD18-T载体,依次进行酶切和测序鉴定。测序结果表明,PCR产物中具有序列表的序列2所示的开放阅读框,编码序列表的序列1所示的蛋白质。将序列表的序列1所示蛋白质命名为ZmPHT1;7蛋白。将ZmPHT1;7蛋白的编码基因命 名为ZmPHT1;7基因,其开放阅读框如序列表的序列2所示。实施例2、转基因拟南芥的获得和鉴定一、重组表达载体的构建1、合成序列表的序列2所示的双链DNA分子并作为模板DNA,采用Primer1和Primer3组成的引物对进行PCR扩增,得到PCR扩增产物。Primer1:5'-tataagcttATGGCGCGCGGGGGAGA-3';Primer3:5-gactagtCTACACCATCTGGGTCTCCGAC-3’。PCR扩增的反应体系(50μL):10μL5×PhusionHFBuffer,4μL2.5mMdNTPmix,2.5μLPrimer1(10μM),2.5μLPrimer3(10μM),1μL模板DNA,1.5μLDMSO,0.5μLPhusionDNAPolymerase(2U/μL),余量为水。PCR扩增的反应程序:98℃预变性3min;98℃15s,63℃30s,72℃1min20s,35个循环;72℃延伸10min。2、用限制性内切酶HindⅢ和SpeI双酶切步骤1得到的PCR扩增产物,回收酶切产物。3、用限制性内切酶HindⅢ和SpeI双酶切pSuper1300载体,回收约11000bp的载体骨架。4、将步骤2回收的酶切产物和步骤3回收的载体骨架连接,得到重组质粒Super:ZmPHT1;7。根据测序结果,对重组质粒Super:ZmPHT1;7进行结构描述如下:在pSuper1300载体的HindⅢ和SpeI酶切位点之间插入了序列表的序列2所示的双链DNA分子。三、转基因拟南芥的获得1、将重组质粒Super:ZmPHT1;7导入农杆菌菌株GV3101,得到重组农杆菌。2、采用花芽浸泡法(CloughandBent,Floraldip:asimplifiedmethodforAgrobacterium-mediatedtransformationofArabidopsisthaliana.PlantJournal1998,16:735-743.),用步骤1得到的重组农杆菌侵染拟南芥pht1;1Δ4Δ突变体,收获T1代种子。T2代表示T1代自交产生的种子及由它所长成的植株,T3代表示T2代自交产生的种子及由它所长成的植株。在含50μg/L潮霉素的MS固体培养基平板上筛选T1代植株并进行T2代和T3代的分离比统计,在T3代得到转Super:ZmPHT1;7拟南芥单拷贝纯合株系,随机取两个株系并分别命名为pht1;1Δ4Δ/ZmPHT1;7-3和pht1;1Δ4Δ/ZmPHT1;7-14。四、转空载体拟南芥的获得用pSuper1300载体代替重组质粒Super:ZmPHT1;7,其他同步骤三,得到转空载 体拟南芥。五、转基因拟南芥的鉴定分别将pht1;1Δ4Δ/ZmPHT1;7-3的T3代植株(或T3代种子)、pht1;1Δ4Δ/ZmPHT1;7-14的T3代植株(或T3代种子)、pht1;1Δ4Δ突变体植株(或种子)、转空载体拟南芥的T3代植株(或T3代种子)和野生型拟南芥植株(或种子)进行如下鉴定:(一)PCR鉴定提取植株的总RNA并反转录为cDNA,采用Primer1和Primer3组成的引物对进行PCR鉴定。Primer1:5'-tataagcttATGGCGCGCGGGGGAGA-3';Primer3:5-gactagtCTACACCATCTGGGTCTCCGAC-3’。PCR鉴定的反应体系(20μL):含10×PCR缓冲液2μL,2.5mMdNTPmix0.4μL,10μMPrimer1和Primer3各0.4μL,TaqDNA聚合酶(15U/μL)0.2μL,余量为水。PCR鉴定的反应程序:95℃预变性5min,95℃30s,63℃30s,72℃1min40s,35个循环;72℃延伸10min。结果见图1A。pht1;1Δ4Δ突变体和野生型拟南芥均没有扩增出约1620bp的目的条带,pht1;1Δ4Δ/ZmPHT1;7-3和pht1;1Δ4Δ/ZmPHT1;7-14均扩增出了约1620bp的目的条带。(二)表型和生理性状鉴定1、表型鉴定将种子播种于MS固体培养基平板并培养至萌发,将萌发生长7天的幼苗分成两组,第一组移入MS固体培养基并继续培养7天,第二组移入LP固体培养基并继续培养7天,然后拍照。培养条件:16h光照(光强80μmol·m-2·s-1)/8h黑暗,22℃。照片见图1B。萌发生长7天的幼苗在MS培养基上生长7天后,pht1;1Δ4Δ突变体较野生型拟南芥小,pht1;1Δ4Δ/ZmPHT1;7-3和pht1;1Δ4Δ/ZmPHT1;7-14不仅比pht1;1Δ4Δ突变体大且根数多而且比野生型拟南芥大且根数多。萌发生长7天的幼苗在LP培养基上生长7天后,pht1;1Δ4Δ突变体较野生型拟南芥小,pht1;1Δ4Δ/ZmPHT1;7-3和pht1;1Δ4Δ/ZmPHT1;7-14的冠部比pht1;1Δ4Δ突变体和野生型拟南芥大。在MS培养基上和在LP培养基上,转空载体拟南芥的表型与pht1;1Δ4Δ突变体的表型均一致。2、生物量指标检测将种子播种于MS固体培养基平板并培养至萌发,将萌发生长7天的幼苗分成两组(每组120株,各分三个平行),第一组移入MS培养基并继续培养7天,第二组移入LP固体培养基并继续培养7天,然后整株取材,称取鲜重,进行统计。结果见图1C。在MS固体培养基或LP培养基上,pht1;1Δ4Δ突变体较野生型拟南芥轻,pht1;1Δ4Δ/ZmPHT1;7-3和pht1;1Δ4Δ/ZmPHT1;7-14鲜重明显高于野生型拟南芥和pht1;1Δ4Δ突变体。在MS培养基上和在LP培养基上,转空载体拟南芥的结果数据均与pht1;1Δ4Δ突变体的结果数据无显著差异。3、磷含量指标检测⑴将种子播种于MS固体培养基平板并培养至萌发,将萌发生长7天的幼苗分成两组(每组120株,各分三个平行),第一组移入MS培养基并继续培养7天,第二组移入LP固体培养基并继续培养7天,然后整株取材。⑵取步骤(1)得到的材料,80℃烘干过夜,然后在马福炉中进行灰化处理(先300℃、1小时,再575℃、6小时),然后用1mL0.1MHCl浸提,得到浸提液。⑶取步骤(2)得到的浸提液,用钒钼黄法进行磷含量测定。钒钼黄法:取96孔酶标板,加入10μL浸提液、150μLH2O和40μL钒钼酸铵显色液,充分混匀,室温反应15分钟,然后将酶标板置于酶标仪,在波长410nm下测定吸光值。根据同时反应的标准样品计算出标准曲线,计算磷含量。结果见图1D。测定结果显示,在正常供磷和低磷条件下,pht1;1Δ4Δ/ZmPHT1;7-3和pht1;1Δ4Δ/ZmPHT1;7-14的磷含量明显高于野生型拟南芥和pht1;1Δ4Δ突变体,pht1;1Δ4Δ突变体的磷含量明显低于野生型拟南芥,说明ZmPHT1;7有利于植物(拟南芥)的磷积累。在MS培养基上和在LP培养基上,转空载体拟南芥的结果数据均与pht1;1Δ4Δ突变体的结果数据无显著差异。4、磷吸收指标检测(分四个平行,每个平行中取15株)将种子播种于MS固体培养基平板并培养,萌发生长7天后,进行磷吸收实验。磷吸收实验:将植株放入1.5mL预处理液中,室温放置20min;吸弃预处理液,加入1.5mL磷吸收液,置于23℃光照培养箱(光强80μmol·m-2·s-1)中,在2小时和4小时时用预冷的解吸附剂终止对32P的吸收,并用解吸附剂漂洗植物样品2次(每次30min);用吸水纸吸掉残留于植物样品表面的液体,将植物样品于80℃烘干;将烘干的植物样品放入闪烁瓶,加入1mL闪烁液,用液闪仪进行测定,记录数据,根据进入植物材料的32P量折算出进入植物材料的磷元素含量。预处理液:溶剂为水,含5mMMES和0.1mMCaCl2,用Tris将pH值调至5.7。磷吸收液:溶剂为水,含5mMMES、0.1mMCaCl2和500μMKH2PO4,用Tris将pH值调至5.7,用前加入0.2μCi/mLH332PO4。解吸附剂:溶剂为水,含5mMMES、0.1mMCaCl2和1mMKH2PO4,用Tris将pH值调至5.7。结果见图1E。测定结果显示,pht1;1Δ4Δ/ZmPHT1;7-3和pht1;1Δ4Δ /ZmPHT1;7-14的磷吸收速率明显高于野生型拟南芥和pht1;1Δ4Δ突变体,pht1;1Δ4Δ突变体的磷吸收速率明显低于野生型拟南芥,说明提高ZmPHT1;7表达有利于植物(拟南芥)的磷吸收。转空载体拟南芥的结果数据均与pht1;1Δ4Δ突变体的结果数据无显著差异。实施例3、转基因玉米的获得和鉴定一、重组表达载体的构建1、合成序列表的序列2所示的双链DNA分子并作为模板DNA,采用Primer1和Primer3组成的引物对进行PCR扩增,得到PCR扩增产物。Primer1:5'-tataagcttATGGCGCGCGGGGGAGA-3';Primer3:5-gactagtCTACACCATCTGGGTCTCCGAC-3’。2、使用Taq酶对步骤1得到的PCR扩增产物的平末端进行补A,使其具有A粘末端。3、采用限制性内切酶XcmI(NEB公司)酶切载体pCXUN(GenBank:FJ905215.1),使其线性化并具有T粘末端。4、通过TA克隆方法,将步骤2的产物与步骤3的产物连接,得到重组质粒UBI:ZmPHT1;7。根据测序结果,对重组质粒UBI:ZmPHT1;7进行结构描述如下:在载体pCXUN的XcmI酶切位点插入了序列表的序列2所示的双链DNA分子。二、转基因玉米的获得1、将重组质粒UBI:ZmPHT1;7导入农杆菌EHA105,得到重组农杆菌。2、用步骤1得到的重组农杆菌对受体材料的胚性愈伤组织进行遗传转化(FrameandWang,Agrobacteriumtumefaciens-mediatedtransformationofmaizeembryosusingastandardbinaryvectorsystem.PlantPhysiology2002,129:13-22.),得到转基因玉米。受体材料为玉米自交系B73。OE1、OE2和OE3为随机取的三个纯合转基因玉米株系。三、转空载体玉米的获得用载体pCXUN代替重组质粒UBI:ZmPHT1;7,其他同步骤二,得到转空载体玉米。四、转基因玉米的鉴定分别将OE1、OE2和OE3的T3代植株(或T3代种子)、玉米B73的植株(或种子)和转空载体玉米的T3代植株(或T3代种子)进行如下鉴定:(一)ZmPHT1;7插入鉴定1、将植株培养至三叶一心期,剪取叶片并提取基因组DNA。2、以步骤1提取的基因组DNA为模板,采用UbipF和Primer3组成的引物对(靶 序列约为1700bp)进行PCR鉴定。UbipF:5’-TTGATCTTGATATACTTGGATG-3’;Primer3:5’-gactagtCTACACCATCTGGGTCTCCGAC-3’。PCR鉴定的反应体系(20μL):含10×PCR缓冲液2μL,2.5mMdNTPmix0.4μL,10μMUbipF和Primer3各0.4μL,TaqDNA聚合酶(15U/μL)0.2μL,余量为水。PCR鉴定的反应条件:95℃预变性5min;95℃30s,63℃30s,72℃1min40s,35个循环;72℃延伸10min。结果见图2A。结果显示,OE1、OE2和OE3均有UBI1:ZmPHT1;7片段插入。(二)ZmPHT1;7基因表达鉴定1、将植株培养至三叶一心期,分别取根部和冠部,提取总RNA并反转录为cDNA。2、以步骤1得到的cDNA为模板,采用ABI公司7500型Real-TimePCRSystem(AppliedBiosystems,FosterCity,CA,USA)、ABIPOWERSYBRGREENPCRMASTERMIX试剂盒、Primer4和Primer5组成的引物对,进行定量PCR(qRT-PCR)反应。ZmUBQ基因为内参基因。Primer4:5’-GAACCAGGACAGGAGCAAGA-3’;Primer5:5’-CCTCCTCTGAGTCTTCAGCC-3’。结果见图2B。qRT-PCR结果显示,OE1、OE2和OE3中ZmPHT1;7基因的表达量均显著高于玉米自交系B73。转空载体玉米中ZmPHT1;7基因的表达量与玉米自交系B73没有差异。(三)生理指标检测1、根部磷含量检测(每个株系120株,分三个平行)取在湿润蛭石中萌发生长至一叶一心期的幼苗,去掉胚乳,移苗至1/2Hogaland营养液中培养2天,然后移苗至Hogaland营养液中培养至三叶一心期,然后取根。将根在80℃烘箱烘干至恒重,称量干重并记录数值。将根用剪刀剪碎,置于坩埚,灰化处理(灰化程序为:300℃2h,然后575℃10h)。灰化后的样品用10mL0.1NHCl浸提,所得浸提液用H2O稀释至10倍体积,然后采用钒钼黄法进行磷含量测定。钒钼黄法:取96孔酶标板,加入160μL浸提液的10倍稀释液和40μL钒钼酸铵显色液,充分混匀,反应15分钟,然后将酶标板置于酶标仪,在波长410nm下测定吸光值。根据同时反应的标准样品计算出标准曲线,计算各样品的磷含量。结果见图2C。实验结果显示,OE2和OE3的根部磷含量均明显高于玉米自交系B73,转空载体玉米的根部磷含量与玉米自交系B73没有显著差异,说明过量表达ZmPHT1;7基因能增加玉米根部的磷含量。2、磷吸收指标检测(每个株系120株,分三个平行)取在湿润蛭石中萌发生长至一叶一心期的玉米幼苗,去掉胚乳,移苗至1/2Hogaland营养液中培养2天,然后移苗至Hogaland营养液培养至三叶一心期,然后进行玉米磷吸收耗竭实验。培养条件:28℃,光周期为14h光/10h黑暗。玉米磷吸收耗竭实验:三棵苗为一组,先用磷吸收耗竭液(磷浓度调整为100μM,其它同1/2Hogaland营养液)轻柔漂洗玉米幼苗根部,用滤纸吸掉多余液体后,小心放入盛有500mL磷吸收耗竭液的三角瓶,置于摇床(100rpm/min)上,分别在0、0.5、3、8、12、16、21、25和30小时取样品液,用钼蓝法测定样品液中的磷含量。钼蓝法测定磷含量:取1.5mL离心管,加入350μL显色反应工作液和60μL样品液,充分混匀,置于42℃水浴30min,然后吸取200μL反应液,置于96孔酶标板中,在波长820nm下测定吸光值。根据同时反应的标准样品计算出标准曲线,计算各样品液的磷浓度值。显色反应储液:(NH4)6Mo7O24·4H2O3.5g,98%硫酸23.39mL,用H2O定容至1L;显色反应储液加入1.4%抗坏血酸即为显色反应工作液,需要现用现配。测定结果见图2D。实验结果显示,OE2和OE3的磷吸收速率明显快于玉米自交系B73,转空载体玉米的磷吸收速率与玉米自交系B73没有显著差异,说明过量表达ZmPHT1;7能提高玉米的磷吸收速率。3、低磷胁迫条件下,ZmPHT1;7玉米过量表达材料的表型和生理指标测定取在湿润蛭石中萌发生长到一叶一心期的植株,去掉胚乳,移苗至1/2Hogaland营养液中,继续生长至两叶一心期。选取长势一致的植株移至低磷营养液、总体积为600L的水培循环系统中培养,进行低磷表型检测,9天后照相。照相后,将不同叶位的叶片(第1片到第8片)分别取材,在80℃烘箱烘干至恒重,称量干重并记录数值(生物量结果)。将样品用剪刀剪碎,置于坩埚,进行灰化处理(灰化程序为:先300℃2h,然后575℃10h)。灰化后的样品用0.1MHCl浸提,浸提液用钒钼黄法进行磷含量测定(方法同步骤1)。图3A为全植株照片。图3B至图3H依次为第一至第七叶位的叶片的照片,自左至右依次为B73、OE1、OE2和OE3。照片结果显示,在低磷胁迫条件下,OE1、OE2和OE3的第一位叶(L1)和第二位叶(L2)叶边缘枯黄,而玉米自交系B73的第一位叶和第二位叶依然呈现绿色,OE1、OE2和OE3的第七位叶和第八叶位的叶片大于玉米自交系B73。生物量的测定结果如3I,测定结果显示,OE1、OE2和OE3的第一位叶和第二位叶的叶片干重小于玉米自交系B73,OE1、OE2和OE3的第七位叶和第八叶位的叶片的生物量明显大于玉米自交系B73。磷含量测定结果如图3J。测定结果显示,OE1、OE2和OE3的第一位叶和第二位叶的磷含量显著地低于玉米自交系B73,OE1、OE2和OE3的第三、四、五及六位叶的磷 含量与玉米自交系B73无明显差异,OE1、OE2和OE3的第七位叶和第八叶位的的磷含量高于玉米自交系B73。上述结果表明,在低磷条件下,ZmPHT1;7的表达上调能提高玉米磷素从老叶运向幼叶的转移。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1