双特异性HER2和CD3结合分子的制作方法
本发明申请主张2014年7月25日提交的美国临时专利申请no.62/029,342的权益,该专利申请以其全部内容作为参考并入本文。
本发明申请作为参考引入了作为标题为“sequence_listing_13542-006-228.txt”的文本文件与本发明申请一起提交的序列表,该文本文件于2015年7月23日生成并且大小为184千字节。
1.技术领域
本文提供了用于控制和治疗病症,如癌症的涉及特异性结合至her2(受体酪氨酸激酶)和cd3(t细胞受体)并且介导t细胞毒性的双特异性结合分子的组合物、方法和用途。
2.发明背景
her2是表皮生长因子受体家族的受体酪氨酸激酶。已在癌症的发生和发展中显示了her2的扩增或过表达。赫塞汀(曲妥珠单抗)是批准用于治疗her2-阳性转移性乳腺癌和her2-阳性胃癌的抗her2单克隆抗体(曲妥珠单抗[处方信息的突出部分],southsanfrancisco,ca:genentech,inc.;2014)。厄马索单抗是具有完整fc-受体结合的三重-特异性her2-cd3抗体(参见,例如,kiewe等人,2006,clincancerres,12(10):3085-3091)。厄马索单抗是大鼠-小鼠抗体;因此,一旦给予于人,预期出现人抗小鼠抗体应答和人抗大鼠抗体应答。2502a是厄马索单抗的亲代抗体,其对her2具有低亲合力和低亲合力(diermeier-daucher等人,mabs,2012,4(5):614-622)。需要能够在her2-阳性癌症中介导t细胞毒性的疗法。
3.发明概述
在某些实施方式中,本文提供了双特异性结合分子,其包含作为结合至her2的包含两个相同的重链和两个相同的轻链的免疫球蛋白的非糖基化单克隆抗体,所述轻链是第一轻链和第二轻链,其中第一轻链通过肽接头融合至第一单链可变片段(scfv)以产生第一轻链融合多肽,并且其中第二轻链通过肽接头融合至第二scfv以产生第二轻链融合多肽,其中第一和第二scfv(i)是相同的,并且(ii)结合至cd3,并且其中第一和第二轻链融合多肽是相同的。
在双特异性结合分子的某些实施方式中,每个重链的序列是seqidno:23或27中的任一个。在双特异性结合分子的某些实施方式中,每个轻链的序列是seqidno:25。在双特异性结合分子的某些实施方式中,肽接头的序列是seqidno:14。在双特异性结合分子的某些实施方式中,第一scfv中vh域的序列是seqidno:15或17中的任一个。在双特异性结合分子的某些实施方式中,第一scfv中vh域和vl域之间的scfv内肽接头的序列是seqidno:14。在双特异性结合分子的某些实施方式中,第一scfv中vl域的序列是seqidno:16。在双特异性结合分子的某些实施方式中,scfv的序列是seqidno:19。在双特异性结合分子的某些实施方式中,第一轻链融合多肽的序列是seqidno:29。
在双特异性结合分子的某些实施方式中,每个重链的序列是seqidno:23,27、62或63中的任一个。在双特异性结合分子的某些实施方式中,每个轻链的序列是seqidno:25。在双特异性结合分子的某些实施方式中,肽接头的序列是seqidno:14或35-41中的任一个。在双特异性结合分子的某些实施方式中,第一scfv中vh域的序列是seqidno:15,17或64中的任一个。在双特异性结合分子的某些实施方式中,第一scfv中vh域和vl域之间的scfv内肽接头的序列是seqidno:14或35-41中的任一个。在双特异性结合分子的某些实施方式中,第一scfv中vl域的序列是seqidno:16或65中的任一个。在双特异性结合分子的某些实施方式中,scfv的序列是seqidno:19或48-59中的任一个。在双特异性结合分子的某些实施方式中,第一轻链融合多肽的序列是seqidno:29、34、42-47或60中的任一个。
在双特异性结合分子的某些实施方式中,每个重链的序列是seqidno:27,每个轻链的序列是seqidno:25。在双特异性结合分子的某些实施方式中,scfv的序列是seqidno:19。在双特异性结合分子的某些实施方式中,重链序列是seqidno:27,每个轻链的序列是seqidno:25,scfv的序列是seqidno:19。在双特异性结合分子的某些实施方式中,肽接头长度为5-30、5-25、5-15、10-30、10-20、10-15、15-30或15-25个氨基酸。在某些实施方式中,肽接头的序列是seqidno:14。
在某些实施方式中,第一轻链融合多肽的序列是seqidno:60。在某些实施方式中,重链的序列是seqidno:62,每个轻链融合多肽的序列是seqidno:60。
在某些实施方式中,第一轻链融合多肽的序列是seqidno:47。在某些实施方式中,重链的序列是seqidno:27,每个轻链融合多肽的序列是seqidno:47。
在某些实施方式中,第一轻链融合多肽的序列是seqidno:29。在某些实施方式中,重链的序列是seqidno:27,每个轻链融合多肽的序列是seqidno:29。
在双特异性结合分子的某些实施方式中,对于cd3,kd在70nm至1μm之间。
在双特异性结合分子的某些实施方式中,双特异性结合分子的scfv包含一个或多个突变以稳定二硫化物结合。在双特异性结合分子的某些实施方式中,二硫化物结合的稳定防止双特异性结合分子的聚集。在双特异性结合分子的某些实施方式中,与无二硫化物结合稳定的双特异性结合分子的聚集相比,二硫化物结合的稳定降低了双特异性结合分子的聚集。在双特异性结合分子的某些实施方式中,稳定二硫化物结合的一个或多个突变包括vhg44c突变和vlq100c突变(例如,如seqidno:54-59中存在的)。在双特异性结合分子的某些实施方式中,稳定二硫化物结合的一个或多个突变是vh44处(根据kabat编号系统)氨基酸残基被半胱氨酸替换和vl100处(根据kabat编号系统)氨基酸残基被半胱氨酸替换,从而在vh44和vl100之间引入二硫键(例如,如seqidno:54-59中存在的)。
在双特异性结合分子的某些实施方式中,双特异性结合分子不以其可溶性或细胞结合形式结合fc受体。在双特异性结合分子的某些实施方式中,重链已突变以破坏n-连接的糖基化位点。在双特异性结合分子的某些实施方式中,重链具有氨基酸取代从而用不用作糖基化位点的氨基酸替代作为n-连接的糖基化位点的天门冬酰胺。在双特异性结合分子的某些实施方式中,重链已突变以破坏c1q结合位点。在某些实施方式中,双特异性结合分子不激活补体。
在某些实施方式中,本文提供了双特异性结合分子,其包含作为结合至her2的包含两个相同的重链和两个相同的轻链的免疫球蛋白的非糖基化单克隆抗体,所述轻链是第一轻链和第二轻链,其中第一轻链通过肽接头融合至第一单链可变片段(scfv)以产生第一轻链融合多肽,并且其中第二轻链通过肽接头融合至第二scfv以产生第二轻链融合多肽,其中第一和第二scfv(i)是相同的,并且(ii)结合至cd3,并且其中第一和第二轻链融合多肽是相同的,并且其中(a)每个重链的序列是seqidno:62;和(b)每个轻链融合多肽的序列是seqidno:60。
在某些实施方式中,本文提供了双特异性结合分子,其包含作为结合至her2的包含两个相同的重链和两个相同的轻链的免疫球蛋白的非糖基化单克隆抗体,所述轻链是第一轻链和第二轻链,其中第一轻链通过肽接头融合至第一单链可变片段(scfv)以产生第一轻链融合多肽,并且其中第二轻链通过肽接头融合至第二scfv以产生第二轻链融合多肽,其中第一和第二scfv(i)是相同的,并且(ii)结合至cd3,并且其中第一和第二轻链融合多肽是相同的,并且其中(a)每个重链的序列是seqidno:27;和(b)每个轻链融合多肽的序列是seqidno:47。
在某些实施方式中,本文提供了双特异性结合分子,其包含作为结合至her2的包含两个相同的重链和两个相同的轻链的免疫球蛋白的非糖基化单克隆抗体,所述轻链是第一轻链和第二轻链,其中第一轻链通过肽接头融合至第一单链可变片段(scfv)以产生第一轻链融合多肽,并且其中第二轻链通过肽接头融合至第二scfv以产生第二轻链融合多肽,其中第一和第二scfv(i)是相同的,并且(ii)结合至cd3,并且其中第一和第二轻链融合多肽是相同的,并且其中(a)每个重链的序列是seqidno:27;和(b)每个轻链融合多肽的序列是seqidno:29。
在某些实施方式中,本文提供了包含编码轻链融合多肽的核苷酸序列的多核苷酸,所述轻链融合多肽包含通过肽接头融合至scfv的免疫球蛋白轻链,其中所述轻链结合至her2并且其中所述scfv结合至cd3。在所述多核苷酸的某些实施方式中,轻链的序列是seqidno:25。在所述多核苷酸的某些实施方式中,编码轻链的核苷酸序列是seqidno:24。在所述多核苷酸的某些实施方式中,scfv的序列是seqidno:19。在所述多核苷酸的某些实施方式中,编码scfv的核苷酸序列是seqidno:18。在所述多核苷酸的某些实施方式中,轻链序列是seqidno:25,scfv序列是seqidno:19。在所述多核苷酸的某些实施方式中,编码轻链的核苷酸序列是seqidno:24,编码scfv的核苷酸序列是seqidno:18。在所述多核苷酸的某些实施方式中,肽接头长度为5-30、5-25、5-15、10-30、10-20、10-15、15-30或15-25个氨基酸。在所述多核苷酸的某些实施方式中,肽接头的序列是seqidno:14。在所述多核苷酸的某些实施方式中,编码肽接头的核苷酸序列是seqidno:13。
在某些实施方式中,本文提供了包含编码轻链融合多肽的多核苷酸编码核苷酸序列的载体,所述轻链融合多肽包含通过肽接头融合至scfv的免疫球蛋白轻链,其中所述轻链结合至her2并且其中所述scfv结合至cd3,其可操作性连接至启动子。在某些实施方式中,本文提供了包含可操作性连接至启动子的本文所提供的多核苷酸的离体细胞。在某些实施方式中,本文提供了包含载体的离体细胞。
在某些实施方式中,本文提供了载体,其包含(i)包含编码轻链融合多肽的核苷酸序列的第一多核苷酸,所述轻链融合多肽包含通过肽接头融合至scfv的免疫球蛋白轻链,其中所述轻链结合至her2并且其中所述scfv结合至可操作性连接至第一启动子的cd3,和(ii)可操作性连接至第二启动子的编码结合至her2的免疫球蛋白重链的第二多核苷酸。在某些实施方式中,本文提供了包含载体的离体细胞。
在某些实施方式中,本文提供了产生双特异性结合分子的方法,其包括(a)培养包含载体的细胞,所述载体包含(i)包含编码轻链融合多肽的核苷酸序列的第一多核苷酸,所述轻链融合多肽包含通过肽接头融合至scfv的免疫球蛋白轻链,其中所述轻链结合至her2并且其中所述scfv结合至可操作性连接至第一启动子的cd3,和(ii)可操作性连接至第二启动子的编码结合至her2的免疫球蛋白重链的第二多核苷酸,以表达第一和第二多核苷酸,从而表达包含所述轻链融合多肽和所述免疫球蛋白重链的双特异性结合分子,和(b)回收所述双特异性结合分子。
在某些实施方式中,本文提供了药物组合物,其包含治疗有效量的(i)可操作性连接至第一启动子的第一多核苷酸,和(ii)可操作性连接至第二启动子的编码结合至her2的免疫球蛋白重链的第二多核苷酸。在某些实施方式中,本文提供了药物组合物,其包含治疗有效量的载体,所述载体包含(i)可操作性连接至第一启动子的第一多核苷酸,和(ii)可操作性连接至第二启动子的编码结合至her2的免疫球蛋白重链的第二多核苷酸。在某些实施方式中,所述载体是病毒载体。
在某些实施方式中,本文提供了多核苷酸的混合物,其包含(i)包含编码轻链融合多肽的核苷酸序列的多核苷酸,所述轻链融合多肽包含通过肽接头融合至scfv的免疫球蛋白轻链,其中所述轻链结合至her2并且其中所述scfv结合至可操作性连接至第一启动子的cd3,和(ii)可操作性连接至第二启动子的编码结合至her2的免疫球蛋白重链的第二多核苷酸。在所述多肽混合物的某些实施方式中,重链序列是seqidno:27。在所述多肽混合物的某些实施方式中,编码重链的核苷酸序列是seqidno:26。在某些实施方式中,本文提供了包含本文所提供的多核苷酸的混合物的离体细胞。
在某些实施方式中,本文提供了产生双特异性结合分子的方法,其包括(i)培养包含多核苷酸混合物的细胞以表达第一和第二多核苷酸,从而产生包含所述轻链融合多肽和所述免疫球蛋白重链的双特异性结合分子,和(ii)回收所述双特异性结合分子。
在某些实施方式中,本文提供了产生双特异性结合分子的方法,其包括(i)表达多核苷酸混合物,从而产生包含所述第一轻链融合多肽和所述免疫球蛋白重链的双特异性结合分子,和(ii)回收所述双特异性结合分子。
在某些实施方式中,本文提供了制备治疗性t细胞的方法,其包括将本文所述的双特异性结合分子结合至t细胞。在某些实施方式中,所述t细胞是人t细胞。在某些实施方式中,所述结合是非共价的。
在某些实施方式中,本文提供了药物组合物,其包含治疗有效量的双特异性结合分子和可药用的载体。
在某些实施方式中,本文提供了药物组合物,其包含治疗有效量的双特异性结合分子、可药用的载体和t细胞。在某些实施方式中,所述t细胞结合至双特异性结合分子。在某些实施方式中,t细胞与双特异性结合分子的结合是非共价的。在某些实施方式中,将所述t细胞给予于受试者以用于治疗受试者中her2-阳性癌症。在某些实施方式中,t细胞对其所给予的受试者是自体同源的。在某些实施方式中,t细胞对其所给予的受试者是同种异体的。在某些实施方式中,所述t细胞是人t细胞。
在某些实施方式中,本文提供了治疗对其有需要的受试者中her2-阳性癌症的方法,其包括给予本文所提供的药物组合物。在某些实施方式中,本文提供了治疗对其有需要的受试者中her2-阳性癌症的方法,其包括给予治疗有效量的本文所提供的双特异性结合分子。在某些实施方式中,所述her2-阳性癌症是乳腺癌、胃癌、骨肉瘤、促纤维增生性小圆细胞癌、头颈癌的鳞状细胞癌、卵巢癌、前列腺癌、胰癌、多形性胶质母细胞瘤、胃结合部腺癌、胃食管结合部腺癌、宫颈癌、唾液腺癌、软组织肉瘤、白血病、黑素瘤、尤文氏肉瘤、横纹肌肉瘤、成神经细胞瘤、小细胞肺癌或表达her2受体的任何其他肿瘤组织。在某些实施方式中,所述her2-阳性癌症是原发瘤或转移性瘤,例如,脑或腹膜转移。
在治疗方法的某些实施方式中,所述给予是静脉内的。在治疗方法的某些实施方式中,所述给予是腹膜内、鞘内、脑室内或实质内的。在治疗方法的某些实施方式中,所述方法还包括向受试者给予多柔比星、环磷酰胺、紫杉醇、多西他赛和/或卡铂。在治疗方法的某些实施方式中,所述方法还包括向受试者给予放射疗法。在治疗方法的某些实施方式中,与多模式蒽环-基疗法结合进行给予。在治疗方法的某些实施方式中,与细胞减少性化疗结合进行给予。在具体的实施方式中,在用细胞减少性化疗治疗受试者之后进行给予。在治疗方法的某些实施方式中,所述双特异性结合分子不结合至t细胞。在治疗方法的某些实施方式中,所述双特异性结合分子结合至t细胞。在治疗方法的某些实施方式中,双特异性结合分子与t细胞的结合是非共价的。在治疗方法的某些实施方式中,与t细胞输注结合进行给予。在具体的实施方式中,在用t细胞输注治疗患者之后进行给予。在某些实施方式中,使用与给予t细胞的患者自体同源的t细胞进行t细胞输注。在某些实施方式中,使用与给予t细胞的患者同种异体的t细胞进行t细胞输注。在某些实施方式中,t细胞可以结合至与如本文所述的双特异性结合分子相同的分子。在某些实施方式中,t细胞与和双特异性结合分子相同的分子的结合是非共价的。在某些实施方式中,所述t细胞是人t细胞。
在治疗方法的某些实施方式中,所述方法还包括向受试者给予提高细胞her2表达的试剂。在治疗方法的某些实施方式中,her2-阳性癌症耐受使用曲妥珠单抗、西妥昔单抗、拉帕替尼、厄洛替尼或靶向her受体家族的任何其他小分子或抗体的治疗。在治疗方法的某些实施方式中,所述受试者是人。在治疗方法的某些实施方式中,所述受试者是狗。
4.附图说明
图1a、图1b、图1c、图1d和图1e描述了her2-bsab。图1a显示了her2-bsab的示意图。箭头指出了引入重链以除去糖基化的n297a突变。图1b显示了如在还原性sds-page条件下所显示的her2-bsab的纯度。图1c显示了如通过sec-hplc所显示的her2-bsab的纯度。图1d显示人igg1-fc中的n297a突变抑制与cd16afc受体的结合。图1e显示人igg1-fc中的n297a突变抑制与cd32afc受体的结合。
图2a和图2b显示her2-bsab结合至乳腺癌细胞系和t细胞。图2a显示了用曲妥珠单抗(左)或用her2-bsab(右)对au565乳腺癌细胞的染色。图2b显示了用huokt3(左)或用her2-bsab(右)对cd3+t细胞的染色。
图3显示在4小时51cr释放测定中,her2-bsab显示出有效的细胞毒性t淋巴细胞活性。对于曲妥珠单抗-mokt3的描述,参见thakur等人,2010,curropinmolther,12:340。
图4比较了在一组癌细胞系中抗her2-bsabt细胞毒性的her2表达。
图5a和图5b显示her2-bsab-重导向的t细胞毒性是抗原特异性的。图5a显示her2-bsab介导了对her2-阳性细胞系umscc47的t细胞毒性,而不是对her2-阴性细胞系htb-132的t细胞毒性。图5b显示huokt3和曲妥珠单抗可以阻断her2-bsab介导t细胞毒性的能力。
图6显示通过将her2-bsab介导的t细胞毒性与通过流式细胞术的her2检测阈值相比较,her2-bsab检测了低水平的her2。
图7a、图7b和图7c提供了her2-bsab的特异性、亲合力和抗增殖作用。图7a显示her2-阳性skov3卵巢癌细胞系的预培育阻断了her2-bsab的结合。图7b显示当将平均荧光强度(mfi)对抗体浓度作图时,用曲妥珠单抗的稀释或者用her2-bsab标记的skov3细胞显示出类似的曲线。图7c显示在曲妥珠单抗敏感性乳腺癌细胞系skbr3中,与曲妥珠单抗相比较的her2-bsab的抗增殖作用。
图8显示her2-bsab对头颈鳞状细胞癌(scchn)细胞系是有效的。对一组scchn细胞分析了her2-bsab-介导的细胞毒性和ec50,并与每个细胞系中如通过流式细胞术和通过qrt-pcr所确定的her2的表达水平相比较。
图9a、图9b和图9c。her2-bsab介导了对耐受其他her靶向疗法的scchn的t细胞毒性。图9a显示scchn细胞系pci-30表达egfr和her2。图9b显示pci-30细胞耐受her-靶向疗法拉帕替尼、厄洛替尼、来那替尼、曲妥珠单抗和西妥昔单抗。图9c显示在存在her2-bsab的情况下,pci-30细胞系对t细胞敏感。数据表示3个不同的细胞毒性测定的平均值。
图10显示her2-bsab对骨肉瘤细胞系有效。对一组骨肉瘤细胞系分析了her2-bsab-介导的细胞毒性和ec50,并与每个细胞系中如通过流式细胞术和通过qrt-pcr所确定的her2的表达水平相比较。
图11a、图11b和图11c显示her2-bsab对耐受其他靶向疗法的骨肉瘤细胞系有效。图11a显示骨肉瘤细胞系u2os表达egfr和her2。图11b显示usos细胞耐受her-靶向疗法拉帕替尼、厄洛替尼、来那替尼、曲妥珠单抗和西妥昔单抗。图11c显示在存在her2-bsab的情况下,usos细胞对t细胞敏感。数据表示3个不同的细胞毒性测定的平均值。
图12a、图12b、图12c和图12d显示her2-bsab对耐受其他靶向疗法的hela宫颈癌细胞系有效。图12a显示hela细胞表达egfr和her2。图12b显示hela细胞耐受her-靶向疗法拉帕替尼、厄洛替尼、来那替尼、曲妥珠单抗和西妥昔单抗。图12c显示在存在her2-bsab的情况下,hela细胞对t细胞敏感。数据表示3个不同的细胞毒性测定的平均值。图12d显示用拉帕替尼预处理提高hela对her2-bsab的敏感性。
图13证明her2-bsab降低肿瘤体内生长。图13显示her2-bsab保护与pbmc混合的植入的mcf7乳腺癌细胞中肿瘤的发展。
图14显示her2-bsab体内保护与周围血单核细胞(pbmc)混合的植入的hcc1954乳腺癌中肿瘤的发展。
图15显示her2-bsab体内保护通过静脉内引入荧光素酶-标签的mcf7细胞引起的转移性肿瘤发展模型。
图16a、图16b、图16c和图16d显示her2-bsab体内阻断荧光素酶-标签的mcf7细胞的转移性肿瘤生长。图16a表示无治疗的小鼠。图16b表示用pbmc和her2-c825治疗的小鼠。图16c表示用her2-bsab治疗的小鼠。图16d表示用pbmc和her2-bsab治疗的小鼠。
图17a、图17b和图17c描述了her2-bsab。图17a显示了her2-bsab的示意图。箭头指出了引入重链以除去糖基化的n297a突变。图17b显示了如在还原性sds-page条件下所显示的her2-bsab的纯度。图17c显示了如通过尺寸排阻色谱高效液相色谱法(sec-hplc)所示的her2-bsab的纯度。
图18a、图18b和图18c显示her2-bsab具有与曲妥珠单抗相同的特异性、类似的亲合力和抗增殖作用。
图19a和图19b显示her2-bsab重导向的t细胞毒性是her2-特异性的并且依赖于cd3。
图20显示在存在atc和her2-bsab的情况下,在来自不同肿瘤系统的35个不同的细胞系中her2的表达和半最大有效浓度(ec50)。
图21a、图21b、图21c、图21d、图21e、图21f、图21g、图21h和图21i显示了her2-bsab介导对耐受其他her-靶向疗法的癌细胞系的细胞毒反应。
图22显示her2-bsab的ec50与通过流式细胞术确定的her2的表达水平有关。pm=皮摩尔;mfi=平均荧光强度。
图23a、图23b和图23c显示her2-bsab以对通过派姆单抗(pembrolizumab)的pd-1阻断相对不敏感,甚至在效应细胞t细胞上具有pd-1表达的方式介导对pd-l1-阳性hcc1954靶标的t细胞毒性。
图24a和图24b显示her2-bsab以对效应细胞t细胞上pd-1表达相对不敏感的方式介导对pd-l1-阳性hek-293靶标的t细胞毒性。细胞毒性是6次实验的平均值。
图25a、图25b、图25c和图25d显示her2-bsab对her2-阳性异种移植有效。
5.发明详述
本文提供了结合至her2和cd3两者的双特异性结合分子。本文还提供了编码这些双特异性结合分子或其片段的分离的核酸(多核苷酸),如互补dna(cdna)。还提供了包含核酸(多核苷酸)或编码这些双特异性结合分子或其片段的载体(例如,表达载体)的载体(例如,表达载体)和细胞(例如,离体细胞)。本文还提供了制备这些双特异性结合分子、细胞和载体的方法。本文还提供了结合至本文所提供的双特异性结合分子的t细胞。本文还提供了将这些双特异性结合分子结合至t细胞的方法。在其他实施方式中,本文提供了使用本文所述的双特异性结合分子、核酸、载体和/或t细胞治疗her2-阳性癌症的方法和用途。另外,本文还提供了相关组合物(例如,药物组合物)、试剂盒和诊断方法。
在某些实施方式中,本文提供了特异性结合至her2和cd3并引起t细胞毒性用于治疗癌症的双特异性结合分子。不受任何理论限制,据信本文所述的双特异性结合分子不但将肿瘤结合至t细胞,它们还交联t细胞上的cd3并引起激活级联,并且通过这种方法,t细胞受体(tcr)-基细胞毒性重新针对所期望的肿瘤靶标,从而绕过了主要组织相容性复合体(mhc)限制。
5.1双特异性结合分子
本文提供了结合至her2和cd3的双特异性结合分子。可以在本文所提供的方法内使用的结合分子是双特异性结合分子,其包含作为结合至her2的包含两个相同的重链和两个相同的轻链的免疫球蛋白的非糖基化单克隆抗体,所述轻链是第一轻链和第二轻链,其中第一轻链通过肽接头融合至第一单链可变片段(scfv)以产生第一融合多肽,并且其中第二轻链通过肽接头融合至第二scfv以产生第二融合多肽,其中第一和第二scfv(i)是相同的,并且(ii)结合至cd3,并且其中第一和第二融合多肽是相同的。
her2是受体酪氨酸激酶的表皮生长因子受体(egfr)家族成员。在具体的实施方式中,her2是人her2。genbank登录号nm_004448.3(seqidno:1)提供了示例性人her2核酸序列。genbank登录号np_004439.2(seqidno:2)提供了示例性人her2氨基酸序列。在另一个具体的实施方式中,her2是狗her2。genbank登录号nm_001003217.1(seqidno:3)提供了示例性狗her2核酸序列。genbank登录号np_001003217.1(seqidno:4)提供了示例性狗her2氨基酸序列。
cd3是t细胞共受体,其由γ链、δ链和两个ε链组成。在具体的实施方式中,cd3是人cd3。genbank登录号nm_000073.2(seqidno:5)提供了示例性人cd3γ核酸序列。genbank登录号np_000064.1(seqidno:6)提供了示例性人cd3γ氨基酸序列。genbank登录号nm_000732.4(seqidno:7)提供了示例性人cd3δ核酸序列。genbank登录号np_000723.1(seqidno:8)提供了示例性人cd3δ氨基酸序列。genbank登录号nm_000733.3(seqidno:9)提供了示例性人cd3ε核酸序列。genbank登录号np_000724.1(seqidno:10)提供了示例性人cd3ε氨基酸序列。在另一个具体的实施方式中,cd3是狗cd3。genbank登录号nm_001003379.1(seqidno:11)提供了示例性狗cd3ε核酸序列。genbank登录号np_001003379.1(seqidno:12)提供了示例性狗cd3ε氨基酸序列。
作为非限制性实例,本发明所述的双特异性结合分子中的免疫球蛋白可以是单克隆抗体、裸抗体、嵌合抗体、人源化抗体或人抗体。如本文所使用的,术语“免疫球蛋白”以与其本领域中熟知的含义相同的含义使用,并且包含两个重链和两个轻链。在5.3节描述了制备抗体的方法。
嵌合抗体是重组蛋白质,其含有包含来源于一个物种的抗体,优选地啮齿类抗体的互补决定区(cdr)的可变域,而抗体分子的恒定域来源于人抗体。对于兽医应用,嵌合抗体的恒定域可以来源于其他物种,如(例如)马、猴、牛、猪、猫或狗。
人源化抗体是通过dna重组技术产生的抗体,其中不需要抗原结合的人免疫球蛋白轻链或重链的一些或全部氨基酸(例如,可变域的恒定区和框架区)用于替代来自同源、非人抗体的轻链或重链的相应氨基酸。举例来说,抗给定抗原的鼠科抗体的人源化形式在其重链和轻链上具有(1)人抗体的恒定区;(2)来自人抗体可变域的框架区;和(3)来自鼠抗体的cdr。必要时,人框架区中的一个或多个残基可以改变为鼠抗体中相应位置的残基,从而保持人源化抗体对抗原的结合亲合力。这种变化有时被称为“回复突变”。类似地,出于所期望的原因,例如,稳定性或对抗原的亲合力,可以使正向突变恢复到鼠序列。不受任何理论限制,与嵌合人抗体相比,人源化抗体通常不太可能在人中引起免疫应答,这是因为前者含有显著较少的非人成分。
术语“表位”是本领域承认的并且通常被本领域技术人员理解为表示与抗体相互作用的抗原区域。蛋白质抗原的表位可以是直链或构象的,或者可以通过抗原邻接或非邻接氨基酸序列形成。
scfv是本领域承认的术语。scfv包含免疫球蛋白重链(vh)和轻链(vl)可变区的融合蛋白,其中所述融合蛋白保留了和完整免疫球蛋白相同的抗原特异性。vh通过肽接头(在本文中这种肽接头有时被称为“scfv内肽接头”)融合至vl。
在本发明的某些实施方式中,scfv具有肽接头,其长度在5-30、5-25、5-15、10-30、10-20、10-15、15-30或15-25个氨基酸残基。在某些实施方式中,scfv肽接头显示出适合于本领域的技术人员已知的肽接头的一个或多个特征。在某些实施方式中,scfv肽接头包含使scfv肽接头可溶的氨基酸,如(例如)丝氨酸和苏氨酸。在某些实施方式中,scfv肽接头包含使scfv肽接头具有灵活性的氨基酸,如(例如)甘氨酸。在某些实施方式中,scfv肽接头将vh的n-末端连接至vl的c-末端。在某些实施方式中,scfv肽接头可以将vh的c-末端连接至vl的n-末端。在某些实施方式中,scfv肽接头是如下表1所述的接头(例如,seqidno:14或35-41中的任一个)。在优选的实施方式中,肽接头是seqidno:14。
在本发明的双特异性结合分子的某些实施方式中,结合至cd3的scfv包含本领域中已知的cd3-特异抗体的vh和vl,如(例如)huokt3(参见,例如,adair等人,1994,humantibodieshybridomas5:41-47)、yth12.5(参见,例如,routledge等人,1991,eurjimmunol,21:2717-2725)、hum291(参见,例如,norman等人,2000,clinicaltransplantation,70(12):1707-1712)、替利珠单抗(参见,例如,herold等人,2009,clinimmunol,132:166-173)、huclb-t3/4(参见,例如,labrijn等人,2013,proceedingsofthenationalacademyofsciences,110(13):5145-5150)、奥昔珠单抗(参见,例如,keymeulen等人,2010,diabetologia,53:614-623)、博纳吐单抗(参见,例如,cheadle,2006,curropinmolther,8(1):62-68)、mt110(参见,例如,silkeandgires,2011,mabs,3(1):31-37)、卡妥索单抗(参见,例如,heissandmurawa,2010,intjcancer,127(9):2209-2221)、28f11(参见,例如,加拿大专利申请ca2569509a1)、27h5(参见,例如,加拿大专利申请ca2569509a1)、23f10(参见,例如,加拿大专利申请ca2569509a1)、15c3(参见,例如,加拿大专利申请ca2569509a1)、维西珠单抗(参见,例如,dean等人,2012,swissmedwkly,142:w13711)和hum291(参见,例如,dean等人,2012,swissmedwkly,142:w13711)。
在某些实施方式中,本发明的双特异性结合分子中的scfv结合至与本领域中已知的cd3-特异抗体相同的表位。在具体的实施方式中,本发明的双特异性结合分子中的scfv结合至与cd3-特异抗体huokt3相同的表位。可以通过本领域技术人员已知的测定,如(例如)突变分析或结晶学研究确定结合至相同表位。在某些实施方式中,scfv与本领域中已知的抗体竞争与cd3的结合。在具体的实施方式中,本发明的双特异性结合分子中的scfv与cd3-特异抗体huokt3竞争与cd3的结合。可以通过本领域技术人员已知的测定,如(例如)流式细胞术确定对结合至cd3的竞争。参见,例如,6.1.2.4节。在某些实施方式中,scfv包含与本领域中已知的cd3-特异抗体的vh具有至少85%、90%、95%、98%或至少99%的相似性的vh。在某些实施方式中,scfv包含本领域中已知的cd3-特异抗体的vh,其包含1-5个保守氨基酸取代。在某些实施方式中,scfv包含与本领域中已知的cd3-特异抗体的vl具有至少85%、90%、95%、98%或至少99%的相似性的vl。在某些实施方式中,scfv包含本领域中已知的cd3-特异抗体的vl,其包含1-5个保守氨基酸取代。
保守氨基酸取代是在氨基酸种类内发生的氨基酸取代,其中以它们的侧链对氨基酸相关联。通常,遗传编码的氨基酸分为以下几类:(1)酸性氨基酸,其包括天冬氨酸和谷氨酸;(2)碱性氨基酸,其包括精氨酸、赖氨酸和组氨酸;(3)非极性氨基酸,其包括异亮氨酸、丙氨酸、缬氨酸、脯氨酸、蛋氨酸、亮氨酸、苯丙氨酸、色氨酸);和(4)不带电的极性氨基酸,其包括半胱氨酸、苏氨酸、谷氨酰胺、甘氨酸、天门冬酰胺、丝氨酸和酪氨酸。另外,脂肪族-羟基类包括丝氨酸和苏氨酸。另外,含酰胺类包括天门冬酰胺和谷氨酰胺。另外,脂肪族类包括丙氨酸、缬氨酸、亮氨酸和异亮氨酸。另外,芳香族类包括苯丙氨酸、色氨酸和酪氨酸。最后地,含硫侧链类包括半胱氨酸和蛋氨酸。举例来说,本领域技术人员将合理地预期用异亮氨酸或缬氨酸单独替代亮氨酸,用谷氨酸单独替代天冬氨酸,用丝氨酸单独替代苏氨酸或用结构相关的氨基酸类似地替代氨基酸将不会对所得分子的结合或性质造成巨大影响,特别是如果替代不包括框架位点内的氨基酸时。优选的保守氨基酸取代基团包括:赖氨酸-精氨酸、丙氨酸-缬氨酸、苯丙氨酸-酪氨酸、谷氨酸-门冬氨酸、缬氨酸-亮氨酸-异亮氨酸、半胱氨酸-蛋氨酸和天门冬酰胺-谷氨酰胺。
在优选的实施方式中,scfv来源于huokt3抗体,并因此含有huokt3单克隆抗体的vh和vl(分别为seqidno:15和16)。参见,例如,vanwauwe等人,1991,nature,349:293-299。在双特异性结合分子的具体实施方式中,scfv来源于huokt3单克隆抗体并且相对于天然huokt3vh和vl序列,具有不超过5个氨基酸突变。在双特异性结合分子的某些实施方式中,scfv来源于huokt3单克隆抗体并且相对于天然huokt3vh和vl序列,包含一个或多个突变以稳定二硫化物结合。在双特异性结合分子的某些实施方式中,二硫化物结合的稳定防止双特异性结合分子的聚集。在双特异性结合分子的某些实施方式中,与无二硫化物结合稳定的双特异性结合分子的聚集相比,二硫化物结合的稳定降低了双特异性结合分子的聚集。在双特异性结合分子的某些实施方式中,稳定二硫化物结合的一个或多个突变包括vhg44c突变和vlq100c突变(例如,如seqidno:54-59中存在的)。在双特异性结合分子的某些实施方式中,稳定二硫化物结合的一个或多个突变是vh44处(根据kabat编号系统)氨基酸残基被半胱氨酸替换和vl100处(根据kabat编号系统)氨基酸残基被半胱氨酸替换,从而在vh44和vl100之间引入二硫键(例如,如seqidno:54-59中存在的)。在特别优选的实施方式中,scfv包含在编号位置105包含氨基酸取代的huokt3的vh,其中所述半胱氨酸被丝氨酸取代(seqidno:17)。在某些实施方式中,scfv的vh的序列如下表4所述(例如,seqidno:15、17或64中的任一个)。在某些实施方式中,scfv的vl的序列如下表5所述(例如,seqidno:16或65中的任一个)。在某些实施方式中,scfv的序列如下表6所述(例如,seqidno:19或48-59中的任一个)。在优选的实施方式中,scfv的序列是seqidno:19。在具体的实施方式中,scfv包含相对于huokt3vh的天然序列,具有不超过5个氨基酸突变的huokt3的vh的变体。在具体的实施方式中,scfv包含相对于huokt3vl的天然序列,具有不超过5个氨基酸突变的huokt3的vl的变体。
可以通过插入、取代和缺失来修饰抗cd3scfv可变区序列,从而所得scfv维持结合至cd3的能力,如通过(例如)elisa、流式细胞术和biacore所确定的。一般技术人员可以确定通过实施如本文以下所述的功能测定,如(例如)结合分析和细胞毒性分析的这种活性的维持。
在某些实施方式中,将免疫球蛋白轻链与scfv缀合的肽接头的长度为5-30、5-25、5-15、10-30、10-20、10-15、15-30或15-25个氨基酸。在某些实施方式中,肽接头显示出适合于本领域的技术人员已知的肽接头的一个或多个特征。在某些实施方式中,肽接头包含使肽接头可溶的氨基酸,如(例如)丝氨酸和苏氨酸。在某些实施方式中,肽接头包含使肽接头具有灵活性的氨基酸,如(例如)甘氨酸。在某些实施方式中,将免疫球蛋白轻链和scfv缀合的肽接头序列如下表1所述(例如,seqidno:14或35-41中的任一个)。在优选的实施方式中,肽接头是seqidno:14。
在本发明的双特异性结合分子的某些实施方式中,结合至her2的免疫球蛋白包含本领域中已知的her2-特异抗体的重链和/或轻链,如(例如)曲妥珠单抗(参见,例如,baselga等人1998,cancerres58(13):2825-2831)、m-111(参见,例如,higgins等人,2011,jclinoncol,29(suppl):abstracttps119)、帕妥珠单抗(参见,例如,franklin等人,2004,cancercell,5:317-328)、厄妥索单抗(参见,例如,kieweandthiel,2008,expertopininvestigdrugs,17(10):1553-1558)、mdxh210(参见,例如,schwaab等人,2001,journalofimmunotherapy,24(1):79-87)、2b1(参见,例如,borghaei等人,2007,jimmunother,30:455-467)和mm-302(参见,例如,wickhamandfutch,2012,cancerresearch,72(24):supplement3)。在本发明的双特异性结合分子的某些实施方式中,结合至her2的免疫球蛋白包含曲妥珠单抗的重链。在本发明的双特异性结合分子的某些实施方式中,结合至her2的免疫球蛋白包含如seqidno:23中所示的序列。在本发明的双特异性结合分子的某些实施方式中,结合至her2的免疫球蛋白包含曲妥珠单抗的重链变体(参见,例如,下表2)。在本发明的双特异性结合分子的具体实施方式中,结合至her2的免疫球蛋白包含相对于曲妥珠单抗的天然序列具有不超过5个氨基酸突变的曲妥珠单抗的轻链变体。在本发明的双特异性结合分子的某些实施方式中,结合至her2的免疫球蛋白包含曲妥珠单抗的轻链(seqidno:25)。在本发明的双特异性结合分子的某些实施方式中,结合至her2的免疫球蛋白包含曲妥珠单抗的轻链变体。在本发明的双特异性结合分子的具体实施方式中,结合至her2的免疫球蛋白包含相对于曲妥珠单抗的天然序列具有不超过5个氨基酸突变的曲妥珠单抗的轻链变体。
在本发明的双特异性结合分子的某些实施方式中,结合至her2的免疫球蛋白结合至与本领域中已知的her2-特异抗体相同的表位。在具体的实施方式中,本发明的双特异性结合分子中的免疫球蛋白结合至与曲妥珠单抗相同的表位。可以通过本领域技术人员已知的测定,如(例如)突变分析或晶体研究确定结合至相同表位。在某些实施方式中,结合至her2的免疫球蛋白与本领域中已知的抗体竞争与her2的结合。在具体的实施方式中,本发明的双特异性结合分子中的免疫球蛋白与曲妥珠单抗竞争与her2的结合。可以通过本领域技术人员已知的测定,如(例如)流式细胞术确定对结合至her2的竞争。参见,例如,6.1.2.4节。在某些实施方式中,免疫球蛋白包含与本领域中已知的her2-特异抗体的vh具有至少85%、90%、95%、98%或至少99%的相似性的vh。在某些实施方式中,免疫球蛋白包含本领域中已知的her2-特异抗体的vh,其包含1-5个保守氨基酸取代。在某些实施方式中,免疫球蛋白包含与本领域中已知的her2-特异抗体的vl具有至少85%、90%、95%、98%或至少99%的相似性的vl。在某些实施方式中,免疫球蛋白包含本领域中已知的her2-特异抗体的vl,其包含1-5个保守氨基酸取代。在某些实施方式中,免疫球蛋白包含下表2中所述的重链vh(例如,seqidno:23、27、62或63中任一个的vh)。在某些实施方式中,免疫球蛋白包含下表3中所述的轻链的vl(例如,seqidno:25的vl)。
可以通过插入、取代和缺失来修饰抗her2抗体的可变区序列,从而所得抗体维持结合至her2抗体的能力,如通过(例如)elisa、流式细胞术和biacore所确定的。一般技术人员可以确定通过实施如本文以下所述的功能测定,如(例如)结合分析和细胞毒性分析的这种活性的维持。
在本发明的双特异性结合分子的某些实施方式中,结合至her2的免疫球蛋白是igg1免疫球蛋白。
产生人抗体的方法对于本领域技术人员是已知的,如(例如)使用来源于人免疫球蛋白序列的抗体文库的上述噬菌体展示法。参见,例如,美国专利no.4,444,887和4,716,111;和pct公开wo98/46645、wo98/60433、wo98/24893、wo98/16664、wo96/34096、wo96/33735和wo91/10741;以上每篇文献以其全部内容作为参考并入本文。cole等人和boerder等人的技术也可用于人单克隆抗体的制备(cole等人,monoclonalantibodiesandcancertherapy,alanr.riss,(1985);和boerner等人,j.immunol.,147(1):86-95,(1991))。
在某些实施方式中,使用不能表达功能性内源小鼠免疫球蛋白,但是可以表达人免疫球蛋白基因的转基因小鼠产生人抗体。例如,可以随机或通过同源重组将人免疫球蛋白重链和轻链基因综合体引入小鼠胚胎干细胞。作为另外一种选择,除了人重链和轻链基因外,可以将人可变区、恒定区和多变区引入小鼠胚胎干细胞。通过同源重组引入人免疫球蛋白位点,小鼠免疫球蛋白重链和轻链基因可以单独或同时无功能性。具体地,jh区的纯合缺失防止内源抗体产生。增殖修饰的胚胎干细胞并微注射至胚泡以产生嵌合小鼠。然后,将嵌合小鼠育种以产生表达人抗体的纯合后代。以正常方式,使用选择的抗原,例如,本文所提供的多肽的全部或部分,免疫转基因小鼠。使用常规杂交瘤技术,可以从免疫的转基因小鼠获得针对抗原的单克隆抗体。在b细胞分化期间,转基因小鼠具有的人免疫球蛋白转基因重排,然后经历类别转换和体细胞突变。因此,使用这种技术,有可能产生治疗有用的igg、iga、igm和ige抗体。用于产生人抗体的这种技术的概述,参见lonbergandhuszar,int.rev.immunol.13:65-93(1995)。对于用于产生人抗体和人单克隆抗体的详细讨论以及用于产生这种抗体的规程,参见,例如,pct公开wo98/24893;wo92/01047;wo96/34096;wo96/33735;欧洲专利no.0598877;美国专利no.5,413,923;5,625,126;5,633,425;5,569,825;5,661,016;5,545,806;5,814,318;5,886,793;5,916,771;和5,939,598,以上文献以其全部内容作为参考并入本文。另外,使用类似于上述那些的技术,可以预定公司,如abgenix,inc.(freemont,calif.)、genpharm(sanjose,calif.)和medarex,inc.(princeton,n.j.)以提供针对所选抗原的人抗体。
还可以通过免疫用人周围血液白细胞、脾细胞或骨髓移植的小鼠制备人单克隆抗体(例如,xtl的trioma技术)。可以使用称为“定向选择”的技术产生识别所选表位的完全人抗体。在该方法中,所选的非人单克隆抗体,例如,小鼠抗体用于指导识别相同表位的完全人抗体的选择。参见,例如,jespers等人,bio/technology12:899-903(1988)。还可以通过体外激活b细胞产生人抗体。参见美国专利no.5,567,610和5,229,275,以上专利以其全部内容作为参考并入本文。
用于制备人源化抗体的方法是本领域技术人员已知的。参见,例如,winterep0239400;jones等人,nature321:522-525(1986);riechmann等人,nature332:323-327(1988);verhoeyen等人,science239:1534-1536(1988);queen等人,proc.nat.acad.sclusa86:10029(1989);美国专利no.6,180,370;和orlandi等人,proc.natl.acad.sd.usa86:3833(1989);以上所有参考文献的公开内容以它们的全部内容作为参考并入本文。通常,如下所示实现人抗体上鼠科(或其他非人)cdr的移植。从杂交瘤分离编码重链和轻链可变域的cdna。通过测序确定可变域,包括cdr的dna序列。将编码cdr的dna插入人抗体重链或轻链可变域编码序列的相应区域,连接至所期望的同种型的人恒定区基因节段(例如,对于ch的γ-l和对于cl的k),是合成的基因。在哺乳动物宿主细胞(例如,cho或nso细胞)中共表达人源化重链和轻链基因以产生可溶性人源化抗体。为了有利于抗体的大规模生产,它通常期望在产生系中使用dhfr基因或gs基因选择高表达子。在生物反应器或中空纤维培养系统或wave技术中培养这些产生细胞系以产生可溶性抗体的大批培养物或产生在乳汁中表达抗体的转基因哺乳动物(例如,山羊、牛或绵阳)(参见,例如,美国专利no.5,827,690)。
如本领域中已知的和/或如本文所述的,可以通过酶促切割、合成或重组技术产生抗体片段。还可以使用其中一个或多个终止密码子已引入到天然终止位点上游的抗体基因在多种截短形式中产生抗体。例如,编码f(ab')2重链部分的组合基因可以设计以包含编码重链的ch、域和/或铰链区的dna序列。可以通过常规方法化学地将抗体的多个部分连接在一起,或者可以使用基因工程技术作为邻接蛋白质制备。在某些实施方式中,将人重链和轻链位点的原件引入到来源于含有内源重链和轻链位点的靶向破坏的胚胎干细胞系的小鼠株。转基因小鼠可以合成对人抗原特异的人抗体,并且小鼠可以用于产生分泌人抗体的杂交瘤。用于从转基因小鼠获得人抗体的方法通过green等人,naturegenet.7:13(1994);lonberg等人,nature368:856(1994)和taylor等人,int.immun.6:579(1994)有所描述。还可以通过遗传或染色体转染法以及噬菌体展示技术构建完全人抗体,所有这些在本领域中是已知的。有关从来自未免疫的供体的免疫球蛋白可变域基因谱系体外产生人抗体及其片段的信息,参见,例如,mccafferty等人,nature348:552-553(1990)。在该技术中,将抗体可变域基因框内克隆到丝状噬菌体主要或次要外壳蛋白基因中,并作为功能性抗体片段在噬菌体颗粒表面上展示。由于丝状颗粒含有噬菌体基因组的单链dna拷贝,因此基于抗体功能性的选择还导致编码展示那些性质的抗体的基因的选择。以这种方式,噬菌体模拟了b细胞的一些性质。噬菌体展示可以以多种形式进行,对于它们的综述,参见,例如,johnsonandchiswell,currentopinioninstructuralbiology3:5564-571(1993)。
还可以通过(例如)合成包含框内融合至单个人框架的混合物中的非人靶标单克隆抗体的6个cdr的组合文库进行抗体人源化。可以使用含有多有已知重链和轻链人种系基因的代表性基因的人框架文库。然后,可以对所得组合文库筛选对所关心的抗原的结合。就维持对亲代抗体的结合活性而言,该方法可以允许选择完全人框架的最良好组合。然后,可以通过多种技术对人源化抗体进一步优化。
抗体人源化可以用于将小鼠或其他非人抗体发展为“完全人”抗体。所得抗体仅含人序列并且无小鼠或非人抗体序列,同时维持了与起始抗体类似的结合亲合力和特异性。
对于全长抗体分子,免疫球蛋白基因可以得自杂交瘤细胞系的基因组dna或mrna。在哺乳动物载体系统中克隆抗体重链和轻链。用双链序列分析记录了组装体(assembly)。可以在其他人或哺乳动物宿主细胞系中表达抗体构建体。然后,可以通过表达的所关心的抗体的瞬时转染测定和免疫印迹分析验证构建体。可以使用快速测定方法分离和筛选具有最高产率的稳定细胞系。
在一种方法中,通过融合适合的永生细胞系(例如,骨髓瘤细胞系,如(但不限于)sp2/0、sp2/0-ag14、nso、ns1、ns2、ae-1、l.5、>243、p3x63ag8.653、sp2sa3、sp2mai、sp2ss1、sp2sa5、u937、mla144、activ、molt4、da-1、jurkat、wehi、k-562、cos、raji、nih3t3、hl-60、mla144、namaiwa、neuro2a)等或异源骨髓瘤、其融合产物或从中来源的任何细胞或融合细胞或如本领域中已知的任何其他适合的细胞系来产生杂交瘤。参见,例如,atcc或lifetech网站等,抗体产生细胞,如(但不限于)分离或克隆的脾脏、周围血液、淋巴、扁桃体或含有其他免疫或b细胞的细胞,或者表达重链或轻链恒定区或可变区或框架区或cdr序列的任何其他细胞,其作为内源或异源核酸,作为重组和内源的、病毒、细菌、藻、原核、两栖动物、禽、昆虫、爬行动物、鱼、哺乳动物、啮齿类、马、羊、山羊、绵羊、灵长类、真核、基因组dna、cdna、rdna、线粒体dna或rna、叶绿体dna或rna、hnrna、mrna、trna、单链、双链或三链、杂交等或它们的任意组合。参见,例如,ausubel,如上和colligan,immunology,如上,等2章,其完全作为参考并入本文。可以使用选择培养条件或其他适合的已知方法分离融合细胞(杂交瘤)或重组细胞,和通过限度稀释或细胞分选或其他已知的方法克隆。可以通过适合的测定(例如,elisa)选择产生具有所期望的特异性的抗体的细胞。
在优选的具体实施方式中,双特异性结合分子包含变体fc区,其中所述变体fc区相对于野生型fc区包含至少一种氨基酸修饰,从而所述分子不结合处于可溶形式或细胞-结合形式(包括在免疫-效应细胞上,如(例如)nk细胞、单核细胞和嗜中性白细胞)的fc受体(fcr)或者对fc受体的结合降低。这些fcr包括(但不限于)fcr1(cd64)、fcrii(cd32)和fcriii(cd16)。对新生儿fc受体fcr(n)的亲合力不受影响,并因此在双特异性结合分子中保持。例如,如果免疫球蛋白是igg,优选地,igg对fcγ受体的亲合力降低或无亲合力。在某些实施方式中,使得与fcγ受体直接接触的fc区内的一个或多个位置,如(例如)氨基酸234-239(铰链区)、氨基酸265-269(b/c环)、氨基酸297-299(c'/e环)和氨基酸327-332(f/g)环突变,从而双特异性结合分子对fcγ受体的亲合力降低或无亲合力。参见,例如,sondermann等人,2000,nature,406:267-273,该文献以其全部内容作为参考并入本文。优选地,对于igg,进行突变n297a以破坏fc受体结合。在某些实施方式中,通过(例如)如(例如)okazaki等人,2004.jmolbiol,336(5):1239-49中所述的biacore测定确定双特异性结合分子或其片段对fcγ受体的亲合力。还参见,第6节。在某些实施方式中,与参考fc区相比,包含这种变体fc区的双特异性结合分子与具有fcr的免疫-效应细胞上fc受体的结合具有小于25%、20%、15%、10%或5%的结合。不受任何具体理论限制,包含这种变体fc区的双特异性结合分子将具有降低的引起细胞因子风暴的能力。在优选的实施方式中,包含这种变体fc区的双特异性结合分子不以其可溶性或细胞结合形式结合fc受体。
在某些实施方式中,所述双特异性结合分子包含变体fc区,如(例如)在本文所提供的抗体的fc区中对一个或多个氨基酸具有添加、缺失和/或取代的fc区,以改变效应细胞功能,或者提高或减弱抗体对fcr的亲合力。在优选的实施方式中,抗体对fcr的亲合力减弱。在某些情况下,效应细胞功能的降低或消除是所期望的,如(例如)就其作用机制包括阻断或拮抗但不杀死具有靶标抗原的细胞的抗体来说。在某些实施方式中,本文所提供的fc变体可以与其他fc修饰组合,其包括(但不限于)改变效应细胞功能的修饰。在某些实施方式中,这些修饰在抗体或fc融合中提供了添加、协同或新型性质。优选地,本文所提供的fc变体提高了它们所组合的修饰的表型。
在优选的实施方式中,本发明的双特异性结合分子是非糖基化的。优选地,这是通过将其fc受体中双特异性结合分子的抗her2免疫球蛋白部分突变以破坏糖基化位点,优选地n-连接的糖基化位点来实现。在另一个具体的实施方式中,将免疫球蛋白突变以破坏n-连接的糖基化位点。在某些优选实施方式中,已将双特异性结合分子突变以破坏n-连接的糖基化位点。在某些实施方式中,双特异性结合分子的重链具有氨基酸取代从而用不用作糖基化位点的氨基酸替代作为n-连接的糖基化位点的天门冬酰胺。在优选的实施方式中,所述方法涵盖了通过将位置297从天门冬酰胺修饰为丙氨酸(n297a),使双特异性结合分子的fc区的糖基化位点缺失。例如,在某些实施方式中,双特异性结合分子包含具有seqidno:20的序列的重链。如本文所使用的,“糖基化位点”包括寡糖(即,含有连接在一起的两个或更多个单糖的碳水化合物)将具体且共价连接的抗体中的任何具体的氨基酸序列。寡糖侧链通常通过n-或o-键连接至抗体主链。n-连接的糖基化是指将寡糖部分连接至天门冬酰胺残基的侧链。o-连接的糖基化是指寡糖部分与羟氨基酸,例如,丝氨酸、苏氨酸的连接。修饰抗体糖基化含量的方法在本领域中是熟知的,参见,例如,美国专利no.6,218,149;ep0359096b1;美国专利公开no.us2002/0028486;wo03/035835;美国专利公开no.2003/0115614;美国专利no.6,218,149;美国专利no.6,472,511;以上所有专利以其全部内容作为参考并入本文。在另一个实施方式中,可以通过在不能糖基化的细胞或表达系统,如(例如)细菌中重组产生双特异性结合分子来实现本发明的双特异性结合分子的非糖基化。在另一个实施方式中,可以通过酶促去除糖基化位点的碳水化合物部分来实现本发明的双特异性结合分子的非糖基化。
在优选的实施方式中,本发明的双特异性结合分子不结合补体组分c1q或对其的结合亲合力降低(相对于参考或野生型免疫球蛋白)。优选地,这是通过将双特异性结合分子的抗her2免疫球蛋白部分突变以破坏c1q结合位点来实现。在某些优选的实施方式中,所述方法涵盖了通过将位置322从赖氨酸修饰为丙氨酸(k322a),使抗体fc区的c1q结合位点缺失。例如,在某些实施方式中,双特异性结合分子包含具有seqidno:21的序列的重链。在某些实施方式中,通过(例如)biacore测定确定双特异性结合分子或其片段对补体组分c1q的亲合力,所述测定如(例如)okazaki等人,2004.jmolbiol,336(5):1239-49中所述。参见,第6节。在某些实施方式中,包含含有破坏的c1q结合位点的抗her2-免疫球蛋白的双特异性结合以比参考或野生型免疫球蛋白小于25%、20%、15%、10%或5%的结合与补体组分c1q结合。在某些实施方式中,双特异性结合分子不激活补体。
在优选的实施方式中,本发明的双特异性结合分子包含免疫球蛋白,其中所述免疫球蛋白(i)相对于野生型fc区,包含至少一个氨基酸修饰,从而所述分子不结合处于可溶形式或细胞结合形式的fc受体或对其结合降低;(ii)在fc区中包含一个或多个突变以破坏n-连接的糖基化位点;和(iii)不结合至补体组分c1q或对其结合降低。例如,在某些实施方式中,双特异性结合分子包含在fc区中含有第一突变n297a的igg以(i)消除或降低与处于可溶形式或细胞结合形式的fc受体的结合;和(ii)破坏fc区中的n-连接的糖基化位点;和包含在fc区中含有第二突变k322a的igg以(iii)消除或降低与补体组分c1q的结合。参见,例如,seqidno:27。
在优选的实施方式中,结合至her2的免疫球蛋白包含曲妥珠单抗的可变区(参见,例如,表2和3)和优选地人igg1恒定区。在优选的实施方式中,结合至her2的免疫球蛋白包含曲妥珠单抗的可变区,其中重链序列是seqidno:27,并且其中轻链序列是seqidno:25。在优选的实施方式中,结合至her2的免疫球蛋白是曲妥珠单抗的变体,其中所述重链不结合处于可溶形式或细胞结合形式的fc受体或对其结合降低。在优选的实施方式中,不结合处于可溶形式或细胞结合形式的fc受体的重链在fc区域中包含突变以破坏n-连接的糖基化位点。在优选的实施方式中,重链具有氨基酸取代从而用不用作糖基化位点的氨基酸替代作为n-连接的糖基化位点的天门冬酰胺。在优选的实施方式中,破坏n-连接的糖基化位点的突变是fc区中的n297a(seqidno:20)。在优选的实施方式中,结合至her2的免疫球蛋白包含曲妥珠单抗的可变区,其中重链序列包含fc区中的突变以破坏c1q结合位点。在优选的实施方式中,免疫球蛋白不激活补体。在优选的实施方式中,破坏c1q结合位点的突变是fc区中的k322a(seqidno:21)。在特别优选的实施方式中,结合至her2的免疫球蛋白包含曲妥珠单抗的可变区,其中免疫球蛋白重链包含fc区中的突变以破坏n-连接的糖基化位点和fc区中的突变以破坏c1q结合位点(参见,例如,seqidno:27)。在特别优选的实施方式中,结合至her2的免疫球蛋白包含曲妥珠单抗的可变区,其中在fc区中免疫球蛋白的重链序列已突变并且是seqidno:27,并且其中轻链序列是seqidno:25。在特别优选的实施方式中,轻链融合多肽的序列是seqidno:29。在某些实施方式中,重链包含曲妥珠单抗的恒定区。在某些实施方式中,重链包含如下表2所述的重链恒定区(例如,seqidno:23、27、62或63中任一个的恒定区)。在某些实施方式中,重链序列如下表2所述(例如,seqidno:23、27、62或63中的任一个)。在某些实施方式中,轻链包含下表3所述的轻链恒定区(例如,seqidno:25的恒定区)。在某些实施方式中,轻链序列如下表3所述(例如,seqidno:25)。
在某些实施方式中,双特异性结合分子具有在曲妥珠单抗免疫球蛋白中含有一个或多个修饰的曲妥珠单抗-来源序列,并且具有在如下表8所述的huokt3vh和vl序列中含有一个或多个修饰的huokt3-来源序列。具有其他免疫球蛋白或scfv序列的双特异性结合分子可以在这些其他免疫球蛋白或scfv序列的相应位置含有类似突变。在某些实施方式中,双特异性结合分子(a)来源于曲妥珠单抗和huokt3;和(b)含有如下表8所述的一个或多个修饰。在某些实施方式中,将免疫球蛋白轻链和scfv缀合的肽接头序列如下表1所述(例如,seqidno:14或35-41中的任一个)。在某些实施方式中,重链序列如下表2所述(例如,seqidno:23、27、62或63中的任一个)。在某些实施方式中,轻链序列如下表3所述(例如,seqidno:25)。在某些实施方式中,scfv的vh的序列如下表4所述(例如,seqidno:15、17或64中的任一个)。在某些实施方式中,scfv的vl的序列如下表5所述(例如,seqidno:16或65中的任一个)。在某些实施方式中,scfv肽接头序列如下表1所述(例如,seqidno:14或35-41中的任一个)。在某些实施方式中,scfv的序列如下表6所述(例如,seqidno:19、48-59或66中的任一个)。在某些实施方式中,轻链融合多肽序列如下表7所述(例如,seqidno:29、34、42-47或60中的任一个)。
在某些实施方式中,所述双特异性结合分子包含作为结合至her2的免疫球蛋白的糖基化单克隆抗体,所述免疫球蛋白包含两个相同的重链和两个相同的轻链,所述轻链是第一轻链和第二轻链,其中所述第一轻链通过肽接头融合至第一单链可变片段(scfv)以产生第一轻链融合多肽,并且其中第二轻链通过肽接头融合至第二scfv以产生第二轻链融合多肽,其中第一和第二scfv(i)是相同的,并且(ii)结合至cd3,其中第一和第二轻链融合多肽是相同的,其中每个重链的序列是seqidno:62,并且其中每个轻链融合多肽的序列是seqidno:60。
在某些实施方式中,所述双特异性结合分子包含作为结合至her2的免疫球蛋白的糖基化单克隆抗体,所述免疫球蛋白包含两个相同的重链和两个相同的轻链,所述轻链是第一轻链和第二轻链,其中所述第一轻链通过肽接头融合至第一单链可变片段(scfv)以产生第一轻链融合多肽,并且其中第二轻链通过肽接头融合至第二scfv以产生第二轻链融合多肽,其中第一和第二scfv(i)是相同的,并且(ii)结合至cd3,其中第一和第二轻链融合多肽是相同的,其中每个重链的序列是seqidno:27,并且其中每个轻链融合多肽的序列是seqidno:47。
在某些实施方式中,所述双特异性结合分子包含作为结合至her2的免疫球蛋白的糖基化单克隆抗体,所述免疫球蛋白包含两个相同的重链和两个相同的轻链,所述轻链是第一轻链和第二轻链,其中所述第一轻链通过肽接头融合至第一单链可变片段(scfv)以产生第一轻链融合多肽,并且其中第二轻链通过肽接头融合至第二scfv以产生第二轻链融合多肽,其中第一和第二scfv(i)是相同的,并且(ii)结合至cd3,其中第一和第二轻链融合多肽是相同的,其中每个重链的序列是seqidno:27,并且其中每个轻链融合多肽的序列是seqidno:29。
在某些实施方式中,所述双特异性结合分子具有低免疫原性。低或可接受的免疫原性和/或高亲合力以及其他适合的性质可以有助于所实现的治疗结果。在本文中,将“低免疫原性”定义为在小于约75%,或优选地小于约50%的治疗患者中引起明显的haha、haca或hama反应和/或在治疗患者中引起低滴度(elliott等人,lancet344:1125-1127(1994),该文献完全作为参考并入本文)。
本文所提供的双特异性结合分子可以以多种亲合力结合her2和cd3。可以使用任何适合的方法通过实验确定抗体对抗原的亲合力或亲合力。参见,例如,berzofsky等人,“antibody-antigeninteractions,”infundamentalimmunology,paul,w.e.,(主编),ravenpress:newyork,n.y.(1984);kuby,janisimmunology,w.h.freemanandcompany:newyork,n.y.(1992);和本文所述的方法。如果在不同条件(例如,盐浓度、ph)下测量时,具体的抗体-抗原相互作用的测量亲合力可以改变。因此,优选地使用抗体和抗原的标准溶液和标准化缓冲液,如本文所述的缓冲液进行亲合力及其他抗原结合参数的测量。亲合力kd是kon/koff的比值。通常,微摩尔范围的kd被认为是低亲合力。通常,皮摩尔范围的kd被认为是高亲合力。在另一个具体的实施方式中,双特异性结合分子对her2具有高亲合力并且对cd3具有低亲合力。在另一个具体的实施方式中,双特异性结合分子对her2具有高亲合力并且对cd3具有平均亲合力。在具体的实施方式中,双特异性结合分子对cd3的kd在70nm至1μm之间。在具体的实施方式中,双特异性结合分子对cd3的kd在70nm至500nm之间。在具体的实施方式中,双特异性结合分子对cd3的kd在500nm至1μm之间。
在某些实施方式中,双特异性结合分子结合至一种或多种her2-阳性癌细胞系,如通过本领域技术人员已知的测定所确定的,如(例如)elisa、biacore和流式细胞术。在某些实施方式中,所述癌细胞系是乳腺癌细胞系,如(例如)mda-mb-361、mda-mb-468、au565、skbr3、htb27、htb26、hcc1954和/或mcf7。在某些实施方式中,癌细胞系是卵巢癌细胞系,如(例如)ovcar3和/或skov3。在某些实施方式中,癌细胞系是黑素瘤细胞系,如(例如)ht144、skmel28、m14和/或htb63。在某些实施方式中,癌细胞系是骨肉瘤细胞系,如(例如)rg160、rg164、crl1427和/或u2os。在某些实施方式中,癌细胞系是尤文氏瘤细胞系,如(例如)skeaw和/或skes-1。在某些实施方式中,所述癌细胞系是横纹肌肉瘤细胞系,如(例如)htb82。在某些实施方式中,癌细胞系是成神经细胞瘤细胞系,如(例如)nmb7、sknbe(2)c、imr32、sknbe(2)s、sknbe(1)n和/或nb5。在某些实施方式中,癌细胞系是鳞状细胞癌头颈(scchn)细胞系,如(例如)15b、93-vu-147t、pci-30、ud-scc2、pci-15b、scc90和/或umscc47。在某些实施方式中,癌细胞系是宫颈癌细胞系,如(例如)hela。在某些实施方式中,癌细胞系是小细胞肺癌细胞系,如(例如)nci-h524、nci-h69和/或nci-h345。在某些实施方式中,双特异性结合分子以皮摩尔范围的ec50结合至her2-阳性癌细胞系。参见,例如,6.1.3.4节和6.1.3.6节。
在某些实施方式中,双特异性结合分子结合至cd3+t细胞,如通过本领域技术人员已知的测定所确定的,如(例如)elisa、biacore和流式细胞术。在某些优选实施方式中,双特异性结合分子以比huokt3与cd3+t细胞的结合大于15倍更少的结合结合至cd3+t细胞。参见,例如,6.1.3.1节。在某些实施方式中,cd3+t细胞是人t细胞。
在某些实施方式中,双特异性结合分子介导对her2-阳性细胞的t细胞毒性,如通过本领域技术人员已知的测定所确定的,如(例如)细胞毒性测定。在优选的实施方式中,双特异性结合分子以皮摩尔范围的ec50介导对her2-阳性细胞系的t细胞毒性。在某些实施方式中,her2-阳性细胞是乳腺癌细胞系,如(例如)mda-mb-361、mda-mb-468、au565、skbr3、htb27、htb26和/或mcf7。在某些实施方式中,her2-阳性细胞是卵巢癌细胞系,如(例如)ovcar3和/或skov3。在某些实施方式中,her2-阳性细胞是黑素瘤细胞系,如(例如)ht144、skmel28、m14和/或htb63。在某些实施方式中,her2-阳性细胞是骨肉瘤细胞系,如(例如)rg160、rg164、crl1427和/或u2os。在某些实施方式中,her2-阳性细胞是尤文氏瘤细胞系,如(例如)skeaw和/或skes-1。在某些实施方式中,her2-阳性细胞是横纹肌肉瘤细胞系,如(例如)htb82。在某些实施方式中,her2-阳性细胞是成神经细胞瘤细胞系,如(例如)nmb7、sknbe(2)c、imr32、sknbe(2)s、sknbe(1)n和/或nb5。在某些实施方式中,her2-阳性细胞是鳞状细胞癌头颈(scchn)细胞系,如(例如)15b、93-vu-147t、pci-30、ud-scc2、pci-15b、scc90和/或umscc47。在某些实施方式中,her2-阳性细胞是宫颈癌细胞系,如(例如)hela。在某些实施方式中,her2-阳性细胞是小细胞肺癌细胞系,如(例如)nci-h524、nci-h69和/或nci-h345。参见,例如,6.1.3.4节和6.1.3.6节。
在某些实施方式中,her2-阳性细胞与huokt3预培育阻断了双特异性结合分子诱导t细胞毒性的能力。在某些实施方式中,her2-阳性细胞与曲妥珠单抗预培育阻断了双特异性结合分子诱导t细胞毒性的能力。参见,例如,6.1.3.3节。
在某些实施方式中,双特异性结合分子介导对her2-阳性细胞的t细胞毒性,其中所述细胞中her2-表达水平低于通过使用双特异性结合分子进行的流式细胞术的检测阈值。参见,例如,6.1.3.4节。
在某些实施方式中,双特异性结合分子介导对耐受其他her-靶向疗法,如(例如)靶向受体her家族的曲妥珠单抗、西妥昔单抗、拉帕替尼、厄洛替尼、来那替尼或任何其他小分子或抗体的her2-阳性细胞的t细胞毒性。在具体的实施方式中,耐受其他her-靶向疗法,如(例如)靶向受体her家族的曲妥珠单抗、西妥昔单抗、拉帕替尼、厄洛替尼、来那替尼或任何其他小分子或抗体的肿瘤对使用本发明的双特异性结合分子的治疗起反应。参见,例如,6.1.3.7节、6.1.3.8节、6.1.3.9节和6.1.3.10节。
在某些实施方式中,双特异性结合分子降低her2-阳性肿瘤的发展、转移和/或减小肿瘤尺寸。参见,例如,6.1.3.11节。
在某些实施方式中,双特异性结合分子结合至t细胞。在某些实施方式中,双特异性结合分子与t细胞的结合是非共价的。在某些实施方式中,将t细胞给予于受试者。在某些实施方式中,t细胞对t细胞所给予的受试者是自体同源的。在某些实施方式中,t细胞对t细胞所给予的受试者是同种异体的。在某些实施方式中,所述t细胞是人t细胞。
在某些实施方式中,双特异性结合分子不结合至t细胞。
在某些实施方式中,双特异性结合分子缀合至如5.2节所述的有机部分、可检测标志物和/或同位素。
在某些实施方式中,如5.3节所述产生双特异性结合分子或其片段。在某些实施方式中,通过如5.3.1节所述的多核苷酸编码双特异性结合分子或其片段。在某些实施方式中,通过如5.3.2节中所述的载体(例如,表达载体)编码双特异性结合分子或其片段。在某些实施方式中,通过如5.3.2节所述的细胞产生双特异性结合分子或其片段。
在某些实施方式中,双特异性结合分子是如5.5节中所述的组合物(例如,药物组合物)的组分和/或试剂盒的部分。
在某些实施方式中,根据5.6节所提供的方法使用双特异性结合分子。在某些实施方式中,根据5.6.2节所提供的方法将双特异性结合分子用作诊断工具。在某些实施方式中,根据5.6.1节所提供的方法将双特异性结合分子用作治疗剂。在某些实施方式中,将双特异性结合分子给予于受试者,如5.7节所述的受试者,以用于根据5.6节所提供的方法。在某些实施方式中,将双特异性结合分子作为5.9节所述的组合疗法的一部分给予于受试者以用于5.6节所提供的方法。
表1.接头序列
表2.重链序列。非斜体、非下划线序列表示vh域。斜体序列表示恒定区。下划线、斜体和加粗序列表示“说明”列中描述的突变。
图3.轻链序列。非斜体序列表示vl域。斜体序列表示恒定区。
表4.scfvvh序列。下划线、斜体和加粗序列表示“说明”列中描述的突变。
表5.scfvvl序列。下划线、斜体和加粗序列表示“说明”列中描述的突变。
表6.scfvvl序列。大写、非斜体、非加粗、非下划线序列表示vh域。大写、斜体序列表示vl域。大写、下划线、斜体和加粗序列表示“说明”列中描述的突变。小写加粗序列代表scfv内接头。
表7.轻链融合多肽序列。大写、非斜体、非加粗、非下划线序列表示曲妥珠单抗轻链的vl域。大写、斜体序列表示曲妥珠单抗轻链的恒定区。小写、非斜体、非加粗、非下划线序列表示将轻链缀合只scfv的接头。大写、下划线序列表示scfv的vh域。大写加粗序列表示scfv的vl域。大写、下划线、斜体和加粗序列表示“说明”列中描述的突变。小写加粗序列代表scfv内接头。
表8.双特异性结合分子的修饰
5.2双特异性结合分子缀合物
在优选的实施方式中,本文所提供的双特异性结合分子未缀合至任何其他分子,如有机部分、可检测标记物或同位素。在替代性实施方式中,本文所提供的双特异性结合分子缀合至一个或多个有机部分。在替代性实施方式中,本文所提供的双特异性结合分子缀合至一个或多个可检测标记物。在替代性实施方式中,本文所提供的双特异性结合分子缀合至一个或多个同位素。
5.3可检测标记物和同位素
在某些实施方式中,本文所提供的双特异性结合分子缀合至一个或多个可检测标记物或同位素(例如)以用于成像目的。在某些实施方式中,通过共价或非共价连接生色、酶促、放射性同位素、同位素、荧光、毒性、化学发光、核磁共振造影剂或其他标记物来可检测标记双特异性结合分子。
适合的生色标记物的非限制性实例包括二氨基联苯胺和4-羟基偶氮-苯-2-羧酸。
适合的酶标记物的非限制性实例包括苹果酸脱氢酶、葡萄球菌核酸酶、δ-5-类固醇异构酶、酵母-乙醇脱氢酶、α-磷酸甘油脱氢酶、磷酸丙糖异构酶、过氧化物酶、碱性磷酸酶、门冬酰胺酶、葡萄糖氧化酶、β-半乳糖苷酶、核糖核酸酶、尿酶、催化酶、葡萄糖-6-磷酸脱氢酶、葡糖淀粉酶和乙酰化胆碱脂酶。
适合的放射性同位素标记物的非限制性实例包括3h、111in、125i、131i、32p、35s、14c、51cr、57to、58co、59fe、75se、152eu、90y、67cu、217ci、211at、212pb、47sc、223ra、223ra、89zr、177lu和109pd。在某些实施方式中,111in对于体内成像是优选的同位素,这是因为它避免了125i或131i-标记的双特异性结合分子在肝中的脱卤问题。另外,111in对于成像具有更良好的γ发射能(perkins等人,eur.j.nucl.med.70:296-301(1985);carasquilloetah,j.nucl.med.25:281-287(1987))。例如,用1-(p-异硫氰酸苄基)-dpta偶联至单克隆抗体的111in在非肿瘤组织,特别是肝中显示出很少的吸收,并因此提高了肿瘤定位的特异性(esteban等人,j.nucl.med.28:861-870(1987))。
适合的非放射性同位素标记物的非限制性实例包括157gd、55mn、162dy、52tr和56fe。
适合的荧光标记物的非限制性实例包括152eu标记物、荧光素标记物、异硫氰酸盐标记物、罗丹明标记物、藻红蛋白标记物、藻青蛋白标记物、别藻蓝蛋白标记物、绿色荧光蛋白(gfp)标记物、邻苯二甲醛标记物和荧光胺标记物。
化学发光标记物的非限制性实例包括鲁米诺标记物、异鲁米诺标记物、芳香族吖啶鎓酯标记物、咪唑标记物、吖啶鎓盐标记物、草酸酯标记物、萤光素标记物、荧光素酶标记物和水母发光蛋白标记物。
核磁共振造影剂的非限制性实例包括重金属核,如gd、mn和铁。
本领域的技术人员已知用于将上述标记物结合至本文所提供的双特异性结合分子的技术描述于(例如)kennedy等人,clin.cmm.acta70:1-31(1976)和schurs等人,clin.cmm.acta81:1-40(1977)。后者中提及的偶联技术是戊二醛法、高碘酸盐法、二马来酰亚胺法、m-马来酰亚胺基苄基-n-羟基-琥珀酰亚胺酯法,所有方法作为参考并入本文。
在某些实施方式中,所述双特异性结合分子缀合至诊断试剂。诊断试剂是通过定位含有抗原的细胞在确诊或检测疾病中有用的试剂。有用的诊断试剂包括(但不限于)放射性同位素、染料(如具有生物素-抗生蛋白链菌素复合物)、造影剂、荧光化合物或分子和用于磁共振成象(mri)的增强剂(例如,顺磁离子)。美国专利no.6,331,175描述了mri技术和缀合至mri增强剂的抗体的制备,并将该专利以其全部内容作为参考引入。优选地,所述诊断试剂选自放射性同位素、磁共振成象中使用的增强剂和荧光化合物。为了加载具有放射性金属或顺磁离子的抗体成分,可能必需使其与具有长尾的试剂反应,所述长尾连接了多个用于结合离子的螯合基团。这种尾可以是聚合物,如聚赖氨酸、多糖或具有可以结合螯合基团的侧基的其他衍生化或可衍生化链,如(例如)乙二胺四乙酸(edta)、二乙烯三胺五乙酸(dtpa)、卟啉、聚胺、冠醚、双-缩氨基硫脲、聚肟等已知对于该目的有用的基团。使用标准化学方法,将螯合物偶联至抗体。通常,螯合物通过使其以最小免疫反应性损失和最低聚集和/或内部交联与分子形成键的基团连接至抗体,在1989年4月25日授权于hawthorne的标题为“抗体缀合物”的美国专利no.4,824,659中公开了用于将螯合物缀合至抗体的其他更不常见的方法和试剂,该专利的公开内容以其全部内容作为参考并入本文。特别有用的金属-螯合物组合包括2-苄基-dtpa及其一甲基和环己基类似物,其与诊断同位素一起用于放射成像。当与非放射性金属,如锰、铁和钆络合时,当与本文所提供的双特异性结合分子一起使用时,相同螯合物对于mri是有用的。大环螯合物,如nota、dota和teta与多种金属和放射金属,最具体地与镓、钇和铜的放射性核素一起是有用的。通过调节所关心的金属的环尺寸,可以制备非常稳定的这些金属-螯合物。本文涵盖了其他环状螯合物,如大环多醚,其对于稳定结合核素,如用于rait的223ra是有兴趣的。
5.2.2有机缀合物
在某些实施方式中,本文所提供的双特异性结合分子包含直接或间接共价键键合至双特异性结合分子的一个或多个有机部分。这种修饰可以产生药物动力学性质改善的抗体或抗原-结合片段(例如,体内血清半衰期升高)。所述有机部分可以是亲水聚合物基团、脂肪酸基团或脂肪酸酯基团。如本文所使用的,术语“脂肪酸”涵盖了单羧酸和二羧酸。如本文所使用的,“亲水性聚合物基团”是指在水中比在辛烷中更可溶的有机聚合物,例如,聚赖氨酸。适合于修饰本文所提供的双特异性结合分子的亲水聚合物可以是直链或支链的并且包括(例如)聚链烷二醇(例如,聚乙二醇(peg)、单甲氧基-聚乙二醇和聚丙二醇)、碳水化合物(例如,右旋糖酐、纤维素、寡糖和多糖)、亲水氨基酸的聚合物(例如,聚赖氨酸、聚精氨酸和聚天冬氨酸)、聚链烷氧化物(例如,聚环氧乙烷和聚环氧丙烷)和聚乙烯吡咯烷酮。在某些实施方式中,修饰本文所提供的双特异性结合分子的亲水聚合物作为单个分子实体的分子量为约800至约150,000道尔顿。例如,可以使用peg5000和peg20,000,其中下标是聚合物的平均分子量(道尔顿)。可以用1至约6个烷基、脂肪酸或脂肪酸酯基团取代亲水性聚合物基团。可以使用适合的方法制备用脂肪酸或脂肪酸酯基团取代的亲水聚合物。例如,可以将包含胺基的聚合物偶联至脂肪酸或脂肪酸酯的羧酸脂,并且可以将脂肪酸或脂肪酸酯上活化的羧酸脂(例如,用n,n-羰基二咪唑活化)偶联至聚合物上的羟基。
适合于修饰本文所提供的双特异性结合分子的脂肪酸和脂肪酸酯可以是饱和的或者可以含有一个或多个不饱和单元。适合于修饰本文所提供的双特异性结合分子的脂肪酸包括(例如)n-十二酸酯、n-四癸酸酯、n-硬脂酸酯、n-二十烷酸酯、n-二十二烷酸酯、n-三十烷酸酯、n-四十烷酸酯、顺式-δ-9-硬脂酸酯、所有顺式-δ-5,8,11,14-二十碳四烯酸酯、辛二酸、十四烷二酸、十八烷二酸、二十二烷二酸等。适合的脂肪酸酯包括包含直链或支链低级烷基基团的二羧酸的单酯。低级烷基基团可以包含1至约12,优选地1至约6个碳原子。
可以使用适合的方法,如通过与一种或多种改性剂反应来制备本文所提供的双特异性结合分子缀合物。如本文所使用的,“活化基团”是在适当条件下可以与第二化学基团反应的化学部分或官能团,借此在改性剂和第二化学基团之间形成共价键。例如,胺-反应性活化基团包括亲电子基团,如(例如)甲苯磺酸酯、甲磺酸酯,卤代(氯代、溴代、氟代、碘代)、n-羟基琥珀酰亚胺酯(nhs)等。可以与硫醇反应的活化基团包括(例如)马来酰亚胺、碘乙酰、丙烯酰、吡啶二硫化物、5-硫醇-2-硝基苯甲酸硫醇(tnb-硫醇)等。醛官能团可以偶联至含胺或含酰肼分子,并且叠氮基可以与三价磷基团反应以形成氨基磷酸酯或磷酰亚胺键。将活化基团引入分子的适合方法在本领域中是已知的(参见,例如,hernanson,g.t.,bioconjugatetechniques,academicpress:sandiego,calif.(1996))。可以将活化基团直接键合至有机基团(例如,亲水聚合物、脂肪酸、脂肪酸酯)或通过接头部分键合,例如,二价c1-c12基团,其中可以用杂原子,如氧、氮或硫取代一个或多个碳原子。适合的接头部分包括(例如)四乙二醇醚、(ch2)3和nh。可以(例如)通过在存在1-乙基-3-(3-二甲基氨丙基)碳二亚胺(edc)的情况下将单-boc-烷基二胺(例如,单-boc-乙二胺或单-boc-二氨基己烷)与脂肪酸反应来产生包含接头部分的改性剂,从而在游离胺和脂肪酸羧酸酯之间形成酰胺键。可以通过用三氟乙酸(tfa)处理从产物中除去boc保护基以暴露出可以与如所述的另一种羧酸酯偶联的伯胺,或者boc保护基可以与马来酸酐反应并将所得产物环化以产生脂肪酸活化的马来酰亚胺基衍生物。(参见,例如,thompson等人,wo92/16221,该专利的全部教导内容作为参考并入本文。)
如本文所使用的,“改性剂”是指包含活化基团的适合的有机基团(例如,亲水性聚合物、脂肪酸和脂肪酸酯)。例如,通过使用胺-反应性改性剂,例如,peg的n-羟基琥珀酰亚胺酯,可以以非位点特异的方式将有机部分键合至双特异性结合分子。还可以通过将双特异性结合分子的二硫键(例如,链内二硫键)还原来制备修饰的双特异性结合分子。然后,还原的双特异性结合分子可以与硫醇反应性改性剂反应以产生本文所提供的修饰的双特异性结合分子。可以使用适合的方法,如逆向蛋白水解(fisch等人,bioconjugatechem.,3:147-153(1992);werlen等人,bioconjugatechem.,5:411-417(1994);kumaran等人,proteinsci.6(10):2233-2241(1997);itoh等人,bioorg.chem.,24(1):59-68(1996);capellas等人,biotechnol.bioeng.,56(4):456-463(1997))和hermanson,g.t.,bioconjugatetechniques,academicpress:sandiego,calif.(1996)中所述的方法,制备包含键合至本文所提供的双特异性结合分子的特异性位的有机部分的修饰的双特异性结合分子。
5.3双特异性结合分子的产生
本文提供了用于产生如5.1节和5.2节中所述的双特异性结合分子的方法。在某些实施方式中,本文提供了用于产生双特异性结合分子的方法,所述双特异性结合分子包含作为结合至her2的包含两个相同的重链和两个相同的轻链的免疫球蛋白的非糖基化单克隆抗体,所述轻链是第一轻链和第二轻链,其中第一轻链通过肽接头融合至第一单链可变片段(scfv)以产生第一融合多肽,并且其中第二轻链通过肽接头融合至第二scfv以产生第二融合多肽,其中第一和第二scfv(i)是相同的,并且(ii)结合至cd3,并且其中第一和第二融合多肽是相同的。
例如,通过化学合成、通过从生物来源纯化或通过重组表达技术,包括(例如)从哺乳动物细胞或转基因制剂产生本文所述的双特异性结合分子的方法对于本领域的技术人员已知的。除非另外指明,否则本文所述的方法使用了本领域技术范围内的分子生物学、微生物学、基因分析、重组dna、有机化学、生物化学、pcr、寡核苷酸合成和修饰、核酸杂交和相关领域中的常规方法。例如,在本文引用的参考文献中描述了并且在文献中充分解释了这些技术。参见,例如,maniatis等人(1982)molecularcloning:alaboratorymanual,coldspringharborlaboratorypress;sambrook等人(1989),molecularcloning:alaboratorymanual,第2版,coldspringharborlaboratorypress;sambrook等人(2001)molecularcloning:alaboratorymanual,coldspringharborlaboratorypress,coldspringharbor,ny;ausubel等人,currentprotocolsinmolecularbiology,johnwiley&sons(1987以及每年更新版);currentprotocolsinimmunology,johnwiley&sons(1987以及每年更新版)gait(主编)(1984)oligonucleotidesynthesis:apracticalapproach,irlpress;eckstein(主编)(1991)oligonucleotidesandanalogues:apracticalapproach,irlpress;birren等人(主编)(1999)genomeanalysis:alaboratorymanual,coldspringharborlaboratorypress。
在本领域中存在用于产生双特异性结合分子的多种方法。例如,可以通过重组dna法,如美国专利no.4,816,567中所述的那些制备双特异性结合分子。使用常规程序(例如,通过使用能够特异性结合至编码鼠抗体重链和轻链,或者来源于人、人源化或其他来源的这些链的基因的寡核苷酸探针),可以将编码本文所提供的双特异性结合分子的一种或多种dna容易地分离并测序。一旦分离,可以将dna置于表达载体中,然后将所述载体转化到宿主细胞中,如ns0细胞、猿cos细胞、中国仓鼠卵巢(cho)细胞、酵母细胞、藻细胞、卵或不产生免疫球蛋白的骨髓瘤细胞,从而在重组宿主细胞中获得双特异性结合分子的合成。还可以(例如)通过用所需物种的人重链和轻链恒定域的编码序列代替同源人序列(美国专利no.4,816,567;morrison等人,如上)或通过将非免疫球蛋白多肽的编码序列的全部或部分共价连接至免疫球蛋白编码序列来修饰dna。可以用这种非免疫球蛋白多肽替代本文所提供的双特异性结合分子的恒定域。在某些实施方式中,dna如5.3.1节中所述。
还可以使用至少一种双特异性结合分子-编码多核苷酸制备本文所提供的双特异性结合分子,从而提供在它们的乳汁中产生这些抗体的转基因动物或哺乳动物,如山羊、牛、马、绵羊等。可以使用已知的方法提供这些动物。参见,例如,但不限于,美国专利no.5,827,690;5,849,992;4,873,316;5,849,992;5,994,616,5,565,362;5,304,489等,以上每篇专利全部作为参考并入本文。
在某些实施方式中,还可以使用本文所提供的至少一种双特异性结合分子-编码多核苷酸制备本文所提供的双特异性结合分子以提供在植物部分或从中所培养的细胞中产生这些抗体、指定部分或变体的转基因植物和培养的植物细胞(例如,但不限于烟草和玉米)。作为非限制性实例,已成功将表达重组蛋白质的转基因烟叶(例如,使用诱导型启动子)用于提供大量重组蛋白。参见,例如,cramer等人,curr.top.microbol.immunol.240:95-118(1999)和其中引用参考文献。另外,转基因玉米已用于以大规模生产水平表达哺乳动物蛋白,其生物活性相当于其他重组系统中产生的或从天然来源纯化的那些。参见,例如,hood等人,adv.exp.med.biol.464:127-147(1999)和其中引用参考文献。还从转基因植物种子(包括烟草种子和马铃薯块茎)中大量生产了抗体,其包括抗体片段,如scfv。参见,例如,conrad等人,plantmol.biol.38:101-109(1998)和其中引用参考文献。因此,根据已知方法,还可以使用转基因植物生产双特异性结合分子。参见,例如,fischer等人,biotechnol.appl.biochem.30:99-108(october,1999);ma等人,trendsbiotechnol.13:522-7(1995);ma等人,plantphysiol.109:341-6(1995);whitelam等人,biochemsoc.trans.22:940-944(1994);和其中引用参考文献。以上参考文献中的每一个完全作为参考并入本文。
在某些实施方式中,可以使用本文所提供的至少一种双特异性结合分子-编码多核苷酸制备本文所提供的双特异性结合分子以提供产生这些双特异性结合分子的细菌。作为非限制性实例,表达重组蛋白质的大肠杆菌(e.coli)已成功用于提供大量重组蛋白质。参见,例如,verma等人,1998,216(1-2):165-181和其中引用参考文献。
有关设计和产生本文所述的双特异性结合分子的详细实例,另外参见6.1.2.1节。
在某些实施方式中,可以通过熟知的方法从重组细胞培养物中回收和纯化双特异性结合分子,所述方法包括(但不限于)蛋白a纯化、蛋白g纯化、硫酸铵或乙醇沉淀、酸萃取、阴离子或阳离子交换色层分离法、磷酸纤维素色谱法、疏水性相互作用色谱法、亲和色谱法、羟基磷灰石色谱法和凝集素色谱法。高效液相色谱法(“hplc”)也可以用于纯化。参见,例如,colligan,currentprotocolsinimmunology或currentprotocolsinproteinscience,johnwiley&sons,ny,n.y.,(1997-2001),例如,第1、4、6、8、9和10章,每章完全作为参考并入本文。
在某些实施方式中,本文所提供的双特异性结合分子包括天然纯化的产物、化学合成程序的产物和通过重组技术从真核宿主产生的产物,所述宿主包括(例如)酵母、高等植物、昆虫和哺乳动物细胞。在优选的实施方式中,在宿主中产生双特异性结合分子,从而所述双特异性结合分子是非糖基化的。在另一个优选的实施方式中,在细菌细胞中产生所述双特异性结合分子,从而所述双特异性结合分子是非糖基化的。在多个标准实验手册中描述了这些方法,如sambrook,如上,17.37-17.42节;ausubel,如上,10、12、13、16、18和20章;colligan,proteinscience,如上,第12-14章,以上所有参考文献完全作为参考并入本文。
可以通过(例如)elisa、elispot、流式细胞术、免疫细胞学、biacoretm分析、sapidynekinexatm动力学排除测定、sds-page和免疫印迹或通过hplc分析以及通过本文所公开的一些其他功能测定来鉴定纯化的抗体。
5.3.1多核苷酸
在某些实施方式中,本文提供了包含免疫特异性结合至her2和cd3的编码本文所述的双特异性结合分子或其片段(例如,重链和/或轻链融合多肽)的核苷酸序列的多核苷酸,如5.1节和5.2节所述。本文还提供了包含这些多核苷酸的载体。参见,5.3.2节。本文还提供了编码本文所提供的双特异性结合分子的抗原的多核苷酸。本文还提供了在严格性或低严格性杂交条件下杂交至编码本文所提供的双特异性结合分子或其片段的多核苷酸的多核苷酸。
语言“纯化的”包括具有小于约15%、10%、5%、2%、1%、0.5%或0.1%(具体地小于约10%)的其他材料,例如,细胞材料、培养基、其他核酸分子、化学前体和/或其他化学物质的多核苷酸或核酸分子的制剂。在具体的实施方式中,分离或纯化了编码本文所述的双特异性结合分子的核酸分子。
本文所提供的核酸分子可以处于rna形式,如mrna、hnrna、trna或任何其他形式,或处于dna形式,包括(但不限于)通过克隆或合成产生的cdna和基因组dna或它们的任意组合。所述dna可以是三链、双链或单链的或它们的任意组合。所述dna或rna的至少一条链的任何部分可以是编码链,也称为有义链,或者它可以是非编码链,也称为反义链。
在某些实施方式中,本文提供了包含编码如5.1节和5.2节所述的双特异性结合分子或其片段的核苷酸序列的多核苷酸,其中所述双特异性结合分子包含作为结合至her2的包含两个相同的重链和两个相同的轻链的免疫球蛋白的非糖基化单克隆抗体,所述轻链是第一轻链和第二轻链,其中第一轻链通过肽接头融合至第一scfv以产生第一轻链融合多肽,并且其中第二轻链通过肽接头融合至第二scfv以产生第二轻链融合多肽,其中第一和第二scfv(i)是相同的,并且(ii)结合至cd3,并且其中第一和第二轻链融合多肽是相同的。
对于如本文所述的双特异性结合分子的产生的详细实例,对于本文所述的双特异性结合分子的设计和产生的详细实例,参见6.1.2.1节。
在某些实施方式中,本文提供了包含编码轻链融合多肽的核苷酸序列的多核苷酸,所述轻链融合多肽包含通过肽接头融合至scfv的轻链,其中所述轻链结合至her2并且其中所述scfv结合至cd3。在某些实施方式中,所述轻链是本领域中已知的her2-特异抗体的轻链,如(例如)曲妥珠单抗、m-111、帕妥珠单抗、厄马索单抗、mdxh210、2b1和mm-302。在某些实施方式中,scfv包含本领域中已知的抗cd3抗体的vh和vl,如(例如)huokt3、yth12.5、hum291、替利珠单抗、huclb-t3/4、奥昔珠单抗、博纳吐单抗、mt110、卡妥索单抗、28f11、27h5、23f10、15c3、维利珠单抗和hum291。在优选的实施方式中,抗cd3抗体是huokt3。在特别优选的实施方式中,scfv包含huokt3的vh,还包含编号位置105处的氨基酸取代,其中所述半胱氨酸被丝氨酸取代。参见,例如,kipriyanov等人,1997,proteineng.445-453。在某些实施方式中,scfv来源于huokt3单克隆抗体并且相对于天然huokt3vh和vl序列,包含一个或多个突变以稳定二硫化物结合。在某些实施方式中,二硫化物结合的稳定防止双特异性结合分子的聚集。在某些实施方式中,与无二硫化物结合稳定的双特异性结合分子的聚集相比,二硫化物结合的稳定降低了双特异性结合分子的聚集。在双特异性结合分子的某些实施方式中,稳定二硫化物结合的一个或多个突变包括vhg44c突变和vlq100c突变(例如,如seqidno:54-59中存在的)。在双特异性结合分子的某些实施方式中,稳定二硫化物结合的一个或多个突变是vh44处(根据kabat编号系统)氨基酸残基被半胱氨酸替换和vl100处(根据kabat编号系统)氨基酸残基被半胱氨酸替换,从而在vh44和vl100之间引入二硫键(例如,如seqidno:54-59中存在的)。在某些实施方式中,肽接头长度在5-30、5-25、5-15、10-30、10-20、10-15、15-30或15-25个氨基酸残基。在某些实施方式中,肽接头序列如上表1所述(例如,seqidno:14或35-41中的任一个)。在特别优选的实施方式中,肽接头的序列是seqidno:14。在某些实施方式中,scfv序列包含如上表8中所述的一个或多个修饰。
在具体的方面,本文提供了编码特异性结合至her2和cd3并且包含如本文所述的氨基酸序列的双特异性结合分子或其片段的核苷酸序列的多核苷酸,以及与这些双特异性结合分子竞争与her2和/或cd3的结合或结合至与这些抗体相同的表位的抗体。
在优选的实施方式中,轻链序列是seqidno:25。在优选的实施方式中,编码轻链的核苷酸序列是seqidno:24。在优选的实施方式中,scfv的序列是seqidno:19。在优选的实施方式中,编码scfv的核苷酸序列是seqidno:18。在优选的实施方式中,轻链序列是seqidno:25,scfv序列是seqidno:19。在优选的实施方式中,编码轻链的核苷酸序列是seqidno:24,编码scfv的核苷酸序列是seqidno:18。在优选的实施方式中,轻链融合多肽的序列是seqidno:29。在优选的实施方式中,编码轻链融合多肽的核苷酸序列是seqidno:28。
在某些实施方式中,双特异性结合分子具有在曲妥珠单抗免疫球蛋白中含有一个或多个修饰的曲妥珠单抗-来源序列,并且具有在如下表8所述的huokt3vh和vl序列中含有一个或多个修饰的huokt3-来源序列。具有其他免疫球蛋白或scfv序列的双特异性结合分子可以在这些其他免疫球蛋白或scfv序列的相应位置含有类似突变。在某些实施方式中,双特异性结合分子(a)来源于曲妥珠单抗和huokt3;和(b)含有如上表8所述的一个或多个修饰。在某些实施方式中,将免疫球蛋白轻链和scfv缀合的肽接头序列如上表1所述(例如,seqidno:14或35-41中的任一个)。在某些实施方式中,重链序列如上表2所述(例如,seqidno:23、27、62或63中的任一个)。在某些实施方式中,轻链序列如上表3所述(例如,seqidno:25)。在某些实施方式中,scfv的vh的序列如上表4所述(例如,seqidno:15、17或64中的任一个)。在某些实施方式中,scfv的vl的序列如上表5所述(例如,seqidno:16或65中的任一个)。在某些实施方式中,scfv肽接头序列如上表1所述(例如,seqidno:14或35-41中的任一个)。在某些实施方式中,scfv的序列如上表6所述(例如,seqidno:19或48-59中的任一个)。在某些实施方式中,轻链融合多肽序列如上表7所述(例如,seqidno:29、34、42-47或60中的任一个)。
在某些实施方式中,本文提供了包含编码5.2节中所述的her2-特异抗体的重链的核苷酸序列的多核苷酸。在某些实施方式中,所述重链是本领域中已知的her2-特异抗体的重链,如(例如)曲妥珠单抗、m-111、帕妥珠单抗、厄马索单抗、mdxh210、2b1和mm-302。在优选的实施方式中,所述抗体包含曲妥珠单抗的vh,其中所述重链的序列是seqidno:27。在优选的实施方式中,所述抗体包含曲妥珠单抗的vh,其中编码重链的核苷酸序列是seqidno:26。在优选的实施方式中,重链的序列包含曲妥珠单抗的vh并且包含fc区中的氨基酸取代n297a(seqidno:26)。在优选的实施方式中,编码重链的核苷酸序列包含编码曲妥珠单抗vh的核苷酸序列并且包含fc区中的氨基酸取代n297a(seqidno:26)。在优选的实施方式中,重链的序列包含曲妥珠单抗vh的序列并且包含fc区中的氨基酸取代k322a(seqidno:27)。在优选的实施方式中,编码重链的核苷酸序列包含编码曲妥珠单抗vh的核苷酸序列并且包含fc区中的氨基酸取代k322a(seqidno:26)。在特别优选的实施方式中,重链的序列包含曲妥珠单抗vh的序列并且包含fc区中的氨基酸取代n297a和k322a(seqidno:27)。在特别优选的实施方式中,编码重链的核苷酸序列包含编码曲妥珠单抗vh的核苷酸序列并且包含fc区中的氨基酸取代n297a和k322a(seqidno:26)。
可以通过本领域中已知的任何方法获得本文所提供的多核苷酸。例如,如果编码本文所述的双特异性结合分子或其片段的核苷酸序列是已知的,则编码双特异性结合分子或其片段的多核苷酸可以从化学合成的寡核苷酸组装(例如,如kutmeier等人,biotechniques17:242(1994)中所述),简要地,其包括含有编码所述抗体的序列的部分的重叠寡核苷酸的合成,退火和那些寡核苷酸的连接,然后通过pcr扩增连接的寡核苷酸。
作为另外一种选择,可以从来自适合来源的核酸产生编码双特异性结合分子或其片段的多核苷酸。如果含有编码特定双特异性结合分子或其片段的核酸的克隆不可用,但是双特异性结合分子或其片段的序列已知,则可以化学合成或使用杂交至所述序列3'和5'端的合成引物通过pcr扩增或者通过使用对特定基因序列特异的寡核苷酸探针的克隆从适合的来源(例如,抗体cdna文库,或从表达抗体的任何组织或细胞,如选择以表达本文所提供的抗体的杂交瘤细胞产生的cdna文库,或从中分离的核酸,优选地多聚a+rna)获得编码双特异性结合分子或其片段的核酸。然后,可以使用本领域中熟知的任何方法将通过pcr产生的扩增的核酸克隆到可复制的克隆载体中。参见,例如,5.3.2节。
在某些实施方式中,双特异性结合分子的抗体的氨基酸序列在本领域中是已知的。在这些实施方式中,可以使用本领域中熟知的对于操控核苷酸序列的方法,例如,重组dna技术、定点突变、pcr等(参见,例如,sambrook等人,1990,molecularcloning,alaboratorymanual,第2版,coldspringharborlaboratory,coldspringharbor,n.y.andausubel等人主编,1998,currentprotocolsinmolecularbiology,johnwiley&sons,n.y.中所述的技术,以上文献以其全部内容作为参考并入本文)操控编码这种抗体的多肽,以产生具有不同氨基酸序列的双特异性结合分子,例如,以产生氨基酸取代、缺失和/或插入。例如,可以实施这些操控以使所编码的氨基酸非糖基化,或者破坏抗体结合至c1q,fc受体的能力,或者激活补体系统。
本文所提供的分离的核酸分子可以包括包含开放阅读框(orf),以及任选地一个或多个内含子,例如(但不限于)至少一个互补决定区(cdr)的至少一个指定部分,如至少一个重链或轻链的cdr1、cdr2和/或cdr3的核酸分子;包含抗her2抗体或可变区、抗cd3scfv或单链融合多肽的编码序列的核酸分子;和包含基本不同于上述那些,但由于遗传密码的简并度仍编码如本文所述和/或如本领域中已知的至少一种双特异性结合分子的核酸分子。
本文还提供了在选择性杂交条件下杂交至本文所公开的多核苷酸的分离的核酸。因此,该实施方式的多核苷酸可以用于分离、检测和/或定量包含这些多核苷酸的核酸。例如,本文所提供的多核苷酸可以用于鉴别、分离或扩增保存文库中的部分或全长克隆。在一些实施方式中,所述多核苷酸是分离自人或哺乳动物核酸文库或否则与其互补的基因组或cdna序列。
所述核酸可以方便地包含除本文所提供的多核苷酸之外的序列。例如,可以将包含一个或多个核酸内切酶限制性酶切位点的多克隆位点插入核酸以帮助分离所述多核苷酸。另外,可以插入可翻译序列以帮助分离本文所提供的翻译的多核苷酸。例如,六组氨酸标志物序列提供了纯化本文所提供的多肽的适合方式。本文所提供的核酸-除编码序列之外-任选地为用于克隆和/或表达本文所提供的多核苷酸的载体、接头(adapter)或接头(linker)。
可以将其他序列添加到这些克隆和/或表达序列中以优化它们在克隆和/或表达中的功能,以帮助分离所述多核苷酸,或者以改善所述多核苷酸向细胞的引入。克隆载体、表达载体、接头(adapter)和接头(linker)的使用在本领域中是熟知的(参见,例如,ausubel,如上;或者sambrook,如上)。
在具体的实施方式中,使用常规重组dna技术,可以将本文所述抗体的一个或多个cdr插入到框架区内。所述框架区可以是天然存在的或者是共有框架区,并且优选地人框架区(对于人框架区列表,参见,例如,chothia等人,j.mol.biol.278:457-479(1998))。优选地,通过框架区和cdr的组合产生的多核苷酸编码了特异地结合her2的抗体。可以在框架区内制备一个或多个氨基酸取代,并且优选地,所述氨基酸取代改善了抗体与其抗原的结合。另外,这些方法可以用于造成参与链内二硫键的一个或多个可变区半胱氨酸残基的氨基酸取代或缺失,从而产生缺少一个或多个链内二硫键的抗体分子。本文提供了多核苷酸的其他改变并且这些改变是在本领域的技术范围内的。
在某些实施方式中,一旦与另一个核酸分子连接,则分离或纯化的核酸分子或其片段可以编码融合蛋白。融合蛋白的产生在本领域的一般技术范围内并且可以包括限制酶或重组克隆技术的使用(参见,例如,gateway.tm.(invitrogen))。另外参见,美国专利no.5,314,995。
在某些实施方式中,本文所提供的多核苷酸处于如5.3.2节中所述的载体(例如,表达载体)的形式。
5.3.2细胞和载体
在某些实施方式中,本文提供了(例如,重组)表达如本文所述的双特异性结合分子的细胞(例如,离体细胞)。本文还提供了包含用于在宿主细胞,优选地哺乳动物细胞中重组表达的核苷酸序列(参见,例如,5.3.1节)的载体(例如,表达载体),所述核苷酸序列编码本文所述的双特异性结合分子或其片段。本文还提供了包含用于重组表达本文所述的双特异性结合分子的这些载体或核苷酸序列的细胞(例如,离体细胞)。本文还提供了用于产生本文所述的双特异性结合分子的方法,其包括从细胞(例如,离体细胞)表达这种双特异性结合分子。在优选的实施方式中,所述细胞是离体细胞。
载体(例如,表达载体)是包含在细胞(例如,离体细胞)中表达的基因的dna分子。通常,将基因表达置于某些调控元件的控制之下,所述调控元件包括组成型或诱导型启动子、组织-特异性调控元件和增强子。据称这种基因“可操作连接至”调控元件,例如,启动子。重组宿主可以是含有克隆载体或表达载体的任何原核或真核细胞。该术语还包括通过基因工程在宿主细胞或宿主细胞的细胞(例如,离体细胞)的染色体或基因组中包含克隆基因的那些原核或真核细胞和转基因动物。
在优选的实施方式中,所述启动子是cmv启动子。
在某些实施方式中,本文提供了包含一个或多个如5.3.1节所述的多核苷酸的载体。
在某些实施方式中,可以将如5.3.1节所述的多核苷酸克隆到适合的载体中并且可以用于转化或转染任何适合的宿主。载体和构建这类载体的方法是本领域的技术人员所知的并且在一般技术参考资料中有述(一般地,参见,“recombinantdnapartd,”methodsinenzymology,vol.153,wuandgrossman主编,academicpress(1987))。在某些实施方式中,载体包含调控序列,如转录和翻译起始和终止密码子,根据情况并且考虑载体是dna还是rna,所述序列对引入载体的宿主类型(例如,细菌、真菌、植物、昆虫或哺乳动物)特异。在某些实施方式中,所述载体包含对宿主属特异的调控序列。在某些实施方式中,所述载体包含对宿主种特异的调控序列。
在某些实施方式中,所述载体包含一个或多个标志物基因,其允许选择转化或转染的宿主。标志物基因的非限制性实例包括杀菌剂耐受性,例如,抗生素、重金属等的耐受性,营养缺陷型宿主中的补充以提供原养等。在优选的实施方式中,所述载体包含氨苄西林和潮霉素可选择标志物。
在某些实施方式中,表达载体可以包含可操作性连接至如5.3.1节所述的多核苷酸的天然或标准启动子。对启动子的选择(例如,强、弱、可诱导、组织-特异性和发育特异性)在本领域技术范围内。类似地,如上所述的核酸分子或其片段与启动子的组合也在本领域技术范围内。
适合载体的非限制性实例包括设计用于增殖和扩增或用于表达或两者的那些。例如,克隆载体可以选自puc系列、pbluescript系列(stratagene,lajolla,calif.)、pet系列(novagen,madison,wis.)、pgex系列(pharmaciabiotech,uppsala,sweden)和pex系列(clontech,paloalto,calif.)。还可以使用噬菌体载体,如lamda-gt10、lamda-gt11、lamda-zapii(stratagene)、lamda-embl4和lamda-nm1149。植物表达载体的非限制性实例包括pbi110、pbi101.2、pbi101.3、pbi121和pbin19(clontech)。动物表达载体的非限制性实例包括peuk-c1、pmam和pmamneo(clontech)。还可以根据生产商的建议使用topo克隆系统(invitrogen,carlsbad,calif.)。
在某些实施方式中,所述载体是哺乳动物载体。在某些实施方式中,哺乳动物载体含有至少一个调节mrna转录起始的启动子元件,双特异性结合分子编码序列以及转录本转录和多腺苷酸化终止所需的信号。在某些实施方式中,哺乳动物载体含有其他元件,如,例如,增强子、kozak序列以及用于rna拼接的供体和受体位点侧接的间插序列。在某些实施方式中,可以通过(例如)来自sv40的早期和晚期启动子、来自反转录病毒的长末端重复(ltrs),例如,rsv、htlvi、hivi和巨细胞病毒(cmv)的早期启动子实现高效转录。然而,还可以使用细胞分子(例如,人肌动蛋白启动子)。哺乳动物表达载体的非限制性实例包括,载体,如pireslneo、pretro-off、pretro-on、plxsn或plncx(clonetechlabs,paloalto,calif.)、pcdna3.1(+/-)、pcdna/zeo(+/-)或pcdna3.1/hygro(+/-)(invitrogen)、psvl和pmsg(pharmacia,uppsala,sweden)、prsvcat(atcc37152)、psv2dhfr(atcc37146)和pbc12mi(atcc67109)。可以与这些哺乳动物载体组合使用的哺乳动物宿主细胞的非限制性实例包括人hela293、h9和jurkat细胞、小鼠nih3t3和c127细胞、cos1、cos7和cv1、quailqc1-3细胞、老鼠l细胞和中国仓鼠卵巢(cho)细胞。
在某些实施方式中,所述载体是病毒载体,例如,反转录病毒载体、细小病毒-基载体,例如,腺病毒相关病毒(aav)-基载体、aav-腺病毒嵌合载体和腺病毒-基载体以及慢病毒载体,如单纯性疱疹(hsv)-基载体。在某些实施方式中,调控所述病毒载体以使其病毒复制缺陷。在某些实施方式中,调控所述病毒载体以消除对宿主的毒性。可以使用标准重组dna技术制备这些病毒载体,例如,sambrook等人,molecularcloning,alaboratorymanual,第2版,coldspringharborpress,coldspringharbor,n.y.(1989);和ausubel等人,currentprotocolsinmolecularbiology,greenepublishingassociatesandjohnwiley&sons,newyork,n.y.(1994)。
在某些实施方式中,可以通过常规技术将本文所述的载体或多核苷酸转移到细胞(例如,离体细胞),并且可以通过常规技术培养所得细胞以产生本文所述的双特异性结合分子。因此,本文提供了包含编码双特异性结合分子或其片段、其重链或轻链或其轻链融合多肽的多核苷酸的细胞,所述多核苷酸可操作性连接至启动子以用于在宿主细胞中表达这些序列。在某些实施方式中,可以将可操作性连接至启动子的编码重链的载体和可操作性连接至启动子的编码轻链融合多肽的载体在细胞中共表达以用于整个双特异性结合分子的表达,如下所述。在某些实施方式中,细胞包含载体,其包含可操作性连接至启动子的编码本文所述的双特异性结合分子的重链和轻链融合多肽两者的多核苷酸。在某些实施方式中,细胞包含两个不同的载体,所述第一载体包含可操作性连接至启动子的编码重链的多核苷酸,并且所述第二载体包含可操作性连接至启动子的编码轻链融合多肽的多核苷酸。在某些实施方式中,第一细胞包含第一载体,其包含编码本文所述的双特异性结合分子的重链的多核苷酸,并且第二细胞包含第二载体,其包含编码本文所述的双特异性结合分子的轻链融合多肽的多核苷酸。在某些实施方式中,本文提供了包含这种第一细胞和这种第二细胞的细胞混合物。在优选的实施方式中,所述细胞表达所述载体,从而细胞有效地转录和翻译所述寡核苷酸。
在实施方式中,所述细胞表达所述载体,从而细胞有效地转录和翻译寡核苷酸或其片段。
在某些实施方式中,所述细胞存在于宿主中,所述宿主可以是动物,如哺乳动物。细胞的实例包括(但不限于)人细胞、人细胞系、大肠杆菌(e.coli)(例如,大肠杆菌(e.coli)tb-1、tg-2、dh5a、xl-bluemrf'(stratagene)、sa2821和y1090)、枯草芽孢杆菌(b.subtilis)、铜绿假单胞菌(p.aerugenosa)、酿酒酵母(s.cerevisiae)、粗糙脉孢菌(n.crassa)、昆虫细胞(例如,sf9、ea4)以及下文所述的其他细胞。在优选的实施方式中,所述细胞是cho细胞。在特别优选的实施方式中,所述细胞是cho-s细胞。
在某些实施方式中,可以在包含通过将多核苷酸引入细胞整合到染色体中的多核苷酸的稳定细胞系中表达本文所述的多核苷酸。在某些实施方式中,通过(例如)电穿孔将多核苷酸引入细胞。在某些实施方式中,通过(例如)将包含多核苷酸的载体转染到细胞中,将所述多核苷酸引入细胞。在某些实施方式中,用可选择标志物共转染载体,如dhfr、gpt、新霉素或潮霉素,以使得能够鉴别和分离转染的细胞。在某些实施方式中,可以扩增转染的多核苷酸以表达大量编码的双特异性结合分子。例如,可以使用dhfr(二氢叶酸还原酶)标志物以发展具有数百甚至数千个所关心的多核苷酸的拷贝的细胞系。选择标志物的另一个实例是酶谷氨酰胺合酶(gs)(murphy等人,biochem.j.227:277-279(1991);bebbington等人,bio/technology10:169-175(1992))。使用这些标志物,将细胞在选择性培养基中生长,并且选择具有最高耐受性的细胞。这些细胞系含有整合到染色体中的扩增的基因。通常,将中国仓鼠卵巢(cho)和nso细胞用于双特异性结合分子的生产。
在优选的实施方式中,所述载体包含(i)可操作性连接至第一启动子的编码包含通过肽接头融合至scfv的免疫球蛋白轻链的轻链融合多肽的第一多核苷酸序列,其中所述轻链结合至her2并且其中所述scfv结合至cd3,和(ii)可操作性连接至第二启动子的编码结合至her2的免疫球蛋白重链的第二多核苷酸。在某些实施方式中,所述载体是病毒载体。
5.4结合至双特异性结合分子的t细胞
不受任何理论束缚,据信当通过(例如)程序,如本文所述的那些程序将本文所提供的双特异性结合分子结合至t细胞时,双特异性结合分子的抗cd3scfv结合至t细胞表面上的cd3。不受任何理论束缚,据信双特异性结合分子与t细胞的结合(即抗cd3scfv与t细胞上表达的cd3的结合)激活t细胞,并因此使得能够将t细胞受体-基细胞毒性重导向至所需的肿瘤靶标,从而绕过mhc限制。
因此,本发明还提供了结合至本发明的双特异性结合分子(例如,如5.1节和5.2节所述)的t细胞。在具体的实施方式中,所述t细胞非共价结合至双特异性结合分子。在具体的实施方式中,t细胞对t细胞所给予的受试者是自体同源的。在具体的实施方式中,t细胞对t细胞所给予的受试者时同种异体的。在具体的实施方式中,所述t细胞是人t细胞。
在具体的实施方式中,根据5.6节中所述的方法使用结合至本发明的双特异性结合分子的t细胞。在具体的实施方式中,如5.9节所述,作为组合疗法的一部分使用结合至本发明的双特异性结合分子的t细胞。
5.5药物组合物和试剂盒
在某些实施方式中,本文提供了包含药物有效量的如5.1节或5.2节中所述的一种或多种双特异性结合分子的组合物(例如,药物组合物)和试剂盒。可以在单个单一单位剂量形式的制备中使用组合物。本文提供的组合物可以配制用于胃肠外、皮下、肌内、静脉、关节内、支气管内、腹内、囊内、软骨内、腔内、体腔内、小脑内、脑室内、奥马耶贮器(ommaya)内、眼内、玻璃体内、大肠内、颈管内、胃内、肝内、心肌内、骨内、骨盆内、心包内、腹膜内、胸膜内、前列腺内、肺内、直肠内、肾内、视网膜内、脊柱内、滑膜内、胸骨正中内、子宫内、膀胱内、丸剂、阴道、直肠、口腔、舌下、鼻内、鞘内、脑中脑室内、脑中实质内或透皮给予。在优选的实施方式中,将所述组合物配制用于胃肠外给予。在特别优选的实施方式中,将所述组合物配制用于静脉内给予。在优选的实施方式中,将所述组合物配制用于腹膜内给予。在具体的实施方式中,将所述组合物配制用于腹膜内给予以治疗腹膜转移。在优选的实施方式中,将所述组合物配制用于鞘内给予。在具体的实施方式中,将所述组合物配制用于鞘内给予以治疗脑转移。参见,例如,kramer等人,2010,97:409-418。在优选的实施方式中,将所述组合物配制用于脑中脑室内给予。在具体的实施方式中,将所述组合物配制用于脑室内给予以治疗脑转移。参见,例如,kramer等人,2010,97:409-418。在优选的实施方式中,将所述组合物配制用于脑中实质内给予。在具体的实施方式中,将所述组合物配制用于实质内给予以治疗脑肿瘤或脑肿瘤转移。参见,例如,luther等人,2014,neurooncol,16:800-806和临床试验idnonct01502917。
在具体的实施方式中,将所述组合物配制用于腹膜内给予以用于腹膜转移。
在某些实施方式中,本文提供了包含一种或多种多核苷酸的组合物,所述多核苷酸包含编码如本文所述的双特异性结合分子的核苷酸序列。在某些实施方式中,本文提供了包含细胞的组合物,其中所述细胞包含一种或多种多核苷酸,所述多核苷酸包含编码如本文所述的双特异性结合分子的核苷酸序列。在某些实施方式中,本文提供了包含载体的组合物,其中所述载体包含一种或多种多核苷酸,所述多核苷酸包含编码如本文所述的双特异性结合分子的核苷酸序列。在某些实施方式中,本文提供了包含细胞的组合物,其中所述细胞包含载体,其中所述载体包含一种或多种多核苷酸,所述多核苷酸包含编码如本文所述的双特异性结合分子的核苷酸序列。
在某些实施方式中,本文所述的组合物是稳定或保存的制剂。在某些实施方式中,所述稳定制剂包含具有盐水或所选的盐的磷酸盐缓冲液。在某些实施方式中,所述组合物是多用途的保存的制剂,其适合于药物或兽医使用。在某些实施方式中,本文所述的组合物包含防腐剂。防腐剂是本领域技术人员已知的。防腐剂的非限制性实例包括苯酚、m-甲酚、p-甲酚、o-甲酚、氯甲酚、苯甲醇、硝酸苯基汞、苯氧乙醇、甲醛、氯代丁醇、氯化镁(例如,六水合物)、烷基苯甲酸酯(甲基、乙基、丙基、丁基等)、苯扎氯铵、苄索氯铵和脱氢醋酸钠以及硫柳汞或其在水性稀释剂中的混合物。如本领域中已知的,可以使用任何适合的浓度或混合物,如0.001-5%或其中任何范围或值,如(但不限于)0.001、0.003、0.005、0.009、0.01、0.02、0.03、0.05、0.09、0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1.0、1.1、1.2、1.3、1.4、1.5、1.6、1.7、1.8、1.9、2.0、2.1、2.2、2.3、2.4、2.5、2.6、2.7、2.8、2.9、3.0、3.1、3.2、3.3、3.4、3.5、3.6、3.7、3.8、3.9、4.0、4.3、4.5、4.6、4.7、4.8、4.9,或其中任何范围或值。非限制性实例包括无防腐剂、0.1-2%间甲酚(例如,0.2、0.3、0.4、0.5、0.9、1.0%)、0.1-3%苯甲醇(例如,0.5、0.9、1.1、1.5、1.9、2.0、2.5%)、0.001-0.5%硫柳汞(例如,0.005、0.01)、0.001-2.0%苯酚(例如,0.05、0.25、0.28、0.5、0.9、1.0%)、0.0005-1.0%烷基苯甲酸酯(例如,0.00075、0.0009、0.001、0.002、0.005、0.0075、0.009、0.01、0.02、0.05、0.075、0.09、0.1、0.2、0.3、0.5、0.75、0.9、1.0%)等。
有时可以期望在持续的一段时间内,例如,1周至1年或以上的一段时间内,将本文提供的组合物从一次给予递送至受试者。可以使用多种缓释、贮库或植入剂量形式。例如,剂量形式可以含有在体液中具有低溶解度的化合物的可药用的无毒的盐,例如,(a)与多价酸的酸加成盐,如磷酸、硫酸、柠檬酸、酒石酸、鞣酸、双羟萘酸、海藻酸、聚谷氨酸、萘单或二磺酸、多聚半乳糖醛酸等;(b)与多价金属阳离子的盐,如锌、钙、铋、钡、镁、铝、铜、钴、镍、镉等,或与从(例如)n,n'-二苄基-乙二胺或乙二胺形成的有机阳离子形成的盐;或者(c)(a)和(b)的组合,例如,丹宁酸锌盐。另外,可以将本文提供的组合物,优选地,相对不溶性盐,如前述那些在凝胶,例如,单硬脂酸铝凝胶中与适合于注射的(例如)芝麻油配制。特别优选的盐是锌盐、丹宁酸锌盐、双羟萘酸锌盐等。用于注射的另一类缓释贮库制剂将含有用于在缓慢降解、无毒、非抗原性聚合物中包封而分散的化合物或盐,所述聚合物如聚乳酸/聚乙醇酸聚合物,例如,如美国专利no.3,773,919中所述。还可以将所述化合物,或者优选地,相对不溶性盐,如上述那些在胆固醇基质硅胶颗粒中配制,具体地,用于动物。其他缓释、贮库或植入组合物,例如,气体或液体脂质体在文献中是已知的(美国专利no.5,770,222和“sustainedandcontrolledreleasedrugdeliverysystems”,j.r.robinson主编,marceldekker,inc.,n.y.,1978)。
本文提供的至少一种双特异性结合分子组合物的范围包括一旦复原所获得的量,如果在湿/干系统中,约1.0毫克/ml至约1000mg/ml的浓度,尽管较低和较高的浓度是可操作的并且取决于预期递送媒介,例如,溶液制剂将不同于透皮贴片、肺部、经粘膜或渗透性或微泵方法。
在某些实施方式中,本文提供的组合物包含任何适合助剂中的至少一种,如(但不限于)稀释剂、粘结剂、稳定剂、缓冲剂、盐、亲脂性溶剂、防腐剂、佐剂等。在某些实施方式中,可药用的助剂是优选的。制备这些无菌溶液的非限制性实例和方法在本领域中是熟知的,如(但不限于)gennaro(主编),remington’spharmaceuticalsciences,第18版,mackpublishingco.(easton,pa.)1990。可以常规选择适合于如本文所述的双特异性结合分子的给予形式、溶解度和/或稳定性的可药用的载体。
在某些实施方式中,本文提供的组合物含有一种或多种药物赋形剂和/或添加剂。药物赋形剂和添加剂的非限制性实例是蛋白质、肽、氨基酸、脂质和碳水化合物(例如,糖,包括单糖、二糖、三糖、四糖和寡糖;衍生化的糖,如醛醇、醛糖酸、酯化糖等;和多糖或糖聚合物),其可以单独或组合存在,包括单独的或按重量或体积计1-99.99%组合。蛋白质赋形剂的非限制性实例包括血清白蛋白,如人血清白蛋白(hsa)、重组人白蛋白(rha)、明胶、酪蛋白等。还可以在缓冲能力中起作用的氨基酸/抗体组分的非限制性实例包括丙氨酸、甘氨酸、精氨酸、甜菜碱、组氨酸、谷氨酸、门冬氨酸、半胱氨酸、赖氨酸、亮氨酸、异亮氨酸、缬氨酸、蛋氨酸、苯丙氨酸、阿司帕坦等。在某些实施方式中,所述氨基酸是甘氨酸。碳水化合物赋形剂的非限制性实例包括单糖,如果糖、麦芽糖、半乳糖、葡萄糖、d-甘露糖、山梨糖等;二糖,如乳糖、蔗糖、海藻糖、纤维二糖等;多糖,如棉子糖、松三糖、麦芽糖糊精、右旋糖酐、淀粉等;和醛醇,如甘露糖醇、木糖醇、麦芽糖醇、拉克替醇、木糖醇、山梨糖醇(葡糖醇)、肌醇等。在某些实施方式中,所述碳水化合物赋形剂是甘露糖醇、海藻糖或棉子糖。
在某些实施方式中,本文提供的组合物包括一种或多种缓冲液或ph调节剂;通常,所述缓冲液是从有机酸或碱制备的盐。缓冲液的非限制性实例包括有机酸盐,如柠檬酸、抗坏血酸、葡糖酸、碳酸、酒石酸、丁二酸、乙酸或邻苯二甲酸的盐;tris、氨丁三醇盐酸盐或磷酸盐缓冲液。在某些实施方式中,所述缓冲液是有机酸盐,如柠檬酸。其他赋形剂,例如,等渗剂、缓冲剂、抗氧化剂、防腐剂、增强剂,可以任选地和优选地加入到稀释剂中。通常,以已知浓度使用等渗剂,如甘油。优选地,加入生理学耐受的缓冲液以提供改善的ph控制。所述组合物可以覆盖宽泛的ph,如约ph4至约ph10,并且优选地,约ph5至约ph9的范围,并且最优选地,约6.0至约8.0的范围。优选地,本文提供的组合物具有约6.8至约7.8之间的ph。优选的缓冲液包括磷酸盐缓冲液,最优选地磷酸钠,具体地磷酸盐缓冲盐水(pbs)。
在某些实施方式中,本文提供的组合物包括一种或多种聚合物赋形剂/添加剂,如(例如)聚乙烯吡咯烷酮、聚蔗糖(聚合物糖)、葡聚糖结合剂(dextrate)(例如,环糊精,如2-羟丙基-β-环糊精)、聚乙二醇、调味剂、抗微生物剂、甜味剂、抗氧化剂、抗静电剂、表面活性剂(例如,聚山梨醇酯,如“吐温20”至“吐温80”)、脂质(例如,磷脂、脂肪酸)、类固醇(例如,胆固醇)和/或螯合剂(例如,edta)。
可以将其他添加剂,如可药用的增溶剂,如吐温20(聚氧乙烯(20)单月桂酸山梨聚糖酯)、吐温40(聚氧乙烯(20)一棕榈酸山梨聚糖酯)、吐温80(聚氧乙烯(20)单油酸脱水山梨糖醇酯)、普卢兰尼克f68(聚氧乙烯聚氧化丙烯嵌段共聚物)和peg(聚乙二醇)或非离子型表面活性剂,如聚山梨酯20或80或者泊洛沙姆184或188、pluronic.rtm.polyls、其他嵌段共聚物和螯合剂,如edta和egta加入到所述组合物中以减少聚集。如果将泵或塑料容器用于给予所述组合物,则这些添加剂是特别有用的。可药用的表面活性剂的存在减轻了蛋白质聚集的倾向。
适合在本文提供的组合物中使用的其他药物赋形剂和/或添加剂是本领域技术人员已知的并且在(例如)“remington:thescience&practiceofpharmacy”,19.sup.thed.,williams&williams,(1995)和“physician’sdeskreference”,第52版,medicaleconomics,montvale,n.j.(1998)中提及,以上参考文献完全作为参考并入本文。在某些优选的实施方式中,所述载体或赋形剂材料是碳水化合物(例如,糖和醛醇)和缓冲剂(例如,柠檬酸)或聚合剂。
优选地,水性稀释剂任选地还包含可药用的防腐剂。优选的防腐剂包括选自苯酚、m-甲酚、p-甲酚、o-甲酚、氯甲酚、苯甲醇、烷基苯甲酸酯(甲基、乙基、丙基、丁基等)、苯扎氯铵、苄索氯铵、脱氢醋酸钠和硫柳汞或其混合物的那些。组合物中使用的防腐剂的浓度是足以产生抗微生物作用的浓度。这些浓度取决于所选的防腐剂并且是技术人员容易确定的。
可以通过以下方法制备本文提供的组合物,其包括在水性稀释剂中将至少一种如本文所述的双特异性结合分子与防腐剂混合,所述防腐剂选自苯酚、m-甲酚、p-甲酚、o-甲酚、氯甲酚、苯甲醇、烷基苯甲酸酯(甲基、乙基、丙基、丁基等)、苯扎氯铵、苄索氯铵、脱氢醋酸钠和硫柳汞或其混合物。使用常规溶解和混合程序,在水性稀释剂中混合至少一种双特异性结合分子和防腐剂。为了制备适合的组合物,例如,将缓冲溶液中测量的量的至少一种双特异性结合分子与缓冲溶液中所需的防腐剂以足以提供处于所需浓度的双特异性结合分子和防腐剂的量合并。可以通过以下方法制备本文提供的组合物,所述方法包括将至少一种如本文所述的双特异性结合分子与所选缓冲液,优选地含有盐水或所选的盐的磷酸盐缓冲液混合。使用常规溶解和混合程序,在水性稀释剂中混合至少一种双特异性结合分子和缓冲液。为了制备适合的组合物,例如,将水或缓冲液中测量的量的至少一种双特异性结合分子与水中所需的缓冲液以足以提供处于所需浓度的蛋白质和缓冲液的量合并。本领域的技术人员将认识这些方法的变化。例如,组分加入顺序,是否使用其他添加剂,制备组合物时的温度和ph均是可以对所使用的浓度和给予方式优化的因素。
在涉及具有t细胞输注的组合疗法的具体实施方式中,本文提供了药物组合物,其包含(a)本文所述的双特异性结合分子(参见,例如,5.1或5.2节);(b)t细胞;和/或(c)药物有效的载体。在具体的实施方式中,t细胞对t细胞所给予的受试者是自体同源的。在某些实施方式中,t细胞对t细胞所给予的受试者是同种异体的。在具体的实施方式中,t细胞结合至双特异性结合分子。在具体的实施方式中,t细胞与双特异性结合分子的结合是非共价的。在具体的实施方式中,所述t细胞是人t细胞。可以用于将双特异性结合分子结合至t细胞的方法在本领域中是已知的。参见,例如,lum等人,2013,biolbloodmarrowtransplant,19:925-33;janeway等人,immunobiology:theimmunesysteminhealthanddisease,第5版,newyork:garlandscience;vaishampayan等人,2015,prostatecancer,2015:285193和stromnes等人,2014,immunolrev.257(1):145-164。还参见,vaishampayan等人,2015,prostatecancer,2015:285193,其描述了用于将双特异性结合分子结合至t细胞的以下示例性、非限制性方法:
从1或2次白细胞去除术收集周围血单核细胞(pbmc)以获得用于激活的t细胞扩增的淋巴细胞。在cgmp条件下最长14天的培养期间,用(例如)20ng/mlokt3激活pbmc,并在100iu/mlil-2中扩增以产生400-3200亿个激活的t细胞,如ueda等人,1993,transplantation,56(2):351-356和uberti等人,1994,clinicalimmunologyandimmunopathology,70(3):234-240中所述。将细胞在透气性烧瓶(fep袋,750-cl型,americanfluorosealcorporation,gaithersburg,md)中添加有2%混合的热失活人血清的rpmi1640培养基(lonza)中生长。基于细胞计数,激活的t细胞约每2-3天分裂一次。14天后,将激活的t细胞与50ng本文所述的双特异性结合分子(每106个激活的t细胞)一起培养。然后,清洗混合物并冷冻保存。
在某些实施方式中,根据本文所提供的方法使用本文所述的药物组合物(参见,例如,5.6节)。
5.5.1胃肠外制剂
在某些实施方式中,将本文提供的组合物配制用于胃肠外可注射给予。如本文所使用的,术语“胃肠外”包括静脉内、血管内、肌内、皮内、皮下和眼内。对于胃肠外给予,可以将所述组合物配制成溶液、混悬液、乳液或冷冻干燥粉剂以与可药用的胃肠外媒介物组合或单独提供。这些媒介物的非限制性实例为水、盐水、林格氏溶液、葡萄糖溶液、甘油、乙醇和1-10%人血清白蛋白。还可以使用脂质体和非水媒介物,如固定油剂。媒介物或冷冻干燥粉剂可以含有维持等渗性(例如,氯化钠、甘露糖醇)和化学稳定性(例如,缓冲剂和防腐剂)的添加剂。通过已知或适合的技术对制剂灭菌。
在作为本领域标准参考教科书的最近版本的remington'spharmaceuticalsciences,a.osol中描述了适合的药物载体。
用于胃肠外给予的制剂可以作为常规赋形剂含有无菌水或盐水、聚亚烷基二醇,如聚乙二醇、植物来源的油剂、氢化萘等。根据已知的方法,可以通过使用适合的乳化剂或增湿剂和助悬剂制备用于注射的水性或油性混悬液。用于注射的试剂可以是无毒的、非可口服给予的稀释剂,如水溶液或处于溶剂中的无菌可注射溶液或混悬液。作为可用的媒介物或溶剂,水、林格氏溶液、等渗盐水等是允许的;作为常规溶剂或混悬溶剂,可以使用无菌不挥发油剂。出于这些目的,可以使用任何类型的不挥发油剂和脂肪酸,包括天然或合成或半合成的脂肪油剂或脂肪酸;天然或合成或半合成的甘油单酯、二酯或三酯。胃肠外给予在本领域中是已知的,并且包括(但不限于)常规注射方式、气体压力无针注射装置,如美国专利no.5,851,198中所述,和激光穿孔装置,如美国专利no.5,839,446中所述,以上专利完全作为参考并入本文。
5.5.2肺部制剂
在某些实施方式中,将包含本文所述的双特异性结合分子的组合物配制用于肺部给予。对于肺部给予,将所述组合物在处于对到达肺部下呼吸道或窦有效的尺寸的颗粒中递送。可以通过本领域中对于通过吸入法给予治疗剂已知的多种吸入或鼻部装置中的任一种递送用于肺部给予的组合物。能够在患者窦腔或肺泡中沉积雾化制剂的这些装置包括定量剂量吸入器、喷雾器、干燥粉末发生器、喷雾器等。适合于导向本文所述的双特异性结合分子的肺部或鼻部给予的其他装置在本领域中也是已知的。所有这些装置使用适合于将本文所述的双特异性结合分子在气溶胶中分散给予的制剂。这些气溶胶可以由溶液(水和非水两者)或固体颗粒组成。定量剂量吸入器,如ventolin定量剂量吸入器,通常使用推进气体并且需要在吸入期间动作(参见,例如,wo94/16970、wo98/35888)。干粉吸入器,如(仅举几个例子)turbuhaler(astra)、rotahaler(glaxo)、diskus(glaxo)、通过inhaletherapeutics上市的装置,使用混合粉末的呼吸-动作(美国专利no.4,668,218astra、ep237507astra、wo97/25086glaxo、wo94/08552dura、美国专利no.5,458,135inhale、wo94/06498fisons,以上专利完全作为参考并入本文)。喷雾器,如ultravent喷雾器(mallinckrodt)和acornii喷雾器(marquestmedicalproducts)(美国专利no.5,404,871aradigm,wo97/22376),以上参考文献完全作为参考并入本文,从溶液产生气溶胶,而定量剂量吸入器、干粉吸入器等产生小颗粒气溶胶。可商购吸入装置的这些实例是非限制性实例,并且不意欲限制范围。
在某些实施方式中,可以通过迫使如本文所述的至少一种双特异性结合分子的混悬液或溶液在压力下通过喷嘴来产生包含如本文所述的双特异性结合分子的喷雾。可以选择喷嘴尺寸和构造、施加的压力以及进液速率来实现所期望的输出和颗粒尺寸。可以(例如)通过电场结合毛细管或喷嘴进料来产生电喷雾。有利地,包含通过喷雾器递送的本文所述的至少一种双特异性结合分子的组合物的颗粒具有小于约10μm的颗粒尺寸,优选地,约1μm至约5μm范围内的,并且最优选地约2μm至约3μm的颗粒尺寸。
包含适合通过喷雾器使用的本文所述的至少一种双特异性结合分子的组合物的制剂通常包括以每ml溶液约0.1mg至约100mg或mg/gm或其中任何范围或值的浓度(例如,但不限于0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8、0.9、1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、30、40、45、50、60、70、80、90或100mg/ml或mg/gm)处于水溶液中的至少一种双特异性结合分子。所述制剂可以包括试剂,如赋形剂、缓冲剂、等渗剂、防腐剂、表面活性剂和优选地,锌。所述制剂还可以包括用于双特异性结合分子组合物稳定的赋形剂或试剂,如缓冲剂、还原剂、大蛋白质或碳水化合物。在配制这些组合物中有用的大蛋白质包括白蛋白、鱼精蛋白等。在配制抗体组合物蛋白中有用的典型碳水化合物包括蔗糖、甘露糖醇、乳糖、海藻糖、葡萄糖等。所述组合物还可以包含表面活性剂,其可以减少或防止在形成气溶胶时溶液雾化所引起的组合物表面诱导聚集。可以使用多种常规表面活性剂,如聚氧乙烯脂肪酸酯和醇,以及聚氧乙烯山梨糖醇脂肪酸酯。量通常将在按制剂重量计的0.001至14%的范围内。优选的表面活性剂是聚氧乙烯单油酸脱水山梨糖醇酯、聚山梨酯80、聚山梨酯20等。
在某些实施方式中,通过喷雾器,如射流式喷雾器或超声喷雾器给予所述组合物。通常,在射流式喷雾器中,使用压缩空气源产生通过孔口的高速空气喷射。由于气体扩大超过喷嘴,因此产生低压区,其将抗体组合物蛋白质溶液牵引通过连接到液体贮器的毛细管。当离开管时,将来自毛细管的液体流剪切成不稳定的细丝和液体,从而产生气溶胶。可以使用一定范围的构造、流速和挡板类型,从而从给定射流式喷雾器实现预期性能特征。在超声喷雾器中,使用高频电能产生振动、机械能,通常使用压电换能器。将该能量直接或通过耦合流体输送至抗体组合物蛋白质制剂,从而产生包含抗体组合物蛋白质的气溶胶。有利地,通过喷雾器递送的抗体组合物蛋白质颗粒具有小于约10μm,优选地,约1μm至约5μm范围内,并且最优选地,约2μm至约3μm的颗粒尺寸。
在某些实施方式中,通过定量剂量吸入器(mdi)给予所述组合物,其中在金属罐中作为包含液化压缩气体的混合物包含推进剂、至少一种本文所述的双特异性结合分子和任何赋形剂或其他添加剂。计量阀动作释放作为气溶胶的冲模混合物(diemixture),优选地含有尺寸范围小于约10μm,优选地约1μm至约5μm,并且最优选地约2μm至约3μm的颗粒。可以通过使用通过本领域技术人员已知的多种方法产生的抗体组合物蛋白质制剂获得所需的气溶胶颗粒尺寸,所述方法包含喷射研磨、喷雾干燥、临界点凝结等。优选的定量剂量吸入器包括3m或glaxo生产并且使用氢氟化碳推进剂的那些。
用于通过计量剂量吸入器装置使用的本文所述的双特异性结合分子的制剂通常将包括细碎粉剂,其作为非水媒介中的混悬液包含(例如)借助于表面活性剂在推进剂中混悬的至少一种抗il-6抗体。所述推进剂可以是出于该目的的任何常规材料,如氟氯化碳、氢化含氯氟烃、氢氟化碳或烃类,包括三氯氟甲烷、二氯二氟甲烷、二氯四氟乙烷和1,1,1,2-四氟乙烷、hfa-134a(氢氟烷-134a)、hfa-227(氢氟烷-227)等。优选地,所述推进剂是氢氟化碳。可以选择表面活性剂以稳定作为推进剂中的混悬液的至少一种双特异性结合分子,以保护活性剂不被化学降解等。适合的表面活性剂包括三油酸山梨聚糖酯、大豆磷脂、油酸等。在一些情况下,使用溶剂,如乙醇,溶液气溶胶是优选的。本领域中已知的用于配制蛋白质的其他试剂也可以包含在所述制剂中。
5.5.3口服制剂
在某些实施方式中,将本文提供的组合物配制用于口服。在某些实施方式中,对于口服给予,给予至少一种本文所述的双特异性结合分子的组合物和方法依赖于佐剂的共给予,所述佐剂如(例如)间苯二酚和非离子型表面活性剂,如聚氧乙烯油烯基醚和n-十六烷基聚乙烯醚,以人为提高肠壁的渗透性,并且依赖于酶促抑制剂,如(例如)胰腺胰蛋白酶抑制剂、二异丙基氟磷酸(dff)和抑肽酶的共给予以抑制酶促降解。用于口服给予的固体类型剂量形式的活性组分化合物可以与至少一种添加剂混合,其包括蔗糖、乳糖、纤维素、甘露糖醇、海藻糖、棉子糖、麦芽糖醇、右旋糖酐、淀粉、琼脂、精氨酸盐、几丁质、壳聚糖、果胶、黄芪胶、阿拉伯树胶、明胶、胶原蛋白、酪蛋白、白蛋白、合成或半合成聚合物和甘油酯。这些剂量形式还可以含有其他类型的添加剂,如(例如)非活性稀释剂、润滑剂,如硬脂酸镁、对羟苯甲酸,防腐剂,如山梨酸、抗坏血酸、α-维生素e,抗氧化剂,如半胱氨酸、崩解剂、粘结剂、增稠剂、缓冲剂、甜味剂、调味剂、香味剂等。
在某些实施方式中,可以将片剂和丸剂进一步加工成肠衣制剂。在某些实施方式中,用于口服给予的液体制剂包括(例如)乳液、糖浆、酏剂、混悬液和容许用于医学使用的溶液制剂。这些制剂可以含有通常在所述领域中使用的非活性稀释剂,例如,水。脂质体制剂可以用于口服给予制剂,例如,如对胰岛素和肝素所述的(美国专利no.4,239,754)。另外,可以将混合氨基酸(类蛋白)的人工聚合物微球用于药物的口服给予,例如,如美国专利no.4,925,673中所述。此外,在生物活性剂的口服给予中使用如美国专利no.5,879,681和美国专利no.5,871,753中所述那些的载体化合物。
5.5.4粘膜制剂
在某些实施方式中,将本文提供的组合物配制用于通过粘膜表面吸收。在某些实施方式中,对于通过粘膜表面的吸收,给予本文所述的至少一种双特异性结合分子的组合物和方法包括包含多种亚微颗粒、粘膜粘附大分子、生物活性肽和水性连续相的乳液,其通过实现乳剂颗粒的粘膜粘附促进通过粘膜表面的吸收(美国专利no.5,514,670)。适合于应用本文所提供的乳液的粘液表面可以包括(例如)角膜、结膜、口腔、舌下、鼻、阴道、肺、胃、肠和直肠给予途径。用于阴道或直肠给予的制剂(例如,栓剂)可以作为赋形剂含有(例如)聚烷撑二醇、凡士林、可可脂等。用于鼻内给予的制剂可以是固体的并且作为赋形剂含有(例如)乳糖或者可以是滴鼻剂的水性或油性溶液。对于口腔给予,赋形剂包括(例如)糖、硬脂酸钙、硬脂酸镁、预胶凝淀粉等(美国专利no.5,849,695)。
5.5.5透皮制剂
在某些实施方式中,将本文提供的组合物配制用于透皮给予。在某些实施方式中,对于透皮给予,所述组合物包含包封在递送装置中的至少一种本文所述的双特异性结合分子,所述递送装置如(例如)脂质体或聚合物纳米颗粒、微粒、微胶囊或微球(除非另有说明,否则统称为微粒)。对于透皮给予,一些适合的装置是已知的,其包括由合成聚合物,如多羟基酸,如聚乳酸、聚乙醇酸及其共聚物、聚原酸酯、聚酐和聚磷腈以及天然聚合物,如胶原蛋白、聚氨基酸、白蛋白及其他蛋白质、海藻酸盐及其他多糖以及它们的组合制成的微粒(美国专利no.5,814,599)。
5.5.6试剂盒
本文提供了包含一种或多种如本文所述的双特异性结合分子或一种或多种如本文所述的组合物的试剂盒。在某些实施方式中,所述试剂盒包含包装材料和至少一个包含含有本文所述的双特异性结合分子或组合物的组合物的小瓶。在某些实施方式中,所述小瓶包含任选地处于水性稀释剂中的具有指定缓冲液和/或防腐剂的至少一种如本文所述的双特异性结合分子或组合物的溶液。在某些实施方式中,所述包装材料包含表明这种溶液可以保持1、2、3、4、5、6、9、12、18、20、24、30、36、40、48、54、60、66、72小时或更长的一段时间的标签。在某些实施方式中,所述试剂盒包含两个小瓶。在某些实施方式中,第一小瓶包含至少一种冷冻干燥的双特异性结合分子或如本文所述的组合物,并且第二小瓶包含指定缓冲液或防腐剂的水性稀释剂。在某些实施方式中,包装材料包含指示受试者在水性稀释剂中复原至少一种冷冻干燥的双特异性结合分子以形成可以保持24小时或更长的一段时间的溶液的标签。在某些实施方式中,包装材料包含指示该溶液可以保持1、2、3、4、5、6、9、12、18、20、24、30、36、40、48、54、60、66、72小时或更长的一段时间的标签。
在某些实施方式中,可以作为溶液或作为双重小瓶向受试者提供本文提供的组合物,所述双重小瓶包括用第二小瓶复原的冷冻干燥的至少一种双特异性结合分子或组合物的小瓶,所述第二小瓶含有水、防腐剂和/或赋形剂,优选地磷酸盐缓冲液和/或盐水和处于水性稀释剂中的所选的盐。需要复原的任一个单一溶液小瓶或双重小瓶可以重复使用多次并且可以满足受试者治疗的单次或多次循环,并因此可以提供比现用方案更方便的治疗方案。
在某些实施方式中,包含本文所述的双特异性结合分子或组合物的试剂盒对于立即至24小时或更长的一段时间内的给予是有用的。因此,所述试剂盒为患者提供了显著的优势。在某些实施方式中,包含本文所述的双特异性结合分子或组合物的试剂盒可以任选地在约2℃至约40℃的温度安全储存并且将蛋白质的生物学活性保留延长的一段时间,因此,允许具有指明溶液可以在6、12、18、24、36、48、72或96小时或更长的一段时间内保持和/或使用的包装标签。在某些实施方式中,所述试剂盒包含
如果使用防腐稀释剂,则该标签可以包括使用长达1-12个月、半年、一年半和/或两年。
通过向药店、诊所或其他这些机构和研究室提供溶液或包括用含有水性稀释剂的第二小瓶复原的冷冻干燥的至少一种双特异性结合分子或组合物的小瓶的双重小瓶,可以将试剂盒直接提供给受试者,如5.7节中所述的受试者。在这种情况下,所述溶液可以多达1升或更大的体积,只要提供可以从中取出1次或多次较小部分的至少一种抗体溶液以用于转移到较小的瓶中或通过药店或诊所将其提供给它们的顾客和/或患者的较大容器。
包含这些单一小瓶系统的认可的装置包括用于递送溶液的那些笔式注射装置,如bdpens、bd
在某些实施方式中,所述试剂盒包含包装材料。在某些实施方式中,除管理机构要求的信息之外,所述包装材料提供了可以使用产品的条件。在某些实施方式中,对于两个小瓶(湿/干)的产品,所述包装材料向受试者提供了在水性稀释剂复原至少一种双特异性结合分子以形成溶液并在2-24小时或更长的一段时间内使用溶液的说明。对于单一小瓶溶液产品,标签表明该溶液可以在2-24小时或更长的一段时间内使用。在优选的实施方式中,所述试剂盒对于人药物产品使用是有用的。在某些实施方式中,所述试剂盒对于兽医药物产品使用是有用的。在优选的实施方式中,所述试剂盒对于狗药物产品使用是有用的。在优选的实施方式中,所述试剂盒对于静脉内给予是有用的。在另一个优选的实施方式中,所述试剂盒对于腹膜内、鞘内、脑中室内或脑中实质内给予是有用的。
5.6使用和方法
5.6.1治疗性使用
在某些实施方式中,本文提供了用于在受试者中治疗her2-阳性癌细胞的方法,其包括向对其有需要的受试者给予治疗有效量的如5.1节或5.2节所述的双特异性结合分子、治疗有效量的如5.3节所述的编码这种双特异性结合分子的细胞、多核苷酸或载体,或治疗有效量的如5.5节所述的药物组合物,或治疗有效量的如5.4节所述的结合至双特异性结合分子的t细胞。在具体的实施方式中,所述受试者是如5.7节所述的受试者。在具体的实施方式中,以5.8节所述的剂量给予所述双特异性结合分子。在具体的实施方式中,根据如5.5节所述的方法给予所述双特异性结合分子。在优选的实施方式中,静脉内给予所述双特异性结合分子。在另一个优选的实施方式中,鞘内、脑中室内、脑中实质内或腹膜内给予所述双特异性结合分子。在具体的实施方式中,将所述双特异性结合分子与如5.9节中所述的一种或多种其他药物活性剂组合给予。
在某些实施方式中,本文提供了在受试者中用于治疗her2-阳性癌细胞的方法,其包括向对其有需要的受试者给予如5.1节或5.2节所述的药物组合物。在具体的实施方式中,所述药物组合物是如5.5节所述的组合物。在具体的实施方式中,所述受试者是如5.7节所述的受试者。在具体的实施方式中,以5.8节所述的剂量给予所述药物组合物。在具体的实施方式中,根据如5.5节所述的方法给予所述药物组合物。在优选的实施方式中,静脉内给予所述药物组合物。在另一个优选的实施方式中,鞘内、脑中室内、脑中实质内或腹膜内给予所述双特异性结合分子。在具体的实施方式中,将所述药物组合物与如5.9节中所述的一种或多种其他药物活性剂组合给予。
对于双特异性结合分子在具体物种受试者中的使用,使用结合至特定物种的her2和cd3的双特异性结合分子。例如,为了治疗人,所述双特异性结合分子包含作为结合至人her2的包含两个相同的重链和两个相同的轻链的免疫球蛋白的非糖基化单克隆抗体,所述轻链是第一轻链和第二轻链,其中所述第一轻链通过肽接头融合至第一单链可变片段(scfv)以产生第一轻链融合多肽,并且其中所述第二轻链通过肽接头融合至第二scfv以产生第二轻链融合多肽,其中所述第一和第二scfv(i)是相同的,并且(ii)结合至人cd3,并且其中所述第一和第二轻链融合多肽是相同的。在另一个实例中,为了治疗狗,所述双特异性结合分子包含作为结合至狗her2的包含两个相同的重链和两个相同的轻链的免疫球蛋白的非糖基化单克隆抗体,所述轻链是第一轻链和第二轻链,其中所述第一轻链通过肽接头融合至第一单链可变片段(scfv)以产生第一轻链融合多肽,并且其中所述第二轻链通过肽接头融合至第二scfv以产生第二轻链融合多肽,其中所述第一和第二scfv(i)是相同的,并且(ii)结合至狗cd3,并且其中所述第一和第二轻链融合多肽是相同的。与不同物种的her2和/或cd3交叉反应的双特异性结合分子可以用于治疗那些物种的受试者。例如,由于曲妥珠单抗所识别的her2中的表位相对保守,因此预期曲妥珠单抗结合人和狗her2。另外参见,例如,singer等人,2012,molimmunol,50:200-209。
另外,对于特定物种受试者中双特异性结合分子的使用,所述双特异性结合分子,优选地免疫球蛋白部分的恒定区来源于该特定物种。例如,为了治疗人,所述双特异性结合分子可以包含免疫球蛋白的非糖基化单克隆抗体,其中所述免疫球蛋白包含人恒定区。在另一个实例中,为了治疗狗,所述双特异性结合分子可以包含免疫球蛋白的非糖基化单克隆抗体,其中所述免疫球蛋白包含狗恒定区。在具体的实施方式中,当治疗人时,所述免疫球蛋白是人源化的。在具体的实施方式中,所述受试者是人。在具体的实施方式中,所述受试者是狗。
在具体的实施方式中,所述her2-阳性癌症是乳腺癌、胃癌、骨肉瘤、促纤维增生性小圆细胞癌、头颈癌的鳞状细胞癌、卵巢癌、前列腺癌、胰癌、多形性胶质母细胞瘤、胃结合部腺癌、胃食管结合部腺癌、宫颈癌、唾液腺癌、软组织肉瘤、白血病、黑素瘤、尤文氏肉瘤、横纹肌肉瘤、成神经细胞瘤或表达her2受体的任何其他肿瘤组织。
在具体的实施方式中,her2-阳性癌细胞耐受使用曲妥珠单抗、西妥昔单抗、拉帕替尼、厄洛替尼或靶向her受体家族的任何其他小分子或抗体的治疗。在具体的实施方式中,耐受使用曲妥珠单抗、西妥昔单抗、拉帕替尼、厄洛替尼或靶向her受体家族的任何其他小分子或抗体的治疗的肿瘤对使用根据本发明的双特异性结合分子的治疗起反应。
在具体的实施方式中,治疗可以实现有益或所期望的临床结果,其包括(但不限于)减轻症状,降低疾病程度,疾病状态稳定(即,不恶化),延迟或延缓疾病发展,改善或减轻疾病状态和症状缓解(无论是部分或完全),无论是可检测的或不可检测的。在具体的实施方式中,与不接受治疗的预期存活相比,“治疗”还可以延长存活。
5.6.2诊断使用
在某些实施方式中,本文所述的双特异性结合分子可以用于诊断目的以检测、诊断或监控本文所述的病况(例如,包括her2-阳性癌细胞的病况)。在某些实施方式中,如5.2节中所述标记在诊断目的中使用的双特异性结合分子。
在某些实施方式中,本文提供了检测本文所述的病况的方法,其包括(a)使用本文所述的一个或多个双特异性结合分子测定受试者细胞或组织样品中her2的表达;和(b)将her2表达水平与对照水平,例如,正常组织样品中的水平(例如,来自未患有本文所述的病况或来自病况发生前的相同患者)相比较,借此与her2表达的对照水平相比,her2表达的测定水平的升高或降低指示了本文所述的病况。
使用如本文所述的或如本领域技术人员所知的经典免疫组织学方法,本文所述的抗体可以用于测定生物样品中her2的水平。(参见,例如,jalkanen等人,1985,j.cell.biol.101:976-985;和jalkanen等人,1987,j.cell.biol.105:3087-3096)。用于检测蛋白质基因表达的其他抗体基方法包括免疫测定,如酶联免疫吸附测定(elisa)和放射免疫测定(ria)。适合的抗体测定标记物是本领域已知的并且包括酶标记物,如葡萄糖氧化酶;放射性同位素,如碘(125i、121i)、碳(14c)、硫(35s)、氚(3h)、铟(121in)和锝(99tc);发光标记物,如氨基苯二酰肼;和荧光标记物,如荧光素和罗丹明,和生物素。
在某些实施方式中,通过在初始诊断后重复用于诊断的方法一段时间来进行本文所述的病况(例如,her2-阳性癌症)的监控。
可以使用本领域中已知的用于体内扫描的方法检测受试者中标记分子的存在。熟练的技术人员将能够确定用于检测特定标记物的适当方法。可以在本发明的诊断方法中使用的方法和装置包括(但不限于)计算机断层(ct)、全身扫描如正电子发射体层成像(pet)、磁共振成象(mri)和声图描记法。
5.7患者群体
根据本文所提供的方法治疗的受试者可以是任何哺乳动物,如啮齿类、猫、狗、马、牛、猪、猴、灵长类或人等。在优选的实施方式中,所述受试者是人。在另一个优选的实施方式中,所述受试者是狗。
在某些实施方式中,根据本文所提供的方法治疗的受试者已诊断患有her2-阳性癌症,包括(但不限于)乳腺癌、胃癌、骨肉瘤、促纤维增生性小圆细胞癌、头颈癌的鳞状细胞癌、卵巢癌、前列腺癌、胰癌、多形性胶质母细胞瘤、胃结合部腺癌、胃食管结合部腺癌、宫颈癌、唾液腺癌、软组织肉瘤、白血病、黑素瘤、尤文氏肉瘤、横纹肌肉瘤、成神经细胞瘤或表达her2受体的任何其他肿瘤组织。
在某些实施方式中,受试者耐受使用曲妥珠单抗、西妥昔单抗、拉帕替尼、厄洛替尼或靶向her受体家族的任何其他小分子或抗体的治疗。在具体的实施方式中,耐受使用曲妥珠单抗、西妥昔单抗、拉帕替尼、厄洛替尼或靶向her受体家族的任何其他小分子或抗体的治疗的肿瘤对使用根据本发明的双特异性结合分子的治疗起反应。
在某些实施方式中,根据本文所提供的方法治疗的受试者患有耐受使用曲妥珠单抗、西妥昔单抗、拉帕替尼、厄洛替尼或靶向her受体家族的任何其他小分子或抗体的治疗的her2-阳性癌症。在某些实施方式中,根据本文所提供的方法治疗的受试者患有对使用根据本发明的双特异性结合分子的治疗起反应的her2-阳性癌症。
在某些实施方式中,根据所述本文所提供的方法治疗的受试者先前接受了用于转移性疾病,例如,脑或腹膜转移的一种或多种化疗方案。在某些实施方式中,所述受试者先前未接受用于转移性疾病的治疗。
5.8剂量和方案
在某些实施方式中,根据本文所提供的方法给予于受试者的如5.1节所述的双特异性结合分子的剂量是通过受试者的需要所确定的剂量。在某些实施方式中,根据受试者的需要,医师确定剂量。
在具体的实施方式中,本文所提供的双特异性结合分子的剂量小于曲妥珠单抗的剂量。参见,例如,曲妥珠单抗[处方信息的突出部分]。southsanfrancisco,ca:genentech,inc.;2014。在具体的实施方式中,本文所提供的双特异性结合分子的剂量在比fda批准的曲妥珠单抗的剂量小约20至40倍之间。
在某些实施方式中,根据本文所提供的方法给予于受试者的如5.1节所述的双特异性结合分子的剂量在0.01mg/kg至0.025mg/kg之间,0.025mg/kg至0.05mg/kg之间,0.05mg/kg至0.1mg/kg之间,0.1mg/kg至0.5mg/kg之间,0.1mg/kg至0.6mg/kg之间,0.2mg/kg至0.7mg/kg之间,0.3mg/kg至0.8mg/kg之间,0.4mg/kg至0.8mg/kg之间,0.5mg/kg至0.9mg/kg之间或0.6mg/kg至1mg/kg之间。
在某些实施方式中,根据本文所提供的方法给予于受试者的如5.1节所述的双特异性结合分子的剂量是初始剂量,然后是作为维持剂量的调节剂量。在某些实施方式中,初始剂量给予一次。在某些实施方式中,初始计量在0.01mg/kg至0.025mg/kg之间,0.025mg/kg至0.05mg/kg之间,0.05mg/kg至0.1mg/kg之间,0.1mg/kg至0.5mg/kg之间,0.1mg/kg至0.6mg/kg之间,0.2mg/kg至0.7mg/kg之间,0.3mg/kg至0.8mg/kg之间,0.4mg/kg至0.8mg/kg之间,0.5mg/kg至0.9mg/kg之间或0.6mg/kg至1mg/kg之间。在某些实施方式中,通过静脉内输注在90分钟内给予初始计量。在某些实施方式中,约每4周给予一次调节剂量。在某些实施方式中,调节剂量给予至少13、至少26或至多52周。在某些实施方式中,调节剂量给予52周。在某些实施方式中,调节剂量在0.01mg/kg至0.025mg/kg之间,0.025mg/kg至0.05mg/kg之间,0.05mg/kg至0.1mg/kg之间,0.1mg/kg至0.5mg/kg之间,0.1mg/kg至0.6mg/kg之间,0.2mg/kg至0.7mg/kg之间,0.3mg/kg至0.8mg/kg之间,0.4mg/kg至0.8mg/kg之间,0.5mg/kg至0.9mg/kg之间或0.6mg/kg至1mg/kg之间。在某些实施方式中,通过静脉内输注在30分钟内给予调节计量。在某些实施方式中,通过静脉内输注在30至90分钟内给予调节剂量。
在另一个具体的实施方式中,用于通过本文所提供的方法使用的如5.1节所述的双特异性结合分子每1、2、3或4周给予,一周给予1、2或3次。在某些实施方式中,根据以下方案给予双特异性结合分子:(i)第1周1、2或3次给予;(ii)第1周后,一周给予1、2、3或4次;然后(iii)每个月在1周内给予1、2或3次,给予总计1、2、3、4、5、6、7、8、9、10、11或12个月。在某些实施方式中,根据以下方案给予双特异性结合分子:(i)第1周3次给予;(ii)第1周后,一周给予3次;然后(iii)每个月在1周内给予3次,给予总计1、2、3、4、5、6、7、8、9、10、11或12个月。在某些实施方式中,根据以下方案给予双特异性结合分子:(i)第1周3次给予;(ii)第1周后,一周给予2次;然后(iii)每个月在1周内给予2次,给予总计1、2、3、4、5、6、7、8、9、10、11或12个月。在某些实施方式中,根据以下方案给予双特异性结合分子:(i)第1周3次给予;(ii)第1周后,一周给予1次;然后(iii)每个月在1周内给予1次,给予总计1、2、3、4、5、6、7、8、9、10、11或12个月。在某些实施方式中,根据以下方案给予双特异性结合分子:(i)第1周2次给予;(ii)第1周后,一周给予2次;然后(iii)每个月在1周内给予2次,给予总计1、2、3、4、5、6、7、8、9、10、11或12个月。在某些实施方式中,根据以下方案给予双特异性结合分子:(i)第1周2次给予;(ii)第1周后,一周给予1次;然后(iii)每个月在1周内给予1次,给予总计1、2、3、4、5、6、7、8、9、10、11或12个月。在某些实施方式中,根据以下方案给予双特异性结合分子:(i)第1周1次给予;(ii)第1周后,一周给予1次;然后(iii)每个月在1周内给予1次,给予总计1、2、3、4、5、6、7、8、9、10、11或12个月。
在某些实施方式中,根据本文所提供的方法,与如5.9节所述的第二药物活性剂组合,将如5.1节所述的双特异性结合分子给予于受试者。
在另一个优选的实施方式中,在脑中鞘内、脑室内、在脑中实质内或腹膜内给予双特异性结合分子。
5.9组合疗法
在某些实施方式中,可以将本文所提供的双特异性结合分子,或编码所述双特异性结合分子的多核苷酸、载体或细胞与一种或多种其他药物活性剂,例如,癌症化疗剂组合给予。在某些实施方式中,可以通过单独的治疗组分的同时、顺序或单独剂量给予来实现这种组合疗法。在某些实施方式中,双特异性结合分子或者编码所述双特异性结合分子的多核苷酸、载体或细胞与一种或多种其他药物活性剂可以是协同的,从而与作为单一疗法提供的任一种组分的剂量相比,任一种或两种组分的剂量可以降低。作为另外一种选择,在某些实施方式中,双特异性结合分子或者编码所述双特异性结合分子的多核苷酸、载体或细胞与一种或多种其他药物活性剂可以是加和的,从而双特异性结合分子的剂量和一种或多种其他药物活性剂的剂量与作为单一疗法提供的任一种组分的剂量类似或相同。
在某些实施方式中,将本文所提供的双特异性结合分子,或编码所述双特异性结合分子的多核苷酸、载体或细胞与一种或多种其他药物活性剂同天给予。在某些实施方式中,在一种或多种其他药物活性剂之前1、2、3、4、5、6、7、8、9、10、11或12小时给予双特异性结合分子或者编码所述双特异性结合分子的多核苷酸、载体或细胞。在某些实施方式中,在一种或多种其他药物活性剂之后1、2、3、4、5、6、7、8、9、10、11或12小时给予双特异性结合分子或者编码所述双特异性结合分子的多核苷酸、载体或细胞。在某些实施方式中,在一种或多种其他药物活性剂之前1、2、3或更多天给予双特异性结合分子或者编码所述双特异性结合分子的多核苷酸、载体或细胞。在某些实施方式中,在一种或多种其他药物活性剂之后1、2、3或更多天给予双特异性结合分子或者编码所述双特异性结合分子的多核苷酸、载体或细胞。在某些实施方式中,在一种或多种其他药物活性剂之前1、2、3、4、5或6周给予双特异性结合分子或者编码所述双特异性结合分子的多核苷酸、载体或细胞。在某些实施方式中,在一种或多种其他药物活性剂之后1、2、3、4、5或6周给予双特异性结合分子或者编码所述双特异性结合分子的多核苷酸、载体或细胞。
在某些实施方式中,所述其他药物活性剂是多柔比星。在某些实施方式中,所述其他药物活性剂是环磷酰胺。在某些实施方式中,所述其他药物活性剂是紫杉醇。在某些实施方式中,所述其他药物活性剂是多西他赛。在某些实施方式中,所述一种或多种其他药物活性剂是卡铂。
在某些实施方式中,所述其他药物活性剂是细胞因子,如(例如)il15、il15r/il15复合物、il2或gmcsf。
在某些实施方式中,所述其他药物活性剂是提高细胞her2表达的试剂,如(例如)外束或放射免疫疗法。参见,例如,wattenberg等人,2014,britishjournalofcancer,110:1472。
在某些实施方式中,所述其他药物活性剂是放疗剂。
在某些实施方式中,所述其他药物活性剂是直接控制her2信号通路的试剂,例如,拉帕替尼。参见,例如,scaltiri等人,2012,28(6):803-814。
在某些实施方式中,所述其他药物活性剂是提高肿瘤细胞的细胞死亡、细胞凋亡、自体吞噬或坏死的试剂。
在某些实施方式中,可以将本文所提供的双特异性结合分子,或编码所述双特异性结合分子的多核苷酸、载体或细胞与两种其他药物活性剂组合给予,例如,与曲妥珠单抗组合使用的那些(参见,曲妥珠单抗[处方信息的突出部分],southsanfrancisco,ca:genentech,inc.;2014)。在某些实施方式中,所述两种其他药物活性剂是多柔比星和紫杉醇。在某些实施方式中,所述两种其他药物活性剂是多柔比星和多西他赛。在某些实施方式中,所述两种其他药物活性剂是环磷酰胺和紫杉醇。在某些实施方式中,所述两种其他药物活性剂是环磷酰胺和多西他赛。在某些实施方式中,所述两种其他药物活性剂是环磷酰胺和卡铂。在某些实施方式中,所述两种其他药物活性剂是顺铂和卡培他滨。在某些实施方式中,所述两种其他药物活性剂是顺铂和5-氟尿嘧啶。
在某些实施方式中,可以在多模式蒽环-基疗法之后,作为单一试剂给予本文所提供的双特异性结合分子,或编码所述双特异性结合分子的多核苷酸、载体或细胞。
在某些实施方式中,可以在用于转移性疾病,例如,脑或腹膜转移的一种或多种化疗方案之后给予本文所提供的双特异性结合分子,或编码所述双特异性结合分子的多核苷酸、载体或细胞。在具体的实施方式中,可以将本文所提供的双特异性结合分子,或编码所述双特异性结合分子的多核苷酸、载体或细胞与细胞减少性化疗组合给予。在具体的实施方式中,在用细胞减少性化疗治疗受试者之后进行给予。
在具体的实施方式中,与t细胞输注组合给予本文所提供的双特异性结合分子、编码所述双特异性结合分子的多核苷酸、载体或细胞,或包含所述双特异性结合分子的药物组合物。在具体的实施方式中,双特异性结合分子不结合至t细胞。在具体的实施方式中,双特异性结合分子结合至t细胞。在具体的实施方式中,双特异性结合分子与t细胞的结合是非共价的。在具体的实施方式中,在用t细胞输注治疗患者后进行本文所提供的双特异性结合分子、编码所述双特异性结合分子的多核苷酸、载体或细胞,或包含所述双特异性结合分子的药物组合物的给予。在具体的实施方式中,使用与给予t细胞的受试者自体同源的t细胞进行t细胞输注。在具体的实施方式中,使用与给予t细胞的受试者同种异体的t细胞进行t细胞输注。在具体的实施方式中,t细胞可以结合至与如本文所述的双特异性结合分子相同的分子。在具体的实施方式中,t细胞与和双特异性结合分子相同的分子的结合是非共价的。在具体的实施方式中,所述t细胞是人t细胞。可以用于将双特异性结合分子结合至t细胞的方法在本领域中是已知的。参见,例如,lum等人,2013,biolbloodmarrowtransplant,19:925-33;janeway等人,immunobiology:theimmunesysteminhealthanddisease,第5版,newyork:garlandscience;vaishampayan等人,2015,prostatecancer,2015:285193和stromnes等人,2014,immunolrev.257(1):145-164。还参见,vaishampayan等人,2015,prostatecancer,2015:285193,以上文献描述了将双特异性结合分子结合至t细胞的以下示例性、非限制性方法:
可以从1或2次白细胞去除术收集周围血单核细胞(pbmc)以获得用于激活的t细胞扩增的淋巴细胞。在cgmp条件下最长14天的培养期间,可以用(例如)20ng/mlokt3激活pbmc,并在100iu/mlil-2中扩增以产生400-3200亿个激活的t细胞,如ueda等人,1993,transplantation,56(2):351-356和uberti等人,1994,clinicalimmunologyandimmunopathology,70(3):234-240中所述。将细胞在透气性烧瓶(fep袋,750-cl型,americanfluorosealcorporation,gaithersburg,md)中添加有2%混合的热失活人血清的rpmi1640培养基(lonza)中生长。基于细胞计数,激活的t细胞约每2-3天分裂一次。14天后,将激活的t细胞与50ng本文所述的双特异性结合分子(每106个激活的t细胞)一起培养。然后,清洗混合物并冷冻保存。
6.实施例
6.1实施例1
6.1.1引言
本实施例描述了基于igg1平台的her2/cd3双特异性结合分子(本文称为“her2-bsab”)。使用该平台以允许:(1)最佳尺寸以使肿瘤吸收最大化,(2)对肿瘤靶标具有二价以维持亲合力,(3)在cho细胞中自然组装成像任何igg(重链和轻链)的骨架,通过标准蛋白a亲和色谱可纯化,(4)结构排布使得抗cd3组分在功能上是一价的,因此降低t细胞的自发激活和(5)在动物模型中具有已证明的肿瘤靶向效率的平台。该双特异性结合分子具有与曲妥珠单抗相同的特异性;并且招募和激活cd3(+)t细胞,从而使它们对her2表达肿瘤细胞重定向,并产生稳健的抗肿瘤反应。不受任何理论束缚,独立于her2通路的激活状态,该bsab的有效性以多克隆t细胞的细胞毒潜能的利用及其靶向表达甚至低水平her2的肿瘤细胞的独特能力为中心。
6.1.2材料和方法
6.1.2.1her2-bsab的设计、生产和纯化分析
将her2-bsab的形式设计为对人igg1轻链c-末端的huokt3scfv融合。除了标准人igg1fc区中对非糖基化形式的n297a突变外,vh与曲妥珠单抗igg1相同(seqidno:62),而将轻链构建为vl-cκ-(g4s)3-scfv(seqidno:60)。通过具有适当侧接限制酶位点的genscript,合成了编码来自曲妥珠单抗的vh和vl域以及huokt3scfv的核苷酸序列,并将其亚克隆至标准哺乳动物表达载体。以类似方式,构建了her2-c825对照bsab(c825是鼠科scfv抗体,其对于与镧系元素(包括镥和钇)的1,4,7,10-四氮杂环十二烷-1,4,7,10-乙二醇双乙胺醚(dota)-金属复合物具有高亲和力)。
将线性化质粒dna用于转染cho-s细胞(invitrogen)以用于稳定产生bsab。通过nucleofection(lonza),用5μg质粒dna转染2×106个细胞,然后在6-孔培养平板中,在37℃,在添加有8mml-谷氨酰胺(invitrogen)的cdopticho培养基中2天进行回收。在约2周中,用500μg/ml潮霉素选择稳定混合物,然后通过有限稀释选出单个克隆。分别通过her2(+)au565细胞和cd3(+)jurket细胞elisa确定her2-bsab滴度,并选择具有最高表达的稳定克隆。
在opticho培养基中培养bsab产生系,并收获成熟上清液。用ph8.2,具有0.15mnacl的25mm柠檬酸钠缓冲液预平衡蛋白a亲和柱(gehealthcare)。用ph3.9的0.1m柠檬酸/柠檬酸钠缓冲液洗脱结合的bsab,并用ph8.5的25mm柠檬酸钠中和(1:10的v/v比)。对于存储,将bsab透析到ph8.2的具有0.15mnacl的25mm柠檬酸钠中,并以小等份在-80℃冷冻。使用4-15%tris-甘氨酸即用凝胶系统(bio-rad),在还原条件下通过sds-page分析2微克蛋白。将invitrogenseeblueplus2预染色标准品用作蛋白mw标志物。电泳后,使用考马斯亮蓝g-250(gelcode蓝色染色试剂;pierce)对凝胶染色。还通过尺寸排阻高效液相色谱(se-hplc)评价her2-bsab的纯度。使用0.4mnaclo4,0.05mnah2po4,ph6.0的缓冲液,以0.5ml/min的流速将约20μg蛋白注入tsk-gelg3000swxl7.8mm×30cm,5μm柱(tosohbioscience)中,并在280nm进行uv检测。同时分析10微升凝胶-过滤标准品(bio-rad)作为mw标志物。
6.1.2.2facs分析
将细胞与5μg/ml的第一抗体(曲妥珠单抗、her2-bsab或西妥昔单抗)在4℃在pbs中培育30分钟,然后在用过量第一抗体清洗后,使用藻红蛋白-标记的对人fc特异的第二抗体。在facscalibur细胞计数器(bdbiosciences)上进行分析之前,将细胞用1%多聚甲醛(pfa)固定。对照是仅具有第二抗体的细胞,对其将平均荧光强度(mfi)设置为5。facs数据在每幅图的右上部分中显示mfi。
6.1.2.351cr释放测定
用在存在抗cd3和抗cd28的情况下离体培养约14天的效应细胞t细胞进行51cr释放测定。用2mmedta的pbs溶液收获所有靶标肿瘤细胞,并在37℃以100μci/106个细胞用51cr(amersham,arlingtonheight,il)标记1h。将5000个靶标细胞/孔与50000个效应细胞(e:t=10:1)和bsab抗体在96-孔聚苯乙烯圆底板(bdbiosciences)中混合至最终体积250l/孔。将板在37℃培育4h。在γ-计数器(packedinstrument,downersgrove,il)中对上清液中释放的51cr计数。使用下式计算特异性释放百分比:(实验cpm-背景cpm)/(总cpm-背景cpm)×100%,其中cpm表示每分钟释放的51cr计数。通过用10%sds(sigma,stlouis,mo)溶胞评价总释放,并且在不存在效应细胞的情况下测量背景释放。使用sigmaplot软件计算ec50。
6.1.2.4竞争测定
为了评价曲妥珠单抗和/或huokt3干扰her2-bsab结合的能力,将her2-阳性skov3细胞系在4℃与pbs或与10g/ml曲妥珠单抗或huokt3培育30min。随后,用10g/ml的alexa-fluor488-缀合的her2-bsab对细胞染色,并通过流式细胞术分析。根据生产商的说明,通过zenonalexafluor488人igg标记试剂盒(lifetechnologies)产生alexa-fluor488-缀合的her2-bsab。
6.1.2.5结合测定
如okazaki等人,2004,jmolbiol;336(5):1239-1249中所述,使用biacoret100通过表面等离子共振进行结合测定。
6.1.2.6亲合力测定
为了比较her2-bsab和曲妥珠单抗的亲合力,将her2-阳性skov3细胞与10倍稀释(从10至1×10-5g/ml)的曲妥珠单抗或her2-bsab培育,并使用fitc-标记的人fc-特异抗体作为第二抗体通过流式细胞术分析。将mfi对抗体浓度作图并比较曲线。
6.1.2.7增殖测定
为了确定抗增殖作用,用同种型对照单克隆抗体、10nm拉帕替尼(作为阳性对照)、10g/mlher2-bsab、10g/ml曲妥珠单抗、10nm拉帕替尼、10nm厄洛替尼、10nm来那替尼或10g/ml西妥昔单抗处理细胞72小时并测定细胞增殖。使用elisa酶标仪,根据生产商的说明书使用wst-8试剂盒(dojindotechnologies)并且根据下式:存活率%=(样品-背景)/(阴性对照-背景),确定细胞增殖。如前所述,使用研钵研磨拉帕替尼(mskcc药店)并悬浮在dmso中。为了确定统计显著性,使用prism6.0,通过单向anova分析结果。
6.1.2.8qrt-pcr
当细胞70%汇合时提取rna,并在prism7700序列检测系统中使用来自appliedbiosciences的her2特异性、可商购试剂盒hs01001580_m1分析cdna。
6.1.2.9动物和体内测定
对于体内研究,balb-rag2-ko-il-2r-γc-ko(dko)小鼠(来源于dr.mamoruito,ciea,kawasaki,japan的集落)。参见,例如,koo等人,2009,expertrevvaccines,8:113-120和andrade等人,2011,arthritisrheum,2011,63:2764-2773。将mcf7细胞或hcc1954以1:1的比值与pmbcs(未激活,来自血沉棕黄层)混合并皮下植入dko小鼠。植入后4天,用pbs、10g曲妥珠单抗或10gher2-bsab处理小鼠2周,每周2次。在植入后指定天数测量肿瘤尺寸。通过卡尺使用下式v=0.5(长×宽×宽),或者通过使用peiratm900光学系统确定肿瘤尺寸。
对于转移性模型,将表达荧光素酶的mcf7细胞静脉内给予于dko小鼠。给予后4天,在静脉内给予或不给予5×106个pbmc的情况下,用100ugher2-bsab、20ugher2-bsab或20ug缺少cd3靶标的her2-bsab(her2-c825)处理小鼠3周,每周两次。在指定时间点,使用定量荧光素生物发光的ivis200(xenogen)来定量肿瘤尺寸。
6.1.3结果
6.1.3.1her2-bsab结合至肿瘤细胞和t细胞两者。
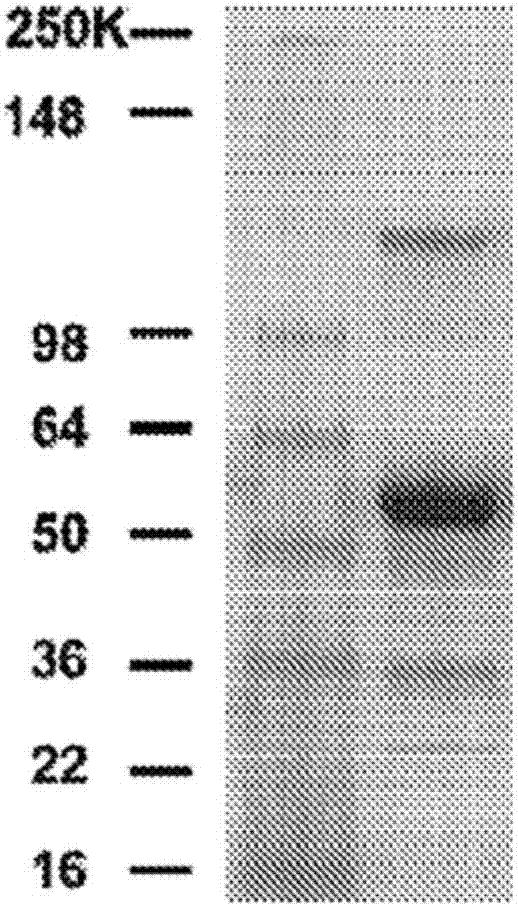
是在人igg1fc区中包含n297a突变以除去糖基化的曲妥珠单抗变体产生her2-bsab(seqidno:62)。通过将抗cd3人源化okt3(huokt3)单链fv片段(scfv)通过c末端(g4s)3接头连接至曲妥珠单抗igg1轻链的羧基端来产生bsab轻链融合多肽(图1a和seqidno:60)。为了避免聚集,用丝氨酸取代huokt3可变重链位置105的半胱氨酸。还将n297a突变引入到her2-bsabfc区以除去her2-bsab与fc受体的结合。先前已显示该突变消除了人igg1-fc结合至cd16a(图1d)和cd32afc受体(图1e)的能力。
为了产生her2-bsab,将编码重链和轻链融合多肽的哺乳动物表达载体转染到cho-s细胞中,选择稳定克隆,收集上清液并通过蛋白a亲和色谱纯化her2-bsab。在图1b和图1c中显示了bsab的生物化学纯度分析。在还原性sds-page条件下,her2-bsab在约50kda产生两条带,这是因为huokt3scfv融合至曲妥珠单抗轻链将mw提高至~50kda。
sec-hplc显示了mw约210kda的主峰(通过uv分析,97%)以及通过凝胶过滤可除去的多聚体小峰。在多次冻融循环后,通过sds-page和sec-hplc显示her2-bsab稳定。
实施facs和免疫染色来评价her2-bsab与靶细胞和效应细胞两者的结合。曲妥珠单抗和her2-bsab显示出与her2-阳性乳腺癌细胞系au565相当的结合(图2a)。相反,her2-bsab显示与huokt3相比,与cd3+t细胞的结合小超过20倍(图2b)。这与以下观察结果一致:轻链-锚定的scfv对t细胞的亲合力小于常规huokt3igg1,其故意设计成在不存在靶标肿瘤细胞的情况下最大程度降低细胞因子释放。
通过使用biacore的结合亲合力分析进一步确认了her2-bsab对t细胞较低的亲合力,如cheung等人,2012,oncoimmunology,1:477-486中所述。对于抗原cd3,her2-bsab的kon为4.53×105m-1s-1,koff为8.68×10-2s-1,并且整体kd为192nm;与亲代huokt3igg1-aglyco的koff(1.09×10-1s-1)相当,但是kon(1.68×106m-1s-1)和整体kd(64.6nm)较小。总之,her2-bsab比其亲代huokt3-aglyco的kon要低得多,表明在相同条件下,bsab结合至并激活t细胞的机会较少,因此细胞因子释放较少。
6.1.3.2her2-bsab重定向人肿瘤细胞系的t细胞杀死
为了评价her2-bsab是否可以重定向t细胞以杀死肿瘤细胞,在标准4-小时51cr释放测定中测试t细胞对her2(+)乳腺癌au565细胞的细胞毒性。在存在her2-bsab的情况下,观察到肿瘤细胞的大量杀死,其ec50为300fm(图3)。此外,对于包括乳腺癌、卵巢癌、黑素瘤、骨肉瘤、尤文氏肉瘤、横纹肌肉瘤和成神经细胞瘤的广泛的人肿瘤细胞系组,杀死是有效的,其中杀死效力与通过facs的细胞中her2的表达水平相关联(图4)。
6.1.3.3her2-bsab介导肿瘤抗原特异性t细胞毒性。
为了研究her2-bsab在t细胞毒性中的肿瘤抗原特异性,在her2-阳性umscc47细胞中(头颈癌模型)和her2-阴性htb-132细胞中(乳腺癌模型)进行细胞毒性测定。her2-bsab介导对her2-阳性um-scc47细胞(ec50为14.5pm)的t细胞毒性,但对her2-阴性htb-132细胞无t细胞毒性(图5a)。
为了研究her2-bsab在t细胞毒性中的特异性,首先用huokt3或者用曲妥珠单抗阻断her2-阳性细胞。在不存在her2-bsab的情况下,t细胞显示出最低的细胞毒性,从而再次确保t细胞自身具有最小非特异性细胞毒性。huokt3和曲妥珠单抗两者阻断her2-bsab引起t细胞毒性的能力。
6.1.3.4her2-bsab介导低于通过流式细胞术的her2检测阈值的对her2-阳性细胞的t细胞毒性。
在存在t细胞的情况下,在使用10倍稀释的her2-bsab的51cr细胞毒性测定中使用了her2+卵巢癌细胞系skov3。以相同浓度,使用her2-bsab对这些相同的细胞染色,并通过流式细胞术分析,将mfi对与细胞毒性相同的x轴作图,并对两条曲线计算ec50。甚至当通过流式细胞术检测不到her2-bsab结合时,her2-bsab介导对her2-阳性细胞的t细胞毒性(图6)。将细胞毒性测定的ec50(2pm)与流式细胞术曲线的ec50(3.5nm)相比较,表明在存在her2-bsab的情况下,t细胞在检测her2-阳性细胞时比流式细胞术有效2500×。
6.1.3.5her2-bsab具有与曲妥珠单抗相同的特异性、亲合力和抗增殖作用。
在用her2-bsab处理前,将her2-阳性细胞与曲妥珠单抗预培育以确定her2-bsab是否具有与曲妥珠单抗相同的抗原特异性。与曲妥珠单抗预培育阻断了her2-bsab与细胞的结合,表明共有特异性(图7a)。为了比较her2-bsab对曲妥珠单抗的亲合力,将her2-阳性细胞与曲妥珠单抗或her2-bsab的稀释培育,并通过流式细胞术分析细胞结合。对于曲妥珠单抗和her2-bsab,将mfi对抗体浓度作图显示出类似的曲线,表明了类似的结合亲合力(图7b)。此外,曲妥珠单抗和her2-bsab对her2-阳性细胞显示出类似的抗增殖作用(图7c)。
6.1.3.6her2-bsab介导对scchn的ec50在皮摩尔范围的t细胞毒性。
通过流式细胞术,使用曲妥珠单抗评价先前鉴定的头颈癌细胞系93-vu-147t、pci-30、ud-scc2、scc90、umscc47和pci-15b中her2的水平和频率。还通过qrt-pcr检测细胞的her2表达(图8)。在头颈癌细胞系组中,相当地表达her2。最终,在存在t细胞和her2-bsab的情况下,细胞毒性水平与细胞中her2的水平相关,从而表明her2-bsab对这些头颈细胞系显示出皮摩尔范围的ec50(图8)。
6.1.3.7her2-bsab介导了对耐受其他her靶向疗法的scchn的t细胞毒性。
为了确定scchn细胞系pci-30的egfr和her2状态,如前所述,用曲妥珠单抗或西妥昔单抗对细胞染色并通过流式细胞术分析(图9a)。增殖测定显示这些细胞耐受her-特异性靶向疗法,曲妥珠单抗、西妥昔单抗、拉帕替尼、厄洛替尼和pan-her抑制剂来那替尼(图9b)。然而,通过使用三种不同的细胞毒性测定,pci-30对使用her2-bsab的处理敏感(图9c)。独立于它们对其他her靶向疗法的敏感性,甚至当这些药物靶向这些受体中不止一种时,her2-bsab对pci-30产生有效的细胞毒性反应。这些测定表明不考虑靶标细胞对egfr或her2靶向疗法的敏感性,her2-bsab能够产生强大的细胞毒性反应。
6.1.3.8her2-bsab介导对骨肉瘤细胞系的ec50在皮摩尔范围的t细胞毒性。
通过流式细胞术,使用曲妥珠单抗(图10)并且通过qrt-pcr,评价了先前鉴定的骨肉瘤细胞系rg-160、crl1427和u2os的her2表达,并且在存在t细胞和her2-bsab的情况下,将her2的水平与细胞毒性相关联(图10)。尽管表达水平不同,但是所有测试细胞系对her2为阳性。此外,所有her2-阳性细胞对通过her2bsab介导的t细胞毒性敏感,其ec50在11-25pm的范围内。
6.1.3.9her2-bsab介导对her-疗法耐受性骨肉瘤细胞系的t细胞毒性。
u2os细胞是her2-阳性、egfr-阳性骨肉瘤细胞系(图11a)。在存在每种抑制剂的情况下,通过增殖测定分析u2os细胞对曲妥珠单抗、西妥昔单抗、拉帕替尼和pan-her抑制剂来那替尼的敏感性。这些细胞耐受西妥昔单抗和曲妥珠单抗,对拉帕替尼、厄洛替尼和来那替尼具有最小的敏感性(图11b)。对这些相同的细胞测试对her2-bsab介导的t细胞毒性反应的敏感性。独立于对其他her靶向疗法的敏感性,使用三种不同的细胞毒性测定,her2-bsab对u2os细胞产生有效的细胞毒性反应(图11c)。
6.1.3.10her2-bsab介导对her-疗法耐受性宫颈癌hela细胞的t细胞毒性。
hela细胞是her2-阳性、egfr-阳性宫颈癌细胞系(图12a)。分析了hela细胞对her家族酪氨酸激酶抑制剂厄洛替尼、拉帕替尼或来那替尼,或对her特异性抗体西妥昔单抗或曲妥珠单抗的敏感性。这些结果显示hela细胞对这些疗法是泛耐受性的(图12b)。然而,对这些相同的细胞测试对her2-bsab介导的t细胞毒性反应的敏感性。独立于对其他her靶向疗法的敏感性,使用三种不同的hela细胞毒性测定,her2-bsab对hela细胞产生有效的细胞毒性反应(图12c)。有趣地,即使当单独的拉帕替尼对细胞增殖无影响时,用拉帕替尼预处理提高了对her2-bsab介导的细胞毒性的敏感性。
6.1.3.11在人源化小鼠中,her2-bsab对人乳腺癌有效。
对于体内疗法研究,使用balb-rag2-ko-il-2r-γc-ko(dko)小鼠(来源于dr.mamoruito,ciea,kawasaki,japan的集落)。参见,例如,koo等人2009,expertrevvaccines8:113-120和andrade等人,2011,arthritisrhem63:2764-2773。将mcf7-荧光素酶乳腺癌细胞与周围血单核细胞(pbmc)混合并皮下植入。细胞植入后4天,用her2-bsab或者用曲妥珠单抗处理小鼠,并随时间分析肿瘤尺寸(图13)。her2-bsab显示出肿瘤发展的显著抑制。当将曲妥珠单抗耐受性hcc1954乳腺癌细胞(参见,例如,huang等人,2011,breastcancerresearch,13:r84)与pbmc皮下植入时,her2-bsab也对肿瘤发展有效(图14)。
为了评价转移性肿瘤模型,静脉内接种mcf7-荧光素酶细胞。给予her2-bsab,并随后与pbmc组合。肿瘤荧光素生物发光信号显示her2-bsab加pbmc显示出肿瘤发展的完全抑制(图15、图16a、图16b、图16c和图16d)。
6.1.4结论
非糖基化her2-bsab使得能够最大程度减少fc功能并避免细胞因子风暴和除去所有补体激活、补体介导和补体受体介导的免疫粘附。另外,尽管igg-scfv平台中huokt3是二价的,但是与cd3的结合在功能上是一价的;因此,在不存在肿瘤靶标的情况下,不存在t细胞的自发激活。
her2-bsab显示出对her2-阳性肿瘤细胞,甚至对低抗原表达的细胞或耐受曲妥珠单抗、西妥昔单抗、拉帕替尼、厄洛替尼或pan-her抑制剂来那替尼的体外有效细胞毒性,her2-bsab还显示出对乳腺癌、卵巢癌、scchn、骨肉瘤和肉瘤有效的细胞毒性。最终,her2-bsab对肿瘤异种移植显示出强烈的体内效力,其显著优于曲妥珠单抗higg1对应物。
6.2实施例2
本实施例提供了(a)对实施例1所述的一定实验的更详细说明(6.1节);和(b)与实施例1相比的其他实验(6.1节)。
6.2.1引言
曲妥珠单抗已显著改善乳腺癌中患者的结局,并且还是其他靶向疗法的设计和实施中的关键(singh等人,2014,brjcancer111:1888-98)。然而,her2表达不确保对曲妥珠单抗或其他her2靶向疗法的临床反应(gajria等人,2011,expertreviewofanticancertherapy,11(2):263-75;lipton等人,2013,breastcancerresearchandtreatment,141(1):43-53)。少于35%的her2阳性乳腺癌患者开始对曲妥珠单抗起反应,并且70%的初始起反应者在1年内最终发展出转移性疾病(vuandclaret.,2011,frontiersinoncology2:62)。在骨肉瘤和尤文氏肉瘤中,当her2的高表达水平与存活降低相关时(gorlick等人,1999,journalofclinicaloncology:officialjournaloftheamericansocietyofclinicaloncology17:2781-2788),曲妥珠单抗未显示出任何益处,甚至当结合细胞毒性化疗使用时(ebb等人,2012,journalofclinicaloncology:officialjournaloftheamericansocietyofclinicaloncology30:2545-2551)。此外,如其他her靶向疗法一样,曲妥珠单抗对her2-阳性头颈癌显示出少量或无益处(pollock等人,2014,clinicalcancerresearch,21(3):526-33)。
这些失败的原因是复杂的并且仅理解部分。恶性肿瘤的基因组多样性和持续发展使它们较少倾向于癌基因成瘾,这是靶向疗法成功的要求。此外,即使当存在癌基因成瘾时,仍可能从通过使用靶向疗法所引起的选择压力出现耐受性(lipton等人,2013,breastcancerresearchandtreatment,141(1):43-53)。事实上,即使收到初始的积极性,但是大部分靶向疗法在接受它的患者的整个治疗过程中未产生显著的益处(nathanson等人,2014,science,343:72-76)。不同的方法,即选择性靶向过表达her家族受体的恶性细胞并且可以独立于受体激活状态而产生细胞毒性抗肿瘤反应的方法可以是有益的。
2014年,批准博纳吐单抗-cd19/cd3bsab用于治疗急性成淋巴细胞性白血病(sanford,2015,drugs75:321-7)。然而,即使其结果良好,但是这些小分子不利的pk需要延长输注,这使其给予复杂(shalaby等人,1995,clinimmunolimmunopathol74:185-92,1995;portell等人,2013,clinpharmacol5:5-11)。此外,所导致的细胞因子释放综合征(crs)仍具有昂贵且通常危急生命的并发症。重要地,即使双特异性抗体具有激活t细胞的能力,但是调节经典t细胞功能的相同抑制途径仍限制了它们的有效性。例如,通过pd-1/pd-l1抑制轴抑制一价结合her2/cd3双特异性抗体的异二聚体设计(junttila等人,2014,cancerres74:5561-71)。
本实施例提供了双特异性结合分子(本文中称为“her2-bsab”),与现有技术相比,其提供了两个明显的优势:(1)它基于完全人源化的her2特异性igg1mab曲妥珠单抗,从而保持了其药理学优势(wittrup等人,2012,methodsenzymol503:255-68)和与her2的二价结合;肿瘤亲合力最大化;和(2)通过来源于人源化huokt3mab序列的scfv,其与cd3的结合在功能上是一价的。因此,her2-bsab是建立在两个mab上的,并具有广泛的临床安全记录。此外,这是其fc功能缺失以消除所有抗体依赖性细胞介导的细胞毒性(adcc)和cmc活性以减轻细胞因子释放综合征的平台。
本实施例中提供的数据显示了her2-bsab对耐受her2靶向疗法或曲妥珠单抗的肿瘤细胞产生体外和体内有效抗肿瘤反应的能力。
6.2.2材料和方法
6.2.2.1细胞系
除下列细胞系之外,所有细胞系购自atcc(manassasva):um-scc47得自universityofmichigan的dr.carey;scc-90、pci-30和pci-15b得自universityofpittsburgh的dr.robertferris;hcc1954得自memorialsloanketteringcancercenter的dr.saratchandarlapaty;93-vu-147t和hela得自dr.lucmorris;和ud-scc2得自hals-nasen-ohrenklinikundpoliklinik的henningbier。使用powerplex1.2系统(promega),通过短串联重复序列谱鉴定所有细胞,并使用商品化试剂盒(lonza)定期测试支原体。通过使用sfg-gfluc载体的反转录病毒感染产生荧光素酶-标记的肿瘤细胞系mcf7-luc。
6.2.2.2her2-bsab设计和在cho-s细胞中的表达
在her2-bsabigg-scfv形式中(图17a,“her2-bsab”),vh与曲妥珠单抗igg1vh相同,除了将fc区中的n297a突变引入her2-bsab以除去糖基化,借此使fc功能缺失(seqidno:62)。通过用c末端(g4s)3接头和huokt3scfv延长曲妥珠单抗igg1轻链构建轻链融合多肽(seqidno:60)。将编码重链和轻链两者的dna插入到哺乳动物表达载体,转染至cho-s细胞中,并选择具有最高表达的稳定克隆。从震荡器烧瓶收集上清液,并通过蛋白a亲和色谱纯化her2-bsab。如前所述,产生对照bsab、her2-c825(由seqidno:71和72组成)(xu等人,2015,cancerimmunolres3:266-77;cheal等人,2014,molcancerther13:1803-12)。
6.2.2.3其他抗体和小分子
根据生产商的说明,使用来自lifetechnologies的zenonalexafluor488人igg标记试剂盒产生荧光团-标记的her2-bsab。派姆单抗(pembrolizumab)、西妥昔单抗、曲妥珠单抗、厄洛替尼、拉帕替尼和来那替尼购自memorialsloanketteringcancercenter药店。将小分子再悬浮在dmso中。cd4、cd8、cd16和cd56抗体购自bdbiosciences(sanjoseca)。可商购的pe标记的pd-l1特异性mab10f.9g2购自biolegend。
6.2.2.4细胞增殖测定
对于细胞增殖测定,使用添加有10%fbs的rpmi-1640将5,000个肿瘤细胞在96孔板中铺板36小时,然后用指定浓度的拉帕替尼或抗体处理。根据生产商的说明,使用elisa酶标仪和wst-8试剂盒(dojindotechnologies)并使用公式:存活率%=(样品-背景)/(阴性对照-背景),确定细胞增殖。使用研钵研磨拉帕替尼(memorialsloanketteringcancercenter药店)并如前所述在dmso中混悬(chen等人,2012,molecularcancertherapeutics11:660-669)。为了确定统计显著性,使用prism6.0,使用单向anova分析结果。
6.2.2.5细胞毒性测定(51铬释放测定)
通过如前所述的51cr释放测定细胞毒性(xu等人,2015,cancerimmunolres3:266-77),并且使用sigmaplot软件计算ec50。使用pant细胞分离试剂盒(miltenyibiotec)从人pbmc纯化效应细胞t细胞,然后激活并根据生产商的规程通过cd3/cd28dynabeads(invitrogen)扩增。
6.2.2.6pd-1/pd-l1表达
为了在hek293细胞中过表达pd-l1,在添加有10%热失活的fbs和青霉素(100iu/ml)以及链霉素(100μg/ml)的dmem(cellgro)中培养细胞。在(-1)天,将hek293细胞胰蛋白酶化,计数并以0.5m个细胞/孔铺板至6孔板,并保持在2ml新鲜培养基中。转染当天,(0)天,用2ml新鲜培养基更换培养基。对于hpd-l1和对照质粒两者,如下制备转染试剂:将2.5gdna稀释至250μl未添加的dmem中(无血清)。将5μllipofectamine2000(invitrogen)稀释至单独的250μldmem(无血清)中,并在室温下培育5分钟。5分钟后,将稀释的dna与稀释的lipofectamine2000(invitrogen)合并并在室温下另外培育30分钟。30分钟后,将整个500μl反应滴加至hek293细胞的单个孔中。将板简单地来回摇动以帮助混合试剂。对于未转染的对照,将500μl无dna或lipofectamine2000的未添加的dmem加入1个孔中。收获前,将细胞在37℃培育24-48小时。在(1)天或(2)天,使用2mmedta在pbs中的溶液将细胞从板中提起,并计数。将100,000-200,000个细胞用于facs分析,并将其他的用于杀死测定。
为了引起激活t细胞(atcs)的pd-1表达,在将这些靶标细胞与10μg/ml浓度的her2-bsab培育30分钟并除去过量抗体后,将效应细胞以3:1的比值与her2-高乳腺癌细胞系hcc1954培育24小时,收获细胞,并如前所述在对pd-l1转染的hek293细胞的细胞毒性测定中使用。
6.2.2.7体内实验
对于体内疗法研究,使用balb-rag2-/-il-2r-γc-ko(“dko”)小鼠(来源于dr.mamoruito,ciea,kawasaki,japan的集落;参见,例如,koo等人,2009,expertrevvaccines8:113-20和andrade等人,2011,arthritisrheum63:2764-73)。使用了三种人源化小鼠异种移植模型:(1)静脉内肿瘤加静脉内效应细胞;(2)皮下肿瘤加皮下效应细胞;和(3)皮下肿瘤加静脉内效应细胞。使用在matrigel(corningcorp,tewksburyma)中混悬的5×106个细胞产生皮下异种移植,并植入dko小鼠侧部。从购自newyorkbloodcenter的血沉棕黄层纯化出效应细胞周围血单核细胞(pbmc)。在每个实验程序之前,分析pbmc的cd3、cd4、cd8和cd56细胞的百分比以保证一致性。从效应细胞前2天开始,每次注射5-10×106个pbmc,以100μg/注射,每周静脉内注射两次her2-bsab,持续3周,并每周一次,持续2周。使用(1)手持式tm900扫描器(pieira,brussels,be);(2)卡尺;或(3)生物发光测量肿瘤尺寸。使用xenogen体内成像系统(ivis)200(caliperlifesciences)进行生物发光成像。简要地,对小鼠静脉内注射0.1mld-荧光素溶液(goldbiotechnology;30mg/ml在pbs中的母液)。在注射后1-2分钟,使用以下参数:10至60秒曝光时间,中等合并(binning)和8f/stop采集图像。使用livingimage2.6(caliperlifesciences)进行生物发光图像分析。
6.2.3结果
6.2.3.1her2-bsab
使用igg-scfv形式设计her2-bsab(图17a)。除了用于除去糖基化的her2-bsab的fc区中的n297a突变之外,vh与曲妥珠单抗igg1的相同(seqidno:62)。通过用c末端(g4s)3接头和huokt3scfv延长曲妥珠单抗igg1轻链构建轻链融合多肽(xu等人,2015,cancerimmunolres3:266-77)(seqidno:60)。将编码重链和轻链两者的dna插入到哺乳动物表达载体,转染至cho-s细胞中,并选择具有最高表达的稳定克隆。从震荡器烧瓶收集上清液,并在蛋白a亲和色谱上纯化。
图17b和图17c分别显示了her2-bsab的sec-hplc和sds-page。在还原性sds-page条件下,her2-bsab在约50kda产生两条带,这是因为huokt3scfv融合至曲妥珠单抗轻链,从而将分子量提高至约50kda。sec-hplc显示出分子量约200kda的主锋(通过uv分析为97%),以及通过凝胶过滤可除去的多聚体小峰。通过sds-page和sec-hplc,在多次冻融循环后,bsab仍稳定。
6.2.3.2her2-bsab保留了曲妥珠单抗的特异性、亲合力和抗增殖作用
为了确定her2-bsab是否保留了曲妥珠单抗的特异性和抗增殖作用,将her2-阳性-高skov3卵巢癌细胞系与10μg/ml曲妥珠单抗预培育30分钟,然后使用alexa488标记的her2-bsab免疫染色(图18a)。与曲妥珠单抗培育防止了her2-bsab与skov3细胞的结合,表明这些抗体共有相同的特异性。为了比较her2-bsab与曲妥珠单抗的亲合力,将相同细胞系与10-倍向下稀释(从10μg/ml至1x10-5μg/ml)的曲妥珠单抗或her2-bsab培育,并通过流式细胞术分析。将平均荧光强度(mfi)对抗体浓度(单位μm)作图。结合曲线中的相似性确认曲妥珠单抗和her2-bsab对它们共有的her2靶标具有类似的结合亲和力(图18b)。
最后,用同种型对照mab、10mm拉帕替尼(作为阳性对照)、10μg/mlher2-bsab或10μg/ml曲妥珠单抗处理曲妥珠单抗-敏感性乳腺癌细胞系skbr372小时,并测定细胞增殖。如图18c所示,曲妥珠单抗和her2-bsab具有类似的抗增殖作用,其与阴性对照相比是显著的。如所期望的,拉帕替尼显示出最强的细胞增殖抑制。
6.2.3.3her2-bsab重导向的t细胞毒性是her2-特异性的并且依赖于cd3
为了在存在her2-bsab的情况下建立t细胞的细胞毒性反应的特异性,使用atcs(效应细胞:t细胞(“e:t”)的比值为10:1)和降低浓度的her2-bsab,在细胞毒性测定中测定her2-阴性和her2-阳性细胞系(图19a和图20)。对于her2-阴性细胞系,缺少细胞毒性。为了显示细胞毒性对cd3的依赖性,在存在特异性阻断mabokt3的cd3的情况下测试her2-bsab的细胞毒性(图19b)。与曲妥珠单抗或okt3的预培育防止her2-bsabt细胞介导的细胞毒性。
6.2.3.4her2-bsab介导对耐受其他her2靶向疗法的her2-阳性细胞系的细胞毒性。
通过流式细胞术对来自不同肿瘤系统(例如,头颈、乳腺和肉瘤)的一些细胞系鉴定了它们的her2表达水平(图20)。在该组中,通过流式细胞术,这些细胞中75%测试为对her2表达阳性。对代表性细胞系测定了它们对酪氨酸激酶抑制剂(例如,厄洛替尼、拉帕替尼和来那替尼)或her抗体(例如,曲妥珠单抗和西妥昔单抗)以及her2-bsab介导的t细胞毒性的敏感性。图21显示了来自三种不同肿瘤系统的三种不同细胞系的这些实验的代表性实例。如所示的,在存在atc和her2-bsab的情况下,在体外耐受her-靶向疗法的细胞系中,her2的表达-即使以低的量-足以介导t细胞毒性。当在存在atc和her2-bsab的情况下,对这些细胞系测试细胞毒性时,对her2-bsab的敏感性(表示为ec50)与表面her2表达强烈相关(图22)。
6.2.3.5her2-bsab介导的t细胞毒性对肿瘤靶标上的pd-l1表达或t细胞上的pd-1表达相对不敏感。
已知肿瘤微环境中肿瘤-特异性ctl的激活促进了pd-1/pd-l1的表达,从而导致t细胞消耗或抑制,该现象被称为“适应性免疫耐受”(tumeh等人,2014,nature515:568-71)。还报道pd-1/pd-l1途径的存在限制了t细胞接合双特异性抗体的抗肿瘤作用(junttila等人,2014,cancerres74:5561-71)。为了确定her2-bsab是否具有相同限制,在使用或不使用pd-1-特异性mab派姆单抗(pembrolizumab)的情况下,对her2-阳性、pd-l1-阳性乳腺癌细胞系hcc1954使用pd-1-阳性atcs。如图23a、图23b和图23c所示,在存在her2-bsab的情况下,pd-1-阳性t细胞产生类似的细胞毒性反应,这与派姆单抗(pembrolizumab)的存在无关。当用pd-l1的完整序列转染her2-阳性人胚肾细胞(hek-293)并用作靶标时,对表达pd-l1的细胞的细胞毒性未显著不同于未转染的hek-293细胞中观察到的细胞毒性(尽管相对于pd-l1-阴性hek-293,pd-l1-阳性hek-293的最大细胞毒性稍小)(图24a和图24b显示了6次实验的平均值,并且误差线代表标准偏差)。
6.2.3.6her2-bsab对her2-阳性异种移植有效
为了确定her2-bsab的体内效力,在dko小鼠的异种移植模型中使用了乳腺癌细胞系hcc1954(her2-高)和mcf-7(her2-低)。使用了在肿瘤位置和效应细胞途径方面不同的三种肿瘤模型:(1)静脉内肿瘤细胞和静脉内效应细胞pbmc;(2)皮下肿瘤细胞和scpbmc;和(3)皮下肿瘤细胞和静脉内pbmc。图25总结了这些实验的结果。通过尾静脉注射至dko接种her2-低mcf-7-luc(具有荧光素酶报告子)细胞。当通过生物发光确认肿瘤存在时,用6次剂量的静脉内her2-bsab或对照bsab处理小鼠,每周2次,持续3周。在her2-bsab的第1剂量后48小时,给予静脉内效应细胞pbmc,并再次给予(一周以后)。每周使用荧光素生物发光评价小鼠的肿瘤负荷。在该血原性疾病模型中,mcf-7细胞完全消除而无疾病发展(图25b)。将该相同细胞系与效应细胞pbmc皮下混合并皮下植入,并且每周2次,持续2周,用4次her2-bsab注射处理(第1次实验中总计4次注射)或者每周2次,持续3周处理(第2次实验中总计6次注射)。在两次实验中,her2-bsab导致肿瘤发展显著迟延,而pbmc+曲妥珠单抗或单独的pbmc无效(图25a)。在两个其他单独的实验中,将皮下her2-阳性乳腺癌细胞系hcc1954与皮下pbmc混合。另外,4或6次her2-bsab注射导致肿瘤生长的完全抑制,而曲妥珠单抗或对照bsabher2-c825没有效果(图25c)。在第3个模型中,当用静脉内pbmc(每周1次,3周)和静脉内her2-bsab(每周2次,3周)处理皮下hcc1954异种移植时,肿瘤生长显著延迟(在2个单独的实验中),相比之下,曲妥珠单抗+huokt3+pbmc、对照抗体(her2-c825)+pbmc、huokt3+pbmc或无pbmc的单独的her2-bsab仅有少量作用(图25d)。做出以下观察:当效应细胞pbmc与肿瘤细胞皮下混合时,在肿瘤植入后90天,对小鼠观察到完全肿瘤退化而无复发。当静脉内给予效应细胞pbmc时,肿瘤尺寸显著减小,但仅在动物亚组中观察到完全消退。
6.2.4结论
本实施例描述了已显示具有体外和体内有效t细胞-介导的抗肿瘤活性的her2-特异性bsab,其在存在人pbmc的情况下,在3种单独的肿瘤模型中消除肿瘤或延迟肿瘤生长。不同于一价双特异性抗体,该her2-bsab具有与曲妥珠单抗相同的抗增殖能力。另外,her2-bsab的血清半衰期和曲线下面积类似于igg。不同于倾向于聚集的其他双特异性抗体,即使长期储存,her2-bsab在-20℃和37℃是稳定的。最重要地,它所引起的t细胞-介导的细胞毒性对通过pd-1/pd-l1途径的抑制相对不敏感。
当与靶向her2的现有平台相比时,her2-bsab具有优势。f(ab)xf(ab)形式尽管体外有效,但是在尺寸上与博纳吐单抗相似(sanford,2015,drugs,75:321-7)并且预期具有类似的药物动力学和毒性谱(shalaby等人,1995,clinimmunolimmunopathol74:185-92,1995),从而具有短半衰期,因此需要每天输注,并且具有潜在的向中枢神经系统(cns)的渗漏、潜在的cns毒性和潜在的显著细胞因子释放综合征。另外,这种f(ab)xf(ab)一价系统的抗增殖能力比曲妥珠单抗低10倍。曲妥珠单抗和okt3之间的iggxigg化学缀合物对支持离体t细胞是有用的,但是作为可注射剂是无用的,这可能是由于与化学缀合物有关的杂质所造成的(lumandthakur,2011,biodrugs25:365-79;lum等人,clincancerres21:2305,2015);相反,本文提供的her2-bsab作为可注射剂是允许的。最近描述了使用不保持在her2-bsab中保留的曲妥珠单抗的抗增殖作用的一价系统的异二聚体形式(junttila等人,2014,cancerres74:5561-71)。
存在将her2-bsab与该类其他已知候选相区分的其他设计特征。与大多数双特异性抗体不同,her2-bsab与her2靶标的二价结合得到保留,从而提供了类似于曲妥珠单抗igg1的抗增殖活性。与f(ab)xf(ab)(shalaby等人,1995,clinimmunolimmunopathol74:185-92)或串联scfv构建体(sanford,2015,drugs,75:321-7)不同,her2-bsab的分子量足够高,从而在药物动力学分析中的表现类似于野生型igg。与其他二价双特异性(reusch等人,mabs,7:584,2015)不同,her2-bsab与cd3的反应在功能上是一价的。her2-bsab还不同于处于其修饰的fc的异二聚体双特异性,其中非糖基化除去了adcc和cmc两种功能,借此降低了细胞因子释放综合征,同时不会影响血清药物动力学或者损害t细胞激活。另一个优势是可制造性;在cho细胞中产生her2-bsab并使用igg的标准程序纯化,即使在37℃长时间培育也无明显聚集。考虑到其双重抗增殖和t细胞重靶向性质,her2-bsab是对在标准her2-基疗法上发展的患者的重要救治选择,或者是对曲妥珠单抗的替代。
7.等同内容
本发明不限于本文所述的具体实施方式的范围。的确,除所述那些以外,通过上述说明和附图,本发明的多种改变将对本领域技术人员是显而易见的。这些改变旨在处于所附权利要求的范围内。
本文所引用的所有参考文献以它们的全部内容并且以达到似乎每个专利公开或专利或专利申请均具体并单独指明出于所有目的以其全部内容作为参考并入本文的相同程度出于所有目的作为参考并入本文。
- 还没有人留言评论。精彩留言会获得点赞!