肿瘤抗原肽的制作方法
本发明涉及一种可作为癌症的预防和/或治疗剂的源自boris的肿瘤抗原肽等。
背景技术:
:至今所开发的抗癌剂的治疗效果并不充分,仅凭借采用抗癌剂的治疗能够根治癌症的机率极低。作为其原因,可举出以往的治疗剂未能选择性地靶向形成癌组织的根源的细胞。到了近年,作为该“形成癌组织的根源的细胞”,报道了癌干细胞的存在。癌干细胞是在癌细胞中以极少的比例存在的具有很高的肿瘤形成能力、自我复制能力及分化能力的细胞,被认为是与癌症的产生、复发及转移相关的原因细胞。因此,若能够靶向癌干细胞,则期待有高的可能性能够有效地抑制癌症的增殖、复发及转移。即,癌干细胞的检测技术和靶向癌干细胞的新型治疗剂的开发对于癌症医疗成了重要的课题。另一方面,在源自生物体的肿瘤细胞或病毒感染细胞等的排除中,细胞性免疫,尤其是细胞毒性t细胞(cytotoxictlymphocyte;称为ctl)起到重要的作用。在肿瘤细胞的排除的情况下,ctl识别肿瘤细胞上的抗原肽(肿瘤抗原肽)与mhc(主要组织相容性复合体;majorhistocompatibilitycomplex)i类抗原(人类的情况下称为hla(人类白细胞抗原,humanleukocyteantigen)i类抗原)的复合体,攻击、破坏肿瘤细胞。肿瘤抗原肽通过在细胞内合成肿瘤细胞中特异性表达的蛋白质(肿瘤抗原蛋白质)后,藉由蛋白酶在细胞内被分解而生成。所生成的肿瘤抗原肽在内质网内与mhci类抗原(hlai类抗原)结合而形成复合体,并被运送到细胞表面上进行抗原提呈。肿瘤特异性的ctl识别像这样抗原提呈的含抗原肽的复合体,藉由细胞毒作用或淋巴因子的产生攻击肿瘤细胞而显示出抗肿瘤效果。随着这样的一系列作用的阐明,藉由将肿瘤抗原蛋白质或肿瘤抗原肽作为所谓的癌症免疫治疗剂(癌症疫苗)使用,不断开发出使癌症患者体内的癌特异性ctl增强的治疗法。boris(印迹位点调节物兄弟;brotheroftheregulatorofimprintedsites)基因是ctcf基因的平行同源物,在编码n端肽区域和c端肽区域这2个肽的区域之间具有11个锌指区域。boris除了已知起到如各种基因表达的抑制子及活化子等一般的转录因子的作用之外,还已知在各种肿瘤细胞中,特别是在癌干细胞中有表达。此外,有报导指出boris的锌指区域与ctcf基因具有高同源性,boris中存在被分类成6个亚家族的23个同型异构体,它们全部是转录后产生的剪接变体(非专利文献1)。此外,boris因为在睾丸以外的正常组织不会表达,所以作为癌症诊断及治疗的候选的靶而受到关注,报道了针对boris的各亚家族的特异抗体和用于抑制boris基因的表达的sirna等(专利文献1、2等)。另外,还报道了分析boris蛋白质的序列,由此预测限于hla-a0201的序列,其中之一诱导出了特异性识别实际抗原提呈的细胞的ctl(非专利文献2)。在先技术文献专利文献专利文献1:国际公开第2008/028066号小册子专利文献2:美国专利申请公开第2009/0169613号非专利文献非专利文献1:pugacheva等,plosone5(11):e13872非专利文献2:romagnoli等,rapportiistisan.2006;06(50),36-40发明的概要发明所要解决的技术问题本发明的目的在于提供一种源自boris的肿瘤抗原肽、特别是boris的同型异构体或亚家族特异性肿瘤抗原肽以及一种含有该肿瘤抗原肽作为有效成分的可用于癌症的预防和/或治疗的医药组合物等、特别是特异性地处置癌干细胞的医药组合物等。解决技术问题所采用的技术方案本发明人在研究作为用于癌症疫苗治疗的肿瘤抗原的boris的过程中,发现boris在子宫颈癌或卵巢癌中显示出类似干细胞的性质的细胞中,会特异性表达特定的亚家族的boris。基于该发现进一步反复研究后,发现藉由诱导识别表达特定的同型异构体或亚家族的boris的细胞的细胞毒性t细胞(ctl),能处置许多的癌细胞和/或癌干细胞,更进一步研究后完成了本发明完成。即,本发明涉及下述中揭示的发明:[1]一种诱导特异性识别表达同型异构体a或c、或者属于亚家族5或6的boris基因的ctl的方法,其中,包括使以下的(a)或(b)中的任一种与外周血淋巴细胞接触:(a)多肽,它是所述boris蛋白质的部分肽,长度为8~20个氨基酸,具有hla结合能力;(b)多核苷酸,其编码上述(a)所述的多肽中的至少一种。[2]如[1]所述的方法,其中,该方法在体外(invitro)进行。[3]一种用于[1]或[2]所述的方法的多肽,其中,所述多肽是以序列编号1或序列编号2表示的多肽的部分肽,长度为8~20个氨基酸,具有hla结合能力。[4]如[3]所述的多肽,其中,其长度为8~11个氨基酸。[5]如[3]或[4]所述的多肽,其中,所述多肽是以序列编号1表示的多肽的部分肽。[6]如[5]所述的多肽,其中,所述多肽以序列编号3、序列编号4、序列编号5或序列编号72表示。[7]如[3]或[4]所述的多肽,其中,所述多肽是以序列编号2表示的多肽的部分肽。[8]如[5]所述的多肽,其中,所述多肽是以序列编号10表示。[9]一种用于[1]或[2]的方法的多肽,其中,所述多肽具有hla-a11抗原结合能力。[10]如[9]所述的多肽,其中,所述多肽以序列编号65、序列编号66、序列编号67或序列编号72表示。[11]一种用于[1]或[2]所述的方法的多肽,其中,所述多肽具有hla-a2抗原结合能力,以序列编号4、序列编号5、序列编号10、序列编号47或序列编号57表示。[12]一种用于[1]或[2]所述方法的多肽,其中,所述多肽具有hla-a24抗原结合能力。[13]如[12]所述的多肽,其中,所述多肽以序列编号3或10表示。[14]一种多肽,其中,所述多肽是在[3]~[13]中任一项所述的多肽中插入、缺失、置换了1个或多个氨基酸而形成的。[15]一种用于[1]或[2]所述的方法的多核苷酸,其中,所述多核苷酸编码[3]~[14]所述的多肽。[16]一种细胞毒性t细胞(ctl)诱导剂,其中,包含[3]~[14]所述的多肽中的至少一种作为有效成分。[17]一种医药组合物,其中,包含[16]所述的ctl诱导剂作为有效成分。[18]一种癌干细胞处置用组合物,其中,包含[16]所述的ctl诱导剂作为有效成分。[19]一种癌症的预防和/或治疗用组合物,其中,包含[16]所述的ctl诱导剂作为有效成分。[20]一种癌症的预防和/或治疗用组合物,其中,包含通过[1]或[2]所述的方法诱导得到的细胞毒性t细胞(ctl)作为有效成分。[21]如[19]或[20]所述的癌症的预防和/或治疗用组合物,其中,癌症是女性特有的脏器中的癌症或肺癌。[22]一种表达载体,其中,含有[15]所述的多核苷酸。[23]一种用于癌症的治疗或预防的医药组合物,其中,含有[15]所述的多核苷酸、或[22]所述的表达载体中的任一种作为有效成分。[24]一种hla-四聚体,其中,所述四聚体含有[3]~[14]所述的多肽和hla。[25]一种抗原提呈细胞的制造方法,其中,包括使以下的(a)或(b)与具有抗原提呈能力的细胞在体外进行接触:(a)[3]~[14]所述的多肽;(b)多核苷酸,其编码上述(a)所述的多肽中的至少一种。[26]一种抗体,其中,所述抗体与以序列编号1或序列编号2表示的多肽的至少一部分特异性结合。[27]一种boris蛋白质检测用试剂盒,其中,包含[26]所述的抗体。发明的效果根据本发明,可提供一种诱导识别特定的同型异构体或亚家族的boris的ctl的方法、可作为用于该方法的ctl的诱导剂的肿瘤抗原肽、及一种含有该肽作为有效成分的可用于癌症的预防和/或治疗的医药组合物等。特别是癌症中存在具有类似干细胞的性质的细胞(即癌干细胞)中表达特定的亚家族的boris的癌症,因此也可藉由本发明的治疗剂对癌干细胞选择性地进行处置。附图的简单说明图1是通过球体形成试验所形成的球体的照片。图2是表示子宫颈癌细胞株caski及tcs细胞株中的干细胞性基因sox2、nanog、oct3/4的相对表达量的图表。图3是表示正常组织中的boris的表达的图。(a)表示rt-pcr的结果,(b)是表示相对表达量的图表。图4是表示各种子宫颈癌细胞株的团块群细胞及球体群细胞中的boris相对表达量的图表。图5是表示各种癌细胞中的boris相对表达量的图表。图6是表示子宫颈癌细胞株caski及ms751细胞株中的团块群细胞与球体群细胞的各boris亚家族的表达量的比较的图。图7是表示卵巢癌细胞株tov21g及smov2细胞株中的团块群细胞与球体群细胞的各boris亚家族的表达量的比较的图。图8-1是表示在作为子宫颈癌细胞株的tcs细胞株中使各boris亚家族大量表达时的球体形成试验的结果的照片。图8-2是表示在作为子宫颈癌细胞株的tcs细胞株中使各boris亚家族大量表达时的球体形成试验的结果的图表。图9-1是表示在作为子宫颈癌细胞株的skg-iiib细胞株中使各boris亚家族大量表达时的球体形成试验的结果的照片。图9-2是表示在作为子宫颈癌细胞株的skg-iiib细胞株中使各boris亚家族大量表达时的球体形成试验的结果的图表。图10是表示从borissf6特异性序列中提取的候选hla结合性肽的hla-a02结合试验的结果的图表。图11是表示hla-a*24:02结合性boris特异性ctl表位候选肽的折叠试验的结果的图表。图表显示由表示hla-单体的峰面积所推定的hla-单体形成量。图12-1是表示用流式细胞仪分析将采集自检体编号a24-38的样品与rmm肽共培养后的与hla-四聚体试剂的反应的第一阶段分析的结果的图。图12-2是表示用流式细胞仪分析将采集自检体编号a24-38的样品与rmm肽共培养后的与hla-四聚体试剂的反应的第二阶段分析的结果的图。第一阶段分析中,在第2、4、8及9行中检测到ctl,因此第二阶段分析中对这些行进行分析。图13是表示使用rmm-tet对rmm肽特异性ctl的机能进行机能分析的结果的图。可知用rmm肽刺激的情况下,rmm肽特异性地产生ifnγ。图14-1是表示分别比较经sirna转染的caski细胞株中的mrna表达(a)及细胞增殖(b)的图表。图14-2是经sirna转染的caski细胞的显微镜影像。图15是比较经sirna转染的caski细胞株的干细胞性基因表达的图表。第16-1图是比较经sirna转染的caski细胞株(a)、ms751细胞株(b)的球体形成能力的图表。第16-2图是经sirna转染的各细胞株的显微镜影像。第17图是表示比较经sirna转染的细胞株之辐射耐受性的图表。第18图是表示若boris表达量高则生存率会显著降低的克普兰-麦尔生存曲线(kaplan-meiersurvivalcurve)。图19-1是表示小细胞肺癌细胞株sbc1、sbc3、sbc5及lc817细胞株中的团块群细胞与球体群细胞的各boris亚家族的表达量的比较的图。图19-2是表示非小细胞肺癌细胞株lu99a及86-2细胞株中的团块群细胞与球体群细胞的各boris亚家族的表达量的比较的图。图19-3是表示肺鳞状上皮癌细胞株lk2、ebc1及sq1细胞株中的团块群细胞与球体群细胞的各boris亚家族的表达量的比较的图。图19-4是表示肺腺癌细胞株a549、lhk2、lhk2-sox2及pc3细胞株中的团块群细胞与球体群细胞的各boris亚家族的表达量的比较的图。第19-5图是表示肺腺癌原代培养细胞原代(primary)3、原代(primary)4、原代(primary)5及原代(primary)7细胞中的团块群细胞与球体群细胞的各boris亚家族的表达量的比较的图。图20是表示用流式细胞仪分析将采集自检体编号a2-34的样品与kll肽共培养后的与hla-四聚体试剂的反应的第一阶段分析的结果的图。图21是表示用流式细胞仪分析将采集自检体编号a2-34的样品与kll肽共培养后的与hla-四聚体试剂的反应的第二阶段分析的结果的图。第一阶段分析中,在第5及11行中检测出ctl,因此第二阶段分析中对这些行进行分析。图22是表示用流式细胞仪分析将采集自检体编号a2-29的样品与llf肽共培养后的与hla-四聚体试剂的反应的第一阶段分析的结果的图。图23-1及图23-2是表示用流式细胞仪分析将采集自检体编号a2-29的样品与llf肽共培养后的与hla-四聚体试剂的反应的第二阶段分析的结果的图。第一阶段分析中,在于第1、2、4、5、6、7、8、9、10及11行中检测出ctl,因此第二阶段分析中对这些行进行分析。图24是表示用流式细胞仪分析将采集自检体编号a2-s1的样品与llf肽提呈细胞共培养后的与hla-四聚体试剂的反应的结果的图。图25是表示用elispot分析由采集自检体编号a2-s1、a2-s2、a2-s3的样品与llf肽提呈细胞共培养所诱导的ctl的ifnγ产生能力的结果的图。图26是表示用流式细胞仪分析对由采集自检体编号a2-s1的样品与llf肽提呈细胞共培养后所诱导的ctl进行单克隆化及扩增后的与hla-四聚体试剂的反应的结果的图。图27是表示用elispot分析对由采集自检体编号a2-s1的样品与llf肽提呈细胞共培养后所诱导的ctl进行单克隆化及扩增后的ifnγ产生能力的结果的图。图28是表示ldh杀伤试验分析对由采集自检体编号a2-s1的样品与llf肽提呈细胞共培养后所诱导的ctl进行单克隆化及扩增后的细胞毒性活性的结果的图。图29是表示用流式细胞仪分析将采集自检体编号a24-s4或检体编号a2-s5的样品与rmm肽提呈细胞共培养后的与hla-四聚体试剂的反应的结果的图。图30是表示用elispot分析由采集自检体编号a24-s4或检体编号a2-s5的样品与rmm肽提呈细胞共培养后所诱导的ctl的ifnγ产生能力的结果的图。图31是表示用流式细胞仪分析对由采集自检体编号a24-s4的样品与rmm肽提呈细胞共培养后所诱导的ctl进行单克隆化及扩增后的与hla-四聚体试剂的反应的结果的图。图32是表示用流式细胞仪分析对由采集自检体编号a2-s5的样品与rmm肽提呈细胞共培养后所诱导的ctl进行单克隆化及扩增后的与hla-四聚体试剂的反应的结果的图。图33是表示hla-a*02:01限制性、boris特异性ctl表位候选肽的折叠试验的结果的图表。图表显示由表示hla-单体的峰面积所推定的hla-单体形成量。图34是表示用流式细胞仪分析将采集自检体编号a2-29的样品与vle肽共培养后的与hla-四聚体试剂的反应的第一阶段分析的结果的图。图35是表示用流式细胞仪分析将采集自检体编号a2-29的样品与vle肽共培养后的与hla-四聚体试剂的反应的第二阶段分析的结果的图。第一阶段分析中,在第10行中检测到ctl,因此第二阶段分析中对第10行进行分析。图36是表示用流式细胞仪分析将采集自检体编号a2-27的样品与vle肽共培养后的与hla-四聚体试剂的反应的第一阶段分析的结果的图。图37是表示用流式细胞仪分析将采集自检体编号a2-27的样品与vle肽共培养后的与hla-四聚体试剂的反应的第二阶段分析的结果的图。第一阶段分析中,在第3行中检测到ctl,因此第二阶段分析中对第3行进行分析。图38是表示用流式细胞仪分析将采集自检体编号a2-34的样品与vle肽共培养后的与hla-四聚体试剂的反应的第一阶段分析的结果的图。图39是表示用流式细胞仪分析将采集自检体编号a2-34的样品与vle肽共培养后的与hla-四聚体试剂的反应的第二阶段分析的结果的图。第一阶段分析中,在第4行中检测出ctl,因此第二阶段分析中对第4行进行分析。图40是表示用流式细胞仪分析将采集自检体编号a2-29的样品与kla肽共培养后的与hla-四聚体试剂的反应的第一阶段分析的结果的图。图41是表示用流式细胞仪分析将采集自检体编号a2-29的样品与kla肽共培养后的与hla-四聚体试剂的反应的第二阶段分析的结果的图。第一阶段分析中,在第2、5、11行中检测到ctl,因此第二阶段分析中对第2、5、11行进行分析。图42是表示用流式细胞仪分析将采集自检体编号a2-29的样品与vlt肽共培养后的与hla-四聚体试剂的反应的第一阶段分析的结果的图。图43是表示用流式细胞仪分析将采集自检体编号a2-29的样品与vlt肽共培养后的与hla-四聚体试剂的反应的第二阶段分析的结果的图。第一阶段分析中,在第7及9行中检测到ctl,因此第二阶段分析对第7及9行进行分析。图44是表示使用kla-tet对kla肽特异性ctl的机能进行机能分析的结果的图。可知在用kla肽刺激的情况下,kla肽特异性地检测出cd107a。图45是表示使用vlt-tet对vlt肽特异性ctl的机能进行机能分析的结果的图。可知在用vlt肽刺激的情况下,vlt肽特异性地诱导出cd107a。图46是表示hla-a*11:01限制性、boris特异性ctl表位候选肽的折叠试验的结果的图表。图表显示出表示hla单体的峰面积。图47是表示用流式细胞仪分析将采集自检体编号*11-13的样品与svl肽、nth肽、kql肽、gli肽共培养后的与hla-四聚体试剂的反应的第一阶段分析的结果的图。图48是表示用流式细胞仪分析将采集自检体编号*11-13的样品与svl肽、nth肽、kql肽、gli肽共培养后的与hla-四聚体试剂的反应的第二阶段分析的结果的图。第一阶段分析中,在第1行中检测到ctl,因此第二阶段分析中对第1行进行分析。图49是用流式细胞仪分析将采集自检体编号*11-13的样品与svl肽、nth肽、kql肽、gli肽共培养后的与hla-四聚体试剂的反应的第三阶段分析的结果的图。第二阶段分析中,在第1行的孔b中检测到ctl,因此第三阶段分析中对第1行的孔b进行分析。图50是表示用流式细胞仪分析将采集自检体编号*11-13的样品与sla肽、csy肽、tvy肽、tvl肽共培养后的与hla-四聚体试剂的反应的第一阶段分析的结果的图。图51是表示用流式细胞仪分析将采集自检体编号*11-13的样品与sla肽、csy肽、tvy肽、tvl肽共培养后的与hla-四聚体试剂的反应的第二阶段分析的结果的图。第一阶段分析中,在第12行中检测出ctl,因此第二阶段分析中对第12行进行分析。图52是表示用流式细胞仪分析将采集自检体编号*11-13的样品与sla肽、csy肽、tvy肽、tvl肽共培养后的与hla-四聚体试剂的反应的第三阶段分析的结果的图。第二阶段分析中,在第12行的孔e中检测出ctl,因此第三阶段分析中对第12行的孔e进行分析。图53是表示用流式细胞仪分析将采集自检体编号*11-16的样品与rms肽、gtm肽、aaa肽、kllf肽共培养后的与hla-四聚体试剂的反应的第一阶段分析的结果的图。图54是表示用流式细胞仪分析将采集自检体编号*11-16的样品与rms肽、gtm肽、aaa肽、kllf肽共培养后的与hla-四聚体试剂的反应的第二阶段分析的结果的图。第一阶段分析中,在第7和11行中检测出ctl,因此第二阶段分析中对第7和11行进行分析。图55是表示用流式细胞仪分析将采集自检体编号*11-16的样品与rms肽、gtm肽、aaa肽、kllf肽共培养后的与hla-四聚体试剂的反应的第三阶段分析的结果的图。第二阶段分析中,在第7行的孔e、第11行的孔h中检测出ctl,因此第三阶段分析对第7行的孔e、第11行的孔h进行分析。图56表示使用使附加了myctag的borissf5及borissf6各自短暂性地强制表达而得的293t细胞提取液的蛋白质印迹的结果。不管使用哪种特异抗体的情况下,都在与使用myctag抗体的情况相同的位置上确认到条带,因此显示这些抗体的特异性。图57表示使用borissf5的特异抗体对肺癌组织切片进行免疫染色的结果。即使是相同的肺癌组织,也确认到borissf5的表达呈阳性的组织和呈阴性的组织。(a)表示阴性的染色影像,(b)表示阳性的染色影像。在(b)中可见散布被染色成褐色的细胞,而在(a)中几乎看不到。实施发明的方式以下,对本发明详细地进行说明。(1)本发明的多肽本发明中的“表位肽”是指与mhc(在人类中是hla)结合,并被抗原提呈至细胞表面的多肽。在表位肽中,包括作为与mhci类结合并抗原提呈而被cd8阳性t细胞所识别的表位肽的ctl表位肽,以及作为与mhcii类结合并抗原提呈而被cd4阳性t细胞所识别的表位肽的辅助细胞表位肽。表位肽中,将源自肿瘤细胞中特异性或者过剩地表达的蛋白质的多肽特别称为肿瘤抗原肽。抗原提呈是指存在于细胞内的多肽与mhc结合,此mhc/抗原肽复合体在细胞表面上局部存在的现象。如上所述,已知被提呈于细胞表面的抗原被t细胞等识别后,激活细胞性免疫或体液性免疫,被mhc-i类提呈的抗原激活细胞性免疫的同时,会被初始t细胞的t细胞受体所识别,将初始t细胞诱导成具有细胞毒活性的ctl,因此作为用于免疫疗法的肿瘤抗原肽,较佳为与mhc-i类结合并被抗原提呈的多肽。另一方面,被树状细胞等抗原提呈细胞摄取的抗原蛋白质藉由与mhc-ii类结合并被抗原提呈至抗原提呈细胞的表面,从而被cd4阳性t细胞所识别,最终能够诱导激活细胞性免疫或体液性免疫的辅助t细胞。由于辅助t细胞不只是像ctl那样具有细胞毒活性,而且在ctl的活性维持、生存维持中也扮演重要的角色,因此作为用于免疫疗法的肿瘤抗原肽,与mhc-ii类结合并被抗原提呈的多肽也较佳。已知与mhc-i类结合的多肽的长度约为8~11个氨基酸,与mhc-ii类结合的多肽的长度约为12~20个氨基酸。本发明中,“肿瘤(tumor)”包括良性肿瘤及恶性肿瘤(癌、恶性赘生物(malignantneoplasm))。癌(cancer)包括造血器官的肿瘤、上皮性的恶性肿瘤(癌,carcinoma)和非上皮性的恶性肿瘤(肉瘤,sarcoma)。本发明中,简称“boris”的情况下,表示印迹位点调节物兄弟(brotheroftheregulatorofimprintedsites)基因或作为其表达产物的mrna或蛋白质中的任一种。已知boris基因的表达控制有3种启动子(从上游的启动子起依次称为启动子a、启动子b及启动子c)参与,根据通过哪个启动子控制转录而大致分为3种同型异构体(对应于各启动子,分别称为同型异构体a、同型异构体b及同型异构体c)。并且各同型异构体因转录时所受到的剪接方式的不同而进一步分为多种剪接变体。由此,boris已知具有6种同型异构体a(a1~a6)、8种同型异构体b(b0~b7)、9种同型异构体c(c1~c9),合计23种同型异构体。例如borisc1同型异构体具有以序列编号76表示的序列。如上所述,boris是亦被称为11锌指蛋白的ctcf的平行同源物,boris蛋白质呈在11个锌指区域的n端侧及c端侧各自具有n端肽区域及c端肽区域的结构。n端肽区域根据同型异构体的不同而存在长度为24个氨基酸、长度为53个氨基酸及长度为258个氨基酸的肽区域,但相同长度的肽区域的序列高度保守。c端肽区域存在各种长度的肽区域,其序列也各自不同。boris根据所述c端肽区域的序列分类成6个亚家族(亚家族1~6,本说明书中也简称sf1~6)。因此,各亚家族的c端序列呈各亚家族所固有的序列,属于同一亚家族的同型异构体间高度保守。本发明的多肽被抗原提呈至表达特定的同型异构体或亚家族的boris的细胞的细胞表面,具体而言,被抗原提呈至表达同型异构体a或c、或者属于亚家族5或6的boris的细胞的细胞表面。因此,本发明的多肽是同型异构体a或c、或者属于亚家族5或6的boris的部分肽,是长度为8~20个氨基酸且具有hla结合能力的多肽。在包括癌干细胞的癌细胞中存在许多表达这些boris的细胞,因此本发明的多肽在癌症的免疫疗法中有用。在一种形态中,本发明的多肽是以作为borissf6所固有的序列的序列编号1或作为borissf5所固有的序列的序列编号2表示的多肽的部分肽,且所述多肽包含与mhc、特别是hla结合的肽,较佳为被mhc、特别是hla抗原提呈的肽,更佳为被mhc、特别是hla抗原提呈且能诱导ctl的肽。hla存在多种类型,但本发明的多肽较佳为能与hla-i类结合,更佳为能与hla-a24、hla-a11或hla-a02结合,再更佳为能与hla-a02、hla-a11及hla-a24之中的2种以上的hla结合。另一种形态中,能与hla-ii类结合的多肽亦佳。例如mhc是hla-i类的情况下,已知介以hla-i类分子提呈的抗原几乎都被细胞质内的蛋白酶体分解后,被移送至tap(抗原处理相关转运蛋白;transporterinantigenprocessing),于粗面内质网内与同tap汇合的hla-i类分子和β2-微球蛋白的复合体结合,经过高尔基体藉由胞吐作用运送至细胞表面。因此,本发明的多肽可在与mhc结合之前经过加工等处理,这些处理后生成表位肽的肽也包括在本发明的多肽内。例如,通过使作为目标的肽或蛋白质与在所述一系列的抗原提呈路径上起作用的作为伴侣蛋白的hsp70或hsp90、或者gp96融合,可高效地进行抗原提呈,因此在一种形态中,本发明的多肽与在抗原提呈路径上起作用的伴侣蛋白融合。此外,本发明的表位肽可为实施了能使向生物体内的导入变得容易的各种修饰的肽。作为能使向生物体内的导入变得容易的各种修饰的例子,可例举hiv的pt(蛋白质转导;proteintransduction)结构域。hiv的pt结构域是由tat蛋白的第49~57个氨基酸所构成的肽。通过在作为目标的蛋白质或肽的n端和/或c端添加这样的修饰,能够将目标蛋白质或肽容易地导入到细胞内。如上所述,本发明的多肽可在与mhc结合之前经过加工等处理,因此只要是包含表位肽的氨基酸序列的序列即可,氨基酸长度并没有特别限定。然而,较佳为本发明的多肽其本身为表位肽,因此氨基酸长度较佳为约8~约20个氨基酸左右,更佳为约8~约11个氨基酸左右,再更佳为约8~约10个氨基酸左右。在优选的一种形态中,本发明的多肽是以序列编号1表示的多肽的部分肽,是长度为8~11个氨基酸,具有hla结合能力的多肽。另一种优选的形态中,本发明的多肽是以序列编号2表示之多肽的部分肽,是长度为8~11个氨基酸,具有hla结合能力的多肽。多肽是否“具有hla结合能力”可使用该
技术领域:
中已知的方法简单地调查。作为所述方法,可例举例如下述方法,但并不限定于此:如wo2010/50190号公报中所记载,使用针对hla的单克隆抗体,将表达在细胞表面的hla的量(即与多肽结合的hla的量)作为荧光强度来进行观察的hla结合试验;kim等,methodsmolbiol.2013;960:447-59等中记载的使用biacoresurfaceplasmonresonance(spr)的结合试验;shin等,pnas,nov2007;104:19073-19078等中记载的使用仅在多肽与固定于固相的hla结合时特异性结合的hla抗体来进行观察的利用itopia(itopiaepitopediscoverysystemassay,beckmancoulter公司)的方法等。对上述以序列编号1及序列编号2表示的多肽的部分肽进行探讨后的结果是,作为候选表位肽,鉴定了以序列编号3、序列编号4、序列编号5及序列编号72表示的多肽,以及以序列编号10表示的多肽。因此,更优选的一种形态中,本发明的多肽是以序列编号3、序列编号4、序列编号5或序列编号72表示的多肽。此外,另一种更优选的形态中,本发明的多肽是以序列编号10表示的多肽。另一种形态中,本发明的多肽是同型异构体a或c、或者属于亚家族5或6的boris的部分肽,是具有对hla-a11抗原的结合能力的多肽。hla-a11抗原是属于hla-i类的hla,因此本形态的多肽较佳为长度为约8~约11个氨基酸。对上述具有针对hla-a11抗原的结合能力的boris的部分肽进行探讨后的结果是,作为候选表位肽,鉴定了以序列编号60~73表示的多肽。针对这些多肽进一步反复探讨后的结果是,序列编号65、序列编号66、序列编号67及序列编号72确认具有高ctl诱导能力。因此,更优选的一种形态中,本发明的多肽是以序列编号65、序列编号66、序列编号67或序列编号72表示的多肽。其中,以序列编号72表示的多肽如上所述是borissf6的固有序列(序列编号1)的部分多肽,因此更佳。另一种更优选的形态中,本发明的多肽是以序列编号65、序列编号66或序列编号67表示的多肽,这些多肽也是以序列编号76表示的多肽的部分肽、尤其是存在于锌指区域的肽。以往,boris的锌指区域一直被认为由于与已知在体细胞中广泛表达的ctcf具有高度的同源性,因此难以得到boris特异性肿瘤抗原肽。因此,这次通过本发明人等的研究,获得了源自锌指区域的boris特异性肿瘤抗原肽是令人感到惊讶的。另一种形态中,本发明的多肽是同型异构体a或c、或者属于亚家族5或6的boris的部分肽,是具有针对hla-a2抗原和/或hla-a24抗原的结合能力的多肽。由于hla-a2抗原及hla-a24抗原是属于hla-i类的hla,因此本形态的多肽较佳为长度为约8~约11个氨基酸。对上述具有针对hla-a2抗原和/或hla-a24抗原的结合能力的boris的部分肽进行探讨后的结果是,作为候选表位肽,鉴定了以序列编号3~16及47~57表示之多肽。针对这些多肽进一步反复探讨后的结果,序列编号3、序列编号4、序列编号5、序列编号10、序列编号47、序列编号48及序列编号57确认显示适当的hla结合能力。因此,更优选的一种形态中,本发明的多肽是以序列编号3、序列编号4、序列编号5、序列编号10、序列编号47、序列编号48及序列编号57表示的多肽。其中,以序列编号3、序列编号4及序列编号5表示的多肽如上所述是borissf6的固有序列(序列编号1)的部分多肽,因此更佳。此外,以序列编号10表示的多肽如上所述是borissf5的固有序列(序列编号2)的部分多肽,且具有与hla-a2抗原及hla-a24抗原这两者的结合能力,因此更佳。另一种更优选的形态中,本发明的多肽是以序列编号47、序列编号48及序列编号57表示的多肽,这些也是以序列编号76表示的多肽的部分肽。此外,其中更佳为以序列编号47及序列编号57表示的多肽。其中,特佳的是以序列编号4、序列编号5、序列编号10、序列编号47、序列编号48及序列编号57表示的多肽。这些多肽通过本发明人等的研究确认能够诱导特异性的细胞毒性t细胞(ctl)。本形态的多肽中,作为具有针对hla-a2抗原的结合能力的多肽,可例举以序列编号4、序列编号5、序列编号10、序列编号47及序列编号57表示的多肽等,但并不限定于此。本形态的多肽中,作为具有针对hla-a24抗原的结合能力的多肽,可例举以序列编号3或序列编号10表示的多肽等,但并不限定于此。另一种形态中,本发明的多肽是在上述多肽中插入、缺失、置换了1个或多个氨基酸的多肽。理所当然,本形态的多肽是插入、缺失、置换了1个或多个氨基酸且具有hla结合能力的多肽。已知对hla抗原、尤其是hla-i类抗原具有结合性的肽在特定的位置上具有特定的氨基酸,这被称为锚定基序(anchormotif),认为即使将某锚定基序置换成别的锚定基序也并不会丧失hla结合能力。因此,作为本发明的肽中的插入、缺失、置换,较佳是将锚定基序替换成别的锚定基序的插入、缺失、置换。例如在具有hla-a11抗原结合性的多肽中,已知多是在自n端起第2个的位置上配置ile、met、ser、thr或val中的任一个,在第9个或者第10个的位置上配置lys或arg中的任一个,作为上述较佳的插入、缺失、置换,可例举例如将存在于自n端起第2个的位置上的ile置换为met、ser、thr或val。即,作为本发明的较佳的插入、缺失、置换的例子,可例举:(a)hla-a11抗原结合性肽中,将自n端起第2个的位置的肽设为ile、met、ser、thr或val的肽;(b)hla-a11抗原结合性肽中,将自n端起第9个或者第10个的肽设为lys或arg的肽;(c)hla-a24抗原结合性肽中,将自n端起第2个的位置的肽设为trp、phe、met或tyr的肽;(d)hla-a24抗原结合性肽中,将自n端起第9个或者第10个的肽设为phe、leu、ile或trp的肽;(e)hla-a2抗原结合性肽中,将自n端起第2个的位置的肽设为ile、val、ala或thr的肽;和/或(f)hla-a2抗原结合性肽中,将自n端起第9个或者第10个的肽设为val、leu、ile、ala或met的肽等。关于本发明的多肽的合成,能够依照一般的肽化学中使用的已知方法来进行。作为所述已知方法,可例举记载于文献(peptidesynthesis,interscience,newyork,1966;theproteins,vol2,academicpressinc.,newyork,1976;肽合成,丸善株式会社,1975;肽合成之基础与实验,丸善株式会社,1985;医药品之开发续第14卷·肽合成,广川书店,1991;这些文献藉由引用而构成本申请案的一部分)等的方法。本发明的多肽通过供于后述的ctl诱导方法或使用了人类模型动物的试验(wo02/47474号公报,intj.cancer:100,565-570(2002))等,能够确认在活体内(invivo)的活性。由于包括癌干细胞的癌细胞多数会表达同型异构体a或c、或者属于亚家族5或6的boris,因此如本说明书所记载,本发明的多肽能够用于诱导特异性识别这些细胞的细胞毒性t细胞(ctl)。因此,本发明的多肽对癌症的预防和/或治疗等有用,能够作为医药组合物的有效成分。尤其,本发明人等发现boris亚家族中sf5和/或sf6在癌干细胞中特异性表达,所以源自所述亚家族固有的氨基酸序列的本发明的多肽可特别适宜地用于用来处置癌干细胞的医药组合物。此外,本发明的多肽也可用于癌症的预防和/或治疗。另外,本发明还涉及本发明的多肽在用于癌症的预防和/或治疗的医药的制造中的用途。(2)本发明的多核苷酸本发明的多核苷酸包括编码所述本发明的多肽中的至少1种的多核苷酸。本发明的多核苷酸可以是cdna或mrna、crna,或者合成dna中的任一种。此外,可以是单链、双链中的任一种形态。具体而言,可例举例如由编码序列编号3、序列编号4、序列编号5、序列编号10、序列编号47、序列编号48、序列编号57、序列编号65、序列编号66、序列编号67或序列编号72中记载的氨基酸序列的核苷酸序列形成的多核苷酸,由各自以可表达的方式编码的核苷酸序列形成的多核苷酸等。在一种形态中,本发明的多核苷酸被用于使用基因重组技术使宿主内产生本发明的多肽。这种情况下,由于在宿主间氨基酸密码子的使用频率不同,因此可改变密码子来符合产生多肽的宿主的使用频率。本发明的多核苷酸可采用单链及双链中的任一种形态。本发明的多核苷酸为双链的情况下,通过将所述本发明的多核苷酸插入表达载体,能够制作用以表达本发明的多肽的重组表达载体。即,在本发明的多核苷酸的范畴内还包括将本发明的双链型多核苷酸插入表达载体所制成的重组表达载体。如本说明书中所记载,本发明的多核苷酸对癌症的预防和/或治疗等有用,能够作为医药组合物的有效成分。此外,本发明的多核苷酸亦可用于癌症的预防和/或治疗。另外,本发明还涉及本发明的多核苷酸在用于癌症的预防和/或治疗的医药的制造中的用途。本发明中使用的表达载体可根据使用的宿主和目的等采用各种载体,只要是本领域的技术人员都能够适当选择。作为本发明中可使用的表达载体,可例举例如质粒、噬菌体载体、病毒载体、柯斯粘粒(cosmid)载体、福斯粘粒(fosmid)载体、人工染色体载体(hac、yac、bac、pac)等。例如,宿主是大肠杆菌的情况下,作为载体,可例举puc118、puc119、pbr322、pcr3、pgata等质粒载体,λzapii、λgt11等噬菌体载体。宿主是酵母的情况下,作为载体,可例举pyes2、pyeura3、pyac4等。宿主是昆虫细胞的情况下,可例举pacsghisnt-a、piex、pbac等。宿主是动物细胞的情况下,可例举pcep4、pkcr、pcdm8、pgl2、pcdna3.1、prc/rsv、prc/cmv等质粒载体或逆转录病毒载体、腺病毒载体、腺相关病毒载体、牛痘载体、仙台病毒载体、慢病毒载体等病毒载体等。所述载体可适当具有可诱导表达的启动子、编码信号序列的基因、筛选用标记基因、终止子等元件。此外,为了使分离纯化变得容易,可添加作为与硫氧还原蛋白、组氨酸标签(his-tag)、或者gst(谷胱甘肽硫转移酶)等的融合蛋白进行表达的序列。这种情况下,能够使用具有在宿主细胞内发挥作用的适当的启动子(lac、tac、trc、trp、cmv、sv40早期启动子等)的gst融合蛋白载体(pgex4t等),或具有myc、his等标签序列的载体(pcdna3.1/myc-his等),又或表达与硫氧还原蛋白及组氨酸标签的融合蛋白的载体(pet32a)等。通过用上述所制成的表达载体对宿主进行转化,能够制作出含有该表达载体的转化细胞。作为在此使用的宿主,只要不损及本发明的多肽所具有的功能,可以使用任何细胞,可例举例如大肠杆菌、减毒沙门氏杆菌等细菌、酵母、昆虫细胞、动物细胞等。作为大肠杆菌,可例举e.colik-12品系的hb101株、c600株、jm109株、dh5α株、ad494(de3)株、bl21株等。此外,作为酵母,可例举酿酒酵母(saccharomycescerevisiae)等。作为动物细胞,可例举l929细胞、balb/c3t3细胞、c127细胞、cho细胞、cos细胞、vero细胞、hela细胞、293-ebna细胞等。作为昆虫细胞,可例举sf9、hi5、s2等。作为向宿主细胞导入表达载体的方法,使用适合所述宿主细胞的通常的导入方法即可。具体而言,可例举磷酸钙法、deae-葡聚糖法、电穿孔法、使用基因导入用脂质(lipofectamine,lipofectin;gibco-brl公司)的方法(脂质转染法)等。导入后,通过用包含筛选标记物的通常的培养基培养,能够筛选出所述表达载体被导入宿主细胞中的转化细胞。通过在适当的条件下持续培养如上所述获得的转化细胞,能够制造本发明的多肽。获得的多肽可通过一般的生化学纯化手段进一步进行分离、纯化。在此,作为纯化手段,可例举盐析、离子交换层析法、吸附层析法、亲和性层析法、凝胶过滤层析法等。此外,使本发明的多肽作为与上述的硫氧还原蛋白或组氨酸标签、gst等的融合蛋白表达的情况下,可通过利用这些融合蛋白或标签的性质的纯化法来进行分离、纯化。此外,使用减毒沙门氏杆菌等细菌作为宿主细胞的情况下,可将该细菌当作基因递送载体使用,即可将作为宿主细胞的细菌以直接递送到对象的体内的方式使用。编码本发明的多肽的多核苷酸可以是dna的形态,也可以是rna的形态。这些本发明的多核苷酸可基于本发明哦多肽的氨基酸序列信息及由其编码的dna的序列信息使用该
技术领域:
中周知的常用方法容易地制造。具体而言,能够通过通常的dna合成或采用pcr的扩增等来制造。编码本发明的多肽的多核苷酸包含编码所述表位肽的多核苷酸。(3)将本发明的多肽作为有效成分的ctl诱导剂如上所述,本发明的多肽能够在诱导针对癌细胞的ctl的方法中使用,因此可作为肿瘤抗原肽成为ctl诱导剂。即,通过从人血液试样分离出外周血淋巴细胞,在体外(invitro)添加本发明的多肽进行刺激,能够诱导特异性识别经该肽冲击(pulse)的hla抗原阳性细胞的ctl(j.immunol.,154,p2257,1995)。在此,ctl诱导的有无例如能够通过用例如elisa法等测定ctl与抗原肽提呈细胞反应而产生的各种细胞因子(例如ifnγ)的量来进行确认。此外,还能够通过测定ctl对用51cr标记了的抗原肽提呈细胞的毒性的方法(51cr释放试验,int.j.cancer,58:p317,1994)来进行确认。此外,通过int.j.cancer,39,390-396,1987,n.eng.j.med,333,1038-1044,1995等中记载的方法,也能够构建ctl克隆。通过本发明的多肽所诱导的ctl具有对将本发明的多肽作为抗原提呈的细胞的杀伤作用和淋巴因子的产生能力。由于本发明的多肽如上所述是肿瘤抗原肽,因此可通过这些机能发挥抗肿瘤作用,较佳为发挥抗癌作用。因此,本发明的多肽及由它所诱导的ctl能够作为用于癌症的预防和/或治疗的医药或医药组合物的有效成分。若将含有本发明的多肽作为有效成分的ctl诱导剂给予癌症患者,则本发明的多肽被抗原提呈细胞的hla抗原提呈,对hla抗原和被提呈的肽的结合复合体具特异性的ctl增殖而破坏癌细胞,因而能够预防和/或治疗癌症。因此,将本发明的多肽作为有效成分的ctl诱导剂较佳是能对hla-a02抗原、hla-a11抗原和/或hla-a24抗原阳性的对象使用。其中,更佳是能对罹患了表达同型异构体a或c、或者属于亚家族5或6的boris的癌症的对象,再更佳是能对罹患了borissf5和/或sf6阳性的癌症的对象使用。作为同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症,可例举例如子宫颈癌、卵巢癌、子宫癌、乳癌、大肠癌、肺癌、黑色素瘤等癌(肿瘤)等,本发明的ctl诱导剂能够用于这些癌症的预防和/或治疗。特别是能够较佳地用于子宫颈癌、卵巢癌、子宫癌等女性特有脏器中的癌症、以及肺癌的预防和/或治疗。在此,癌症的“预防”不仅是预防患者罹患癌症的预防,还包括预防已通过手术切除原发灶的肿瘤的患者的复发,防止通过手术、放射线疗法或药物疗法等癌症治疗未能完全去除的肿瘤的转移等。此外,癌症的“治疗”不仅是使癌缩小的癌症的治愈、症状改善,还包括抑制癌细胞的增殖、肿瘤的扩大或源自原发灶的癌细胞转移的进展防止等。将本发明的多肽作为有效成分之ctl诱导剂对于罹患了同型异构体a或c、或者属于亚家族5或6的boris阳性,较佳为borissf5和/或sf6阳性的癌症的hla-a02、hla-a11或hla-a24阳性的癌症患者特别有效。具体而言,能够用于例如子宫颈癌、卵巢癌、子宫癌、乳癌、大肠癌、肺癌、黑色素瘤等癌(肿瘤)的预防或治疗。特别是能够较佳地用于子宫颈癌、卵巢癌、子宫癌等女性特有的脏器中的癌症的预防和/或治疗。作为将本发明的多肽作为有效成分的ctl诱导剂的剂型,并没有特别限定,但可例举油乳化液(乳液制剂)、高分子纳米粒子、脂质体制剂、结合于直径数μm的珠粒的粒子状制剂、使脂质结合的制剂、微球制剂、微胶囊制剂等。将本发明的多肽作为有效成分的ctl诱导剂可为了使细胞性免疫有效地实现而与作为医药被容许的载体(carrier)、例如适当的佐剂混合给药,或者并用给药。作为佐剂,可适用该
技术领域:
中已知的佐剂,具体而言,例如,作为凝胶型,可例举氢氧化铝、磷酸铝及磷酸钙等;作为菌体型,可例举cpg、单磷酰脂质a(monophosphoryllipida;mpl)、霍乱毒素、大肠杆菌不耐热肠毒素、百日咳毒素及胞壁酰二肽(muramyldipeptide;mdp)等;作为油乳浊液型(乳液制剂),可例举弗氏不完全佐剂、mf59及saf等;作为高分子纳米粒子型,可例举免疫刺激复合物(immunostimulatorycomplex;iscoms)、脂质体、生物降解性微球(biodegradablemicrosphere)及源自皂素的qs-21等;作为合成型,可例举非离子性嵌段共聚物、胞壁酰肽类似物(muramylpeptideanalogue)、聚磷腈及合成多核苷酸等;作为细胞因子型,可例举ifn-α、ifn-β、ifnγ、il-2及il-12等。作为给药方法,可例举皮内给药、皮下给药、肌肉内给药、静脉内给药等已知的任意的给药方法。制剂中的本发明的多肽的给药量可依照治疗目的的疾病、患者的年龄、体重等来适当调整,但通常为0.0001mg~1000mg,较佳为0.001mg~1000mg,更佳为0.1mg~10mg,以此给药量在数日至数月内给药1次为佳。如上所述,通过使用含有本发明的多肽作为有效成分的ctl诱导剂,可有效地处置同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症。因此,一种形态中,本发明包括含有该ctl诱导剂作为有效成分的医药组合物,较佳为癌干细胞处置用组合物,或者癌症的预防和/或治疗用组合物。(4)将本发明的多核苷酸作为有效成分的ctl诱导剂使本发明的聚核苷酸表达的细胞成为将本发明的多肽作为抗原提呈的细胞,因此具有通过t细胞受体而被t细胞识别的特征。因此,本发明的多核苷酸也可成为ctl的诱导剂。被诱导的ctl与通过本发明的多肽而诱导的ctl同样,能通过细胞毒作用或淋巴因子的产生来发挥抗肿瘤作用,较佳为抗癌作用。因此,本发明的多核苷酸能够作为用于癌症的治疗或预防的医药或医药组合物的有效成分。含有本发明的多核苷酸作为有效成分的ctl诱导剂例如可通过将本发明的多核苷酸给予癌症患者并使之表达来治疗和/或预防癌症。例如,若通过以下的方法将整合进表达载体中的本发明的多核苷酸给予癌症患者,在抗原提呈细胞内肿瘤抗原肽大量表达。然后,生成的肿瘤抗原肽与hla-a02抗原、hla-a11抗原或hla-a24抗原等结合而形成复合体,该复合体被高密度地提呈于抗原提呈细胞表面,从而使癌特异性ctl在体内高效地增殖,破坏癌细胞。如上所述,可实现癌症的治疗或预防。将本发明的多核苷酸作为有效成分的ctl诱导剂较佳为能够对hla-a02抗原、hla-a11抗原和/或hla-a24抗原阳性的对象使用。其中,更佳为能够对罹患表达出同型异构体a或c、或者属于亚家族5或6的boris的癌症的对象使用,再更佳为能够对罹患borissf5和/或sf6阳性的癌症的对象使用。作为同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症,可例举例如子宫颈癌、卵巢癌、子宫癌、乳癌、大肠癌、肺癌、黑色素瘤等癌(肿瘤)等,本发明的ctl诱导剂能够用于这些癌症的预防或治疗。特别是能够用于子宫颈癌、卵巢癌、子宫癌等女性特有的脏器中的癌症,以及肺癌的预防和/或治疗。作为采用病毒载体的方法,可例举例如在逆转录病毒、腺病毒、腺相关病毒、疱疹病毒、牛痘病毒、仙台病毒、慢病毒、痘病毒、小儿麻痹病毒、辛德毕斯病毒(sindbisvirus)等dna病毒或rna病毒中整合本发明的dna并导入的方法。其中,特佳为使用逆转录病毒、腺病毒、腺相关病毒、牛痘病毒等的方法。作为其他方法,可例举将表达质粒直接给予至肌肉内的方法(dna疫苗法)、脂质体法、阳离子脂质体(lipofectin)法、显微注射法、磷酸钙法、电穿孔法等,特佳为dna疫苗法、脂质体法。此外,还能够使用下述细菌载体法:将表达质粒导入到经减毒的沙门氏杆菌等细菌中,给予该细菌使本发明的多肽表达。给予本发明的多核苷酸时,可适当选择符合治疗目的的疾病、症状等的适当的给药途径及给药形态来进行给药。例如,能够以可注射到静脉、动脉、皮下、皮内、肌肉内等的形态给药。给药时,可采用例如液剂等制剂形态,但一般被制成含有作为有效成分的本发明的多核苷酸的注射剂等,可根据需要添加医药上可容许的载体。此外,对于含有本发明的多核苷酸的脂质体或膜融合脂质体(仙台病毒(hvj)-脂质体等),能够采用悬浮剂、冷冻剂、离心分离浓缩冷冻剂等脂质体制剂的形态。制剂中的本发明的多核苷酸的含量可依照治疗目的的疾病、患者的年龄、体重等来适当调整,但可例如以多核苷酸的含量计,0.0001mg~100mg、较佳为0.001mg~10mg的本发明的多核苷酸在数日至数月内给药1次。只要是本领域的技术人员,就能适当选择出合适的细胞、载体、给药方法、给药形态及给药量。(5)本发明的抗原提呈细胞上述的本发明的多肽或多核苷酸在癌症患者的治疗中例如能够如下所述在体外(invitro)使用。即,通过使本发明的多肽或多核苷酸中的任一种与具有抗原提呈能力的细胞进行接触,能够制成抗原提呈细胞。抗原提呈细胞的制作可在体外(invitro)进行,也可在活体内(invivo)进行,但较佳为在体外(invitro)进行。具体而言,本发明提供一种抗原提呈细胞及其制造方法,该抗原提呈细胞是使源自癌症患者的经分离的具有抗原提呈能力的细胞与本发明的多肽或多核苷酸中的任一种接触,较佳为在体外(invitro)进行接触,从而在该细胞的细胞表面提呈例如hla-a02抗原或hla-a11抗原、hla-a24抗原等与本发明的多肽的复合体的细胞。本发明的抗原提呈细胞例如包括(1)在适当的培养液中,将抗原提呈细胞与ctl表位肽混合30分钟到1小时而成的表位肽冲击抗原提呈细胞;(2)使用编码ctl表位肽的核酸,利用基因导入等使抗原提呈细胞提呈ctl表位肽的细胞;(3)人工制作而成的具有抗原提呈能力的人工抗原提呈细胞等。在此,“具有抗原提呈能力的细胞”只要是在细胞表面表达能提呈本发明的多肽的mhc,较佳为hla-a02抗原、hla-a11抗原和/或hla-a24抗原即可,没有特别限定,但其中较佳为专职抗原提呈细胞,特别是被认为抗原提呈能力高的树状细胞更佳。人工制作而成的具有抗原提呈能力的人工抗原提呈细胞能通过下述方法来制作:例如在脂质双层膜或者塑料或胶乳等的珠粒上固定hla、ctl表位肽和β2-微球蛋白这3者的复合体,并固定能刺激ctl的cd80、cd83或cd86等共刺激分子,或者是固定对作为与共刺激分子结合的t细胞侧的配体的cd28具有竞争性作用的抗体等。此外,作为为了由所述具有抗原提呈能力的细胞制备本发明的抗原提呈细胞而添加的物质,可以是本发明的多肽或多核苷酸中的任一种。本发明的抗原提呈细胞例如可如下获得:从癌症患者分离具有抗原提呈能力的细胞,用本发明的多肽对该细胞在体外(invitro)进行冲击,使hla-a02抗原、hla-a11抗原和/或hla-a24抗原与本发明的多肽的复合体提呈。使用树状细胞的情况下,例如可如下制备本发明的抗原提呈细胞:从癌症患者的外周血通过聚蔗糖(ficoll)法分离淋巴细胞,然后除去非粘附细胞,将粘附细胞在gm-csf及il-4的存在下进行培养来诱导树状细胞,将该树状细胞和本发明的多肽一起培养来进行冲击等。此外,通过将本发明的多核苷酸导入至所述具有抗原提呈能力的细胞中来制备本发明的抗原提呈细胞的情况下,该多核苷酸可以是dna的形态,也可以是rna的形态。导入多核苷酸来制成抗原提呈细胞的方法是在该
技术领域:
中已知,本领域的技术人员能够适当选择。所述抗原提呈细胞能够作为ctl诱导剂的有效成分。为了稳定地维持抗原提呈细胞,含有该抗原提呈细胞作为有效成分的ctl诱导剂较佳为包含生理盐水、磷酸缓冲生理盐水(pbs)、培养基等。作为给药方法,可例举静脉内给药、皮下给药、皮内给药等。通过将这样的含有抗原提呈细胞作为有效成分而成的ctl诱导剂送回至患者体内,在罹患同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症的患者体内,对于抗原提呈本发明的多肽的癌细胞具特异性的ctl被高效地诱导,其结果是能够治疗抗原提呈本发明的多肽的同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症。(6)本发明的细胞毒性t细胞(ctl)本发明的多肽及多核苷酸在癌症患者的治疗中能够如下进行应用。即,通过使本发明的多肽及多核苷酸中的任一种与外周血淋巴细胞接触,能够诱导ctl,特别是诱导特异性识别表达同型异构体a或c、或者属于亚家族5或6的boris基因的细胞的ctl。即,本发明提供一种ctl及其诱导方法,该ctl是通过使源自癌症患者的外周血淋巴细胞与本发明的多肽或多核苷酸中的任一种进行接触而诱导。所述方法可以在体外(invitro)进行,也可在活体内(invivo)进行,但较佳为在体外(invitro)进行。作为诱导本发明的ctl的方法,具体可例举例如以下的方法。首先,用本发明的多肽直接刺激pbmc(外围血单个核细胞;peripheralbloodmononuclearcell)或t细胞,或者用经该肽冲击过的抗原提呈细胞、经基因导入的抗原提呈细胞、或人工制作而成的具有抗原提呈能力的人工抗原提呈细胞进行刺激。将通过刺激而诱导的ctl在5%co2恒温槽内于37℃培养7~10天。通过每周重复1次采用ctl表位肽和il-2,或抗原提呈细胞和il-2的刺激确保所需细胞数的ctl。例如对于黑色素瘤,将患者本人的肿瘤内浸润t细胞在体外进行大量培养并将其送回给患者的过继免疫治疗法被确认具有治疗效果。此外,对于小鼠的黑色素瘤,通过将脾细胞在体外(invitro)用肿瘤抗原肽trp-2进行刺激,使对肿瘤抗原肽具特异性的ctl增殖,将该ctl给予黑色素瘤移植小鼠,确认到转移抑制。这基于使特异性识别抗原提呈细胞的mhc与肿瘤抗原肽的复合体的ctl在体外(invitro)增殖的结果。因此,使用本发明的多肽或多核苷酸在体外(invitro)刺激患者外周血淋巴细胞来增加肿瘤特异性ctl后,将该ctl送回给患者的治疗法被认为是有用的。该ctl能够作为癌症的治疗剂或预防剂的有效成分。为了稳定地维持ctl,该治疗剂或预防剂较佳为包含生理盐水、磷酸缓冲生理盐水(pbs)、培养基等。作为给药方法,可例举静脉内给药、皮下给药、皮内给药等。通过将这样的含有ctl作为有效成分而成的癌症的治疗或预防剂送回至患者的体内,在罹患本发明的同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症的患者体内由ctl产生的癌细胞的杀伤作用得到促进,破坏癌细胞,从而能够治疗癌症。(7)本发明的hla-多聚体hla-四聚体是指通过将使hla和β2微球蛋白与肽(抗原肽)集合而成的复合体(hla-单体)生物素化,使之与亲和素结合而四聚体化得到的产物(science279:2103-2106(1998)、science274:94-96(1996)),记载于例如美国专利第5,635,363号、法国专利申请公开第fr9911133号、美国专利第5,723,584号、美国专利第5,874,239号、美国专利第5,932,433号、美国专利第6,265,552号、日本专利登记第4976294号等。现在,含有各种抗原肽的hla-四聚体已被制作出来,可容易地制作含有本发明的多肽与hla-a02、hla-a11或hla-a24的hla-四聚体。此外,hla-二聚体及hla-五聚体也基于相同的原理,这些多聚体中,所述hla单体分别被二聚体化及五聚体化。因此,含有本发明的多肽、即同型异构体a或c、或者属于亚家族5或6的boris的具有hla结合能力、尤其是具有hla-i类结合能力的部分肽与hla-a02、hla-a11或hla-a24的hla单体及hla多聚体、特别是hla-四聚体也是本发明的一种形态。具体而言,可例举例如含有本发明的多肽与hla-a02、hla-a11或hla-a24的hla-四聚体。该hla-四聚体较佳为经荧光标记,使得可以容易地通过流式细胞仪、荧光显微镜等已知的检测手段筛选或检测出结合的ctl。具体而言,可例举例如通过藻红素(pe)、异硫氰酸荧光素(fitc)、多甲藻黄素-叶绿素-蛋白质(percp)等标记的hla-四聚体。作为hla-四聚体的制法例,可例举例如记载于美国专利编号5,635,363号、法国专利申请编号fr9911133号、science279:2103-2106(1998)、science274:94-96(1996)等文献的制法,只要是本领域的技术人员都能够选出适当的方法。作为制作例,简单叙述如下。首先,向可表达蛋白质的大肠杆菌或哺乳动物细胞中导入hla-a24、hla-a11或hla-a02的表达载体及β2微球蛋白表达载体并使其表达。在此,较佳为使用大肠杆菌(例如bl21)。将获得的单体hla-a24、hla-a11或hla-a02复合体与本发明的多肽进行混合,形成可溶性的hla-肽复合体。其次,通过bira酶将hla-肽复合体中的hla-a02、hla-a11或hla-a24的c端部位的序列进行生物素化。通过将该经生物素化的hla-肽复合体与经荧光标记的亲和素以4:1的摩尔比进行混合,能够制备hla-四聚体。另外,在所述各步骤中,较佳为进行采用凝胶过滤等的蛋白质纯化。通过使用本发明的hla-四聚体(或单体),可以检测、纯化本发明的肿瘤特异性ctl。作为生成ctl的方法,可例举例如以下的方法。(i)使pbmc与适当浓度的本发明的hla-四聚体进行反应。与本发明的hla-四聚体结合的ctl被用标记染料染色,所以使用细胞分选仪、显微镜等仅把被染色的ctl分离出来。这样被分离的ctl用通过抗cd3抗体、pha、il-2等t细胞刺激药剂、或者x射线照射或丝裂霉素处理等使其损失了增殖能力的抗原提呈细胞进行刺激增殖,确保必要的细胞数。(ii)将本发明的hla-单体和/或四聚体固相化于无菌板等,将pbmc用固相化板进行培养。为了分离被固相化在板上的与本发明的hla-单体和/或四聚体结合的ctl,冲走未结合而浮游的其他细胞后,仅将残留在板上的特异性ctl悬浮在新培养基中。这样分离的ctl通过用抗cd3抗体、pha、il-2等t细胞刺激药剂、或者x射线照射或丝裂霉素处理等使其损失了增殖能力的抗原提呈细胞进行刺激增殖,确保必要的细胞数。(iii)将本发明的hla-单体和/或四聚体和cd80、cd83、cd86等共刺激分子或对作为与共刺激分子结合的t细胞侧的配体的cd28具竞争性作用的抗体固相化于无菌板等,将pbmc用固相化板进行培养。2天后将il-2添加至培养基,在5%co2恒温槽内于37℃培养7~10天。回收经培养的细胞继续在新的固相化板上培养。通过重复此操作来确保必要的细胞数的ctl。此外,通过与针对细胞表面蛋白的抗体(cd62l、ccr7或cd45ra等)组合使用,能够调查出ctl的分化阶段(sederra,ahmedr.,natimmunol.,2003;4:835-842)。或者,通过与细胞内细胞因子染色法组合,也能用于ctl的功能性评价。因此,只要鉴定ctl表位肽并制作出hla-四聚体,就能对于该表位肽进行被诱导的ctl的定量和定性,在获得对于该表位肽的源头蛋白质相关的疾病的诊断信息方面能有巨大的贡献。(8)肿瘤的检测方法(检查方法、诊断方法)本发明还提供利用所述的本发明的hla-四聚体的肿瘤的检测方法(检查方法、诊断方法)。使用本发明的hla-四聚体的本发明的检测方法(诊断方法)典型的是通过采集受试者的血液,或藉由活体组织检查等采集被怀疑是肿瘤的受试组织的一部分,利用本发明的hla-四聚体检测、测定其中所含的识别源自同型异构体a或c、或者属于亚家族5或6的boris的肿瘤抗原肽与hla抗原的复合体的ctl的量,从而检测、检查或诊断是否罹患子宫颈癌、卵巢癌、子宫癌、乳癌、大肠癌、肺癌、黑色素瘤等同型异构体a或c、或者属于亚家族5或6的boris阳性的癌(肿瘤)或其程度。特别是能够检测、检查或诊断是否罹患子宫颈癌、卵巢癌、子宫癌等女性特有的脏器中的癌症或肺癌或者其程度。使用本发明的hla-四聚体,能够对于对从对象采集的活体试样中的boris、尤其是同型异构体a或c、或者属于亚家族5或6的boris具特异性的ctl进行定量。定量例如能够如下所述实施。使从对象采集的外周血或者pbmc与适当浓度的hla-四聚体进行反应。与hla-四聚体结合的ctl被通过标记染料染色,所以使用流式细胞仪、显微镜等进行计数。在与hla-四聚体试剂进行反应时,通过使被用与hla-四聚体试剂不同的染料进行了标记的抗cd3抗体、抗cd4抗体、抗cd8抗体等进行反应,还能够同时判定boris特异性ctl的t细胞亚群。本发明的检测(检查、诊断)方法还能够例如对于患有肿瘤的患者检测(检查、诊断)为了改善该肿瘤而给予治疗药的情况下的该肿瘤是否有改善或其改善程度。另外,本发明的检测(检查、诊断)方法还能够用于可有效地适用将本发明的多肽或多核苷酸作为有效成分的医药的癌症患者的选择,或者用于基于该医药的治疗效果的预测和判定等。使用本发明的hla-四聚体的本发明的检测(检查)方法的特定形态是包括下述(a)和(b)、以及任选的(c)的工序:(a)使从受试者获得的活体试样与本发明的hla-四聚体进行接触的工序;(b)将上述hla-四聚体所结合的细胞的量作为指标来测定识别源自该生物体试样中的borissf5或sf6的肿瘤抗原肽与hla抗原的复合体的ctl的量的工序;(c)基于(b)的结果,判断癌症的罹患的工序。使用本发明的hla-四聚体的本发明的诊断方法的特定形态包括上述(a)、(b)及(c)的步骤。使用本发明的hla-四聚体的本发明的检测方法(检查方法、诊断方法)的一种形态是通过检测活体试样中的本发明多肽特异性ctl,并测定其量来实施。例如,能够通过制作本发明的hla-四聚体,使用该hla-四聚体以流式细胞仪对被怀疑罹癌症的患者的外周血淋巴细胞中的抗原肽特异性ctl定量来进行。肿瘤的有无的预测、判定、判断或诊断例如能够通过测定受试者的血液或被怀疑是肿瘤的受试组织中的本发明的多肽特异性ctl的量,或者测定提呈本发明的多肽的细胞的量来进行。此时,能够通过根据情况将正常的对应组织中的boris基因或者同型异构体a或c、或者属于亚家族5或6的boris的mrna表达水平、本发明的多肽水平或ctl水平等作为基准值,将该基准值与从受试者获得的试样中的所述水平进行比较,判定两者的差异来进行。在此,受试者的受试组织与正常的对应组织的所述水平的比较能够通过并行进行以受试者的活体试样与正常人的活体试样为对象的测定来实施。在非并行进行的情况下,可将使用多个(至少2个,较佳为3个以上,更佳为5个以上)的正常组织以同等的测定条件进行测定而获得的本发明的多肽特异性ctl的量的平均值或统计中间值作为正常人的值、即基准值,用于比较。此外,对于被给予了本发明的多肽或多核苷酸的受试者,通过测定本发明的多肽特异性ctl的量,还能判定实际上ctl是否有被诱导出来。例如,该受试者的组织中的本发明的多肽特异性ctl的量与正常人的这些水平相比例如多2倍以上、较佳为多3倍以上作为指标,能够判定采用本发明的多肽或多核苷酸的治疗是有效的。(9)癌症的预防和/或治疗方法本发明还涉及一种预防和/或治疗对象的癌症的方法,该方法包括将选自本发明的多肽、多核苷酸、ctl、抗原提呈细胞的有效成分的有效量给予需要该有效成分的对象的工序。本发明中的“对象”是指任意的生物个体,较佳为动物,更佳为哺乳动物,再更佳为人类的个体。本发明中,对象可以是健康的,也可以罹患了某种疾病,但试图进行癌症的预防和/或治疗的情况下,典型的是指罹患了癌症或者有罹患的风险的对象。本发明的一种形态中,对象是hla-a02阳性、hla-a11阳性和/或hla-a24阳性。本发明的一种形态中,对象是罹患了同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症,或者有罹患的风险。本发明的一种形态中,对象是hla-a02阳性、hla-a11和/或hla-a24阳性,且罹患了同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症,或者有罹患的风险。作为用于本发明的预防/治疗方法的本发明的多肽、多核苷酸、ctl及抗原提呈细胞,可例举本说明书所记载的任意的例子。本发明中的有效量是指例如减轻癌的症状、或者延缓或停止其恶化发展的量,较佳为抑制或治愈癌症的量。此外,较佳为不会产生超过给药而得到的益处的不良影响的量。所述量可通过使用培养细胞等的体外(invitro)试验,或小鼠、大鼠等模型动物中的试验来适当决定,这样的试验法为本领域的技术人员所熟知。有效成分的具体用量可考虑到关于需要该有效成分的对象的各种条件,例如症状的严重程度、对象的一般健康状态、年龄、体重、对象的性别、进食、给药的时机及频率、并用的医药、对治疗的反应性、剂型、及对治疗的顺应性等来决定。作为具体用量,例如本发明的多肽的情况下,通常为0.0001mg~1000mg,较佳为0.001mg~1000mg,更佳为0.1mg~10mg,将此多肽在数日到数月内给予1次为佳。此外,本发明的多核苷酸的情况下,通常为0.0001mg~100mg,较佳为0.001mg~10mg,将此多核苷酸在数日到数月内给予1次为佳。此外,作为给药方法,可使用皮内给药、皮下给药、肌肉内给药、静脉内给药等已知的任意的适当给药方法。本发明的预防/治疗方法的一种形态是在给药的工序之前,还包括选择hla-a02阳性、hla-a11阳性和/或hla-a24阳性的对象作为预防/治疗的对象的工序。本发明的此形态可在上述进行选择的工序之前,还包括确定对象的hla型的工序。对象的hla型的确定可通过已知的任意的方法来进行。此外,本发明的预防/治疗方法的一种形态在给药的工序之前,还包括选择患具有同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症的对象作为预防/治疗的对象的工序。本发明的此形态也可在上述进行选择的工序之前,还包括检测对象中的同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症的工序。对象中的同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症的检测可使用上述(8)所记载的肿瘤的检测方法。本发明的预防/治疗方法的一种形态在给药的工序之前,还包括选择是hla-a02阳性、hla-a11阳性和/或hla-a24阳性,且患有同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症的对象作为预防/治疗的对象的工序。本发明的此形态也可在上述进行选择的工序之前,还包括确定对象的hla型的工序及检测对象中的同型异构体a或c、或者属于亚家族5或6的boris阳性的癌症的工序。本说明书中所提及的所有专利、申请及其他出版物通过参照其整体而引用于本说明书中。(10)本发明的抗体本发明还提供一种抗体,该抗体与同型异构体a或c、或者属于亚家族5或6的boris的至少一部分特异性结合,较佳为与以序列编号1、序列编号2或序列编号76表示的多肽的至少一部分特异性结合,更佳为与以序列编号1或序列编号2表示的多肽的至少一部分特异性结合。因此,本发明的抗体较佳为能够特异性识别属于亚家族5或6的boris。抗体,可以是多克隆抗体,也可以是单克隆抗体,但较佳为单克隆抗体。此外,本发明的抗体还包括fab、fab’、f(ab’)2、fv、scfv、dsfv、diabody及sc(fv)2等抗体的功能性片段。此外,这些功能性片段的多聚体(例如,二聚体、三聚体、四聚体、聚合体)也包含在本发明的抗体中。关于本发明的抗体的制造,可依照该
技术领域:
中已知的方法来进行。例如,可将以序列编号1或2表示的多肽的全部或一部分作为免疫原对兔子等进行免疫,从其血清进行纯化来获得抗体。本发明的抗体是能对同型异构体a或c、或者属于亚家族5或6的boris进行特异性结合的抗体,可检测表达同型异构体a或c、或者属于亚家族5或6的boris的细胞,或检测同型异构体a或c、或者属于亚家族5或6的boris本身。因此,在本发明的一种形态中,提供包含本发明的抗体的boris蛋白质的检测用试剂盒和/或纯化用试剂盒。本发明的试剂盒只要包含本发明的抗体即可,没有特别限制,包括该
技术领域:
中已知的所有试剂盒,可例举例如用于elisa法、蛋白质印迹法、层析法、免疫染色法等的试剂盒,但并不限定于此。除了本发明的抗体以外,本发明的试剂盒可还包含1个或2个以上的适合于试剂盒用途的任意的构成部件,作为该构成部件,可例举例如可经标记或未经标记的二次抗体、显色试剂、溶剂、缓冲液、阳性对照、阴性对照、反应容器、预处理试剂、封闭试剂、载玻片、盖玻片、针对各用途的使用说明书等,但并不限定于此。(10)其他本发明是基于在子宫颈癌或卵巢癌中具有干细胞性的性质的细胞中boris蛋白质、特别是borissf5和/或sf6高表达这一知识的发明。因此,基于该知识的各种技术包含在本发明中。一种形态中,本发明是特异性识别borissf5或sf6的抗体。该抗体可按照将具有序列编号1或2所记载的氨基酸序列的多肽或其一部分作为表位识别的方式,使用该
技术领域:
中已知的方法来制作。通过使用该抗体,能检测例如特定的组织和/或细胞中的borissf5和/或sf6的表达量,藉此能判定组织或对象中的癌干细胞或肿瘤是否存在。此外,可通过使用该抗体抑制影响癌干细胞的干细胞性的borissf5和/或sf6的功能,处置癌干细胞,或进行癌症的预防和/或治疗。此外,本发明的另一种形态中,涉及具有与boris基因互补的序列的多核苷酸。如上所述,boris基因、尤其是其特定的亚家族被认为在癌干细胞中特别强力地表达,对干细胞性产生影响。因此,认为通过妨碍boris基因的表达,能够抑制癌干细胞中的干细胞性。因此,一种较佳的形态中,本发明的多核苷酸可作为抑制性核酸、尤其是作为sirna使用。此外,本发明的多核苷酸还能够作为用于检测试样中borissf5和/或sf6的dna或mrna的引物或探针使用。本发明的又另一种形态中,涉及一种癌干细胞的检测方法,其包括检测从对象获得的试样中的borissf5和/或sf6的mrna和/或多肽的水平;以及将正常组织和/或细胞中的borissf5和/或sf6的mrna和/或多肽的水平作为基准值,并将所述检测得到的水平与所述基准进行比较。作为检测mrna和/或多肽的水平的方法,可使用该
技术领域:
中已知的方法。作为检测mrna的水平的方法,可例举例如rt-pcr、dna微阵列、rna印迹等。在该检测mrna的水平的方法中,可使用上述borissf5和/或sf6的引物和/或探针。作为检测多肽的水平的方法,可例举例如免疫组织染色、蛋白质印迹等。在该检测多肽的水平的方法中,可使用上述borissf5和/或sf6的特异性抗体。另一种形态中,本发明涉及一种对象中的肿瘤的检测方法,其包括检测从对象获得的试样中的borissf5和/或sf6的mrna和/或多肽的水平;以及将正常组织和/或细胞中的borissf5和/或sf6的mrna和/或多肽的水平作为基准值,并将所述检测得到的水平与所述基准进行比较。作为检测mrna和/或多肽的水平的方法,可使用该
技术领域:
中已知的方法。作为检测mrna的水平的方法,可例举例如rt-pcr、dna微阵列、rna印迹等。在该检测mrna的水平的方法中,可使用上述borissf5和/或sf6的引物和/或探针。作为检测多肽的水平的方法,可例举例如免疫组织染色、蛋白质印迹等。在该检测多肽的水平的方法中,可使用上述borissf5和/或sf6的特异性抗体。在本发明中,本形态的肿瘤的检测方法可替代上述(8)之方法来进行。因此,可用于例如上述(9)中的癌症的检测工序。本发明的又另一种形态中,涉及一种用于处置女性特有的脏器中的与癌干细胞相关的癌症的医药组合物,其包含boris蛋白质或其同型异构体的部分肽。boris在癌-睾丸抗原中,特别是睾丸以外的组织中的表达少,另一方面,本发明人等发现在子宫颈癌、卵巢癌、子宫癌等女性特有的脏器中的癌症,特别是包含具有干细胞性的细胞的癌症中boris强力表达。因此,在女性特有的脏器中的癌症的处置中,期待发挥低副作用和高特异性等特别优异的效果。实施例以下,示出实施例,具体地说明本发明,但本发明并不限定于这些实施例。除非另有说明,实验法是使用例如《免疫实验操作法》、编辑:右田俊介、绀田进、本庶佑、滨冈利之中所记载的方法等该
技术领域:
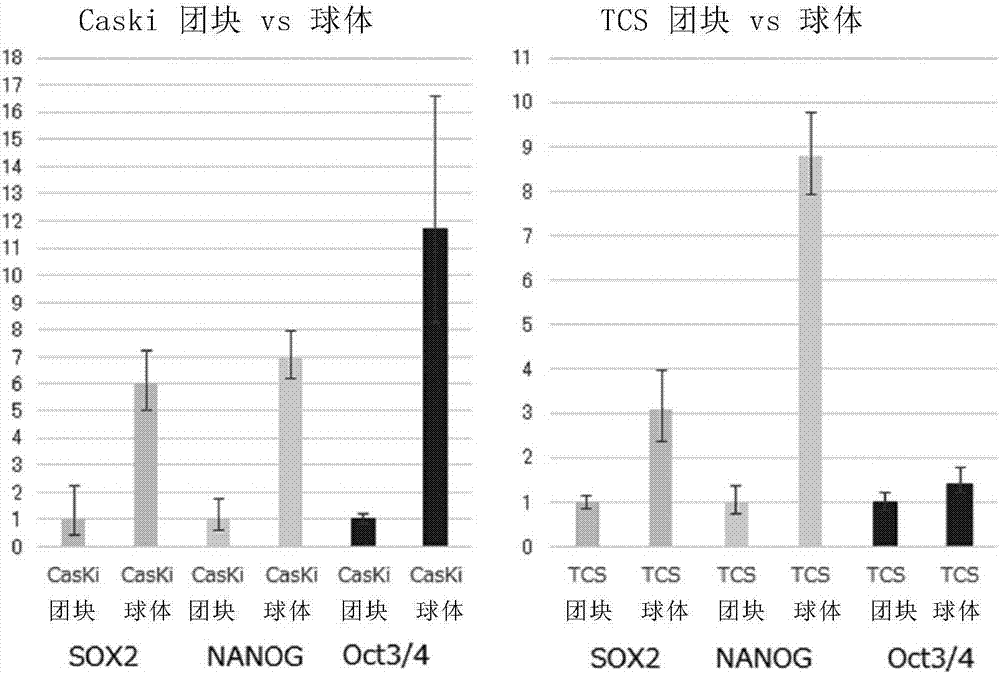
中常用的方法。此外,以下的实施例中使用的boris的同型异构体及亚家族示于以下的表中。除非另外特别记载,记载同型异构体名的情况表示特定的同型异构体,记载亚家族名的情况表示属于亚家族的同型异构体的任一种,简单记作“boris”的情况表示没有特别指定同型异构体或亚家族的一般的boris基因的表达产物、或borisb0同型异构体。此外,以下的实施例中,“肽名-tet”表示与以肽名表示的肽结合的hla四聚体。[表1]表1:boris同型异构体的登录号一览例1.癌干细胞的分离、鉴定(1)球体形成细胞的分离对于子宫颈癌,作为癌干细胞标记物的指针之一,报道有球体形成。于是,进行了使用低粘附性培养皿的球体形成试验。使用具有超低粘附性表面的多孔板(超低粘附性6孔板(ultralowattachment6-wellplate),康宁公司制造)培养了各子宫颈癌细胞株(caski、tcs、ms751、skg-iiib、me-180及siha)。对于细胞,将经粘附培养的细胞使用2mm的edta中添加0.25%的胰蛋白酶的溶液进行剥离,在各孔中以103个/孔接种。作为培养基,使用在无血清dmem/f-12培养基中添加20ng/ml的h-egf(从r&d系统公司(r&dsystems)获得)、10ng/ml的b-fgf(从r&d系统公司获得)、1%的青霉素/链霉素(从吉伯科公司(gibco)获得)、4μg/ml的肝素、及最终浓度1%的n2补充剂(n2supplement)(从和光纯药工业株式会社(wako)获得)的培养基,以通常的培养条件培养7天或14天,在全部的细胞株中确认到100μm以上的球体的形成(图1)。在以下的试验中,以“球体(sphere)”表示的细胞群是指自通过与本试验同样的非粘附培养所形成的球体分离的细胞群。此外,以“团块(bulk)”表示的细胞群是指通过通常的粘附培养获得的细胞群。(2)球体形成细胞的性质为了确认球体形成细胞是显示出类似干细胞的性质的细胞,进行了放射线耐受性试验、抗癌剂耐受性试验、流式细胞分析,确认球体群与团块群相比是更显示出类似干细胞的性质的群。(3)干细胞性基因的表达分析作为干细胞性基因,使用sox2、nanog及oct3/4,针对caski和tcs细胞株的团块群及球体群中的所述各基因的表达量,通过定量rt-pcr分别进行了分析。pcr仪器使用steponerealtimepcrsystem(应用生物系统公司(appliedbiosystems)制),基因的表达以阈值循环数(thresholdcyclenumber;ct)检测,通过δδct法对将团块群中的干细胞性基因的表达设为1时的相对表达量进行了定量。sox2、nanog、oct3/4的引物-探针混合物使用了taqmangeneexpression(应用生物系统公司)。结果示于图2。可知不管是在哪一个细胞株中,球体群的细胞中干细胞性基因都高表达。这提示球体群里显示出类似干细胞的性质的癌细胞被浓缩。使用特别显著地表达干细胞性基因的caski细胞株,进行了下述cdna微阵列分析。(4)cdna微阵列为了针对与团块群相比在球体群中高度表达的基因进行分析,进行了cdna微阵列分析。首先,使用市售的氨烯丙基(aminoallyl)rna扩增试剂盒ver2(高收率型)(西格玛奥德里奇公司(sigmaaldrich)),依照试剂盒中附属的说明书,从各细胞提取总rna。将获得的总rna3μg使用市售的低聚dtt7启动子引物及逆转录酵素进行逆转录,合成了cdna。其次,使用t7rna聚合酶合成crna,同时引入了cy3或cy5标记三磷酸胞苷。通过此操作,用cy5标记了球体群细胞的样品。将团块群细胞的样品作为对照细胞并用cy3进行了标记。再次使用nanodrop(赛默飞世尔科技公司(thermoscientific))确认了crna的品质。然后,将cy3标记crna及cy5标记crna组合,在杂交混合物(hybridizationcocktail)(sigmaaldrich)中进行片段化。使经标记化的crna杂交到60mer探针寡核苷酸微阵列(panoramahumanmicroarray,sigmaaldrich)中,在50℃孵育20小时。使用genepix4000b微阵列扫描仪(阿克松设备公司(axoninstruments))来确定荧光强度。通过相同的方法,用cy3标记球体群细胞的样品,用cy5标记团块群细胞的样品,再次进行实验(染料交叉重复(dyeswap)法)。(5)癌干细胞特异性抗原候选蛋白质的选定在上述cdna微阵列的结果中,将癌-睾丸抗原(ct抗原)作为对象,确认了球体群中的表达。结果显示于下表。[表2]表2:在球状体细胞高表达的癌-睾丸抗原基因作为球体群中特异性表达的ct抗原,鉴定到了boris。因此,提示boris是能成为针对癌干细胞的有效的治疗靶标。例2.作为针对癌干细胞的治疗靶标的boris的评价(1)正常组织中的boris的表达分析作为正常组织的cdna库,使用了人多组织cdna样本i和2(humanmultipletissuecdnapanelsiandii)(克隆泰克公司(clontech社))。pcr是将包含0.1~0.5μl的cdna、0.1μl的taqdna聚合酶(凯杰公司(qiagen社))及12pmol的引物的cdna混合物,首先于94℃进行2分钟的加温后,接着进行30~40次循环,该循环是于94℃进行15秒的解离,于60℃进行30秒的退火,于68℃进行30秒的延伸的循环。引物使用序列编号35及36。结果示于图3。可知boris在正常组织中除了睾丸以外几乎没有表达。(2)各子宫颈癌细胞株中的boris的表达分析作为子宫颈癌细胞株,使用ms751、tcs、caski、skg-iiib、me-180及siha,使用与上述例1(4)同样的方法从各细胞株的团块群及球体群采集cdna,对于各细胞株中的boris的表达量,通过与例1(3)同样的方法,定量将tcs细胞株的团块群中的表达设为1时的相对表达量。boris的引物-探针混合物使用了taqmangeneexpression(应用生物系统公司)。结果示于图4。在半数以上的细胞株中,与团块群相比在球体群中boris的表达量大幅增大。(3)其他癌细胞株中的boris的表达分析对于作为子宫体癌细胞株的rl95-2及hec-1-a,和作为卵巢癌细胞株的tov-21g、es-2、mcas、ovcar-3、smov-2及skov-3的团块群细胞中的boris的表达量,与(2)同样地以将tcs的团块群细胞中的表达量设为1的相对表达量来进行定量。结果示于图5。boris不仅在子宫颈癌,在子宫体癌和卵巢癌中也显示高表达量。(4)子宫颈癌细胞株中的boris的各亚家族的同型异构体的表达分析对于子宫颈癌细胞株中的boris的各亚家族的同型异构体的表达量,与(1)同样地通过rt-pcr进行了分析。作为对各亚家族具特异性的引物,使用了下表的引物。[表3]表3:使用的引物的碱基序列结果示于图6。在caski细胞株的团块群细胞中,亚家族(sf)1~4可见显著的表达,而在球体群细胞中,团块群细胞中几乎未见表达的sf6强烈地表达。此外,对于ms751细胞株,也发现sf1及sf6在团块群细胞中未观察到表达,但在球体群细胞中观察到表达。(5)卵巢癌细胞株中的boris的各亚家族的变体的表达分析使用卵巢癌细胞株tov21g及smov-2代替子宫颈癌细胞株caski及ms751,进行了与上述(4)同样的实验。结果示于图7。与上述子宫颈癌细胞株的结果同样,对于卵巢癌细胞株,也在球体群细胞中观察到borissf6的特异性表达。此外,对于卵巢癌细胞株,不论是哪个细胞株,都不仅是sf6,sf5的表达也相较于团块群细胞显著地上升。(6)肺癌细胞株及由肺癌患者手术切除片所建立的原代培养细胞中的boris的各亚家族的变体的表达分析使用来自小细胞肺癌、非小细胞肺癌、肺鳞状上皮癌、肺腺癌的细胞株以及由肺癌患者手术切除片所建立的原代培养细胞,进行了与上述(5)同样的实验。除了使用未添加n2补充剂及肝素的培养基以外,球体形成细胞使用与上述例1(1)相同的步骤制备。结果示于图19-1、图19-2、图19-3、图19-4及图19-5。来自肺癌的细胞株也确认到boris基因的表达。具体而言,对于图19-1的小细胞肺癌株,sbc1和sbc5中borissf5在球体群表达增强,lc817观察到sf6的表达增强。图19-2中,确认到borissf5和sf4a的表达,同样地观察到肺鳞状上皮癌和肺腺癌中的boris的表达或球体群中的表达增强。另外,如图19-5所示,由肺癌患者手术切除片所建立的原代培养细胞中也确认到boris的表达,特别是primary7细胞在球体群中确认到若干sf的表达增强,所以提示boris可成为癌症免疫疗法的非常有前景的抗原。例3.对borissf6d的探讨(1)boris同型异构体的过量表达株的制作使用包含pmxpuro载体及plat-a细胞的platinum逆转录病毒表达系统,制作编码boris的s作为f1同型异构体的b0同型异构体、作为sf4同型异构体的b3同型异构体、作为sf6同型异构体的b6同型异构体及c7同型异构体的逆转录病毒载体,并导入至tcs细胞株中制成各boris同型异构体的过剩表达株。通过定量pcr确认了boris同型异构体的表达量,结果分别与导入了mock载体的细胞相比,确认到约1万倍的表达。通过同样的方法,也制作了导入至skg-iiib细胞株中的过量表达株。(2)球体形成试验通过与上述例1(1)相同的方法,接种1000个/孔的过量表达tcs细胞株及过量表达skg-iiib细胞株,通过2周的培养进行球体形成试验。结果示于图8及图9。不论在哪一个细胞株中,都在borissf6、特别是borisb6同型异构体的大量表达株中确认到显著的球体形成。(3)候选borissf6特异性hla结合性表位的提取与hla-i类分子结合而被抗原提呈的表位肽由8~10个氨基酸形成,从n端侧起第2个和第9或10个氨基酸是对于与hla-i类分子的结合最重要的氨基酸,被称为锚定基序。该锚定基序被报道根据各hla-i类分子的种类而不同。例如,对于全球研究最深入的与hla-a2分子结合的表位肽,最广为人知的是在自n端起第2个的位置具有亮氨酸并在第9或10个的位置具有亮氨酸或缬氨酸的由9~10个氨基酸形成的肽。此外,作为与hla-a24分子结合的肽,最广为人知的是自n端起第2个的位置具有酪氨酸、苯丙氨酸、甲硫氨酸或色氨酸中的任一种并在第9或10个的位置具有亮氨酸、异亮氨酸、色氨酸或苯丙氨酸中的任一种的由9~10个的氨基酸所构成的肽。从borissf6特异性的c端序列(序列编号1)提取了具有上述hla结合锚定基序结构的肽。提取作为候选hla-a2结合性肽的kllfigtikv(kll肽:序列编号4)及llfigtikv(llf肽:序列编号5)以及作为候选hla-a24结合性肽的sfkkllfigti(序列编号3),通过通常的方法来合成。(4)hla-a2结合试验将t2细胞于26℃培养一晩。然后,用pbs清洗细胞,作为候选hla-a2结合性肽,加入在(3)合成的kll肽及llf肽,作为阳性对照,加入作为源自巨细胞病毒的肽的cmv肽(序列编号37)及作为源自流感病毒的肽的influenza(序列编号38),并且作为阴性对照,加入作为hla-a24结合性肽的gk-12肽(序列编号39),于26℃进行3小时的共培养。将温度设在37℃再进行3小时的共培养后,进行离心分离除去上清液,分离细胞。对分离的细胞添加hla-a2抗体,于4℃静置1小时,然后用pbs清洗。作为二次抗体,添加荧光标记抗小鼠igg+igm抗体,于4℃静置30分钟后,加入1%甲醛将细胞固定。对于固定后的细胞,通过流式细胞仪(碧迪公司(bectondikinson社)或贝克曼库尔特公司(beckmancoulter社)),测定fitc荧光强度。结果示于图10。可知与kll肽及llf肽一起孵育的t2细胞不论哪个都显示出与cmv肽及influenza肽同等程度的荧光强度,使hla-a2分子以同等程度局部分布于细胞表面。这提示这些肽都与hla-a2结合并被抗原提呈至细胞表面。(5)基于多肽刺激的borissf6特异性ctl的诱导从已知保有hla-a*02:01的2名健康的成人采集外周血,以3,000rpm进行5~10分钟离心处理并回收上清液的血浆部分。从血浆部分以外,通过密度梯度离心法分离出pbmc。在96孔u底细胞培养用微量培养板(碧迪公司)的各孔中,加入10ml的培养基及约3×107个/板的上述中分离的pbmc,并使其悬浮进行培养,所述培养基是在hepes改良rpmi1640培养基(西格玛公司)中添加了2-巯基乙醇(最终浓度55μm)、l-谷氨酸(最终浓度2mm)、作为抗生素的链霉素(最终浓度100μg/ml)和青霉素g(最终浓度100u/ml)以及5%的血浆成分的培养基。向其中以10μg/ml的浓度添加序列编号4或序列编号5的borissf6特异性ctl表位候选肽。培养2天后,以50u/ml的最终浓度添加il-2,再培养2周。对于适量的上述培养细胞,添加10μl的pe标记hla-四聚体试剂和20μl的cd8-fitc抗体,平稳地进行混合,于4℃静置30分钟。加入1.5ml的pbs并搅拌后,以3,000rpm离心分离5分钟,吸取上清液并废弃后,将细胞再次悬浮于400μl的pbs中,在24小时以内使用流式细胞仪进行了分析。分析以2阶段进行。首先,第1阶段是将96孔u底细胞培养用微量培养板的纵列的8孔份的细胞作为1个样品回收,确认该样品中的boris特异性ctl的诱导的有无。针对在该阶段确认到ctl诱导的样品,进行第2阶段的分析。第2阶段是从作为1个样品的8孔个别地回收细胞,确认boris特异性ctl的诱导的有无。利用流式细胞仪的分析结果的图通过散点图表示,该散点图以对数标尺(logscale)在x轴示出对cd8的荧光强度,在y轴示出对hla-四聚体试剂的荧光强度。在将展开图四分而成的区域表记为ul(左上)、ur(右上)、ll(左下)、lr(右下)时,散点图中的数字表示(ur+lr)部分的ur的百分比,即cd8阳性的细胞中hla-四聚体试剂阳性的细胞的比例。图20表示样品的第一阶段的分析结果,该样品采集自将检体编号a2-34的pbmc用borissf6特异性ctl表位候选肽的序列编号4培养13天而得的试样。通过kll-tet确认了序列编号4特异性ctl的诱导,结果在检体编号a2-34中于第5行(lane)、第11行的ur检测出显著的cd8阳性kll-tet阳性的细胞集团。这表示序列编号4的肽是borissf6特异性ctl表位肽,在检体编号a2-34的生物体内存在有boris特异性ctl。图21表示在上述第一阶段的分析中确认到ctl的诱导的第5行、第11行的第2阶段的结果。在第5行的孔c、第11行的孔f检测出kll肽(序列编号4)特异性ctl。这证明了kll肽是显示hla-a*02:01限制性的borissf6特异性ctl表位肽。在96孔中的2孔检测出kll肽特异性ctl,所以kll肽特异性ctl在外周血pbmc中的存在比例通过以下的公式算出。kll肽特异性ctl的频率=(hla-四聚体试剂阳性孔数)/(实验中使用的pbmc数×诱导前的cd8阳性率)=2/(3×107×0.16)=4.17×10-7图22表示样品的第一阶段的分析结果,该样品采集自将检体编号a2-29的pbmc用borissf6特异性ctl表位候选肽的序列编号5培养13天而得的试样。通过llf-tet确认了序列编号5的特异性ctl的诱导,结果在检体编号a2-29中于第1行、第2行、第4行、第5行、第6行、第7行、第8行、第9行、第10行及第11行的ur中检测出显著的cd8阳性llf-tet阳性的细胞集团。这表示序列编号5的肽是borissf6特异性ctl表位肽,在检体编号a2-29的生物体内存在boirssf6特异性ctl。图23-1和2表示在上述第一阶段确认到ctl的诱导的第1行、第2行、第4行、第5行、第6行、第7行、第8行、第9行、第10行及第11行的第二阶段的结果。在第1行的孔b、第2行的孔b和d和g和h、第4行的孔c和f和g、第5行的孔b和f和g、第6行的孔e和f、第7行的孔f、第8行的孔c和g、第9行的孔c、第10行的孔a、第11行的孔e中检测出llf肽(序列编号5)特异性ctl。这证明了llf肽是显示hla-a*02:01限制性的borissf6特异性ctl表位肽。在96孔中的19孔检测出llf肽特异性ctl,所以llf肽特异性ctl在外周血pbmc中的存在比例通过以下的公式算出。llf肽特异性ctl的频率=(hla-四聚体试剂阳性孔数)/(实验中使用的pbmc数×诱导前的cd8阳性率)=19/(3×107×0.17)=3.73×10-6(6)采用pha母细胞刺激的borissf6特异性ctl的诱导从已知保有hla-a*02:01的3名健康成人采集外周血50ml,进行离心处理并回收上清液的血浆部分。使用lymphoprep(axis-shieldprosas公司),从去除血浆后的血细胞部分分离出pbmc。分离的pbmc悬浮于10ml的aim-v培养基中,接种在细胞培养用培养皿,在37℃的co2培养器中培养4小时。aim-v培养基是指在生命技术(lifetechnologies)公司的aim-v中添加了最终浓度10mm的hepes(生命技术公司)、最终浓度50μm的2-巯基乙醇(生命技术公司)的培养基。然后,仅回收悬浮细胞,使用macs磁珠(美天旎生物技术(miltenyibiotec)公司),使用磁性细胞分离法分离cd8阳性细胞和阴性细胞。cd8阴性细胞悬浮于aim-v培养基后,以约4×105个/孔分注到48孔板(康宁公司)里,进行了培养。在开始上述培养的同一天,在一部分cd8阴性细胞的孔里添加了最终浓度1μg/ml的pha(植物血凝素;phytohemagglutinin,和光纯药工业株式会社)、最终浓度100u/ml的il-2(生命技术公司)。从培养开始第4天,将细胞回收至培养试管(碧迪公司),悬浮于10ml的aim-v培养基,放入75cm2培养烧瓶(努克(nunc)公司)里。然后,添加了最终浓度100u/ml的il-2(盐野义制药株式会社(シオノギ社))。从培养开始第8天,将细胞回收至培养试管(碧迪公司)里,悬浮于1ml的aim-v(生命技术公司),添加了序列编号5的肽(最终浓度20μg/ml)。然后,于室温放置1小时,进行100gy的放射线照射处置,制成pha母细胞。cd8阳性细胞的培养是悬浮于在aim-v培养基中添加了最终浓度10%的人ab血清(龙沙日本(lonzajapan)公司)的培养基里后,以约2×106个/孔分注到48孔板(康宁公司)里来进行。从培养开始第8天,在各孔添加里10ng的il-7(r&d系统公司)。然后,按照cd8阳性细胞与pha母细胞呈5比1的方式混合,开始进行共培养。从培养开始第9天、第16天,再次开始pha母细胞的制备,pha母细胞的制备结束的第16天、第23天按照cd8阳性细胞与pha母细胞呈5比1的方式再次混合,合计进行3次采用pha母细胞的刺激。培养开始第16天添加10u/ml的il-2(盐野义制药株式会社),分阶段提高浓度,最终提高浓度到50u/ml为止,继续培养至第28天。将这培养了28天的细胞集团使用与上述(5)同样的方法通过pe标记hla-四聚体试剂及cd8-fitc抗体进行染色,确认样品中的borissf6特异性ctl的诱导的有无。图24表示分取自细胞集团的样品的分析结果,该细胞集团是将检体编号a2-s1的pbmc用borissf6特异性ctl表位候选肽的序列编号5培养了28天而得的细胞集团。通过llf-tet确认了序列编号5特异性ctl的诱导,结果在检体编号a2-s1中检测出显著的cd8阳性llf-tet阳性的细胞集团。这表示llf肽(序列编号5)的肽是显示hla-a*02:01限制性的borissf6特异性ctl表位肽,在检体编号a2-s1的生物体内存在boirs特异性ctl。(7)llf肽特异性ctl的功能分析boirs特异性ctl的功能分析使用elispotset(碧迪公司)试剂盒来进行。首先,采集诱导borissf6特异性ctl而得的细胞集团的一部分,制备成5×105个/ml。将此样品以100μl/孔接种于固相化有抗ifnγ抗体的elispost试验用板,于37℃的co2培养器中静置30分钟。向该板里以达到5×104个/孔的方式添加对t2细胞用序列编号5的肽冲击而得的细胞,于37℃的co2培养器中静置一晩。清洗后,添加生物素标记抗ifnγ抗体,于室温反应2小时。清洗反应液,添加hrp标记链霉亲和素进行反应。清洗后,添加100μl/孔的显色剂,反应15~30分钟,从而将ctl所分泌的ifnγ进行光点化来测定。结果示于图25。与添加了阴性对照的源自hiv的肽(sly肽)的情况,或未添加肽的情况(pbs)相比,用llf肽(序列编号5)刺激的情况下,明显地检测出更多ifnγ的光点。因此,确认在添加llf肽进行培养的pbmc中诱导出通过再刺激而产生ifnγ的llf肽(序列编号5)特异性ctl。(8)ctl克隆的分选及培养将在上述(7)确认了ifnγ产生能力的borissf6特异性ctl用hla-四聚体试剂和抗cd8-fitc(mbl公司)抗体进行双重染色,将与hla-四聚体试剂及抗cd8-fitc抗体反应了的细胞通过流式细胞仪逐个接种到96孔板(康宁公司)。培养该细胞的培养基使用在aim-v培养基里添加了最终浓度10%的人ab血清(龙沙日本公司)、最终浓度1%的青霉素/链霉素(生命技术公司)、最终浓度1%的glutamax(生命技术公司)、最终浓度100u/ml的il-2(盐野义制药株式会社)、最终浓度5μg/ml的pha(和光纯药工业株式会社)的培养基。在各孔里添加了50000个从3名健康的供血者采血并分取的pbmc进行了100gy的放射线照射处理的细胞。此外,对于通过流式细胞仪分离的细胞,观察培养基的颜色并随时进行一半量的培养基交换。然后,在细胞增加的阶段,移置到48孔板。将经培养的ctl使用与上述(5)同样的方法通过llf-tet及cd8-fitc抗体进行染色,确认到ctl扩增的结果示于图26。其结果是检测出显著的cd8阳性llf-tet阳性的细胞集团。这表示源自boris的llf肽特异性的ctl的单克隆化及扩增成功。将经培养之ctl以与上述(7)同样的步骤进行处理,进行ctl的功能分析,其结果示于图27。结果是与未添加肽的情况(-)相比,用llf肽刺激的情况下,检测出更多ifnγ的光点。因此,确认经培养的ctl是通过llf肽的再刺激会产生ifnγ的llf肽(序列编号5)特异性的ctl。(9)llf肽特异性ctl的功能分析通过ldh杀伤试验(宝生物株式会社(takarabio社))对在(8)中结束培养的llf肽特异性ctl是否会攻击提呈llf肽的细胞进行了分析。首先,制备成为llf肽特异性ctl的攻撃对象的靶细胞(target)。准备了下述3种细胞:对t2细胞用序列编号5的llf肽进行了冲击的细胞;作为其阴性对照,对t2细胞用源自hiv的肽(sly肽)进行了冲击的细胞;仅t2细胞。靶细胞以1×104个/孔接种于96孔v底板(康宁公司)。对于llf特异性ctl(effector,效应细胞),制备成9×105个/ml、3×105个/ml、1×105个/ml的浓度的细胞悬浮液,每孔接种100μl,与接种于96孔板的靶细胞混合。然后,将96孔板以1800rpm离心10分钟后,于37℃的co2培养器中静置4小时到12小时。将96孔板离心,使细胞沉淀后,将上清液100μl移到平底96孔板。在各孔里添加100μl的包含黄递酶(diaphorase)的反应液并于室温静置30分钟,然后测定490nm的吸光度。通过此操作,一般存在于细胞膜内的ldh在细胞遭受伤害的情况下因细胞膜的损伤而被释放到细胞外,因此通过测定培养液中的ldh量可评定细胞毒性。使用此方法对llf肽特异性ctl是否识别并攻击提呈llf肽的靶细胞进行了探讨。其结果示于图28。在x轴以e/t率示出效应细胞和靶细胞的比例,在y轴示出细胞毒性活性(%)。细胞毒活性可按照以下所示的公式算出。表示为:[试样实测值(490nm的吸光度:a490)-低对照(a490)]/[高对照(a490)-低对照(a490)]×100。高对照(a490)表示在靶细胞悬浮液中添加了2%的tritonx-100的测定值,低对照(a490)表示仅靶细胞的悬浮液的测定值。细胞毒性活性(%)值以3个试样的平均值来表示。对于llf肽特异性ctl,与将阴性对照的用源自hiv的肽(sly肽)冲击的t2细胞作为靶细胞情况、或将未添加肽的t2细胞作为靶细胞的情况相比,在将用llf肽冲击的t2细胞作为靶细胞的情况下以高比例显示出细胞毒性活性。即,明确了会特异性识别提呈llf肽(序列编号5)的癌细胞而发挥细胞毒性活性。例4.对borissf5的探讨(1)候选boris特异性hla结合性表位的提取与上述例3(3)同样地,提取出候选boris特异性hla结合性表位。作为分析对象的boris,使用borisb1同型异构体(亚家族5),它是具有最长的氨基酸序列且在癌干细胞中特异性地表达的候选boris,提取出对于日本人中约60%所保有的hla-a*24:02具有结合性的候选表位,进行合成。合成的肽如下所示。[表4]表4:合成的hla-a*24:02结合性boris特异性ctl表位候选肽表5中示出合成的boris的hla-a*24:02结合性肽的特征。以将合成的肽的自n端起3个或4个氨基酸的序列作为肽名的简称来表示。从左开始示出肽名、氨基酸序列、boris同型异构体b1氨基酸序列上的位置、氨基酸数、以用于分析的bimas(bioinformatics&molecularanalysissection,http://thr.cit.nih.gov/index.shtml)的hla肽结合预测(peptidebindingpredictions)(http://thr.cit.nih.gov/molbio/hla_bind/)所算出的分数。该分数是预测hla-a*24:02与肽的亲和性的数值,分数越高,就意味着hla与肽越有可能形成稳定的复合体。[表5]表5:源自borisb1的具有hla-a*24:02结合性的候选合成肽(2)boris特异性ctl表位候选肽的折叠试验hla-四聚体试剂制造的最初步骤从将作为原料的hla和β2-微球蛋白和肽在试管内的适当的溶液中进行混合的折叠开始。在折叠溶液中,通过这3种原料的缔合反应而形成3者的复合体(hla-单体)。此时,若hla与肽的结合力越高,则该缔合反应顺利进行,通过用凝胶过滤柱进行分析,可检测3种原料的复合体(hla-单体)。另一方面,hla与肽无结合力的情况下,几乎检测不到hla-单体。因此,通过经时分析折叠溶液,或者通过进行热处理等,可验证hla与肽的结合性和稳定性。本说明书中,将此试验称为“折叠试验”。使用上述合成的11种肽来实施折叠试验。简单来说,将利用大肠杆菌表达系统而进行表达纯化的hla-a*24:02(60mg/l)、β2-微球蛋白(20mg/l)及boris特异性ctl表位候选肽(30μm)添加到折叠溶液(1m的tris-hcl、0.5m的edta、2m的精氨酸、5mm的gsh、0.5mm的gssg及蛋白酶抑制剂)中(括号内的浓度都是最终浓度)并混合后,经时分取折叠溶液,用凝胶过滤柱进行了分析。使用了由9个氨基酸形成的阳性对照肽(序列编号40)和由10个氨基酸形成的阳性对照肽(序列编号41)及各自的阴性对照(序列编号42及43)作为比较对象。结果示于图11。在凝胶过滤柱分析的结果中,hla分子和β2-微球蛋白在利用大肠杆菌表达系统进行表达纯化时用8m尿素可溶化,但难溶性的hla分子中未形成hla-单体的分子作为凝集体在7~8分钟被检测出,其次hla-单体的峰值在10分钟前后被检测出,β2-微球蛋白在14分钟附近被检测出。在15分钟以后折叠溶液的成分或肽被检测出。因此,结果是将表示hla-单体的形成的10分钟前后的峰的峰面积换算成推定hla-单体形成量(mg)而得的值以柱状图表示。(3)boris特异性hla-四聚体试剂的制造基于上述(2)的折叠试验的结果,使用序列编号11以外的10种boris特异性ctl表位候选肽和hla-a*24:02制造出pe标记hla-四聚体试剂。本说明书中,制造的hla-四聚体试剂以例如kya-tet等简称来表示,这表示使用hla-a*24:02和肽kya(kyasveaskl)和β2-微球蛋白的3者复合体制造的试剂。简单来说,与上述(2)同样地,将hla-a*24:02和β2-微球蛋白及boris特异性ctl表位候选肽添加到折叠溶液里进行混合,使hla-单体形成。在此,以在重组hla-a*24:02分子的c端侧上添加生物素结合部位的方式设计表达蛋白质,hla-单体形成后,在该部位上添加了生物素。将经染料标记的链霉亲和素与上述生物素化hla-单体以摩尔比1:4进行混合,获得hla-四聚体试剂。(4)boris特异性ctl的诱导从已知保有hla-a*24:02的7名健康的成人采集外周血,以3,000rpm进行5~10分钟离心处理并回收上清液的血浆部分。从血浆部分以外,通过密度梯度离心法分离出pbmc。在96孔u底细胞培养用微量培养板(碧迪公司)的各孔中,加入10ml的培养基及约3×105个/孔在上述中分离的pbmc,并使其悬浮进行培养,所述培养基是在hepes改良rpmi1640培养基(西格玛公司)中添加了2-巯基乙醇(最终浓度55μm)、l-谷氨酸(最终浓度2mm)、作为抗生素的链霉素(最终浓度100μg/ml)和青霉素g(最终浓度100u/ml)及5%的血浆成分。向其中以10μg/ml的浓度添加序列编号11以外的上述boris特异性ctl表位候选肽。培养2天后,以50u/ml的最终浓度添加il-2,再培养2周。对于适量的上述培养细胞,添加10μl的pe标记hla-四聚体试剂和20μl的cd8-fitc抗体,平稳地进行混合,于4℃静置30分钟。加入1.5ml的pbs并搅拌后,以3,000rpm离心分离5分钟,吸取上清液并废弃后,将细胞再次悬浮于400μl的pbs中,在24小时以内使用流式细胞仪进行分析。分析以2阶段进行。首先,第1阶段是将96孔u底细胞培养用微量培养板的纵列的8孔份的细胞作为1个样品回收,确认该样品中的boris特异性ctl的诱导的有无。针对在该阶段确认到ctl诱导的样品,进行第2阶段的分析。第2阶段是从作为1个样品的8孔个别地回收细胞,确认boris特异性ctl的诱导的有无。图12-1表示样品的第一阶段的分析结果,该样品采集自将检体编号a24-38的pbmc用boris特异性ctl表位候选肽的序列编号10培养13天而得的试样。图通过散点图表示,该散点图以对数标尺在x轴示出对cd8的荧光强度、在y轴示出对hla-四聚体试剂的荧光强度,在将展开图四分而成的区域表记为ul(左上)、ur(右上)、ll(左下)、lr(右下)时,散点图中的数字表示(ur+lr)部分的ur的百分比,即cd8阳性的细胞中hla-四聚体阳性的细胞的比例。通过rmm-tet确认了序列编号10的特异性ctl的诱导,结果在检体编号a24-38中于第2行、第4行、第8行、第9行的ur检测出显著的cd8阳性rmm-tet阳性的细胞集团。这表示序列编号10的肽是boris特异性ctl表位肽,在检体编号a24-38的生物体内存在有boris特异性ctl。图12-2表示第二阶段的结果,即对在第一阶段确认到ctl的诱导的第2行、第4行、第8行、第9行的进一步的分析结果。在第2行的h、第4行的g和h、第8行的f、第9行的a孔检测出rmm肽(序列编号10)特异性ctl。这证明了rmm肽是显示hla-a*24:02限制性的boris特异性ctl表位肽。在96孔中的5孔检测出rmm肽特异性ctl,所以rmm肽特异性ctl在外周血pbmc中的存在比例通过以下的公式算出。rmm肽特异性ctl的频率=(hla-四聚体试剂阳性孔数)/(实验中使用的pbmc数×诱导前的cd8阳性率)=5/(3×107×0.18)=9.26×10-7(5)抗原提呈细胞的制备按照kuzushima等,clinexpimmunol.1996;103:192-198所记载的方法,建立了ebv(eb病毒;epstein-barrvirus)感染b细胞株(以下称为ebv感染lcl(淋巴母细胞样细胞系;lymphoblastoidcellline))。简单来说,将作为ebv产生细胞株的b95-8细胞(从jcrbcellbank获得)的培养上清液(包含活ebv病毒)和pbmc进行混合培养而获得ebv感染lcl。(6)rmm肽特异性ctl的功能分析将在(4)中诱导的pbmc的1/2量移到96孔u底细胞培养用微量培养板,以最终浓度达到100ng/ml的方式添加rmm肽。再以最终浓度达到1μg/ml的方式添加布雷菲德菌素a(brefeldina;bfa),在5%co2恒温槽于37℃培养5~16小时。培养后,清洗细胞,添加pe(藻红素)标记hla-四聚体试剂和pc5(藻红素-cy5)标记cd8抗体(贝克曼库尔特公司),于室温放置15~30分钟。清洗后,用4%甲醛于4℃固定15分钟后,用过量的清洗液清洗。用0.1%皂素进行膜渗透处理后,添加fitc标记抗ifnγ抗体(mbl公司制),于室温反应15~30分钟。清洗后,使用流式细胞仪对t细胞中的ifnγ阳性细胞率或者hla-四聚体试剂阳性细胞中的ifnγ阳性细胞率进行了定量。结果示于图13。只有在用rmm肽刺激的情况下,于ur出现了ifnγ阳性hla-四聚体试剂阳性细胞,而在未添加rmm肽的情况下几乎未出现。由此可知,在用rmm肽刺激的情况下,诱导出rmm-tet特异性反应的ctl。根据该结果可知,在添加rmm肽进行培养的pbmc中,诱导出具有通过再刺激而产生ifnγ的细胞毒性活性的rmm肽特异性ctl,该细胞通过hla-四聚体试剂被染色,所以是对作为源自hla-a*24:02限制性boris的肽的rmm肽(序列编号10)特异性的ctl。(7)borissf5特异性ctl的诱导除了在制备pha母细胞时使用序列编号10的肽(rmm肽)以外,使用与例3(6)同样的步骤,从已知保有hla-a*24:02或hla-a*02:01的健康成人进行了borissf5特异性的ctl的诱导。将诱导的ctl通过与例3(5)同样的方法进行染色,确认了样品中的borissf5特异性ctl的诱导的有无。图29是将保有hla-a*24:02的检体编号a24-s4或保有hla-a*02:01的检体编号a2-s5的pbmc与rmm肽(序列编号10)提呈细胞共培养28天而得的细胞集团的分析结果。检体编号a24-s4和a2-s5中的rmm肽特异性ctl诱导的有无的确认使用rmm肽,使用对应各检体所保有的hla的类型而制造的hla四聚体试剂来进行分析。其结果是检体编号a24-s4和a2-s5都有检测出显著的cd8阳性rmm-tet阳性的细胞集团。这表示序列编号10的肽是borissf5特异性ctl表位肽,在检体编号a24-s4和a2-s5的生物体内存在boirs特异性ctl。此外,发现序列编号10的肽具有与hla-a*24:02及hla-a*02:这2种hla型的结合性。boirs特异性ctl的功能分析使用elispotset(碧迪公司)试剂盒以与例3(7)同样的步骤进行,将rmm肽特异性ctl所分泌的ifnγ进行光点化来测定。图30是表示将光点数通过柱状图表示的结果。与阴性对照的添加源自hiv的肽(检体a24-s4中是ryl肽,检体a2-s5中是sly肽)的情况或未添加肽的情况(pbs)相比,在用rmm肽刺激的情况下,检测出显著较多光点数。(8)rmm肽的分析rmm肽是borisb1同型异构体的第670~678个氨基酸。在此,已知borisb1是属于boris的亚家族5的由700个氨基酸形成的同型异构体,borissf5在c端侧的132个氨基酸、尤其是c端侧38个氨基酸(序列编号2)具有亚家族特异性序列,所以rmm肽是对borissf5特异性的序列,是能诱导也能够将根据本发明发现特异性表达borissf5的源自卵巢癌的癌干细胞当作靶标的ctl的表位肽。例5.对borisc1同型异构体的探讨(1)候选boris特异性hla结合性表位的提取除了作为分析对象的boris,使用borisc1同型异构体(亚家族1,序列编号76),作为hla型,使用hla-a*02:01以外,与例3(3)同样地进行操作,提取出候选boris特异性hla结合性表位。合成的肽如下所示。[表6]表6合成的hla-a*02:01结合性boris特异性ctl表位候选肽序列编号序列47valleugluglugluvalgluleuval48lysleualavalserleualagluthr49servalleugluglugluvalgluleu50serleualagluthralaglyleuile51valleusergluglnphethrlysile52ileleuglnlyshisglygluashval53alaleu6lugluashvalmetvalala54tyralaserargaspthrtyrlysleu55metalaalathrgluileservalleu56hisalaleuglugluasnvalmetval57valleuthrvalserasnserashval表7示出合成的boris的hla-a*02:01结合性肽的特征。以将合成的肽的自n端侧起3到4个氨基酸的序列作为肽名的简称来表示。从左开始示出肽名、氨基酸序列、borisc1同型异构体氨基酸序列上的位置、氨基酸数、以用于分析的syfpeithi(http://www.syfpeithi.de/0-home.htm)的表位预测(epitopeprediction)(http://www.syfpeithi.de/bin/mhcserver.dll/epitopeprediction.htm)所算出的分数。该分数是通过hla-a*02:01分子与肽的结构基序来预测hla与肽的亲和性的数值,分数越高,就意味着hla与肽越有可能形成稳定的复合体。[表7]表7源自boris的与hla-a*o2:01具有结合性的候选合成肽(2)boris特异性ctl表位候选肽的折叠试验使用按照表7所合成的11种肽实施了折叠试验。除了作为hla使用hla-a*02:01,作为表位候选肽使用上述表7所记载的肽,阳性对照肽使用序列编号58的肽且阴性对照使用序列编号59的肽作为比较对象以外,折叠试验使用与例4(2)同样的方法进行。其结果示于图33。结果与例4(2)同样,表示换算成推定hla-单体形成量(mg)的值。其结果是,除序列编号55外的序列编号47至序列编号57的10种boris特异性ctl表位候选肽中,与阴性对照相比,确认了充分的hla-单体形成。即,表示除了maa肽以外的表7所登载的boris特异性ctl表位候选肽与hla-a*02:01结合。(3)boris特异性hla-四聚体试剂的制造基于(2)的折叠试验的结果,除了使用除序列编号55外的序列编号47至序列编号57的10种boris特异性ctl表位候选肽和hla-a*02:01以外,以与例4(3)同样的步骤制造了pe标记hla-四聚体试剂。(4)boris特异性ctl的诱导除了将已知保有hla-a*02:01的4名健康的成人作为对象,使用除序列编号55外的序列编号47至序列编号57的boris特异性ctl表位候选肽以外,通过与例3(5)同样的方法进行ctl的诱导。经ctl诱导的细胞集团通过与例3(5)同样的方法确认了ctl的诱导的有无。ctl的染色使用与诱导时所使用的boris特异性ctl表位候选肽对应的hla-四聚体试剂来进行。以下,示出确认到ctl的诱导的代表性结果。图34、图36、图38分别依次表示从将采集自检体编号a2-29、检体编号a2-27、检体编号a2-34的pbmc与boris特异性ctl表位候选肽的序列编号47培养13天而得的试样采集的样品的第一阶段的分析结果。通过vle-tet确认了序列编号47的特异性ctl的诱导,结果在检体编号a2-29中于第10行、在检体编号a2-27中于第3行、在检体编号a2-34中于第4行的ur检测出显著的cd8阳性vle-tet阳性的细胞集团。这表示序列编号47的肽是boris特异性ctl表位肽,在检体编号a2-29、检体编号a2-27、检体编号a2-34的生物体内存在boirs特异性ctl。图35、图37、图39表示在第一阶段确认到ctl的诱导的行的第二阶段的结果。图35中在第10行的孔h,图37中在第3行的孔e,图39中在第4行的孔c检测出vle肽(序列编号47)特异性ctl。这证明了vle肽是显示hla-a*02:01限制性的boris特异性ctl表位肽。不论在哪一个检体中,在96孔中的1孔检测出vle肽特异性ctl,所以vle肽特异性ctl在外周血pbmc中的存在比例通过以下的公式算出。vle肽特异性ctl的频率=(hla-四聚体试剂阳性孔数)/(实验中使用的pbmc数×诱导前的cd8阳性率)=1/(3×107×0.18)=1.85×10-7图40表示样品的第一阶段的分析结果,该样品采集自将采集自检体编号a2-29的pbmc与boris特异性ctl表位候选肽的序列编号48培养13天而得的试样。通过kla-tet确认了序列编号48的特异性ctl的诱导,结果在检体编号a2-29中的第2行、第5行、第11行的ur检测出显著的cd8阳性kla-tet阳性的细胞集团。这表示序列编号48的肽是boris特异性ctl表位肽,在检体编号a2-29的生物体内存在boirs特异性ctl。图41表示在第一阶段确认到ctl的诱导的行的第二阶段的结果。图41中,在第2行的孔h、第5行的孔d、第11行的孔f检测出kla肽(序列编号48)特异性ctl。这证明了kla肽是显示hla-a*02:01限制性的boris特异性ctl表位肽。在96孔中的3孔检测出kla肽特异性ctl,所以kla肽特异性ctl在外周血pbmc中的存在比例通过以下的公式算出。kla肽特异性ctl的频率=(hla-四聚体试剂阳性孔数)/(实验中使用的pbmc数×诱导前的cd8阳性率)=3/(3×107×0.19)=5.26×10-7图42表示样品的第一阶段的分析结果,该样品采集自将采集自检体编号a2-29的pbmc与boris特异性ctl表位候选肽的序列编号57培养13天而得的试样。通过vlt-tet确认了序列编号57的特异性ctl的诱导,结果是在检体编号a2-29中的第7行、第9行的ur检测出显著的cd8阳性vlt-tet阳性的细胞集团。这表示序列编号57的肽是boris特异性ctl表位肽,在检体编号a2-29的生物体内存在boirs特异性ctl。图43表示在第一阶段确认到ctl的诱导的行的第二阶段的结果。图43中,在第7行的孔a、第9行的孔g检测出vlt肽(序列编号57)特异性ctl。这证明了vlt肽是显示hla-a*02:01限制性的boris特异性ctl表位肽。在96孔中的2孔检测出vlt肽特异性ctl,所以vlt肽特异性ctl在外周血pbmc中的存在比例通过以下的公式算出。vlt肽特异性ctl的频率=(hla-四聚体试剂阳性孔数)/(实验中使用的pbmc数×诱导前的cd8阳性率)=2/(3×107×0.19)=3.51×10-7(5)肽特异性ctl的功能分析将包含由检体a2-29所诱导的kla肽特异性ctl的pbmc或包含由检体a2-29所诱导的vlt肽特异性ctl的pbmc以约3×106个分别移至96孔u底细胞培养用微量培养板的2孔。以最终浓度100ng/ml的方式在包含kla肽特异性ctl的pbmc中添加kla肽,在包含vle肽特异性ctl的pbmc中添加vle肽,添加到2孔中的1孔,另1孔准备作为未处理的孔。然后,将抗cd107a-fitc标记抗体和莫能菌素(monensin)同时添加到肽添加孔、未处理孔,在37℃的co2培养器中,培养4小时。培养后,清洗细胞,添加与各肽对应的pe标记hla-四聚体试剂和pc5(藻红素-cy5)标记抗cd8抗体(贝克曼库尔特公司),于室温放置15~30分钟。用过量的清洗液清洗,使用流式细胞仪检测作为ctl的去颗粒标记物cd107a来算出阳性细胞率。已知ctl在释放穿孔素(perforin)、颗粒酶(granzyme)等细胞毒性因子时将存在于细胞内颗粒内膜的cd107a表达在细胞膜上,通过检测cd107a分子,能够间接地调查细胞毒性因子的释放。结果示于图44、图45。图44中,只有在用kla肽刺激的情况下,于ur出现了cd107a阳性hla-四聚体试剂阳性细胞,而在未添加kla肽的情况下几乎未出现。由此可知,在用kla肽刺激的情况下,诱导出kla-tet特异性反应的ctl。此外,图45中,只有在用vlt肽刺激的情况下,于ur出现了cd107a阳性hla-四聚体试剂阳性细胞,而在未添加vlt肽的情况下几乎未出现。由此可知,在用vlt肽刺激的情况下,诱导出vlt-tet特异性反应的ctl。根据此结果可知,在添加kla肽进行培养的pbmc中或在添加vlt肽进行培养的pbmc中,诱导出具有通过再刺激而产生颗粒酶或穿孔素的细胞毒性活性的ctl。此外,该ctl通过hla-四聚体试剂而被染色,所以证明了是对作为源自hla-a*02:01结合性borisc1的肽的kla肽(序列编号48)或vlt肽(序列编号57)具特异性的ctl。hla-a*02:01限制性boris特异性ctl的诱导的探讨结果整理示于表8。[表8]表8boris特异性ctl的诱导结果○:确认有四聚体(+)、cd8(+)细胞的诱导×:无四聚体(+)、cd8(+)细胞的诱导(6)候选boris特异性hla-a*11:01结合性表位的提取与上述例3(3)同样地,提取出候选boris特异性hla结合性表位。但是,仅在一点上不同,即提取出的候选表位对在包含日本人在内的东南亚显示第3位的保有率的hla-a*11:01具有结合性。合成提取出的候选表位的肽序列,其序列示于表9-1,对照肽示于表9-2。[表9-1]表9-1有可能与hla-a*11:01具有结合性的boris特异性肽[表9-2]表9-2对照用肽表9-1表示合成的候选boris特异性hla-a*11:01结合性表位的特征。已知与hla-a11结合的肽大多在自n端起第2个的位置上配置ile、met、ser、thr或val的任一种,在第9个或者第10个的位置上配置lys或arg的任一种。此外,周知该肽的长度由9到10个氨基酸形成(参照rapinn等,currprotocimmunol.2010;chapter18:unit18.17)。以将合成的肽的自n端侧起3到4个氨基酸的序列作为肽名的简称表示。从左开始示出肽名、氨基酸序列、属于sf5的borisb1同型异构体和/或属于sf6的c7/c9同型异构体的氨基酸序列上的位置、氨基酸数、以用于分析的netmhc3.4(http://www.cbs.dtu.dk/services/netmhc/)的hla肽结合预测(peptidebindingpredictions)所算出的分数(参照nielsen等,proteinsci.2003;12:1007-1017,lundegaard等,nucleicacidsres.2008;36(webserverissue):w509-512,lundegaard等,bioinformatics.2008;24:1397-1398)。该分数是预测hla-a*11:01与肽的亲和性的数值,分数越高,就意味着hla与肽越有可能形成稳定的复合体。另外,表9-1、9-2所示的netmhc3.4的分数作为通过用于分析的11种分析软件获得的代表例示出。(7)boris特异性hla-a*11:01限制性ctl表位候选肽的折叠试验使用按照表9-1所合成的13种肽实施了折叠试验。除了作为hla使用hla-a*11:01作为hla,作为表位肽使用表9-1所记载的肽,阳性对照肽使用序列编号73的肽且阴性对照使用序列编号40的肽作为比较对象以外,折叠试验使用与例4(2)同样的方法进行。对15种肽实施的折叠试验的1、3、7天后的分析结果示于图46。作为阳性对照肽,使用源自cmv之pp65蛋白质的hla-a*11:01限制性肽(atv肽,序列编号73)作为比较对象,作为阴性对照,使用源自survivin-2b的hla-a*24:02限制性肽(aya肽,序列编号40)作为比较对象。将表示hla-单体形成的峰的面积以柱状图表示。其结果是,boris特异性ctl表位候选肽(从序列编号60到序列编号72)与阴性对照比较,确认到充分的hla-单体形成。即,表示表9-1所登载的boris特异性ctl表位候选肽与hla-a*11:01结合。(8)boris特异性hla-a*11:01限制性hla-四聚体试剂的制造基于(7)的折叠试验的结果,以与例4(3)同样的步骤制造出pe标记hla-四聚体试剂。但是,作为表位肽使用从序列编号60到序列编号72的13种boris特异性ctl表位候选肽,作为hla使用hla-a*11:01。其结果是,序列编号68未能制造出hla-四聚体试剂。因此,制造例具有除序列编号68外的序列编号60到序列编号72的ctl表位候选肽和hla-a*11:01的12种hla-四聚体试剂。(9)boris特异性ctl的诱导将已知保有hla-a*11:01的2名健康的成人作为对象,通过与例3(5)同样的步骤进行ctl的诱导。但是,作为表位肽,使用了将每4种候选hla-a*11:01限制性ctl表位混合而成的4种混合肽1(序列编号60、序列编号63、序列编号66及序列编号70)、或4种混合肽2(序列编号61、序列编号64、序列编号67及序列编号71)、或4种混合肽3(序列编号62、序列编号65、序列编号69及序列编号72)。尝试ctl的诱导的细胞集团的分析以3阶段来进行。首先,第1阶段是将96孔u底细胞培养用微量培养板的纵列的8孔份的细胞作为1个样品来回收。将该样品通过与诱导时使用的4种混合肽对应的hla-四聚体混合试剂1(svl-tet、nth-tet、kql-tet及gli-tet)、或hla-四聚体混合试剂2(sla-tet、csy-tet、tvy-tet及tvl-tet)、或hla-四聚体混合试剂3(rms-tet、gtm-tet、aaa-tet及kllf-tet)以与例3(5)同样的步骤进行染色,确认boris特异性ctl的诱导的有无。针对在该阶段确认到ctl的诱导的样品,进行第2阶段的分析。第2阶段是从作为1个样品的8孔个别地回收细胞,将该样品通过hla-四聚体混合试剂1、2或3进行染色,确认boris特异性ctl的诱导的有无。第3阶段是分别使用hla-四聚体试剂实施ctl的检测,确认第2阶段中确认到ctl的诱导的孔的细胞与hla-四聚体混合试剂中的哪个hla-四聚体试剂进行反应。使用此方法确认在96孔u底细胞培养用微量培养板的哪个孔诱导出对哪个肽具有特异性的ctl。图47是第一阶段的分析结果。表示样品的第一阶段的分析结果,该样品采集自将检体编号*11-13的pbmc与4种混合肽1培养14天而得的试样。通过hla-四聚体混合试剂1以与例3(5)同样的步骤进行了染色,结果于第1行的ur中检测出显著的cd8阳性hla-四聚体混合试剂1阳性的细胞集团。该结果表示在用于探讨的候选boris特异性ctl表位中至少存在1种ctl表位,且在检体编号a*11-13的生物体内存在boris特异性ctl。图48表示在第一阶段的分析中确认到ctl的诱导的第1行的第二阶段的分析结果。在第1行的孔b(1-b)确认到对hla-a*11:01结合性boris特异性ctl表位有特异性的ctl的诱导。图49表示在第二阶段的分析中确认到ctl的诱导的第1行的孔b的第三阶段的分析结果。结果是仅在用kql-tet进行染色的情况下确认到ctl。这证明了kql肽(序列编号66)是hla-a*11:01限制性boris特异性ctl表位肽。图50是第一阶段的分析结果。表示样品的第一阶段的分析结果,该样品采集自将检体编号*11-13的pbmc与4种混合肽2培养14天而得的试样。通过hla-四聚体混合试剂2以与例3(5)同样的步骤进行了染色,结果于第12行的ur中检测出显著的cd8阳性hla-四聚体混合试剂2阳性的细胞集团。该结果表示在用于探讨的候选boris特异性ctl表位中至少存在1种ctl表位,且在检体编号a*11-13的生物体内存在boris特异性ctl。图51表示在第一阶段的分析中确认到ctl的诱导的第12行的第二阶段的分析结果。在第12行的孔e(12-e)确认到对hla-a*11:01结合性boris特异性ctl表位有特异性的ctl的诱导。图52表示在第二阶段的分析中确认到ctl的诱导的第12行的孔e的第三阶段的分析结果。仅在用tvy-tet进行染色的情况下确认到ctl。这证明了tvy肽(序列编号67)是hla-a*11:01限制性boris特异性ctl表位肽。图53是第一阶段的分析结果。表示样品的第一阶段的分析结果,该样品采集自将检体编号*11-16的pbmc与4种混合肽3培养14天而得的试样。通过hla-四聚体混合试剂3以与例3(5)同样的步骤进行了染色,结果于第7行和第11行的ur中检测出显著的cd8阳性hla-四聚体混合试剂3阳性的细胞集团。该结果表示在用于探讨的候选boris特异性ctl表位中至少存在1种ctl表位,且在检体编号a*11-16的生物体内存在boris特异性ctl。图54表示在第一阶段的分析中确认到ctl的诱导的第7行和第11行的第二阶段的分析结果。在第7行的孔e(7-e)、第11行的孔h(11-h)确认到对hla-a*11:01限制性boris特异性ctl表位有特异性的ctl的诱导。图55表示在第二阶段的分析中确认到ctl的诱导的第7行的孔e、第11行的孔h的第三阶段的分析结果。第7行的孔e仅在用gtm-tet进行染色的情况下确认到ctl,第11行的孔h仅在用kllf-tet进行染色的情况下确认到ctl。这证明了gtm肽(序列编号65)及kllf肽(序列编号72)是hla-a*11:01限制性boris特异性ctl表位肽。例6.borissf5及sf6的特异抗体的制备为了获得borissf5及borissf6特异抗体,由序列编号1及序列编号2分别合成以8~20个氨基酸所构成的肽序列,在该肽的c端或n端上添加半胱氨酸残基,依照通用方法使khl(锁孔血蓝蛋白;keyholelimpethemocyanin)结合并用于免疫原。对兔子及豚鼠,隔周或每周进行了4~6次免疫。免疫结束后,从各个体进行采血,将此血液通过以用于免疫原的肽所制作成的亲和柱进行纯化而获得特异抗体。特异性的验证使用分别使borissf5及borissf6短暂性表达的培养细胞293t的细胞提取液和未处理的293t细胞的细胞提取液实施。在短暂性表达的borissf5及borissf6的基因里添加有myctag序列,使用对其具特异性myctag抗体作为阳性对照。如图56所示,采用蛋白质印迹的验证结果是所得的borissf5及borissf6特异抗体在使用各boris表达293t细胞的提取液的情况下均在表示与在阳性对照中所检出的条带相同的分子大小的位置上检测出条带,与之相对,对于未处理的293t细胞提取物均未检测出条带。由此认为,获得了分别与borissf5及borissf6特异性结合的抗体。另外,将从肺癌患者切除的癌患部组织切片用borissf5特异抗体进行染色的情况下,发现同时有判定为阴性的情况和判定为阳性的情况(参照图57)。通过使用所得的特异抗体,可确认borissf5及borissf6各自的表达的有无,显示出能成为判断使用本发明所鉴定的ctl表位肽的肽疫苗疗法等可否适应的有力工具。例7.针对borissf6的sirna的制备(1)sirna的设计将以具有如下表所示的序列的方式设计的针对boris的sirna依照使用lipofectaminernaimax的制造商的使用说明书所记载的实验方案分别转染至ms751及caski。将细胞在转染后48小时进行分析。作为阴性对照,使用了trilencer-27universalscramblednegativecontrolsirna(sr30004,origene)。[表10]表10:sirna1~3的序列进行基因敲除(knockdown)的结果示于图14及15。图14-1(a)表示通过3种sirna显著地抑制了boris(b0)的表达水平(定量rt-pcr)。此外,根据图14-1(b)及图14-2,对于sirna1及sirna2,观察到少许细胞增殖抑制。认为或许抑制的boris亚家族的数量越多,则增殖抑制效果会越高。但是,sirna1及sirna2完全没有产生干细胞性基因的抑制(图15)。此外,如图16-1及16-2所示,对于caski及ms751各自的球体形成能力,sirna2有显著的抑制(与细胞增殖抑制的结果并不一定一致)。另外,sirna1~3的基因敲除与放射线耐受性无关(图17)。由图18可知,若boris表达高,则生存率会显著降低。因此,boris被认定为有意义的预后不良因子(poorprognosticfactor)。产业上利用的可能性根据本发明,能够提供对各种癌症有效的治疗剂。特别是通过本发明的表位肽所诱导的ctl,可诱导能够特异性攻击各种癌细胞、尤其是被视为恶性肿瘤的原因的癌干细胞的ctl,作为副作用少且效果好的抗癌剂非常有用。序列表<110>北海道公立大学法人札幌医科大学医学生物学研究所<120>肿瘤抗原肽<130>pct2736si<150>jp2014-194391<151>2014-09-24<160>76<170>patentinversion3.5<210>1<211>32<212>prt<213>智人<400>1lysglyserglyalagluglyleuileprothrvalleuthrleulys151015alaserphelyslysleuleupheileglythrilelysvalglnarg202530<210>2<211>38<212>prt<213>智人<400>2asnseralaglycysthrglyargmetmetleuvalseralatrpleu151015leuglyargproglngluthrtyrasnglnglyargargargarggly202530serargargvalthrtrp35<210>3<211>11<212>prt<213>人工序列<220><223>hla-a02结合肽<400>3serphelyslysleuleupheileglythrile1510<210>4<211>10<212>prt<213>人工序列<220><223>肿瘤抗原肽<400>4lysleuleupheileglythrilelysval1510<210>5<211>9<212>prt<213>人工序列<220><223>hla-a24结合肽<400>5leuleupheileglythrilelysval15<210>6<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>6valphehisgluargtyralaleuile15<210>7<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>7thrphehiscysaspvalcysmetphe15<210>8<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>8hisphethrserglualavalgluleu15<210>9<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>9lystyrileleuthrleuglnthrval15<210>10<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>10argmetmetleuvalseralatrpleu15<210>11<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>11lystyrglncysprohiscysalathr15<210>12<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>12lystyralaservalglualaserlysleu1510<210>13<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>13leutyrserproglnglumetgluvalleu1510<210>14<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>14sertyralaserargaspthrtyrlysleu1510<210>15<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>15lystyrglncysprohiscysalathrile1510<210>16<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>16argtyrlyshisthrhisglulysprophe1510<210>17<211>20<212>dna<213>人工序列<220><223>引物<400>17ctgcgaagggatggaaggaa20<210>18<211>19<212>dna<213>人工序列<220><223>引物<400>18gaacacgcaacccgaatcc19<210>19<211>20<212>dna<213>人工序列<220><223>引物<400>19ggataattccgcaggctgta20<210>20<211>20<212>dna<213>人工序列<220><223>引物<400>20tggtcgttcagaggagtgtg20<210>21<211>20<212>dna<213>人工序列<220><223>引物<400>21taacacccacacaggaacca20<210>22<211>22<212>dna<213>人工序列<220><223>引物<400>22gcctctactaagatgccatgaa22<210>23<211>20<212>dna<213>人工序列<220><223>引物<400>23cttttcccgctggattctct20<210>24<211>20<212>dna<213>人工序列<220><223>引物<400>24gtcaggaggacactcaagca20<210>25<211>20<212>dna<213>人工序列<220><223>引物<400>25ccattcacctgcctttcttg20<210>26<211>22<212>dna<213>人工序列<220><223>引物<400>26ggttttaagccactccattttg22<210>27<211>20<212>dna<213>人工序列<220><223>引物<400>27ccacaaagggtcagaaggaa20<210>28<211>21<212>dna<213>人工序列<220><223>引物<400>28ggtcaggagtgagagacatgg21<210>29<211>21<212>dna<213>人工序列<220><223>引物<400>29tgtgatgtctgcatgttcacc21<210>30<211>21<212>dna<213>人工序列<220><223>引物<400>30gcagatcacttgaggtcagga21<210>31<211>20<212>dna<213>人工序列<220><223>引物<400>31tgcacagacattcggagaag20<210>32<211>20<212>dna<213>人工序列<220><223>引物<400>32agatcacaccgtctccgttc20<210>33<211>20<212>dna<213>人工序列<220><223>引物<400>33ctcaggtaagggctctggtg20<210>34<211>20<212>dna<213>人工序列<220><223>引物<400>34tactccacacagtggggttg20<210>35<211>20<212>dna<213>人工序列<220><223>boris正向引物<400>35gatgctgaaaaggccaaatc20<210>36<211>20<212>dna<213>人工序列<220><223>boris反向引物<400>36acttgtagggcctggttcct20<210>37<211>9<212>prt<213>人工序列<220><223>合成肽<400>37asnleuvalprometvalalathrval15<210>38<211>9<212>prt<213>人工序列<220><223>合成肽<400>38glyileleuglyphevalphethrleu15<210>39<211>12<212>prt<213>人工序列<220><223>合成肽<400>39glytyrileserprotyrpheileasnthrserlys1510<210>40<211>9<212>prt<213>人工序列<220><223>合成肽<400>40alatyralacysasnthrserthrleu15<210>41<211>10<212>prt<213>人工序列<220><223>合成肽<400>41glutrptrpargserglyglypheserphe1510<210>42<211>9<212>prt<213>人工序列<220><223>合成肽<400>42sersertyrargargprovalglyile15<210>43<211>10<212>prt<213>人工序列<220><223>合成肽<400>43serserleugluasnpheargalatyrval1510<210>44<211>48<212>dna<213>人工序列<220><223>sirna<400>44rgrcrararururcrarcrcrarargrarurcrararargrararctc48<210>45<211>48<212>dna<213>人工序列<220><223>sirna<400>45rgrgrarararurarcrcrarcrgrarurgrcrarararurururcat48<210>46<211>48<212>dna<213>人工序列<220><223>sirna<400>46rargrcrurgrgrarurarurururcrararargrarararcrarutg48<210>47<211>9<212>prt<213>人工序列<220><223>肿瘤抗原肽<400>47valleugluglugluvalgluleuval15<210>48<211>9<212>prt<213>人工序列<220><223>肿瘤抗原肽<400>48lysleualavalserleualagluthr15<210>49<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>49servalleugluglugluvalgluleu15<210>50<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>50serleualagluthralaglyleuile15<210>51<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>51valleusergluglnphethrlysile15<210>52<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>52ileleuglnlyshisglygluasnval15<210>53<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>53alaleuglugluasnvalmetvalala15<210>54<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>54tyralaserargaspthrtyrlysleu15<210>55<211>9<212>prt<213>人工序列<220><223>候选hla-a02:01结合肽<400>55metalaalathrgluileservalleu15<210>56<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>56hisalaleuglugluasnvalmetval15<210>57<211>9<212>prt<213>人工序列<220><223>肿瘤抗原肽<400>57valleuthrvalserasnserasnval15<210>58<211>9<212>prt<213>人工序列<220><223>合成肽<400>58argmetpheproasnalaprotyrleu15<210>59<211>9<212>prt<213>人工序列<220><223>合成肽<400>59lysalavaltyrasnphealathrmet15<210>60<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>60servalleusergluglnphethrlys15<210>61<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>61serleualagluthrthrglyleuilelys1510<210>62<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>62argmetserserpheasnarghismetlys1510<210>63<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>63asnthrhisthrglythrargprotyrlys1510<210>64<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>64cyssertyralaserargaspthrtyrlys1510<210>65<211>10<212>prt<213>人工序列<220><223>肿瘤抗原肽<400>65glythrmetlysilehisileleuglnlys1510<210>66<211>10<212>prt<213>人工序列<220><223>肿瘤抗原肽<400>66lysglnleuleuasnalahisphearglys1510<210>67<211>10<212>prt<213>人工序列<220><223>肿瘤抗原肽<400>67thrvaltyrlyscysserlyscysglylys1510<210>68<211>10<212>prt<213>人工序列<220><223>hla-a11:01结合肽<400>68alaserglylysglyargargthrarglys1510<210>69<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>69alaalaalagluglualaserthrthrlys1510<210>70<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>70glyleuileprothrvalleuthrleulys1510<210>71<211>10<212>prt<213>人工序列<220><223>候选ctl表位肽<400>71thrvalleuthrleulysalaserphelys1510<210>72<211>9<212>prt<213>人工序列<220><223>肿瘤抗原肽<400>72lysleuleupheileglythrilelys15<210>73<211>9<212>prt<213>人工序列<220><223>候选ctl表位肽<400>73alathrvalglnglyglnasnleulys15<210>74<211>9<212>prt<213>人工序列<220><223>合成肽<400>74serleutyrasnthrvalalathrleu15<210>75<211>10<212>prt<213>人工序列<220><223>合成肽<400>75argtyrleuargglnglnleuleuglyile1510<210>76<211>663<212>prt<213>智人<400>76metalaalathrgluileservalleusergluglnphethrlysile151015lysgluleugluleumetproglulysglyleulysglugluglulys202530aspglyvalcysargglulysasphisargserprosergluleuglu354045alagluargthrserglyalapheglnaspservalleuglugluglu505560valgluleuvalleualaproserglugluserglulystyrileleu65707580thrleuglnthrvalhisphethrserglualavalgluleuglnasp859095metserleuleuserileglnglnglngluglyvalglnvalvalval100105110glnglnproglyproglyleuleutrpleuglugluglyproarggln115120125serleuglnglncysvalalaileserileglnglngluleutyrser130135140proglnglumetgluvalleuglnphehisalaleuglugluasnval145150155160metvalalasergluaspserlysleualavalserleualagluthr165170175alaglyleuilelysleugluglugluglnglulysasnglnleuleu180185190alagluargthrlysgluglnleuphephevalgluthrmetsergly195200205aspgluargseraspgluilevalleuthrvalserasnserasnval210215220glugluglngluaspglnprothralaglyglnalaaspalaglulys225230235240alalysserthrlysasnglnarglysthrlysglyalalysglythr245250255phehiscysaspvalcysmetphethrserserargmetserserphe260265270asnarghismetlysthrhisthrserglulysprohisleucyshis275280285leucysleulysthrpheargthrvalthrleuleuargasnhisval290295300asnthrhisthrglythrargprotyrlyscysasnaspcysasnmet305310315320alaphevalthrserglygluleuvalarghisargargtyrlyshis325330335thrhisglulysprophelyscyssermetcyslystyralaserval340345350glualaserlysleulysarghisvalargserhisthrglygluarg355360365propheglncyscysglncyssertyralaserargaspthrtyrlys370375380leulysarghismetargthrhisserglyglulysprotyrglucys385390395400hisilecyshisthrargphethrglnserglythrmetlysilehis405410415ileleuglnlyshisglygluasnvalprolystyrglncysprohis420425430cysalathrileilealaarglysseraspleuargvalhismetarg435440445asnleuhisalatyrseralaalagluleulyscysargtyrcysser450455460alavalphehisgluargtyralaleuileglnhisglnlysthrhis465470475480lysasnglulysargphelyscyslyshiscyssertyralacyslys485490495glngluarghismetthralahisileargthrhisthrglyglulys500505510prophethrcysleusercysasnlyscyspheargglnlysglnleu515520525leuasnalahisphearglystyrhisaspalaasnpheileprothr530535540valtyrlyscysserlyscysglylysglypheserargtrpileasn545550555560leuhisarghisserglulyscysglyserglyglualalysserala565570575alaserglylysglyargargthrarglysarglysglnthrileleu580585590lysglualathrlysglyglnlysglualaalalysglytrplysglu595600605alaalaasnglyaspglualaalaalagluglualaserthrthrlys610615620glygluglnpheproglyglumetpheprovalalacysarggluthr625630635640thralaargvallysglugluvalaspgluglyvalthrcysglumet645650655leuleuasnthrmetasplys660当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1