一种结核分枝杆菌T细胞抗原表位多肽及其应用的制作方法
本发明涉及结核分枝杆菌特异性抗原表位多肽,特别是抗原rd13区的t细胞抗原表位多肽。
背景技术:
结核病是一种严重危害人类健康的慢性传染病,全球目前有近三分之一的人感染结核分枝杆菌,因结核病死亡人数每年达13万,超过其它传染病死亡人数的总和。
结核病的早期诊断对于控制患者疾病进展和疾病的传播具有重要意义。目前,结核病临床诊断仍然缺乏高灵敏度和高特异性的手段。传统的结核菌素皮试(tst/ppd)所用的抗原结核菌素因为能够跟卡介苗(bcg)接种产生交叉反应使得其产生较高比例的假阳性,而临床诊断的“金标准”——结核分枝杆菌培养,则有时间长,阳性率低等缺陷。另外,基于x射线透射和临床表现的诊断则特异性较低,容易与其他肺部感染或疾病相混淆。
随着近年来我国hiv感染率的快速上升,肺外结核(eptb)以及结核/hiv合并感染发病率亦呈上升趋势。eptb以及结核/hiv合并感染时,由于其结核病菌载量相对于活动性肺结核小,且累及部位不易取样,因而诊断更为困难。此外结核/hiv合并感染者由于免疫功能缺陷,因而常规的免疫学结核检测手段,如结核菌素皮试(tst/ppd)常常出现假阴性。
特异性抗原诊断一直是确认病原体感染及评估状况较为可靠的方法,且有早期诊断价值。由于人体在对抗结核分枝杆菌的感染中,细胞介导的免疫反应起到了关键性的作用,所以寻找结核杆菌特异性的t细胞抗原和检测t细胞免 疫反应成为近年来研究热点。bcg基因组中的某些片段相对于牛型结核分枝杆菌或结核分枝杆菌h37rv来说发生缺失,这些缺失片段被定义为rd区(regionofdeletion,rd)。一种以t细胞为基础的γ-干扰素释放试验(interferon-γreleaseassay,igras)得到较为广泛的应用,其原理是受到结核分枝杆菌特异性rd区抗原刺激而致敏的t细胞,再次遇到同类抗原时能产生γ-干扰素,对全血或分离的外周血单核细胞在结核分枝杆菌特异性抗原刺激后产生的γ-干扰素进行检测,就可以反映机体是否存在潜伏性的结核感染。目前获得商品化应用的igras主要有2种方法,一种称为quantiferon(qft)-tbgold试验(cellestis,victoria,australia),另一种称为t-spot.tb试验(oxfordimmunotec,oxford,uk)。这两种检测方法所采用的结核分枝杆菌特异性的抗原为esat-6(earlysecretedantigenictarget6)和cfp-10(culturefiltrateprotein10),其编码基因位于rd1(regionofdifference1)区,rd1在bcg和绝大多数非结核分枝杆菌的基因组中是缺失的,理论上可以避免上述在tst中影响特异性的ppd交叉抗原反应,能够较好地区分真性结核感染和bcg接种诱导的反应。
但上述esat-6、cfp-10抗原属于结核杆菌早期分泌蛋白,主要在结核杆菌的快速生长期分泌,而在结核持续感染中分泌量减少,导致检测的敏感性不足,局限了该试剂的推广。另有研究显示上述两种igras试剂在发展中国家的效果并不理想,推测可能与发展中国家非结核分枝杆菌的感染率较高有关。此外该两种igras试剂价格昂贵,在发展中国家难以得到广泛应用。
由于目前结核病实验室诊断存在各种不足,因此对于结核病尚无法作出准确快速的诊断,加之临床上早期感染、潜伏感染、免疫缺陷合并结核感染、肺外结核诊断困难,因此急需开发快速、特异,能用于诊断结核早期感染和潜伏 感染(ltbi),能在免疫功能低下者使用,并能用于诊断肺外结核的结核分枝杆菌检测新技术。
技术实现要素:
本发明的目的是为了克服现有技术的缺陷,提供一种检测结核分枝杆菌感染的试剂,其含有seqidno.1代表的多肽。它能有效地检测活动性结核病和结核潜伏感染。
本发明的另一个目的是提供一种检测结核分枝杆菌感染的方法,本方法基于细胞介导的免疫反应,使用seqidno.1的多肽pp4刺激结核杆菌感染后的受检者(宿主)外周血全血淋巴细胞或单个核细胞(pbmc),并通过检测激活的细胞释放细胞因子ifn-γ的水平,从而确定受检者(宿主)是否感染结核分枝杆菌。
本发明的目的还在于进一步提供基于上述多肽的诊断试剂盒和其应用。
本发明所述多肽片段,是通过t细胞抗原表位分析筛选的具有高度敏感性和特异性的多肽片段。该片段来自毒性结核杆菌特有而bcg中缺失的rd区抗原,对该rd区抗原,通过生物信息学方法根据亲水性、疏水性的不同,分为pp1-pp13各肽段,利用多肽合成技术人工合成覆盖抗原蛋白全长的不同大小多肽片断,通过比较不同多肽片断t细胞免疫效果,从而确定pp4为优势t细胞抗原表位。
所述结核杆菌感染,通常指的是活动性结核病或潜伏性结核感染的人群。机体在感染结核分枝杆菌后,只有少数发展成为活动性结核病,表现出相应的临床症状,如发热、咳嗽、胸片异常等。大多数人感染后由于机体免疫系统控制结核杆菌复制,而无相应的临床症状,但机体无法将结核杆菌全部清除,即 潜伏性结核感染(ltbi)。潜伏性结核感染者在免疫力低下等情况下可以发展成为活动性结核病。因此本方法不仅可用于活动性结核病的诊断,还可以在高危人群中对潜伏性结核感染者进行筛查。
上述方法所述t细胞在感染后被结核杆菌的抗原预先致敏,这些t细胞可在宿主的外周血液、淋巴结及其它包含t细胞的组织和体液中被检出。此t细胞主要是cd4+t细胞,也可以是cd8+t细胞等。
本方法中所述的识别,通常是指mhc-肽复合物与tcr(t细胞受体)特异的结合而诱发的t细胞的激活,t细胞激活后开始分泌相关细胞因子(ifn-γ),通过测定细胞因子的含量变化,可以反映t细胞激活的状态。此外,激活的t细胞也会发生大小、数量(增殖)或表面标志的改变。测定细胞因子的方法通常是领域内常用的方法,如elisa、elispot、细胞内细胞因子染色(包括流式细胞术等)、immunoblotting、t细胞增殖试验等。具有代表性的是采用预先加入的抗体与分泌的细胞因子相结合,通过测定抗体或抗体复合物的存在来检测所述的因子。所述抗体可以是单克隆或多克隆抗体,也可以是商品化购买的或者使用标准技术制备的。
在一个实施方案中,本发明采用elisa方法检测不同肽段刺激t细胞分泌的特异性γ干扰素,从而衡量不同肽段刺激t细胞免疫效果。各肽段中,pp4肽段(箭头所示)刺激t细胞分泌的特异性γ干扰素水平最高。elisa方法操作简便,有商品化试剂盒可以应用,适合大量标本的检测。
在另一个实施方案中,使用的检测方法是酶联免疫斑点法,即elispot方法来检测t细胞分泌的ifn-γ。ifn-γ先与固定在固相载体上的ifn-γ单克隆抗体结合形成一抗复合物,再与用生物素偶联的第二ifn-γ抗体结合,然后使用亲 和素-碱性磷酸酶结合物与生物素特异结合。最后通过酶的显色底物在固相载体上形成斑点,每个斑点代表一个分泌ifn-γ的t细胞,斑点的数量可以代表性显示被激活的t细胞的数量。
本发明的另一个目的,提供了pp4肽段联合t-spot.tb试验(oxfordimmunotec,oxford,uk)所用ce多肽刺激t细胞,检测分泌的特异性γ干扰素,从而衡量其刺激t细胞免疫效果。使用的检测方法是酶联免疫斑点法。其结果是联合使用t-spot.tb所用多肽,cutoff值无变化,但敏感性进一步提高。
本发明的再一个方面,提供了实施此方法的试剂盒,所述的试剂盒应包括seqidno.1的肽段pp4或pp4和t-spot.tb试验(oxfordimmunotec,oxford,uk)所用ce多肽的组合,以及一种检测t细胞对相应多肽识别的工具。这种工具可以是一种检测该抗原多肽刺激受检者(宿主)外周血全血淋巴细胞或单个核细胞(pbmc)活化产生细胞因子ifn-γ的试剂盒,此试剂盒中包含ifn-γ抗体。所述的试剂盒中的多肽可以是单独使用,也可以混合或连续使用,以提高检测的敏感性。如实施例2中使用混合多肽。
试剂盒中还包括阳性对照和阴性对照。阳性对照所选用的t细胞活化剂对绝大多数个体的t细胞均能产生应答,如市售的pha(植物血凝素)。阴性对照通常不加入抗原成分,选用培养基或其他缓冲液。
本发明采用结核分枝杆菌t细胞抗原表位多肽刺激从受检者外周血分离的t淋巴细胞,通过elispot技术检测其分泌的特异性γ干扰素,用于检测受检者是否感染结核分枝杆菌,以用于结核病的诊断,以及潜伏感染的辅助诊断。其检测的结果与临床上现有的t-spot.tb较好的一致性,但本发明检测覆盖的t细胞抗原表位与t-spot.tb所采用的cfp10-esat6多肽(简称:ce多肽)不 同的rd区抗原多肽,因而能检测到t-spot.tb漏检的结核病人。联合使用t-spot.tb所用ce多肽,较单独使用各抗原多肽敏感性提高。本发明所述的多肽可由全自动化的仪器合成,费用较低,质量有保证,适合于在发展中国家进行临床诊断和对高危人群进行筛查。
附图说明
图1结核分枝杆菌优势t细胞表位的筛查
a..elisa法检测不同肽段刺激小鼠脾细胞分泌的特异性γ干扰素水平;
b..elisa法检测不同肽段刺激人外周血单个核细胞(pbmc)分泌的特异性γ干扰素水平;
c.不同肽段刺激致敏小鼠发生dth产生硬结的直径。
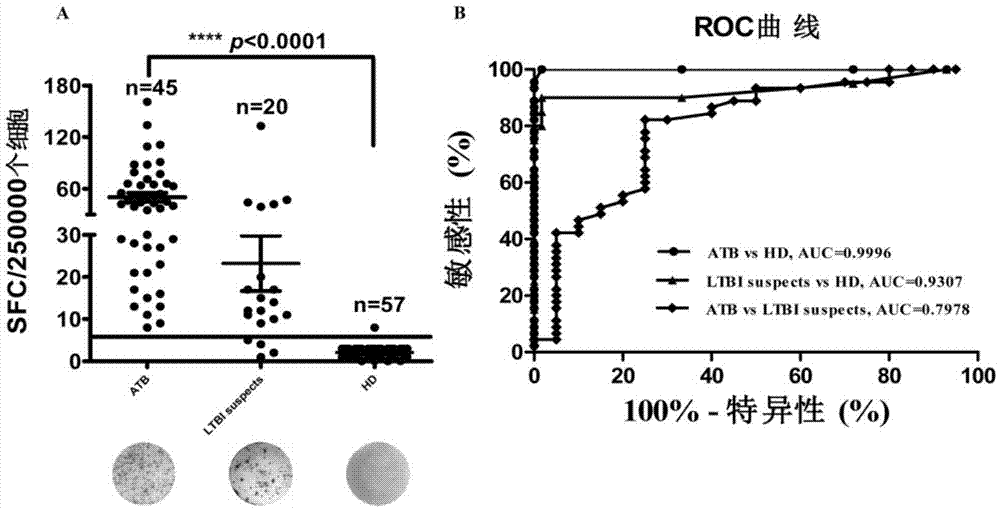
图2.elispot检测结核病人γ干扰素释放水平
a.活动性结核病人(atb,activetb),潜伏感染者(ltbi,latenttbinfection)和健康对照(hd,healthydonor)的人外周血分离的pbmc在经过结核抗原多肽刺激后释放的特异性γ干扰素水平比较;
b.结核抗原多肽pp4的elispot检测的roc曲线;由图中可以看出结核抗原多肽pp4的elispot检测能很好地区分结核病人(atb)和健康对照(hd),反映为曲线下面积(●)达0.9996;同时该检测也能很好地区分潜伏感染者(ltbi)和健康对照(hd),反映为曲线下面积(▲)达0.9307;此外,该pp4多肽的elispot检测也能一定程度上区分结核病人(atb)和潜伏感染者(ltbi),反映为曲线下面积(◆)达0.7978。
图3.分别用pp4以及该多肽联合ce多肽进行刺激,elispot检测结核病人γ干扰素释放水平
a.分别用pp4以及该多肽联合t-spot.tb所用ce多肽进行刺激,结核病人(atb)和健康对照(hd)结核抗原多肽pp4特异性γ干扰素释放水平比较,及相应elispot检测代表性结果;由图中可以看出,以结核抗原多肽,或以该多肽联合t-spot.tb所用ce多肽刺激,结核病人γ干扰素释放水平均高于健康对照(p<0.0001),通过youden指数确定cutoff值,结果显示本发明所述方法敏感性达90.00%,特异性达98.25%,诊断准确率达94.39%,如联合使用t-spot.tb所用多肽,此时cutoff值无变化,但敏感性进一步提高,达95.92%,诊断准确率达97.17%,
b.分别用pp4以及该多肽联合t-spot.tb所用ce多肽进行刺激,elispot检测的roc曲线;由图中可以看出,单独使用pp4多肽,roc曲线下面积(auc)为0.9564,联合使用t-spot.tb所用多肽时,roc曲线下面积(auc)为0.9821。
具体实施方式
通过以下详细说明结合附图可以进一步理解本发明的特点和优点。所提供的实施例仅是对本发明方法的说明,而不以任何方式限制本发明揭示的其余内容。下列实施例中的实验方法,如无特别说明,均为常规方法。
【实施例1】结核分枝杆菌抗原优势t细胞表位的筛查
我们首先通过多肽合成技术人工合成不同结核分枝杆菌抗原多肽片断,该片段来自毒性结核杆菌特有而bcg中缺失的rd区抗原,对该rd区抗原,通过生物信息学方法根据亲水性、疏水性的不同,分为pp1-pp13各肽段(如表1),利用多肽合成技术人工合成覆盖抗原蛋白全长的不同大小多肽片断(pp1-pp13各肽段),比较不同多肽片断t细胞免疫效果,从而确定的新型优势强t细胞抗原表位。
表1.人工合成结核分枝杆菌的rd13区的部分不同多肽片断。
对t细胞优势表位的筛查,是通过elisa方法检测不同肽段刺激t细胞分泌的特异性γ干扰素,从而衡量不同肽段刺激t细胞免疫效果。
通过小鼠结核感染模型分离的脾细胞和结核病人外周血分离的pbmc两种方式,检测不同肽段刺激t细胞免疫效果。小鼠脾细胞由经ih37rv免疫的雌性balb/c小鼠(n=5,6-8周)中获得,人pbmc由结核病人外周血分离(n=10,年龄范围19-65岁,平均年龄44.5岁)。
检测不同肽段刺激t细胞分泌的特异性γ干扰素时,首先对elisa板通过抗γ干扰素的单抗包被96孔板孔,再加入2.5×105细胞(小鼠脾细胞或人pbmc),分别与20μl5μg/ml不同肽段在无血清培养基中共培养24h。5.24小时后,弃掉孔内的细胞和培养基,加冰冷的ddh2o200μl/well,4oc冰箱放置10min,低渗裂解细胞。弃掉孔内的液体,pbst洗板,200μl/well,洗涤5次,每次1min。将稀释好的生物素标记的igg加入微孔,100μl/孔,37℃,1小时。弃掉检测抗体,pbst洗板5次,加100μl/well的酶联亲和素(streptavidin-hrp),孵 育37℃,1h。洗板后,加入配制好的100μl显色液避光显色30min。100μl/well加入tmb,37℃避光孵育5-30min,根据孔内颜色深浅(浅蓝色)来判定终止反应。由显色反应确定不同肽段刺激t细胞分泌的特异性γ干扰素水平,结果见图1a和b。图1a和b为不同肽段刺激t细胞分泌的特异性γ干扰素水平,各肽段中,pp4肽段(箭头所示)刺激t细胞分泌的特异性γ干扰素水平最高。
同时通过对经ih37rv(65度1小时热灭活的h37rv)免疫的雌性balb/c小鼠(n=5,6-8周),利用不同肽段进行皮试,由产生的迟发型超敏反应(delayedtypehypersensitivity,dth)进一步证实不同肽段刺激t细胞免疫效果,结果见图1c。图1c为不同肽段刺激致敏小鼠发生dth产生硬结的直径,各肽段中,pp4肽段(箭头所示)刺激产生的硬结平均直径最大。
由此确定pp4肽段为结核分枝杆菌rd13区抗原的优势t细胞表位。
【实施例2】elispot检测结核病人γ干扰素释放水平
采用所述优势t细胞表位多肽pp4进行刺激,对45名结核病人(atb,无免疫功能低下患者,有tb临床症状和x光检查发现异常,结核杆菌培养确诊)、20名医护人员(ltbi,无tb临床症状和x光检查发现异常,无免疫缺陷等其他异常,结核病院工作长期结核接触史)和57名健康对照(hd,无tb临床症状和x光检查发现异常,无免疫缺陷等其他异常,无结核接触史)进行检测,具体步骤如下:
(1)包被:γ干扰素单抗(100μl1:60稀释)包被96孔酶标板(elisa板):即在elisa板中加入1:60稀释的γ干扰素单抗100μl/孔,37℃孵育l-2h,或4℃过夜;弃包被液,用pbs洗板3次,3min/次;
(2)封闭:每孔加200μl含1-3%bsa的pbs,37℃孵育1-2h;弃封闭液, 将板放于密封袋中,置4℃保存备用;
(3)分离外周血单个核细胞:取5ml血液加入含肝素钠的采血管,在采集血液后和实验前颠倒混匀5次以上避免血液分层;按1:3的比例将抗凝血缓缓加入到含ficoll分离液的无菌离心管中,在室温下2000-3000rpm离心20-30min,吸取pbmc;加入8ml预热至37℃的无血清培养液,混悬后,于室温2000rpm离心l0min;弃去上清培养液,加入6ml预热至37℃的无血清1640培养液重悬沉淀细胞,于室温1500rpm离心8min;弃去上清洗液,加入400μl预热至37℃的无血清培养液重悬沉淀细胞,取10μl细胞悬液加入40μl台酚蓝,取l0μl台酚蓝混合细胞液加入血球计数板,在显微镜下计数,计数每ml悬液细胞数量,用预热至37℃的无血清培养液稀释细胞悬液至2×l06细胞/ml;
(4)抗原刺激:每孔中加入2×l05细胞,再加入结核分枝杆菌抗原多肽(浓度5μg/ml,用量20μl)刺激,同时设立阴性对照(不加刺激物)、阳性对照(植物凝集素pha,50μl60μg/ml),利用无血清培养基培养37℃5%co218-24小时;弃培养上清液,用pbs洗板4次,3min/次,洗板后甩干;
(5)显色:在每个孔中加入100μl用含2%bsa的pbs稀释成1:60的生物素标记的γ干扰素检测抗体,置37℃孵育1小时;孵育后用pbs洗板3次,3min/次,洗板后甩干,加入100μl用pbsl:1000倍稀释的亲和素-碱性磷酸酶结合物(ap-avidin),置37℃孵育2小时;每孔加入100μl显色底物(硝基四唑氮蓝/5-溴-4-氯-3-吲哚磷酸,nbt/bcip),放置于室温闭光显色;在96孔滤膜板中加入纯净水终止反应,室温下过夜凉干96孔滤膜板;
(6)检测计数:将96孔滤膜板放入酶联斑点图像自动分析仪,计数每个反应孔中的紫色斑点,每个点代表1个分泌γ干扰素的t细胞(spotformingcell, sfc);
(7)结果判定:阴性对照孔斑点数少于10个斑点,阳性对照孔斑点数大于20个,结果确定否则复查;再依据以下标准确立检测结果为阳性:阴性对照孔斑点数0-5个斑点时,(抗原孔-阴性对照孔)斑点数≥6;阴性对照孔斑点数6-10个斑点时,抗原孔斑点数≥2×阴性对照孔斑点数。
对45名结核病人(atb)、20名潜伏感染者(ltbi)和57名健康对照(hd)进行检测结果,见图2。如图2a所示,以结核抗原多肽刺激,结核病人(atb)γ干扰素释放水平高于健康对照(hd)(p<0.0001),潜伏感染者(ltbi)γ干扰素释放水平高于健康对照(hd)(p<0.0001),结核病人(atb)γ干扰素释放水平高于潜伏感染者(ltbi)(p=0.0001)。对应实际诊断应用中,如图2b所示,结核抗原多肽pp4elispot检测能很好的区分结核病人(atb)和健康对照(hd),反映为曲线下面积(●)达0.9996;同时该检测也能很好的区分潜伏感染者(ltbi)和健康对照(hd),反映为曲线下面积(▲)达0.9307;此外,该pp4多肽elispot检测也能一定程度上区分结核病人(atb)和潜伏感染者(ltbi),反映为曲线下面积(◆)达0.7978。
【实施例3】分别用优势t细胞表位多肽以及该多肽联合t-spot.tb所用ce多肽进行刺激,elispot检测结核病人γ干扰素释放水平。
利用本发明所述结核感染诊断酶联免疫斑点-elispot试剂盒,分别用所述优势t细胞表位多肽以及该多肽联合t-spot.tb所用ce多肽进行刺激,对50名结核病人(tb,有tb临床症状和x光检查发现异常,结核杆菌培养确诊,含2名结核/艾滋共感染患者和3名75岁以上老年人,分别是78,80和82岁)和56名健康对照(hd,无tb临床症状和x光检查发现异常,无免疫缺陷等 其他异常,无结核接触史)进行检测,具体步骤如下:
(1)包被:γ干扰素捕获抗体(100μl1:60稀释)包被酶标板,elisa板中加入1:60稀释的γ干扰素捕获抗体100μl/孔,37℃孵育l-2h,或4℃过夜;弃包被液,用pbs洗板3次,3min/次;
(2)封闭:每孔加200μl含1-3%bsa的pbs,37℃孵育1-2h;弃封闭液,将板放于密封袋中,置4℃保存备用;
(3)分离外周血单个核细胞:取5ml血液加入含肝素钠的采血管,在采集血液后和实验前颠倒混匀5次以上避免血液分层;按1:3的比例将抗凝血缓缓加入到含ficoll分离液的无菌离心管中,在室温下2000-3000rpm离心20-30min,吸取pbmc;加入8ml预热至37℃的无血清培养液,混悬后,于室温2000rpm离心l0min;弃去上清培养液,加入6ml预热至37℃的无血清1640培养液重悬沉淀细胞,于室温1500rpm离心8min;弃去上清洗液,加入400μl预热至37℃的无血清培养液重悬沉淀细胞,取10μl细胞悬液加入40μl台酚蓝,取l0μl台酚蓝混合细胞液加入血球计数板,在显微镜下计数,计数每ml悬液细胞数量,用预热至37℃的无血清培养液稀释细胞悬液至2×l06细胞/ml;
(4)抗原刺激:每孔中加入2×l05细胞,再加入结核分枝杆菌抗原多肽(pp4)(浓度5μg/ml,用量20μl)或结核分枝杆菌抗原多肽+ce多肽(浓度分别是5μg/ml,1:1混合,总量20μl)刺激,同时设立阴性对照(不加刺激物)、阳性对照(植物凝集素pha,50μl60μg/ml),利用无血清培养基培养37℃5%co218-24小时;弃培养上清液,用pbs洗板4次,3min/次,洗板后甩干;
(5)显色:在每个孔中加入100μl用含2%bsa的pbs稀释成1:60的生物素标记的γ干扰素检测抗体,置37℃孵育1小时;孵育后用pbs洗板3次, 3min/次,洗板后甩干,加入100μl用pbsl:1000倍稀释的亲和素-碱性磷酸酶结合物(ap-avidin),置37℃孵育2小时;每孔加入100μl显色底物(硝基四唑氮蓝/5-溴-4-氯-3-吲哚磷酸,nbt/bcip),放置于室温闭光显色;在96孔滤膜板中加入纯净水终止反应,室温下过夜凉干96孔滤膜板;
(6)检测计数:将96孔滤膜板放入酶联斑点图像自动分析仪,计数每个反应孔中的紫色斑点,每个点代表1个分泌γ干扰素的t细胞(spotformingcell,sfc);
(7)结果判定:阴性对照孔斑点数少于10个斑点,阳性对照孔斑点数大于20个,结果确定否则复查;再依据以下标准确立检测结果为阳性:阴性对照孔斑点数0-5个斑点时,(抗原孔-阴性对照孔)斑点数≥6;阴性对照孔斑点数6-10个斑点时,抗原孔斑点数≥2×阴性对照孔斑点数。
对50名结核病人和56名健康对照进行检测结果,见图3。如图3a所示,以结核抗原多肽刺激,结核病人γ干扰素释放水平高于健康对照(p<0.0001),通过youden指数确定cutoff值,结果显示本发明所述方法敏感性达90.00%(未检出的结核患者中,含2名结核/艾滋共感染患者和3名75岁以上老年人(分别是78,80和82岁),此类患者免疫功能低下,因而无法对结核抗原做出有效的免疫应答,故而结果呈阴性),特异性达98.25%,诊断准确率达94.39%,如联合使用t-spot.tb所用多肽,此时cutoff值无变化,但敏感性进一步提高,达95.92%,诊断准确率达97.17%。如图3b所示,单独使用pp4多肽,roc曲线下面积(auc)为0.9554,联合使用t-spot.tb所用多肽时,roc曲线下面积(auc)为0.9814。
【实施例4】elispot检测与t-spot比较,用于检测结核病人γ干扰素释放水 平
结核抗原多肽elispot检测方法同上,t-spot.tb检测按照oxfordimmunotec产品说明书操作规程进行,比较50名结核病人结核抗原多肽elispot和t-spot.tb检测结果(表2),表明结核抗原多肽elispot和t-spot.tb检测方法一致率kappa=0.898,提示两种方法有极好的相符性和一致性。
表2.结核抗原多肽elispot检测与t-spot.tb检测结核病人结果比较
方法一致率kappa=0.898,一致率(percentageofagreement)=98.0%。
该5个病人,其中2人为结核/艾滋共感染,3人为75岁以上老年人(分别是78,80和82岁),此类患者免疫功能低下,因而无法对结核抗原作出有效的免疫应答,故而结果呈阴性。
【实施例5】elispot检测与t-spot比较,用于检测一线医疗工作者(可疑潜伏感染者)γ干扰素释放水平
结核抗原多肽elispot检测方法同上,t-spot.tb检测按照oxfordimmunotec产品说明书操作规程进行,比较12名一线医疗工作者(可疑潜伏感染者)结核抗原多肽elispot和t-spot.tb检测结果(表3),表明结核抗原多肽elispot和t-spot.tb检测方法对于一线医疗工作者(可疑潜伏感染者)检测一致。
表3.结核抗原多肽elispot与t-spot.tb检测一线医疗工作者(可疑潜伏感染者)结果比较
- 还没有人留言评论。精彩留言会获得点赞!