多价多特异性抗体及免疫杂合蛋白的表达和制备方法与流程
本发明属于生物技术领域,具体涉及一种多价多特异性抗体及免疫杂合蛋白的表达和制备方法。
背景技术:
双特异性抗体是指可以同时识别两个抗原或者两个表位的一个抗体分子,诸如能够结合两种以上抗原的双特异性或者多特异型抗体在本领域中是已知的,可以通过细胞融合法,化学修饰法,基因重组等法,在真核表达系统或者在原核表达系统中获得。与此类似,多特异性抗体是指可以同时识别两个以上抗原或者多个表位的一个抗体分子,免疫杂合蛋白是指具有一个或多个特异抗体并和细胞因子或多肽毒素或其他具有生物活性的多肽分子杂合的免疫杂合蛋白。
药理学研究揭示,多数复杂疾病都涉及多种与疾病相关的信号通路,例如肿瘤坏死因子TNF、白介素6等多种促炎症细胞因子同时介导免疫炎性疾病,而肿瘤细胞的增殖往往是由多个生长因子受体的异常上调造成的。单一信号通路的阻断通常疗效有限,而且容易形成耐药性。在肿瘤治疗方面,由于多数癌细胞表面的MHC的表达下调甚至缺失,从而逃逸免疫杀伤。双功能抗体可以同时结合免疫细胞,和肿瘤细胞,将免疫细胞富集定位到肿瘤上去。因此,开发能够同时结合两个不同靶点的双功能抗体及其多于两个不同靶点的特异抗体等,长期以来成为新结构抗体研发的重要领域。
双功能抗体的一个重要机制是介导T细胞杀伤。近年来,随着对癌细胞免疫逃逸机制认识的深入和肿瘤免疫治疗(cancer immunotherapy)的兴起,激活T细胞的抗体药物研究备受重视。通常认为有效激活T细胞需要双重信号,第一信号来自抗原提呈细胞上MHC-抗原复合物与T细胞受体TCR-CD3的结合,第二信号为T细胞与抗原提呈细胞表达的共刺激分子相互作用后产生的非抗原特异性共刺激信号。由于多数癌细胞表面的MHC的表达下调甚至缺失,从而逃逸免疫杀伤。CD3×双功能抗体则能够分别结合T细胞表面CD3分子和癌细胞表面抗原,从而拉近细胞毒性T细胞(cytotoxic T cell,Tc或CTL)与癌细胞的距离,引导T细胞直接杀伤癌细胞,而不再依赖于T 细胞的双重激活信号(Baeuerle.P.A.,Cancer Res(癌症研究)69(2009)4941-4944)。CD3×双功能抗体独特的T细胞激活方式被认为是其作用机制上的重大优势。多特异抗体还可在利用几种不同的机理进行抗肿瘤或其他治疗方面的用途。
双功能抗体的另一个重要的作用机制是同时结合双靶点,阻断双信号通路。该机制的应用范围更为广泛,包括肿瘤、自身免疫性疾病、抑制血管生长和抗感染等方面的治疗。以在细胞生理过程中发挥重要调节作用的跨膜酪氨酸激酶受体HER家族为例,该家族包括HER1(erbB1、EGFR),HER2(erbB2、NEU),HER3(erbB3)及HER4(erbB4)等成员,在很多上皮来源的实体瘤细胞表面异常高表达,是肿瘤靶向治疗的重要靶点。已经上市的抗体有结合HER2D4结构域的赫赛汀单抗、结合HER2D2结构域的帕妥珠单抗(Perjeta)以及结合HER1/EGFR的爱必妥单抗(Erbitux)等,广泛应用于乳腺癌、胃癌、结直肠癌等实体瘤的临床治疗。研究揭示,HER家族成员自身或不同成员之间的同源或异源二聚体激活细胞内信号,促进细胞增殖、肿瘤发展。赫赛汀抗体阻断HER2受体同源二聚,但不能阻断HER2与其他受体间的异源二聚。HER2与HER3是HER家族激活初始致癌信号的最强二聚体形式,在临床上将能够阻断该二聚化的帕妥珠单抗与赫赛汀联用,取得了比单个抗体更好的疗效,揭示了双靶点阻断的临床效果(Kristjansdottir.K.,Expert Opin biol Ther(生物治疗的专家意见)10(2010)243-250)。
具有对某个抗原或靶点具有特异性的抗体和细胞因子融合可合成免疫细胞因子,这些免疫细胞因子具有抗肿瘤的特异活性并在临床上进行实验(Gillies SD.Immunocytokines:a novel approach to cancer immune therapy.Targeted Cancer Immune Ther 2009:241–56;List T,Neri D.Immunocytokines:a review of molecules in clinical development for cancer therapy.Clin Pharmacol 2013;5:29–45;List T,Casi G,Neri D.A:Chemically Defined Trifunctional Antibody–Cytokine–Drug Conjugate with Potent Antitumor Activity.Mol Cancer Ther November 2014 13;2641)。
杂合蛋白是指具有不同功能的蛋白融合在一起。部分抗体的区域(如FC)和具有特别生物活性或功能的蛋白/多肽融合表达可产生具有特别临床效果的生物药物。如在国际市场上销售多年处于前茅的药物恩博(Enbrel,或etanercept)是一种肿瘤坏死因子受体的可溶部分和抗体的FC片段的杂合蛋白。这类杂合蛋白成为上市药物的还有很多种,说明杂合蛋白具有广泛的应用价值。目前,制备杂合蛋白的方法只有在一种宿主 细胞(原核的或真核的)中进行重组DNA的表达,这在结构上会受到很大的限制。
自从单克隆抗体于1957年被Kohlor应用杂交瘤技术首次制备出来,其就在医学研究以及疾病的临床诊断和治疗领域展示出了广阔的应用前景。长期以来,人们致力于利用单克隆抗体治疗多种疾病,例如肿瘤、自身免疫疾病等等,然而单独使用单克隆抗体的效果有时并不理想。为了达到更有效的治疗效果,人们将一些具有细胞毒性的蛋白与单抗结合,形成了具有选择性杀伤与之相结合的细胞的“免疫毒素”。为疾病的靶向治疗的弹药库装备了新的弹药。
免疫毒素(immunotoxins,ITs)是指将具有导向功能的蛋白与毒素蛋白相结合而产生的一种蛋白分子。其中具有导向性功能的部分主要负责引导免疫毒素蛋白分子与靶细胞的特异性结合,而毒素蛋白部分则主要是起到对细胞进行杀伤的作用。
从免疫毒素发展演变的进程来看,免疫毒素的制备生产主要有化学偶联法和重组表达法两大类。化学偶联法制备免疫毒素首先需要单独制备抗体和毒素,随后通过化学偶联的方式将二者相连而制得免疫毒素。化学偶联法的偶联效率低,生产成本较高,且由于蛋白上可能发生偶联反应的位点众多而导致产品均一性差,另外偶联的化学键在体内循环时倾向于降解,使得裸毒素泄露而导致非特异性毒性,有较大的毒副作用风险,而降解产生的裸抗体则可能封闭抗原,使得治疗效果不佳。而随着基因工程的发展,使得免疫毒素的制备生产进入了新的时代。人们利用基因重组技术将编码导向功能多肽的基因与编码毒素多肽的基因相融合并在适当的表达系统中进行表达。采用这一技术方案生产的免疫毒素我们可以称之为基因工程免疫毒素,它相比化学偶联法制造的免疫毒素而言在产品均一性和稳定性上有了大幅提高,并且使得大量生产免疫毒素成为可能。但基因工程法生产免疫毒素也有其局限性:融合基因被限制在单一宿主中进行表达,而构成免疫毒素的导向部分和毒性部分往往需要不同的宿主表达环境这一矛盾往往导致采用单一的宿主表达目的免疫毒素不能获得很好的产量、收率、纯度以及随之而来的成本的提高。例如目前多采用大肠杆菌表达系统表达单链抗体免疫毒素,由于免疫毒素的导向部分在大肠杆菌表达系统中不能很好的折叠而往往形成包涵体,而包涵体的复性是一个非常复杂的过程,一般来说,蛋白质的复性效率在20%左右;而毒素蛋白对真核细胞具有致命毒性,若采用真核表达系统则可能对宿主细胞产生毒害,但是也有研究人员对利用真核表达系统表达免疫毒素做了大量的工作,如专利CN1863921公开了一种在毕赤酵母以及EF-2突变型毕赤酵母中表达免疫毒素的方法,虽然采用分泌表达的方式在毕赤酵母以及EF-2突变型(毒素免疫型)毕赤 酵母表达系统中成功表达了免疫毒素,较长的发酵周期获得的较低的产量相比于原核表达系统而言并不具备竞争力,且毒素蛋白上的糖基化位点可能被宿主进行糖基化修饰,有可能引入产品不均一性;文献披露了一种在EF-2突变型的CHO细胞中表达免疫毒素的方法,该方法同样遭遇了表达量低下、发酵周期长、成本高昂以及潜在的糖基化的风险(Protein expression and purification,2000,19(2):304-311)。
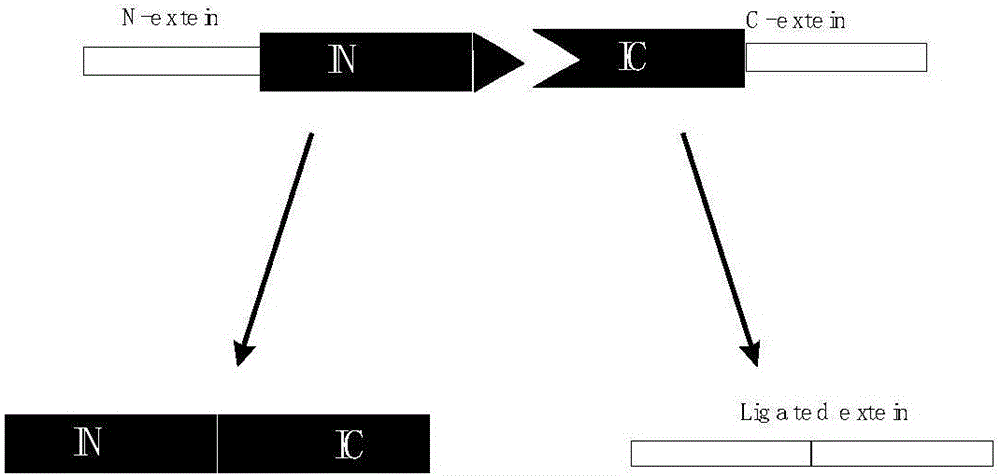
断裂型蛋白质内含子(split intein)是由N-端蛋白质剪接区域(In,N-fragment of intein)和C-端蛋白质剪接区域(Ic,C-fragment of intein)两部分组成,表达前体蛋白质的基因被分裂在两个开放阅读框中,断裂位点是在蛋白质内含子序列的内部。N-端蛋白质外显子(En)与断裂型蛋白质内含子的N-端(In)的基因形成融合基因,翻译形成的融合蛋白称为N-端前体蛋白质。而断裂型蛋白质内含子的C-端(Ic)与C-端蛋白质外显子(Ec)的表达基因形成融合基因,翻译后产生的融合蛋白称为C-端前体蛋白质。单独的断裂型蛋白质内含子的N-端(In)或C-端(Ic)不具有蛋白质剪接功能,但是在蛋白质翻译以后,N-端前体蛋白质中的In与C-端前体蛋白质的Ic通过互相识别以非共价键结合,形成有功能的蛋白质内含子,能够催化蛋白质反式剪接反应,以肽键将两个分离的蛋白质外显子(En、EC)连接起来(Ozawa.T.,Nat Biotechbol(自然技术)21(2003)287-93)。
蛋白质反式剪接(protein/ram-splicing)是指由断裂型蛋白质内含子介导的蛋白质剪接反应。在这种类型的剪接过程中,首先是断裂蛋白质内含子的N-端片段(IN)和C-端片段(IC)相互识别并以非共价键结合,一者结合后正确折脊其结构,重建活性中心的断裂行蛋白质内含子按照典型的蛋白质剪接途径完成蛋白质剪接反应,将两侧的蛋白质外显子的连接(Saleh.L.,Chemical Record(化学档案)6(2006)183-193)。
最近已经开发了广泛多样的重组双特异性抗体形式,例如通过融合例如IgG抗体形式和单链结构域的四价双特异性抗体(参见例如Coloma,M.J.,等,Nature Biotech.(自然生物技术)15(1997)159-163;WO 2001077342;和Morrison,S.,L.,Nature Biotech.(自然生物技术)25(2007)1233-1234)。由于与天然抗体结构相差大,进入体内之后会引起强烈的免疫反应以及较短的半衰期。
此外,开发了能够结合两种以上抗原的若干其他新型形式,其中抗体中心结构(IgA,IgD,IgE,IgG或IgM)不再保持的小分子抗体。诸如双抗体、三链抗体或四链抗体,微型抗体(minibodies),若干单链形式(scFv双-scFv)(Holliger,P.,等,Nature Biotech(自然生物技术)23(2005)1126-1136;Fischer,N.,和Léger,O.,Pathobiology(病理学)74(2007)3-14;Shen,J.,等,J.Immunol.Methods(免疫学方 法杂志)318(2007)65-74;Wu,C.,等.,Nature Biotech(自然生物技术)25(2007)1290-1297)。虽然这种将抗体的核心结合区域通过linker(连接肽)与其它抗体核心结合区相连接,虽然对双特异性抗体改造的优势明显,但是也存一些作为药物应用的问题,大大限制了其成药。实际上,这些外源可能引起针对连接肽本身或者蛋白质和连接肽的免疫反应,容易出现免疫风暴。此外,这些连接肽灵活的本质是使的期更倾向于蛋白质的水解分裂,这潜地导致抗体稳定性差,易于聚集,高的免疫原性以及很短的半衰期。例如安进公司的blinatumomab血液中的半衰期只有1.25小时,必须通过注射泵24小时持续给药才能达到治疗效果,大大限制了其应用(Bargou,R和Leo.E.,Scince(科学)321(2008)974-7)。此外人们希望保留抗体的效应功能,诸如CDC(补体依赖的细胞毒性)或者ADCC(细胞毒作用)与血管内壁FcRn(Fc受体)结合的半衰期延长,这些功能必须通过Fc区来介导。
因此,理想的双特异性抗体是开发结构与天然存在抗体(如IgA,IgD,IgE,IgG,IgM)极度相似双特异性抗体,并且其与人抗体序列具有最小的偏离的人源化双特异性抗体以及全人源的双特异性抗体。
1983年首次利用杂交瘤融合技术(quadrom),获得了与天然抗体非常类似的双特异性抗体(Milstein,C和A.C.cuello,Nature(自然),305(1983)537-40)。在所述杂交融合技术中,将两个不同的鼠源单克隆杂交瘤细胞株融合,融合后抗体的生成会存在10种不同的抗体类型,其中只有一种是所需要的双特异性抗体。由于错配产物与目的产物的理化性质十分相似,且目的产物的含量极低,其意味着需要先进的纯化程序来完成,(Morrison,S.L.,Nature Biotech(自然生物技术25(2007)1233-1234)。例如2009年在欧洲上市的双特异性抗体Catumaxomab(Removab)由于抗体时鼠源种属,注射入人体内会发生严重的免疫风暴现象,限制了其前景(Framton.JE.,Drugs(药物)72(2012)1399-410)。同样的利用基因重组表达技术,重链错配和轻链错配现象仍然不能得到解决。
为了解决重链错配问题,提出了“Knobs-into-Holes(杵-进入-臼)”理论,其目的在于通过在抗体的CH3区引入突变,改变接触界面,来迫使两个不同的抗体重链配对。在一条CH3上大空间结构的氨基酸被突变成短侧脸的氨基酸,以形成“Hole(臼)”,相反的,将大侧链的氨基酸引入另一个CH3区域,以形成“Knobs(杵)”。通过共表达两条重链和两条轻链(必须适合于这两条重链)异型二聚体(杵-臼)比同型二聚体(杵-杵)(臼-臼)产率高(Ridgway,J.B.,Protein Eng. (蛋白质工程)9(1996)617-621;和WO96/027011)尽管这种形式非常有吸引力,但是目前不存在临床应用数据,这种策略的一个重要制约是两个母体抗体的轻链必须相同,以防止轻链错配和形成杂质分子。针对轻链错配问题,通过突变改变抗体结合的特异性形成“Two-in-One”二价双特异性抗体,使得同一个抗体特异性结合域可以与两种抗原的结合,这种抗体对每个靶点的结合都是二价的,虽然可以再连接和激活型靶点中得到期望效果,但是对于阻断抗原作用存在一定不足,并且这种方法需要针对每两个抗体序列进行大量的突变等基因工程改造,不能够达到简单通用的目的(Bostrom,J.,Scince(科学)323(2009)1610-1614;Schaefer,G.,Cancer Cell(癌细胞)20(2011)472-486)。此外crossmab(杂交抗体)方法可以优化轻链错配问题,但是将其中一条Fab的轻链和重链的部分结构域互换,形成crossmab(杂交抗体)可以很好的解决,但是杂交抗体含有非天然的结构域连接,失去了天然的抗体结构(Schaefer,W.,Pro.Natl.Acad.Sci.USA(美国科学院院刊)108(2011)1187-1192)。
美国Genentech(基因泰克)公司利用分别表达两个half-antibody(半抗体)的大肠杆菌共培养的方法得到双特异性抗体,但是这种方法表达出来的抗体是没有糖基化修饰的,将影响其ADCC效应以及血液中的半衰期,限制了其成药可能性(Spiess,C.,Nature Biotechnol(自然技术)31(2013)753-758)。为了生产与天然结构相似的,并且含有糖基化修饰的双特异性抗体,Fab的界面处经过结构分析定向基因突变,同时采用“Knobs-into-Holes(杵-进入-臼)”技术通过顺势转染293E细胞来解决轻链错配和重链错配问题,得到了极大的改进,但是该方法必须每一个抗体都经过建立晶体模型来设计适合的突变筛选位点,不能够通用与一切双特异性抗体的构建(Levis,S.M.,Nature Biotechnol(自然技术)32(2014)191-198)。此外cFAE“半抗体交换技术”,通过在CH3区引入突变可以定向半抗体重新结合,通过体外还原将抗体还原为半抗体,再通过氧化为完整抗体,解决了重链错配和轻链错配问题,但是会存在5%的错配现象无法解决,也无法通过纯化方法去除,杂组份的存在极大的限制了cFAE作为药物使用的可能(Labrijin,A.F.,Nature protocol(自然操作方法)9(2014)2045-2463)。
人们致力于建立一种生产双特异性抗体的方法,不存在非天然的结构域,结构与天然抗体(IgA,IgD,IgE,IgG或IgM)结构及其相似,具有Fc结构域,结构完整稳定性好,并且保留了CDC(补体依赖的细胞毒性)或者ADCC(细胞毒作用),并且有FcRn(Fc受体)结合活性体内半衰期长,免疫原性降低;不引入任何形式的linker(连接肽), 提高抗体分子稳定性,降低在体内的免疫反应;可以用于生产人源化的双特异性抗体,以及全人序列的双特异性抗体,序列与人源抗体跟接近,可以有效降低免疫反应的发生;通过哺乳动物细胞表达系统生产,有糖基化修饰,有更好的生物学功能,且更加稳定,体内半衰期长;有效避免了重链错配,错配率可降低为0%,有效避免轻链错配,轻链错赔率可降低为0%;是一种通用型双特异性抗体的构建方法,没有抗体亚型(IgG,IgA,IgM,IgD,IgE,IgM,以及轻链κ和λ型)的限制性,不需要根据具体的靶点设计不同的突变,可以用于构建任何双特异或多特异性的抗体。
技术实现要素:
本发明的目的在于针对上述现有技术存在的不足,提供一种新型的多价多特异性抗体及免疫杂合蛋白的表达和制备方法。本发明首次将双特异性抗体分割为结合抗原A,和结合抗原B两部分,如(图2A,图2B)所示,分别表达,然后通过断裂蛋白内含肽的反式剪接功能将A和B两部分连接成为完整的抗体。A部分含有A抗体的轻链,A抗体的完整重链,以及N端融合了IC的Fc链;B部分含有B抗体的轻链,和C端融合有IN的B抗体的VH+CH1链。此外,如图3所示,除了双特异抗体外,本发明可在抗体分子的结合区域通过蛋白Intein的反式剪接,接上单链(包括对第二个靶点特异结合的VL和VH)、重链和轻链、细胞因子、活性多肽、毒素多肽等。在抗体分子的FC区域的C端,本发明可在抗体分子的结合区域通过蛋白Intein的反式剪接,接上单链(包括对第二个靶点特异结合的VL和VH)重链和轻链、细胞因子、活性多肽、毒素多肽等。
本发明的目的是通过以下技术方案来实现的:
第一方面,本发明涉及一种多价多特异性抗体的表达和制备方法,所述方法包括如下步骤:
S1、将所述多价多特异性抗体的表达序列进行拆分,获得若干部分抗体,包括A部分抗体和B部分抗体;所述A部分抗体包括第一轻链、第一重链和第二重链的Fc链,该Fc链的N端融合了IC;所述B部分抗体包括第二轻链和第二重链的VH+CH1链,该VH+CH1链的C端融合了IN;所述第一轻链和第一重链为特异性结合第一抗原的抗体的第一轻链和第一重链;所述第二轻链和第二重链为特异性结合第二抗原的抗体的第二轻链和第二重链;
S2、经全基因合成构建真核或原核生物表达载体,用瞬转或稳转方法分别表达、制备包括A部分抗体和B部分抗体的所述若干部分抗体;
S3、进行A部分抗体和B部分抗体的体外反式剪接,或是进行A部分抗体、B部分抗体和其他部分抗体的体外反式剪接,即得所述多价多特异性抗体。
优选的,所述第一重链的CH3结构域的界面生成了凸起,所述凸起可以定位在所述N端融合了IC的第二重链的Fc链的CH3结构域的界面内的凹洞中。
优选的,在第一重链的CH3结构域将366位的苏氨酸突变为色氨酸以形成所述凸起;在N端融合了IC的第二重链的Fc链的CH3结构域将366位的苏氨酸突变为丝氨酸,368位的亮氨酸突变为丙氨酸,407位的酪氨酸突变为缬氨酸以形成所述凹洞。
优选的,在第一重链的CH3结构域将354位的丝氨酸突变为半胱氨酸;在N端融合了IC的第二重链的Fc链的CH3结构域将349位的酪氨酸突变为半胱氨酸。
优选的,所述第一重链的CH3结构域的界面生成了凹洞,在所述凹洞内可以定位在所述N端融合了IC的第二重链的Fc链的CH3结构域的界面生成的凸起。
优选的,在第一重链的CH3结构域将366位的苏氨酸突变为丝氨酸,368位的亮氨酸突变为丙氨酸,407位的酪氨酸突变为缬氨酸以形成凹洞;在N端融合了IC的第二重链的Fc链的CH3结构域将366位的苏氨酸突变为色氨酸以形成凸起。
优选的,在第一重链的CH3结构域将349位的酪氨酸突变为半胱氨酸;在N端融合了IC的第二重链的Fc链的CH3结构域将354位的丝氨酸突变为C半胱氨酸。
本发明为了提高CH3区域结合的稳定性,将“Knobs”(凸起)链上354位的S(丝氨酸)突变为C(半胱氨酸),“Holes”(凹洞)链上349位的Y(酪氨酸)突变为C(半胱氨酸)以引入一对重链间二硫键增强重链间的稳定性。
优选的,步骤S2中,真核生物为哺乳动物细胞;经全基因合成构建哺乳动物细胞表达载体具体为:按照拆分设计好的基因序列,进行化学全合成,并且通过PCR在起始密码子和终止密码子两侧加入限制性内切酶酶切位点,分别插入含有CMV启动子的哺乳动物细胞表达载体中,亚克隆测序质粒抽提即可。
优选的,步骤S2中,所述表达为通过哺乳动物细胞表达系统表达。
优选的,步骤S2中,所述哺乳动物细胞为293E、293F或CHO细胞。
优选的,步骤S2的表达产物,通过亲和层析ProteinL,或ProteinA/G层析纯化方法得到;步骤S3中的多价多特异性抗体,通过ProteinA/G层析纯化方法得到。
优选的,步骤S2中,所述瞬转为瞬时转染293-E、293-F或CHO哺乳动物细胞,所述稳转为稳定转染CHO哺乳动物细胞。
优选的,步骤S3中,所述体外反式剪接为在巯基化合物存在条件下进行的断裂 intein介导的体外反式剪接,即断裂蛋白内含肽的反式剪接反应。
优选的,所述体外反式剪接作用的温度为4℃~37℃,时间为5~120min,巯基化合物的浓度为0.05~2mM。
优选的,步骤S3中,还包括将剪接所得产物进行亲和层析纯化的步骤。
优选的,步骤S1中,所述若干部分抗体还包括C部分抗体,所述C部分抗体包括特异性结合第三抗原的抗体的第三单链,所述第三单链的一端融合了IN;所述第一重链的Fc链的C端融合了IC,或是所述第二重链的Fc链的C端融合了IC。
优选的,步骤S1中,所述若干部分抗体还包括C部分抗体和D部分抗体;所述C部分抗体包括特异性结合第三抗原的抗体的第三单链,所述第三单链的一端融合了IN;所述D部分抗体包括特异性结合第四抗原的抗体的第四单链,所述第四单链的一端融合了IN;所述第二重链的Fc链的C端融合了IC,所述第一重链的Fc链的C端融合了IC。
第二方面,本发明还涉及一种免疫杂交蛋白的表达和制备方法,所述方法包括如下步骤:
A1、将所述免疫杂交蛋白的表达序列进行拆分,获得蛋白分子和A部分抗体,或A部分抗体和B部分抗体;所述A部分抗体包括第一轻链、第一重链和第二重链的Fc链,该Fc链的N端融合了IC;所述B部分抗体包括第二单链,该单链的一端融合了IN;所述蛋白分子的一端融合了IN;所述第一轻链和第一重链为特异性结合第一抗原的抗体的第一轻链和第一重链;所述第二重链和第二单链为特异性结合第二抗原的抗体的第二重链和第二单链;
A2、经全基因合成构建真核或原核生物表达载体,用瞬转或稳转方法表达、制备获得A部分抗体,或分别获得A部分抗体和B部分抗体;
A3、进行A部分抗体和蛋白分子的体外反式剪接,或是进行A部分抗体和B部分抗体的体外反式剪接,即得所述免疫杂交蛋白。
优选的,所述蛋白分子包括细胞因子、毒素多肽或活性多肽。
第三方面,本发明还涉及一种免疫杂交蛋白的表达和制备方法,所述方法包括如下步骤:
B1、将所述免疫杂交蛋白的表达序列进行拆分,获得蛋白分子、A部分抗体和B部分抗体;所述A部分抗体包括第一轻链、第一重链和第二重链的Fc链,该Fc链的N端融合了IC;所述B部分抗体包括第二轻链和第二重链的VH+CH1链,该VH+CH1链的C端融合了IN;所述第一轻链和第一重链为特异性结合第一抗原的抗体的第一轻链和第一重链 ;所述第二轻链和第二重链为特异性结合第二抗原的抗体的第二轻链和第二重链;所述蛋白分子的一端融合了IN,所述第二重链的Fc链、第一重链的Fc链中至少一条Fc链的C端融合了IC;
B2、经全基因合成构建真核或原核生物表达载体,用瞬转或稳转方法分别表达、制备获得A部分抗体和B部分抗体;
B3、进行A部分抗体、B部分抗体和蛋白分子的体外反式剪接,即得所述免疫杂交蛋白。
优选的,所述蛋白分子包括细胞因子、毒素多肽或活性多肽。
第四方面,本发明还涉及一种免疫毒素的制备方法,包括如下步骤:
步骤一,将目标免疫毒素的结构序列分割为结构一和结构二;所述结构一为抗体或者抗体片段部分,所述结构二为毒素部分;
步骤二,分别表达结构一和结构二;
步骤三,通过断裂蛋白内含肽的反式剪接反应,将结构一和结构二连接,得到目标免疫毒素。
第五方面,本发明还涉及一种细胞因子融合抗体的制备方法,包括如下步骤:
步骤一,将目标细胞因子融合抗体的结构序列分割为两部分,即结构一和结构二;所述结构一为抗体或者抗体片段部分,所述结构二为细胞因子部分;
步骤二,分别表达结构一和结构二;
步骤三,通过断裂蛋白内含肽的反式剪接反应,将结构一和结构二连接,得到目标细胞因子融合抗体。
第六方面,本发明还涉及一种ADC抗体的制备方法,包括如下步骤:
步骤一,将目标ADC抗体的结构序列分割为两部分,即结构一和结构二;所述结构一为抗体或者抗体片段部分,所述结构二为化合物部分;
步骤二,分别表达结构一和结构二;
步骤三,通过断裂蛋白内含肽的反式剪接反应,将结构一和结构二连接,得到目标ADC抗体。
与现有技术相比,本发明具有如下有益效果:
1)在本发明的方法表达制备双特异抗体时不存在非天然的结构域,结构与天然抗体(IgA,IgD,IgE,IgG或IgM)结构及其相似,具有Fc结构域,结构完整稳定性好,并且保留了CDC(补体依赖的细胞毒性)或者ADCC(细胞毒作用),并且有FcRn(Fc受体) 结合活性体内半衰期长,免疫原性降低;
2)不引入任何形式的linker(连接肽),提高抗体分子稳定性,降低在体内的免疫反应;
3)可以用于生产人源化的双特异性抗体,以及全人序列的双特异性抗体,序列与人源抗体跟接近,可以有效降低免疫反应的发生;
4)通过哺乳动物细胞表达系统生产,有糖基化修饰,有更好的生物学功能,且更加稳定,体内半衰期长;
5)有效避免了重链错配,错配率可降低为0%,有效避免轻链错配,轻链错赔率可降低为0%,从而改善了产品纯化的效率,确保在最终产品中没有错配的杂质污染;
6)本发明的方法是一种通用型双特异性抗体的构建方法,没有抗体亚型(IgG,IgA,IgM,IgD,IgE,IgM,以及轻链κ和λ型)的限制性,不需要根据具体的靶点设计不同的突变,可以用于构建任意双特异性的抗体。
7)本发明也可以应用于Fc片段残缺的双特异性抗体构建,比如Fc区域仅留下部分CH2区,或者留下完整的CH2区域和部分CH3区域。
8)本发明也可以应用于Fab片段残存的双特异性抗体构建,比如A部分为Scfv,B部分为Fab;A部分为Fab,B部分为Scfv;或者A部分为ScfvB部分为Scfv。同时保留完整Fc区域或者残缺Fc区域的双特异性抗体构建。
9)本发明可应用于图5中C组所指示类型的小分子抗体片段,与D组所指示类型的小分子片段抗体,通过断裂intein介导反式剪接形成的双特异性抗体构建。
10)本发明可应用于图21中的任何一组组合以制备一种多价多特异(包括二价双特异)抗体的制备;应用于免疫杂合蛋白(包括免疫细胞因子、免疫毒素等等)的制备。且都采用了Intein反式剪接,在体外制备多特异(包括双特异)抗体;在产物中没有错配杂质,改善了分离纯化的效率。
附图说明
通过阅读参照以下附图对非限制性实施例所作的详细描述,本发明的其它特征、目的和优点将会变得更明显:
图1为断裂蛋白质内含子介导的蛋白质反式剪接示意图;
图2为双特异性抗体分割示意图;其中,A为双特异性抗体分割为A抗体重链Knob型、Fc hole型和B抗体部分示意图;B为双特异性抗体分割为A抗体重链Hole型、 Fc Knob型和B抗体部分示意图;
图3为具有部分抗体的杂合蛋白(包括杂合细胞因子、毒素、单链等)的示意图;
图4为双特异性抗体制备流程图,其中A为两个哺乳动物细胞表达的片段的剪接,B为原核生物细胞表达的片段的剪接,C为一个在哺乳动物细胞表达,另一个在原核生物细胞表达的两个片段的剪接,D为四种或在哺乳动物细胞或在原核细胞中表达的片段的剪接;
图5中,A为片段型双特异性抗体构建示意图;B为抗体片段免疫杂交蛋白构建示意图;C为全长抗体免疫杂交蛋白构建示意图;
图6为抗体A轻链示意图;
图7为抗体A Knob重链示意图;
图8为抗体A Hole Fc链示意图;
图9为抗体B重链和IN示意图;
图10为抗体B轻链示意图;
图11为抗体A Hole重链示意图;
图12为抗体A Hole Fc链示意图;
图13为双特异性抗体A部分抗体三表达载体共同转染纯化产物SDS-PAGE电泳图;
图14为双特异性抗体B部分抗体三表达载体共同转染纯化产物SDS-PAGE电泳图;
图15为断裂intein介导抗体A部分和抗体B部分剪接(一型)示意图;
图16为断裂intein介导抗体A部分和抗体B部分剪接(二型)示意图;
图17为不同DTT浓度(mM)下断裂intein的诱导双特异性抗体反式剪接示意图;
图18为不同温度(℃)下断裂intein的诱导双特异性抗体反式剪接示意图;
图19为不同反应时间(min)下断裂intein的诱导双特异性抗体反式剪接示意图;
图20为ProteinA(蛋白A)亲和纯化双特异性抗体SDS-PAGE电泳图;
图21为多特异抗体及免疫杂合蛋白制备方法的产物示意图;其中,A为多特异抗体及免疫杂合蛋白制备方法的产物A组(制备双特异抗体、抗体导向的免疫毒素等产品);B为多特异抗体及免疫杂合蛋白制备方法的产物B组(制备抗体片段与细胞因子或毒素的杂合蛋白);C为多特异抗体及免疫杂合蛋白制备方法的产物C组(制备2-4多特异抗体及免疫杂合蛋白的产物)。
具体实施方式
下面结合实施例对本发明进行详细说明。以下实施例将有助于本领域的技术人员进一步理解本发明,但不以任何形式限制本发明。应当指出的是,对本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干调整和改进。这些都属于本发明的保护范围。
本发明涉及的术语解释如下:
抗体:指完整的单克隆抗体。所述完整抗体由两对“轻链”(LC)和“重链”(HC)(所述轻链/重链对缩写为LC/HC)组成。所述抗体的轻链和重链是由若干结构域组成的多肽。在完整抗体中,每条重链包括重链可变区(缩写为HCVR或VH)和重链恒定区。重链恒定区包括重链恒定结构域CH1、CH2和CH3(抗体类型IgA,IgD,和IgG)和任选地,重链恒定结构域CH4(抗体类型IgE和IgM)。每条轻链包括轻链可变结构域VL和轻链恒定结构域CL。一种天然存在的完整抗体,即IgG抗体的结构显示在例如图1中。可变结构域VH和VL可以进一步再分为高变区,称为互补性决定区(CDR),它们之间分布有更加保守的区域,称为构架区(FR)。每个VH和VL由三个CDR和四个FR组成,以以下顺序从氨基端向羧基端排列:FR1,CDR1,FR2,CDR2,FR3,CDR3,FR4((Janeway,C.A.,Jr.等.,Immunobiology(免疫学),第5版,加兰出版社(Garland Publishing)(2001);和Woof J,Burton D Nat Rev Immunol(自然免疫学综述)4(2004)89-99)。两对重链和轻链(HC/LC)能够特异性结合相同抗原。因此所述完整抗体是二价、单特异性抗体。所述“抗体”包括例如小鼠抗体、人抗体、嵌合抗体、人源化抗体和遗传改造的抗体(变异或突变抗体),条件是保持它们的特有特性。特别优选人或人源化抗体,尤其作为重组的人或人源化抗体。存在5种由希腊字母表示的哺乳动物抗体重链类型:α,δ,ε,γ,和μ(Janeway,C.A.,Jr.,等.,Immunobiology(免疫学),第5版,加兰出版社(Garland Publishing)(2001))。存在的重链的类型定义抗体的类型;这些链分别存在于IgA,IgD,IgE,IgG,和IgM抗体中(Rhoades RA,Pflanzer RG(2002).Human Physiology(人体生理学),第4版,汤姆森知识(ThomsonLearning))。不同的重链在尺寸和组成上不同;α和γ含有约450个氨基酸,而μ和ε具有约550个氨基酸。每条重链具有两种区域,即恒定区和可变区。恒定区在相同同种型的所有抗体中相同,但在不同同种型的抗体中不同。重链γ,α和δ具有由3个恒定结构域CH1、CH2和CH3(处于一条线上)组成的恒定区和用于增加灵活性的铰链区(Woof,J.,Burton D Nat Rev Immunol(自然免疫学综述)4(2004)89-99);重链μ和ε具有由4个恒定结构域CH1、CH2、CH3和CH4组成 的恒定区(Janeway,C.A.,Jr.,等.,Immunobiology(免疫学),第5版,加兰出版社(Garland Publishing)(2001))。重链的可变区在由不同B细胞产生的抗体中不同,但对由单种B细胞或B细胞克隆产生的所有抗体都是相同的。每条重链的可变区长约110个氨基酸且由单抗体结构域组成。在哺乳动物中,仅存在两类轻链,其称为λ和κ。轻链具有两个连续的结构域:一个恒定结构域CL和一个可变结构域VL。轻链的近似长度是211-217个氨基酸。优选地,轻链是κ轻链,且恒定结构域CL优选是Cκ。
抗体的Fc部分:是熟练的技术人员公知的术语,并基于抗体的木瓜蛋白酶裂解而定义。按照本发明的抗体包含如Fc部分,优选源自人来源的Fc部分和优选人恒定区的全部其他部分。抗体的Fc部分直接参与补体活化,C1q结合,C3活化和Fc受体结合。尽管抗体对补体系统的影响取决于特定的条件,但是与C1q的结合由Fc部分中确定的结合位点所导致。所述结合位点是现有技术中已知的且记述在例如Lukas,T.J.,等.,J.Immunol.(免疫学杂志)127(1981)2555-2560;Brunhouse,R.,和Cebra,J.J.,Mol.Immunol.(分子免疫学)16(1979)907-917;Burton,D.R.,等.,Nature(自然)288(1980)338-344;Thommesen,J.E.,等.,Mol.Immunol.(分子免疫学)37(2000)995-1004;Idusogie,E.E.,等.,J.Immunol.(免疫学杂志)164(2000)4178-4184;Hezareh,M.,等.,J.Virol.(病毒学杂志)75(2001)12161-12168;Morgan,A.,等.,Immunology(免疫学)86(1995)319-324;和EP 0 307 434中。所述结合位点是例如L234,L235,D270,N297,E318,K320,K322,P331和P329(按照Kabat的EU目录编号)。亚型IgG1,IgG2和IgG3的抗体通常表现出补体活化,C1q结合和C3活化,而IgG4不活化补体系统,不结合C1q且不活化C3。
人源化抗体:指这样的抗体,其中的构架或“互补性决定区”(CDR)已经被修饰为包括与亲本免疫球蛋白的特异性相比特异性不同的免疫球蛋白的CDR。例如将鼠CDR移植到人抗体的构架区以制备“人源化抗体”。(Riechmann,L.,等,自然(Nature)332(1988)323-327;和Neuberger,M.S.,等,自然(Nature)314(1985)268-270)。
人抗体:包括具有源自人种系免疫球蛋白序列的可变区和恒定区的抗体。
重组人抗体:通过重组方法制备、表达、产生或分离的所有人抗体,诸如分离自宿主细胞,诸如NS0或CHO细胞的抗体或分离自人免疫球蛋白基因的转基因动物(例如小鼠)的抗体,或利用转染到宿主细胞中的重组表达载体表达的抗体,这种重组人抗体 具有处于重排形式的可变区和恒定区。
可变区结构域(轻链(VL)的可变区,重链(VH)的可变区)直接参与抗体与抗原结合的每对轻链和重链对。可变人轻链和重链的结构域具有相同的通用结构且每个结构域包括4个构架(FR)区,所述构架区的序列普遍保守,其通过3个“高变区”(或互补性决定区,CDRs)相连接。构架区采用β-折叠构象且CDR可以形成连接β-折叠结构的环。每条链中的CDR通过构架区保持其三维结构并与来自另一条链的CDR一起形成抗原结合位点。
二价双特异性抗体:指如上所述的抗体,其中两对重链和轻链(HC/LC)中的每对特异性结合不同的抗原,即第一重链和第一轻链(源自针对A抗原的抗体)特异性共同结合抗原A,且第二重链和第二轻链(源自针对B抗原的抗体)特异性共同结合B抗原;所述二价双特异性抗体能够同时特异性结合两种不同的抗原,且不超过两种抗原,与其相对照的是,一方面仅能够结合一种抗原的单特异性抗体和另一方面例如能够同时结合四种抗原分子的四价、四特异性抗体。
断裂intein:断裂型蛋白质内含子(split intein)是由N-端蛋白质剪接区域(In,N-fragment of intein)和C-端蛋白质剪接区域(Ic,C-fragment of intein)两部分组成,表达前体蛋白质的基因被分裂在两个开放阅读框中,断裂位点是在蛋白质内含子序列的内部。N-端蛋白质外显子(En)与断裂型蛋白质内含子的N-端(In)的基因形成融合基因,翻译形成的融合蛋白称为N-端前体蛋白质。而断裂型蛋白质内含子的C-端(Ic)与C-端蛋白质外显子(Ec)的表达基因形成融合基因,翻译后产生的融合蛋白称为C-端前体蛋白质。单独的断裂型蛋白质内含子的N-端(In)或C-端(Ic)不具有蛋白质剪接功能,但是在蛋白质翻译以后,N-端前体蛋白质中的In与C-端前体蛋白质的Ic通过互相识别以非共价键结合,形成有功能的蛋白质内含子,能够催化蛋白质反式剪接反应,以肽键将两个分离的蛋白质外显子(En、EC)连接起来(Ozawa.T.,Nat Biotechbol(自然技术)21(2003)287-93)
反式剪接:蛋白质反式剪接(protein/ram-splicing)是指由断裂型蛋白质内含子介导的蛋白质剪接反应。在这种类型的剪接过程中,首先是断裂蛋白质内含子的N-端片段(In)和C-端片段(Ic)相互识别并以非共价键结合(图1),一者结合后正确折脊其结构,重建活性中心的断裂行蛋白质内含子按照典型的蛋白质剪接途径完成蛋白质剪接反应,将两侧的蛋白质外显子的连接(Saleh.L.,Chemical Record(化学档案)6(2006)183-193)。
IN:单独的断裂型蛋白内含子的N-端部分。
IC:单独的断裂型蛋白内含子的C-端部分。
瞬时转染:瞬时转染(transient transfection)是将DNA导入真核细胞的方式之一。在瞬时转染中,重组DNA导入感染性强的细胞系以获得目的基因暂时但高水平的表达。转染的DNA不必整合到宿主染色体,可在比稳定转染较短时间内收获转染的细胞,并对溶解产物中目的基因的表达进行检测。
本发明具体涉及一种新型多价多特异性抗体及免疫杂合蛋白的表达和制备方法。本发明首次将双特异性抗体分割为结合抗原A,和结合抗原B两部分,如(图2A,图2B)所示,分别表达,然后通过断裂蛋白内含肽的反式剪接功能将A和B两部分连接成为完整的抗体。A部分含有A抗体的轻链,A抗体的完整重链,以及N端融合了IC的Fc链;B部分含有B抗体的轻链,和C端融合有IN的B抗体的VH+CH1链。本发明首次将断裂intein的反式剪接功能与双特异性抗体的构建结合,通过将分别表达纯化的A和B两部分抗体,通过断裂intein的反式剪接功能连接成为完整的抗体,这种双特异性抗体与天然存在的抗体分子结构及其相似,避免了因为结构差异引起的抗体分子不稳定,以及体内免疫原性高的情况。首先将获得的抗体表达序列进行分析拆分,经过全基因合成构建哺乳动物细胞表达载体,将纯化所得的载体分别瞬时转染293E,293F,CHO等哺乳动物细胞,或者稳定转染CHO等哺乳动物细胞。将发酵液分别收集,通过proteinL亲和层析纯化,纯化所得A和B两组份体外反式剪接,剪接所得产物进行proteinA亲和层析,即可得到较纯的双特异性抗体所示,工艺流程如(图4)所示。
本发明也可以应用于Fc片段残缺的双特异性抗体构建,比如Fc区域仅留下部分CH2区,或者留下完整的CH2区域和部分CH3区域。此外,可以应用于任意两种类型的抗体片段的连接,成为新型双特异性抗体,如(图5)所示,C部分任意一种形式的抗体片段,都可以通过断裂intein的反式剪接作用于D部分任意一种形式的抗体片段连接。
本发明涉及的新型二价双特异性抗体杂交蛋白的表达和制备方法,包括如下步骤:
1、表达载体构建。
为了构建表达载体,关于人免疫球蛋白轻链和重链的核苷酸序列的一般信息在Kabat,E.A.,等.,免疫目的的蛋白质序列(Sequences of Proteins of ImmunologicalInterest),第5版,公众健康服务,国家健康研究所(Public Health Service,National Institutes of Health),Bethesda,MD.(1991))以及drugbank数据库中提供。按照EU编号对抗体链的氨基酸进行编号和提及(Edelman,G.M.,等., Proc.Natl.Acad.Sci.USA(美国国家科学院学报)63(1969)78-85;Kabat,E.A.,等.,免疫目的的蛋白质序列(Sequences of Proteins of Immunological Interest),第5版,公众健康服务,国家健康研究所(Public Health Service,National Institutes of Health),Bethesda,MD.(1991))。所需基因区段通过化学合成制备的寡核苷酸制备。600-1800bp长的基因区段通过包括PCR扩增的寡核苷酸的退火和连接来装配,并随后通过所指出的限制位点例如KpnI/BamHI等克隆到表达载体中,亚克隆的基因片段的DNA序列通过DNA测序验证。Infomax载体NTI版本8.0(Infomax’s VectorNTI Advance suite version 8.0)用于序列构建、作图、分析、注解和说明。
1.1.为了解决重链错配问题,引入了“Knobs-into-Holes(杵-进入-臼)”和去除一条重链的VH和CH1区域在CH2的N铰链区端融合IC(断裂intein的C段),从而彻底阻止了重链形成无法纯化去除的重链同源二聚体组份。为了引入“Knobs-into-Holes(杵-进入-臼)”结构,在一条CH3区域将366位的T(苏氨酸)突变为W(色氨酸)形成“Knobs”结构;同时在另一条重链CH3区域将366位的T(苏氨酸)突变为S(丝氨酸),368位的L(亮氨酸)突变为A(丙氨酸),407位的Y(酪氨酸)突变为V(缬氨酸)以形成“Holes”结构;此外为了提高CH3区域结合的稳定性,将“Knobs”链上354位的S(丝氨酸)突变为C(半胱氨酸),“Holes”链上349位的Y(酪氨酸)突变为C(半胱氨酸)以引入一对重链间二硫键增强重链间的稳定性。
1.2.为了引入断裂intein,在抗体B的重链铰链区将抗体B的重链分割为Fc区和VH+CH1区,并且在CH1区的C端融合IN(断裂intein的N段),同时在CH2的N端融合IC(断裂intein的C段)。
1.3.a.如(图6)所示抗体A的轻链的序列为天然抗体A轻链序列;如(图7)所示在抗体A重链的CH3区域将366位的T(苏氨酸)突变为W(色氨酸)形成“Knobs”结构同时354位的S(丝氨酸)突变为C(半胱氨酸);如(图8)所示,抗体A的IC+Fc(Fc的N端融合断裂intein的C端)区域CH3区域将366位的T(苏氨酸)突变为S(丝氨酸),368位的L(亮氨酸)突变为A(丙氨酸),407位的Y(酪氨酸)突变为V(缬氨酸)以形成“Holes”结构,同时349位的Y(酪氨酸)突变为C(半胱氨酸);如(图9)所示抗体B的重链VH+CH1+IN(抗体的重链可变区加上CH1区在C端融合intein的N段);如(图10)所示抗体B部分的轻链为天然抗体B的轻链序列。
1.3.b.如(图6)所示抗体A的轻链的序列为天然抗体A轻链序列;如(图11)所示在抗体A重链的CH3区域将366位的T(苏氨酸)突变为S(丝氨酸),368位的L(亮氨酸) 突变为A(丙氨酸),407位的Y(酪氨酸)突变为V(缬氨酸)以形成“Holes”结构,同时349位的Y(酪氨酸)突变为C(半胱氨酸);如(图12)所示抗体B的IC+Fc(Fc的N端融合断裂intein的C端)区域CH3区域将366位的T(苏氨酸)突变为W(色氨酸)形成“Knobs”结构同时354位的S(丝氨酸)突变为C(半胱氨酸);如(图9)所示抗体B的重链VH+CH1+IN(抗体的重链可变区加上CH1区在C端融合intein的N段);如(图10)所示抗体B部分的轻链为天然抗体B的轻链序列。
1.3.c.小片段抗体表达载体的构建。如(图5)所示,选择C组任意一种的抗体片段,在图中所示IN位置融合断裂intein的N端,同时选择D组任意一种抗体片段,在图中所示IC位置融合断裂intein的C端。
1.4.将上述1.3中所设计好的基因序列,进行化学全合成,并且通过PCR(聚合酶链式反应)在起始密码子和终止密码子两侧加入限制性内切酶酶切位点比如KpnI/BamHI等,分别插入含有CMV启动子的哺乳动物细胞表达载体中,亚克隆测序质粒抽提,为了瞬时转染,通过来自转化的大肠杆菌培养物的质粒制备物来制备更大量的质粒(omega)。除抗体表达区域以外,所述载体包括:复制起点,其容许该质粒在大肠杆菌中复制和β-内酰胺酶基因,其在大肠杆菌中赋予氨苄青霉素抗性。抗体基因的转录单元由以下元件组成:5’末端处的特有限制性位点,来自人巨细胞病毒的即时早期增强子和启动子,在cDNA构造的情形中,随后是内含子A序列,人抗体基因的5’非翻译区,免疫球蛋白轻链(或者其他的信号肽序列)信号肽序列,具有加A信号序列的3’非翻译区,和3’末端处的特有限制性位点。
2.使用如Current Protocols in Cell Biology(当前细胞生物学方案)(2000),Bonifacino,J.S.,Dasso,M.,Harford,J.B.,Lippincott-Schwartz,J.和Yamada,K.M.(编),John Wiley&Sons,Inc中所述的标准细胞培养技术。通过在悬浮生长的HEK293-E中或在悬浮生长的HEK29-F细胞中瞬时共转染各种表达质粒来表达A和B部分抗体,如下所述。
2.1.HEK293-E系统中的瞬时转染。双特异性抗体A部分和B部分,通过分别三表达载体和二表达载体共转染HEK293-E(表达EB病毒核抗原的人胚肾细胞系293;美国典型培养物中心,保藏号ATCC#CRL-10852,Lot.959 218)来生成。用SFX4HEK293培养基(HyClone)和Gibco Freestyle 293培养基(Gibco)以1:1的比例,添加100μg/ml遗传霉素(geneticin)(Gibco)培养,转染前一天用新鲜培养基将细胞稀释至1.5-2.5×106个细胞/ml培养以37℃,120rpm,5%CO2培养,以待次日转染。以1L摇瓶(Coming)为 例,次日500-2000rpm 5-10min离心收集细胞,经(10-50ml)Gibco Freestyle 293培养基洗涤细胞数次,500-2000rpm 5-10min离心收集细胞,用150mlGibco Freestyle 293培养基重悬细胞至细胞密度为2-6×106个细胞/ml置于新的1L摇瓶(Coming)中。共转染各个质粒按照每106个细胞DNA用量0.25-1.5μg等摩尔比的分别编码各链基因的载体,用Gibco Freestyle 293培养基稀释DNA至(40ng/μL),DNA:PEI(polyscince阳离子转染试剂)=1:2-1:6加入混匀的DNA中室温孵育5-20min,加入细胞悬液中的混合物,37℃,120rpm,5%CO2转染4小时,4小时后加入等体积预热的SFX4HEK293培养基,添加100μg/ml遗传霉素(geneticin)(Gibco)继续37℃,120rpm,5%CO2培养5-10天。直接收集上清纯化或者收集上清-80℃冷冻保存。
2.1.a.PEI介导A部分抗体三表达载体共转染HEK293-E细胞。用SFX4HEK293培养基(HyClone)和Gibco Freestyle 293培养基(Gibco)以1:1的比例,添加100μg/ml遗传霉素(geneticin)(Gibco)培养,转染前一天用新鲜培养基将细胞稀释至1.5-2.5×106个细胞/ml培养以37℃,120rpm,5%CO2培养,以待次日转染。以1L摇瓶(Coming)为例,次日500-2000rpm 5-10min离心收集细胞,经(10-50ml)Gibco Freestyle 293培养基洗涤细胞数次,500-2000rpm 5-10min离心收集细胞,用150mlGibco Freestyle 293培养基重悬细胞至细胞密度为2-6×106个细胞/ml置于新的1L摇瓶(Coming)中。编码A部分抗体三个表达载体,按照每106个细胞DNA用量0.25-1.5μg等摩尔比混匀,用Gibco Freestyle 293培养基稀释DNA至(40ng/μL),DNA:PEI(polyscince阳离子转染试剂)=1:2-1:6加入混匀的DNA中室温孵育5-20min,加入细胞悬液中的混合物,37℃,120rpm,5%CO2转染4小时,4小时后加入等体积预热的SFX4HEK293培养基,添加100μg/ml遗传霉素(geneticin)(Gibco)继续37℃,120rpm,5%CO2培养5-10天,以获得A部分抗体。直接收集上清纯化,或者收集上清-80℃冷冻保存。
2.1.b.PEI介导B部分抗体两表达载体共转染HEK293-E细胞。用SFX4HEK293培养基(HyClone)和Gibco Freestyle 293培养基(Gibco)以1:1的比例,添加100μg/ml遗传霉素(geneticin)(Gibco)培养,转染前一天用新鲜培养基将细胞稀释至1.5-2.5×106个细胞/ml培养以37℃,120rpm,5%CO2培养,以待次日转染。以1L摇瓶(Coming)为例,次日1000rpm 5min离心收集细胞,经50ml Gibco Freestyle 293培养基洗涤细胞数次,1000rpm 5min离心收集细胞,用150mlGibco Freestyle 293培养基重悬细胞至细胞密度为2-6×106个细胞/ml置于新的1L摇瓶(Coming)中。编码A部分抗体两个表达载体,按照每106个细胞DNA用量0.25-1.5μg等摩尔比混匀,用Gibco Freestyle 293培养基稀 释DNA至(40ng/μL),DNA:PEI(polyscince阳离子转染试剂)=1:2-1:6加入混匀的DNA中室温孵育5-20min,加入细胞悬液中的混合物,37℃,120rpm,5%CO2转染4小时,4小时后加入等体积预热的SFX4HEK293培养基,添加100μg/ml遗传霉素(geneticin)(Gibco)继续37℃,120rpm,5%CO2培养5-10天,以获得B部分抗体。直接收集上清纯化,或者收集上清-80℃冷冻保存。
3.发酵液抗体的Protein L(蛋白L)亲和纯化。参考标准流程,从过滤的细胞培养物上清中纯化蛋白。简言之,将抗体应用于protein L(蛋白L)亲和层析(GE healthcare(GE健康护理))并用PBS(在PBS中,含有20mM磷酸盐,150mM NaCl pH 6.8-7.4)洗涤。用pH5.0的100mM柠檬酸缓冲液洗除去杂组份,在pH3.0的100mM柠檬酸缓冲液实现抗体洗脱,并随后用PH9.0的1M tris-Hcl缓冲液立即中和样品。提供部分样品进行随后的蛋白质分析例如SDS-PAGE汇集单体抗体组分,以用于下一步断裂intein介导的体外剪接。如果需要,利用MILLIPORE Amicon Ultra(30MWCO)离心浓缩器浓缩,冷冻和在-20℃或-80℃保存。
3.1.三表达载体共转染的发酵液中A部分抗体的Protein L(蛋白L)亲和纯化。参考标准流程,从过滤的细胞培养物上清中纯化蛋白。用PBS(在PBS中,含有20mM磷酸盐,150mM NaCl pH 6.8-7.4)与细胞过滤上清1:1混合,流过预先用PBS平衡完毕的Protein L(蛋白L)亲和层析柱,上样完毕用PBS洗涤,用pH5.0的100mM柠檬酸缓冲液洗除去杂组份,在pH3.0的100mM柠檬酸缓冲液实现抗体洗脱,并随后用PH9.0的1M tris-Hcl缓冲液立即中和样品。提供部分样品进行随后的蛋白质分析例如SDS-PAGE如(图13)所示,非还原的样品103KD左右出现组装好的双特异性抗体A部分抗体;还原样品中出现55KD的重链,40KD的IC+Fc链,25KD的轻链。汇集单体抗体组分,以用于下一步断裂intein介导的体外剪接。如果需要,利用MILLIPORE Amicon Ultra(30MWCO)超滤离心管浓缩,冷冻和在-20℃或-80℃保存。
3.2.两表达载体共转染的发酵液中B部分抗体的Protein L(蛋白L)亲和纯化。参考标准流程,从过滤的细胞培养物上清中纯化蛋白。用PBS(在PBS中,含有20mM磷酸盐,150mM NaCl pH 6.8-7.4)与细胞过滤上清1:1混合,流过预先用PBS平衡完毕的Protein L(蛋白L)亲和层析柱,上样完毕用PBS洗涤,用pH5.0的100mM柠檬酸缓冲液洗除去杂组份,在pH3.0的100mM柠檬酸缓冲液实现抗体洗脱,并随后用PH9.0的1M tris-Hcl缓冲液立即中和样品。提供部分样品进行随后的蛋白质分析例如SDS-PAGE,如(图14)所示,非还原样品60KD作用出现组装好的双特异性抗体B部分;还原样品中出现 35KD的VH+CH1+IN链和25KD的轻链。汇集单体抗体组分,以用于下一步断裂intein介导的体外剪接。如果需要,利用MILLIPORE Amicon Ultra(30MWCO)超滤离心管浓缩,冷冻和在-20℃或-80℃保存。
4.1.断裂intein介导的A和B两部分体外反式剪接如(图15,图16)所示。步骤3中纯化所得的A和B两部分抗体,按照摩尔比1:1进行混合,同时加入0.05mM-2mM DTT或β巯基乙醇,如(图17)所示,分别加入DTT终浓度为0.01mM、0.05mM、1mM、2mM,结果显示DTT浓度为0.05mM即可诱导断裂intein反式剪接过程发生,在150KD处双特异性抗体有明显条带出现。TCEP等巯基化合物诱导断裂intein的反式剪接作用发生,4℃-37℃,以1mM DTT或TCEP浓度加入剪接反应体系,分别置于4℃、22℃、和37℃,如(图18)所示在4℃反应即可发生,22℃、和37℃反应效率较高,在150KD处双特异性抗体有明显条带出现。以1mM DTT浓度加入剪接反应体系,置于37℃下,分别静置5min、15min、30min、60min和120min,如(图19)所示,5min即有反应发生生成双特异性抗体,在60min时反应到达平台期。反应结束需要去除巯基化合物,可以通过加入双氧水等氧化剂去除,或者通过透析去除巯基化合物,此外还可以通过高倍缓冲液稀释将巯基化合物稀释到工作浓度以下,以达到终止反应的目的。反应终止取样品进行非还原SDS-PAGE检测。
4.2.断裂intein介导C和D两部分体外反式剪接方法同4.1一致。
5.1.断裂intein介导的A和B部分反式剪接产物的protein A(蛋白A)纯化。参考标准流程,从步骤4反应混合液中纯化蛋白。用PBS(在PBS中,含有20mM磷酸盐,150mM NaCl pH 6.8-7.4)与样品合适比例混合,流过预先用PBS平衡完毕的Protein A(蛋白A)亲和层析柱,上样完毕用PBS洗涤,用pH5.0的100mM柠檬酸缓冲液洗除去杂组份,在pH3.0的100mM柠檬酸缓冲液实现抗体洗脱,并随后用PH9.0的1M tris-Hcl缓冲液立即中和样品。提供部分样品进行随后的蛋白质分析例如SDS-PAGE如(图20)所示,非还原样品有明显的150KD条带为断裂intein介导的反式剪接而生成的双特异性抗体且纯度较高,还原样品仅出现50KD左右的重链和25KD左右的轻链。汇集单体抗体组分,如果需要,利用MILLIPORE Amicon Ultra(30MWCO)超滤离心管浓缩,冷冻和在-20℃或-80℃保存或者用于更高纯度的纯化,例如离子交换层析,疏水层析,以及分子排阻层析等。
5.2.断裂intein介导的C和D部分反式剪接产物的纯化。对于C和D部分反式剪接所得产物,需要进行离子交换层析,疏水层析,分子排阻层析等重组蛋白纯化方法纯化。
具体应用见以下实施例:
实施例1、构建CD3×Her2双特异性抗体
1.1.表达载体构建
为了构建表达载体,关于人免疫球蛋白轻链和重链的核苷酸序列的一般信息在Kabat,E.A.,等.,免疫目的的蛋白质序列(Sequences of Proteins of ImmunologicalInterest),第5版,公众健康服务,国家健康研究所(Public Health Service,National Institutes of Health),Bethesda,MD.(1991))以及drugbank数据库中提供。按照EU编号对抗体链的氨基酸进行编号和提及(Edelman,G.M.,等.,Proc.Natl.Acad.Sci.USA(美国国家科学院学报)63(1969)78-85;Kabat,E.A.,等.,免疫目的的蛋白质序列(Sequences of Proteins of Immunological Interest),第5版,公众健康服务,国家健康研究所(Public Health Service,National Institutes of Health),Bethesda,MD.(1991))。CD3抗体序列来自于人源化OKT3药物序列,所需基因区段通过化学合成制备的寡核苷酸制备。600-1800bp长的基因区段通过包括PCR扩增的寡核苷酸的退火和连接来装配,并随后通过所指出的限制位点例如KpnI/BamHI等克隆到表达载体中,亚克隆的基因片段的DNA序列通过DNA测序验证。Infomax载体NTI版本8.0(Infomax’s VectorNTI Advance suite version 8.0)用于序列构建、作图、分析、注解和说明。为了解决重链错配问题,引入了“Knobs-into-Holes(杵-进入-臼)”和去除一条重链的VH和CH1区域在CH2的N铰链区端融合IC(断裂intein的C段),从而彻底阻止了重链形成无法纯化去除的重链同源二聚体组份。为了引入“Knobs-into-Holes(杵-进入-臼)”结构,在CD3抗体CH3区域将366位的T(苏氨酸)突变为W(色氨酸)形成“Knobs”结构;同时在Her2抗体重链CH3区域将366位的T(苏氨酸)突变为S(丝氨酸),368位的L(亮氨酸)突变为A(丙氨酸),407位的Y(酪氨酸)突变为V(缬氨酸)以形成“Holes”结构;此外为了提高CH3区域结合的稳定性,将“Knobs”链上354位的S(丝氨酸)突变为C(半胱氨酸),“Holes”链上349位的Y(酪氨酸)突变为C(半胱氨酸)以引入一对重链间二硫键增强重链间的稳定性。
1.1.a.以CD3抗体为A部分抗体,各链表达载体分别按照抗体A轻链设计如(图6)所示,抗体A knob重链表达载体设计如(图7)所示,抗体A Hole Fc链设计如(图8)所示;以Her2抗体为B部分抗体,各表达链分别按照抗体B重链IN设计如(图9)所示,抗体B轻链设计,如(图10)所示。
1.1.b.以CD3抗体为A部分抗体,各链表达载体分别按照抗体A轻链设计如(图6)所示,抗体A Hole重链表达载体设计如(图11)所示,抗体A Knob Fc链设计如(图12)所示;以Her2抗体为B部分抗体,各表达链分别按照抗体B重链IN设计如(图9)所示,抗体B轻链设计,如(图10)所示。
1.1.c.以Her2抗体为A部分抗体,各链表达载体分别按照抗体A轻链设计如(图6),抗体A knob重链表达载体设计如(图7)所示,抗体A Hole Fc链设计如(图8)所示;以CD3抗体为B部分抗体,各表达链分别按照抗体B重链IN设计如(图9)所示,抗体B轻链设计,如(图10)所示。
1.1.d.以Her2抗体为A部分抗体,各链表达载体分别按照抗体A轻链设计如(图6)所示,抗体A Hole重链表达载体设计如(图11)所示,抗体A Knob Fc链设计如(图12)所示;以CD3抗体为B部分抗体,各表达链分别按照抗体B重链IN设计如(图9)所示,抗体B轻链设计,如(图10)所示。
1.2.瞬时转染HEK-293E细胞表达
HEK293-E系统中的瞬时转染。双特异性抗体A部分和B部分,通过分别三表达载体和二表达载体共转染HEK293-E(表达EB病毒核抗原的人胚肾细胞系293;美国典型培养物中心,保藏号ATCC#CRL-10852,Lot.959 218)来生成。用SFX4HEK293培养基(HyClone)和Gibco Freestyle 293培养基(Gibco)以1:1的比例,添加100μg/ml遗传霉素(geneticin)(Gibco)培养,转染前一天用新鲜培养基将细胞稀释至1.5-2.5×106个细胞/ml培养以37℃,120rpm,5%CO2培养,以待次日转染。以1L摇瓶(Coming)为例,次日1000rpm 5min离心收集细胞,经(50ml)Gibco Freestyle 293培养基洗涤细胞1次,1000rpm 5min离心收集细胞,用150mlGibco Freestyle 293培养基重悬细胞至细胞密度为4×106个细胞/ml置于新的1L摇瓶(Coming)中。共转染各个质粒按照每106个细胞DNA用量0.5μg等摩尔比的分别编码各链基因的载体,用Gibco Freestyle 293培养基稀释DNA至(40ng/μL),DNA:PEI(polyscince阳离子转染试剂)=1:3加入混匀的DNA中室温孵育20min,加入细胞悬液中的混合物,37℃,110rpm,5%CO2转染4小时,4小时后加入等体积预热的SFX4HEK293培养基,添加100μg/ml遗传霉素(geneticin)(Gibco)继续37℃,130rpm,5%CO2培养10天。直接收集上清纯化或者收集上清-80℃冷冻保存。
1.2.a.PEI介导按照1.1.a.中构建的A部分抗体三表达载体,共转染HEK293-E细胞。用SFX4HEK293培养基(HyClone)和Gibco Freestyle 293培养基(Gibco)以1:1的比例, 添加100μg/ml遗传霉素(geneticin)(Gibco)培养,转染前一天用新鲜培养基将细胞稀释至1.5-2.5×106个细胞/ml培养以37℃,120rpm,5%CO2培养,以待次日转染。以1L摇瓶(Coming)为例,次日1000rpm 5min离心收集细胞,经(50ml)Gibco Freestyle 293培养基洗涤细胞1次,1000rpm 5min离心收集细胞,用150mlGibco Freestyle 293培养基重悬细胞至细胞密度为4×106个细胞/ml置于新的1L摇瓶(Coming)中。共转染各个质粒按照每106个细胞DNA用量0.5μg等摩尔比的分别编码各链基因的载体,用Gibco Freestyle 293培养基稀释DNA至(40ng/μL),DNA:PEI(polyscince阳离子转染试剂)=1:3加入混匀的DNA中室温孵育20min,加入细胞悬液中的混合物,37℃,110rpm,5%CO2转染4小时,4小时后加入等体积预热的SFX4HEK293培养基,添加100μg/ml遗传霉素(geneticin)(Gibco)继续37℃,130rpm,5%CO2培养10天。直接收集上清纯化或者收集上清-80℃冷冻保存。
1.2.b.PEI介导按照1.1.b.中构建的A部分抗体三表达载体共转染HEK293-E细胞。用SFX4HEK293培养基(HyClone)和Gibco Freestyle 293培养基(Gibco)以1:1的比例,添加100μg/ml遗传霉素(geneticin)(Gibco)培养,转染前一天用新鲜培养基将细胞稀释至1.5-2.5×106个细胞/ml培养以37℃,120rpm,5%CO2培养,以待次日转染。以1L摇瓶(Coming)为例,次日1000rpm 5min离心收集细胞,经(50ml)Gibco Freestyle 293培养基洗涤细胞1次,1000rpm 5min离心收集细胞,用150mlGibco Freestyle 293培养基重悬细胞至细胞密度为4×106个细胞/ml置于新的1L摇瓶(Coming)中。共转染各个质粒按照每106个细胞DNA用量0.5μg等摩尔比的分别编码各链基因的载体,用Gibco Freestyle 293培养基稀释DNA至(40ng/μL),DNA:PEI(polyscince阳离子转染试剂)=1:3加入混匀的DNA中室温孵育20min,加入细胞悬液中的混合物,37℃,110rpm,5%CO2转染4小时,4小时后加入等体积预热的SFX4HEK293培养基,添加100μg/ml遗传霉素(geneticin)(Gibco)继续37℃,130rpm,5%CO2培养10天。直接收集上清纯化或者收集上清-80℃冷冻保存。
1.2.c.PEI介导按照1.1.c.中构建的B部分抗体两表达载体共转染HEK293-E细胞。用SFX4HEK293培养基(HyClone)和Gibco Freestyle 293培养基(Gibco)以1:1的比例,添加100μg/ml遗传霉素(geneticin)(Gibco)培养,转染前一天用新鲜培养基将细胞稀释至1.5-2.5×106个细胞/ml培养以37℃,120rpm,5%CO2培养,以待次日转染。以1L摇瓶(Coming)为例,次日1000rpm 5min离心收集细胞,经(50ml)Gibco Freestyle 293培养基洗涤细胞1次,1000rpm 5min离心收集细胞,用150mlGibco Freestyle 293培养 基重悬细胞至细胞密度为4×106个细胞/ml置于新的1L摇瓶(Coming)中。共转染各个质粒按照每106个细胞DNA用量0.5μg等摩尔比的分别编码各链基因的载体,用Gibco Freestyle 293培养基稀释DNA至(40ng/μL),DNA:PEI(polyscince阳离子转染试剂)=1:3加入混匀的DNA中室温孵育20min,加入细胞悬液中的混合物,37℃,110rpm,5%CO2转染4小时,4小时后加入等体积预热的SFX4HEK293培养基,添加100μg/ml遗传霉素(geneticin)(Gibco)继续37℃,130rpm,5%CO2培养10天。直接收集上清纯化或者收集上清-80℃冷冻保存。
1.2.d.PEI介导按照1.1.d.中构建的B部分抗体两表达载体共转染HEK293-E细胞。用SFX4HEK293培养基(HyClone)和Gibco Freestyle 293培养基(Gibco)以1:1的比例,添加100μg/ml遗传霉素(geneticin)(Gibco)培养,转染前一天用新鲜培养基将细胞稀释至1.5-2.5×106个细胞/ml培养以37℃,120rpm,5%CO2培养,以待次日转染。以1L摇瓶(Coming)为例,次日1000rpm 5min离心收集细胞,经(50ml)Gibco Freestyle 293培养基洗涤细胞1次,1000rpm 5min离心收集细胞,用150mlGibco Freestyle 293培养基重悬细胞至细胞密度为4×106个细胞/ml置于新的1L摇瓶(Coming)中。共转染各个质粒按照每106个细胞DNA用量0.5μg等摩尔比的分别编码各链基因的载体,用Gibco Freestyle 293培养基稀释DNA至(40ng/μL),DNA:PEI(polyscince阳离子转染试剂)=1:3加入混匀的DNA中室温孵育20min,加入细胞悬液中的混合物,37℃,110rpm,5%CO2转染4小时,4小时后加入等体积预热的SFX4HEK293培养基,添加100μg/ml遗传霉素(geneticin)(Gibco)继续37℃,130rpm,5%CO2培养10天。直接收集上清纯化或者收集上清-80℃冷冻保存。
1.3.发酵液抗体的Protein L(蛋白L)亲和纯化
参考标准流程,从过滤的细胞培养物上清中纯化蛋白。简言之,将抗体应用于protein L(蛋白L)亲和层析(GE healthcare(GE健康护理))并用PBS(在PBS中,含有20mM磷酸盐,150mM NaCl pH 6.8-7.4)洗涤。用pH5.0的100mM柠檬酸缓冲液洗除去杂组份,在pH3.0的100mM柠檬酸缓冲液实现抗体洗脱,并随后用PH9.0的1M tris-Hcl缓冲液立即中和样品。提供部分样品进行随后的蛋白质分析例如SDS-PAGE汇集单体抗体组分,以用于下一步断裂intein介导的体外剪接。如果需要,利用MILLIPORE Amicon Ultra(30MWCO)离心浓缩器浓缩,冷冻和在-20℃或-80℃保存。
1.3.a.上述步骤1.2.a.细胞发酵液的Protein L(蛋白L)亲和纯化。三表达载体共转染的发酵液中A部分抗体的Protein L(蛋白L)亲和纯化。参考标准流程,从过滤的 细胞培养物上清中纯化蛋白。用PBS(在PBS中,含有20mM磷酸盐,150mM NaCl pH 6.8-7.4)与细胞过滤上清1:1混合,流过预先用PBS平衡完毕的Protein L(蛋白L)亲和层析柱,上样完毕用PBS洗涤,用pH5.0的100mM柠檬酸缓冲液洗除去杂组份,在pH3.0的100mM柠檬酸缓冲液实现抗体洗脱,并随后用PH9.0的1M tris-Hcl缓冲液立即中和样品。提供部分样品进行随后的蛋白质分析例如SDS-PAGE如(图13)所示,非还原的样品103KD左右出现组装好的双特异性抗体A部分抗体;还原电泳出现55KD的重链,40KD的IC+Fc链,25KD的轻链。汇集单体抗体组分,可以纯化得到主要组份是A抗体部分的纯化产品,以用于下一步断裂intein介导的体外剪接。如果需要,利用MILLIPORE Amicon Ultra(30MWCO)超滤离心管浓缩,冷冻和在-20℃或-80℃保存。
1.3.b.上述步骤1.2.b.细胞发酵液的Protein L(蛋白L)亲和纯化。三表达载体共转染的发酵液中A部分抗体的Protein L(蛋白L)亲和纯化。参考标准流程,从过滤的细胞培养物上清中纯化蛋白。用PBS(在PBS中,含有20mM磷酸盐,150mM NaCl pH 6.8-7.4)与细胞过滤上清1:1混合,流过预先用PBS平衡完毕的Protein L(蛋白L)亲和层析柱,上样完毕用PBS洗涤,用pH5.0的100mM柠檬酸缓冲液洗除去杂组份,在pH3.0的100mM柠檬酸缓冲液实现抗体洗脱,并随后用PH9.0的1M tris-Hcl缓冲液立即中和样品。提供部分样品进行随后的蛋白质分析例如SDS-PAGE如(图13)所示,非还原的样品103KD左右出现组装好的双特异性抗体A部分抗体;还原电泳出现55KD的重链,40KD的IC+Fc链,25KD的轻链。汇集单体抗体组分,可以纯化得到主要组份是A抗体部分的纯化产品,以用于下一步断裂intein介导的体外剪接。如果需要,利用MILLIPORE Amicon Ultra(30MWCO)超滤离心管浓缩,冷冻和在-20℃或-80℃保存。
1.3.c.上述步骤1.2.c.细胞发酵液的Protein L(蛋白L)亲和纯化。参考标准流程,从过滤的细胞培养物上清中纯化蛋白。用PBS(在PBS中,含有20mM磷酸盐,150mM NaCl pH 6.8-7.4)与细胞过滤上清1:1混合,流过预先用PBS平衡完毕的Protein L(蛋白L)亲和层析柱,上样完毕用PBS洗涤,用pH5.0的100mM柠檬酸缓冲液洗除去杂组份,在pH3.0的100mM柠檬酸缓冲液实现抗体洗脱,并随后用PH9.0的1M tris-Hcl缓冲液立即中和样品。提供部分样品进行随后的蛋白质分析例如SDS-PAGE如(图14)所示,非还原样品60KD作用出现组装好的双特异性抗体B部分;还原样品中出现35KD的VH+CH1+IN链和25KD的轻链。汇集单体抗体组分,可以纯化得到主要组份是B抗体部分的纯化产品,以用于下一步断裂intein介导的体外剪接。如果需要,利用MILLIPORE Amicon Ultra(30MWCO)超滤离心管浓缩,冷冻和在-20℃或-80℃保存。
1.3.d.上述步骤1.2.d.细胞发酵液的Protein L(蛋白L)亲和纯化。参考标准流程,从过滤的细胞培养物上清中纯化蛋白。用PBS(在PBS中,含有20mM磷酸盐,150mM NaCl pH 6.8-7.4)与细胞过滤上清1:1混合,流过预先用PBS平衡完毕的Protein L(蛋白L)亲和层析柱,上样完毕用PBS洗涤,用pH5.0的100mM柠檬酸缓冲液洗除去杂组份,在pH3.0的100mM柠檬酸缓冲液实现抗体洗脱,并随后用PH9.0的1M tris-Hcl缓冲液立即中和样品。提供部分样品进行随后的蛋白质分析例如SDS-PAGE如(图14)所示,非还原样品60KD作用出现组装好的双特异性抗体B部分;还原样品中出现35KD的VH+CH1+IN链和25KD的轻链。汇集单体抗体组分,可以纯化得到主要组份是B抗体部分的纯化产品,以用于下一步断裂intein介导的体外剪接。如果需要,利用MILLIPORE Amicon Ultra(30MWCO)超滤离心管浓缩,冷冻和在-20℃或-80℃保存。
1.4.断裂intein介导的A和B两部分体外反式剪接
如(图15,图16)所示,步骤1.3中纯化所得的A和B两部分抗体,按照摩尔比1:1进行混合,同时加入0.05mM-2mM DTT或β巯基乙醇,如(图17)所示,分别加入DTT终浓度为0.01mM、0.05mM、1mM、2mM,结果显示DTT浓度为0.05mM即可诱导断裂intein反式剪接过程发生,在150KD处双特异性抗体有明显条带出现。TCEP等巯基化合物诱导断裂intein的反式剪接作用发生,4℃-37℃,以1mM DTT或TCEP浓度加入剪接反应体系,分别置于4℃、22℃、和37℃,如(图18)所示在4℃反应即可发生,22℃、和37℃反应效率较高,在150KD处双特异性抗体有明显条带出现。以以1mMDTT浓度加入剪接反应体系,置于37℃下,分别静置5min、15min、30min、60min和120min,如(图19)所示,5min即有反应发生生成双特异性抗体,在60min时反应到达平台期。反应结束需要去除巯基化合物,可以通过加入双氧水等氧化剂去除,或者通过透析去除巯基化合物,此外还可以通过高倍缓冲液稀释将巯基化合物稀释到工作浓度以下,以达到终止反应的目的。反应终止取样品进行非还原SDS-PAGE检测。
1.5.断裂intein介导的A和B部分反式剪接产物的protein A(蛋白A)纯化
参考标准流程,从步骤4反应混合液中纯化蛋白。用PBS(在PBS中,含有20mM磷酸盐,150mM NaCl pH 6.8-7.4)与样品合适比例混合,流过预先用PBS平衡完毕的Protein A(蛋白A)亲和层析柱,上样完毕用PBS洗涤,用pH5.0的100mM柠檬酸缓冲液洗除去杂组份,在pH3.0的100mM柠檬酸缓冲液实现抗体洗脱,并随后用PH9.0的1M tris-Hcl缓冲液立即中和样品。提供部分样品进行随后的蛋白质分析例如SDS-PAGE如(图20)所示,图20中,rProteinA洗脱SDS-PAGE考马斯亮蓝染色,M.marker;1. 上柱前(N);2.Ni柱子洗脱(N);3.rProteinA洗脱1(N);4.rProteinA洗脱2(N);5.rProteinA洗脱3(N);6.空7.上柱前(R);8.Ni柱子洗脱(R);9.ProteinA洗脱1(R)10.rProteinA洗脱2(R),N-Nonreducing非还原的,R-Reducing还原的;由图20可知,非还原样品有明显的150KD条带为断裂intein介导的反式剪接而生成的双特异性抗体且纯度较高,还原样品仅出现50KD左右的重链和25KD左右的轻链。汇集单体抗体组分,如果需要,利用MILLIPORE Amicon Ultra(30MWCO)超滤离心管浓缩,冷冻和在-20℃或-80℃保存,或者用于更高纯度的纯化,例如离子交换层析,疏水层析,以及分子排阻层析等。图21为多特异抗体及免疫杂合蛋白制备方法的产物示意图;其中,A为多特异抗体及免疫杂合蛋白制备方法的产物A组(制备双特异抗体、抗体导向的免疫毒素等产品);B为多特异抗体及免疫杂合蛋白制备方法的产物B组(制备抗体片段与细胞因子或毒素的杂合蛋白);C为多特异抗体及免疫杂合蛋白制备方法的产物C组(制备2-4多特异抗体及免疫杂合蛋白的产物)。
综上所述,本发明中为了解决重链错配问题,引入了“Knobs-into-Holes(杵-进入-臼)”和去除一条重链的VH和CH1区域在CH2的N铰链区端融合IC(断裂intein的C段),从而彻底阻止了重链形成无法纯化去除的重链同源二聚体组份。为了引入“Knobs-into-Holes(杵-进入-臼)”结构,在一条CH3区域将366位的T(苏氨酸)突变为W(色氨酸)形成“Knobs”结构;同时在另一条重链CH3区域将366位的T(苏氨酸)突变为S(丝氨酸),368位的L(亮氨酸)突变为A(丙氨酸),407位的Y(酪氨酸)突变为V(缬氨酸)以形成“Holes”结构;此外为了提高CH3区域结合的稳定性,将“Knobs”链上354位的S(丝氨酸)突变为C(半胱氨酸),“Holes”链上349位的Y(酪氨酸)突变为C(半胱氨酸)以引入一对重链间二硫键增强重链间的稳定性。此外最重要的是,一条完整的“Knobs”重链和一条“Holes”Fc链共同表达,由于“Knobs”重链同源二聚体,“Holes”Fc同源二聚体,与目的产物“Knobs”重链和“Holes”Fc异源二聚体性质差别很大,可以很简单的分离纯化开,因此最终产物中可以完全避免了重链错配问题。
本发明首次将双特异性抗体分割为结合抗原A,和结合抗原B两部分,如(图.2,图.3)所示,分别表达,然后通过断裂蛋白内含肽的反式剪接功能将A和B两部分连接成为完整的抗体。两条轻链不会同时存在,两条VH+CH1链也不会同时存在,因此不会出现A的轻链结合到B的重链上的情况,也不会出现B的轻链结合到A的重链上的情况,完全避免了轻链错配的产生。
本发明首次将断裂intein的反式剪接功能与双特异性抗体的构建结合,通过将分别表达纯化的A和B两部分抗体,通过断裂intein的反式剪接功能连接成为完整的抗体,这种双特异性抗体与天然存在的抗体分子结构及其相似,避免了因为结构差异引起的抗体分子不稳定,以及体内免疫原性高的情况。
本发明是运用基因重组表达技术生产双特异性抗体,所用的序列可以是人源化的抗体序列,或者是全人的抗体序列,最终可以得到人源化或者全人的双特异性抗体。这将极大的降低了双特异性抗体体内的免疫原性,为双特异性抗体成为药物奠定了基石。
由于A抗体部分保留了完整的Fc区域,intein介导的反式剪接所得到的双特异性抗体保留完整的Fc区域,保留了抗体的效应功能,诸如CDC(补体依赖的细胞毒性)或者ADCC(细胞毒作用)与血管内壁FcRn(Fc受体)结合的半衰期延长特性。
在本发明中A和B两部分抗体,都是通过哺乳动物细胞表达系统表达,比如瞬时转染293E,293F,CHO等细胞,以及稳定转染CHO等细胞生产。哺乳动物细胞表达的产品,是具备糖基化修饰的,与天然的抗体分子更加相近,intein介导的反式剪接所得到的双特异性抗体含有良好的糖基化修饰,能够更好的维持双特异性抗体分子的稳定性,以及ADCC,CDC等抗体效应,并且体内半衰期延长,药效持续时间增长。
本发明制备双特异性抗体的方法,纯化工艺简单易于操作。首先A和B两部分均可通过亲和层析ProteinL或者ProteinA/G等高回收率的层析方法获得,intein介导的反式剪接所得到的双特异性抗体可以经过ProteinA/G等高回收率的层析方法获得,有利于接下来疏水层析,或者离子交换层析的操作。大大降低了纯化难度,可以得到高品质的产品。
由于抗体重链的CH1和CH2之间的铰链区结构灵活,且抗体Fc区一级Fab区域结构基本完全一致,所以,该方法适用于任何双特异性抗体的生产,无需根据每个抗体的性质进行性质分析,本发明完全适用于任何抗体亚型(IgG,IgA,IgM,IgD,IgE,IgM,以及轻链κ和λ型)的双特异性抗体生产,具有广泛的通用性。
实施例2、利用Npu DnaE的反式剪接功能制备免疫毒素Herceptin-PE38KDEL
2.1、构建融合了断裂内含肽Npu DnaE N端的Her HC表达载体pCEP4-Her HC-Nn
利用表1引物,以合成的包含编码信号肽基因的Herceptin重链核酸分子为模板利用表中引物克隆编码Herceptin重链的基因以合成的包含Npu DnaE的核酸分子为模板,克隆Npu DnaE的N端基因,采用TaKaRa公司的PrimerStar Max进行扩增,PCR条件为 94℃10s,55℃10s,72℃10s,30个循环,将得到的片段琼脂糖凝胶电泳回收后利用重叠PCR将编码Herceptin重链的基因与编码Npu DnaE的N端基因Npu DnaE的N端在融合多肽C端的顺序合成,PCR条件为94℃10s,55℃10s,72℃10s,30个循环,将此基因片段用HindIII和BamHI处理,并与同样经过HindIII和BamHI处理的pCEP4进行连接,质粒结构图如图所示。将连接产物转化大肠杆菌DH5α感受态细胞,将转化细胞涂布于含50μg/mL氨苄西林的琼脂平板培养过夜。挑取平板上长出的单克隆,于5mL含50μg/mL氨苄西林的LB培养基中震荡培养过夜,并提取质粒,对其进行测序,测序结果表明所构建的Her HC-Nn序列正确。
表1
2.2、融合多肽Herceptin-Nn的表达与纯化
利用HEK293-E系统中的瞬时表达系统表达融合肽Herceptin-Nn。用SFX4HEK293培养基(HyClone)和Gibco Freestyle 293培养基(Gibco)以1:1的比例,添加100μg/ml遗传霉素(geneticin)(Gibco)培养HEK293-E细胞(表达EB病毒核抗原的人胚肾细胞系293;美国典型培养物中心,保藏号ATCC#CRL-10852,Lot.959 218),转染前一天用新鲜培养基将细胞稀释至1.5-2.5×106个细胞/ml,以37℃,120rpm,5%CO2培养,以待次日转染。转染当日,按照每106个细胞用0.5μg DNA的用量,等质量比混合pCEP4-Her HC-Nn和构建好的Herceptin轻链表达载体pCEP4-Her LC,用Gibco Freestyle 293培养基稀释DNA至(40ng/μL),DNA:PEI=1:3加入混匀的DNA中室温孵育20min备用。同时1000rpm离心5min收集细胞,经Gibco Freestyle 293培养基洗涤细胞1次,1000rpm离心5min收集细胞,用150ml Gibco Freestyle 293培养基 重悬细胞至细胞密度为4×106个细胞/ml置于新的1L摇瓶(Coming)中。将孵育的DNA-PEI复合物加入细胞中,37℃,110rpm,5%CO2转染4小时,随后加入等体积预热的SFX4HEK293培养基,添加100μg/ml遗传霉素(geneticin)(Gibco)继续37℃,130rpm,5%CO2培养10天。直接收集上清纯化或者收集上清-80℃冷冻保存。
所收集的上清用PBS(20mM PBS,150mM NaCl,pH 6.8-7.4)1:1混合,上到预先用PBS平衡完毕的Protein A(蛋白A)亲和层析柱,上样完毕用10倍柱体积的PBS洗涤,用pH3.0的100mM柠檬酸缓冲液洗脱抗体,用pH9.0的1M Tris-Hcl缓冲液立即中和收集到的洗脱样品。取小样进行SDS-PAGG分析,非还原样品于170kD左右出现组装好的Herceptin-Nn,还原样品中出现约70kD的Her HC-Nn链和25KD的轻链。合并含有目的蛋白的样品,以用于下一步断裂intein介导的体外剪接。如果需要,利用MILLIPORE Amicon Ultra(30MWCO)超滤离心管浓缩,冷冻和在-20℃或-80℃保存。
3、利用Npu DnaE反式剪接制备Herceptin-PE38KDEL
将得到的融合多肽Nc-PE38KDEL与融合多肽Herceptin-Nn以摩尔比1:1进行混合,并加入终浓度为1mM的DTT,于25℃下保温60min,取样品进行SDS-PAGE以及Western Blot检测。
4、经由Npu DnaE反式剪接产生的Herceptin-PE38KDEL的分离纯化
利用Ni2+NTA捕获步骤3中未发生反式剪接反应的融合多肽以及反式剪接所产生的副产物来纯化Herceptin-PE38KDEL。装填Ni2+重力柱,柱床体积1ml,用5倍柱体积水洗之后用10倍柱体积结合缓冲液(20mM PBS、500mM NaCl、20mM咪唑、pH7.5)平衡,将步骤3得到的反应体系上柱,流速为1ml/min,收集流穿,上柱完毕后,用5倍柱体积包含40mM咪唑的洗脱缓冲液(20mM PBS、500mM NaCl、40mM咪唑、pH7.5)冲洗,收集冲洗液,随后用10倍柱体积包含150mM咪唑的洗脱缓冲液(20mM PBS、500mM NaCl、150mM咪唑、pH7.5)冲洗,SDS-PAGE检测收集的蛋白样品,依需要,可冷冻和在-20℃或-80℃保存,或者用于更高纯度的纯化,例如离子交换层析,疏水层析,以及分子排阻层析等。
传统生产免疫毒素的技术方法中存在诸多不足之处,如化学偶联法中需要加入化学试剂,由于导向多肽部分中修饰位点较多而导致的产品不均一,同时化学偶联键容易断裂而导致毒性渗漏等;而直接表达免疫毒素融合蛋白的策略中,若采用原核表达系统,则目的蛋白往往以包涵体形式存在,复性效率低且步骤繁琐过程复杂,若采用真核表达系统则免疫毒素的表达可能受限于其对宿主细胞存在的天然毒性。本发明的方法实现了 诸多优点:1、本发明的方法只需要制备不同的导向部分多肽以及毒性部分多肽,就可以将其进行组合,进而产生可以针对不同靶点及拥有不同毒性机制的免疫毒素,具有显著的多样性及灵活性;2、本发明的方法中,导向部分多肽和毒性部分多肽可以在适当的宿主细胞中分开表达,如需要特殊的折叠环境,特别是高级的翻译后修饰,可以在哺乳动物细胞中进行表达,而没有太多修饰需求的多肽可以在大肠杆菌中进行表达,在适合的表达系统中分别表达目的多肽可以获得较高的产量、收率以及纯度;3、本发明的方法中,导向部分多肽和毒素部分多肽的连接是位点特异性的,不会生产副产物,得到的产物产品均一性高;4、本发明的方法中,导向性部分多肽和毒素部分多肽经由内含肽的自剪接,是有肽键连接在一起,相比于化学偶联法等连接方式具有良好的稳定性;5、本发明的方法中,自剪接反应条件温和、反应高效,易于与其他工艺进行整合、放大;反应过程无需加入有毒有害作用物质。
以上对本发明的具体实施例进行了描述。需要理解的是,本发明并不局限于上述特定实施方式,本领域技术人员可以在权利要求的范围内做出各种变形或修改,这并不影响本发明的实质内容。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于治疗HBV感染和相关病症的三特异性结合分子的制造方法与工艺
- 对磺胺类药物具有特异性的固相微萃取纤维的制备方法与流程
- 一种检测猪初乳中抗PEDV特异性IgA抗体的夹心ELISA试剂盒的制造方法与工艺
- 用于施用CD19xCD3双特异性抗体的给药方案的制造方法与工艺
- 双特异性抗‑VEGF/抗‑ANG‑2抗体及其在治疗眼血管疾病中的应用的制造方法与工艺
- 特异性人EWS‑FLI1融合蛋白抗体的制备方法及在制备尤文肉瘤诊断抗体试剂的应用与制造工艺
- 双特异性四价抗体及其制造和使用方法与制造工艺
- 利用特异性挥发物筛选昆虫相关嗅觉蛋白的方法与制造工艺
- 使用与表面偶联的单特异性四聚抗体复合物组合物从样品中分离出靶实体的方法与制造工艺
- 抗-WT1/HLA双特异性抗体的制造方法与工艺