一种基于香豆素的双光子溶酶体极性探针、其制备方法及其用途与流程
一种基于香豆素的双光子溶酶体极性探针、其制备方法及其用途一、技术领域本发明涉及一种荧光探针,具体地说是一种基于香豆素的双光子溶酶体极性探针、其制备方法及其用途。二、背景领域极性是化学化工生产中的一种重要参数,一些特定的无机有机反应均依赖于极性的参与。在生物系统里,尤其在细胞层面上,极性决定了大多数蛋白质和酶的联系并反映了细胞及细胞器膜组分的通透性,甚至极性的反常变化与一些疾病的产生关系密切。溶酶体是真核细胞中的一种细胞器,内含多种水解酶,专司分解各种外源和内源的大分子物质。现已知各类细胞的溶酶体中约含60种酶,包括蛋白质、糖类、脂类等物质的水解酶类,如酸性磷酸脂酶、组织蛋白酶、核糖核酸酶以及芳香基硫酸脂酶A和B等。然而,目前为止针对溶酶体极性进行定性的研究还是少之又少,因此检测溶酶体内极性的变化是十分重要的。荧光探针是在一定体系内,当一种物质或体系中某一物质性质发生变化时,荧光信号能发生相应改变的分子。荧光光谱由于其检测方便,灵敏等优点在痕量检测中展现了优越的性能。近些年来,双光子荧光光谱凭借着自身稳定性高,光漂白性好,细胞穿透性高等优点被广泛使用。因此,能够使用双光子荧光探针来检测细胞溶酶体内极性的变化是非常理想的选择。香豆素作为一个传统的“溶剂致变色”基团,具有良好的光谱特性和水溶性,对包裹在其周围溶剂分子的极性变化很敏感,并且对细胞几乎没有毒性。因此,香豆素非常适合作一个极性探针的荧光报告基团。目前检测细胞内极性的探针大多为单光子激发,然而单光子荧光探针不仅易使生物本体产生自发荧光干扰,而且短的激发波长还会对细胞产生光致毒。因此,在香豆素基团上连接一个较大的共轭结构使其能够被双光子激发具有突破性的意义。三、
技术实现要素:
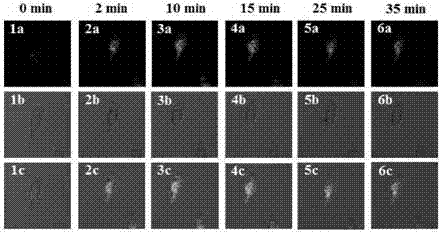
本发明旨在提供一种基于香豆素的双光子溶酶体极性探针、其制备方法及其用途,所要解决的技术问题是通过分子设计遴选合适的荧光探针结构,以实现双光子成像定性检测细胞中溶酶体的极性变化。本发明极性探针具有选择性专一、灵敏度高等优点,细胞毒性测试表明本发明极性探针对细胞几乎没有毒性作用。本发明极性探针(Lyso-OC),是以香豆素为母体,其结构由下式表示:本发明极性探针的制备方法,包括如下步骤:将7-((4-甲氧基苯基)乙炔)-3-羧酸-香豆素(1g,3mmol)、N,N-二异丙基乙胺(1.2g,9mmol)、1-羟基苯并三唑(0.65g,4.5mmol)、EDC·HCl(0.65g,3.3mmol)以及2-吗啡-1-乙胺(1.2g,9mmol)加入史莱克瓶中,在无水无氧条件下加入30mLN,N-二甲基甲酰胺,室温搅拌反应24h;反应结束后向反应液中加入50mL二氯甲烷将反应物溶解,再用30mL水萃取(3次),收集有机相,将有机相通过柱层析200-300目硅胶,洗脱液乙酸乙酯:石油醚=2:1(v/v),得到目标产物Lyso-OC0.3g,产率30%。本发明极性探针Lyso-OC的合成过程如下:本发明极性探针在定性检测环境和细胞中溶酶体极性变化时作为检测试剂应用。将本发明极性探针分子溶于DMSO中制得1mM的母液,取50μL的该母液于10mL容量瓶中,再用不同极性(极性参数设置为Δf)的溶剂定容,配制成5μM溶液。极性探针单光子和双光子的激发波长分别为375nm和750nm,检测390-650nm范围内的荧光光谱变化,可以明显观察到从1,4-二氧六环(极性很小,Δf≈0.09)溶剂极性依次增大到水(极性很大,Δf≈0.32)时,荧光的最大发射峰从470nm红移至525nm(斯托克斯位移约为55nm),荧光强度也随之降低了约550倍。为了排除溶剂效应的干扰并且进一步研究本发明极性探针与溶剂极性的关系,通过调节水-四氢呋喃中水的含量来控制混合溶剂的极性,取50μL的该母液于10mL容量瓶中,再用不同水含量的水-四氢呋喃混合溶剂定容,配置成5μM溶液。单光子和双光子的激发波长和检测范围均同上,可以观察到水含量从1%(Δf≈0.22)增加到80%(Δf≈0.31)时,荧光的最大发射峰从475nm红移至525nm(斯托克斯位移约为50nm),荧光强度随之降低了约75倍,荧光量子产率也随之从55%逐渐降低到了约1%,同时荧光寿命也随着极性的增加线性减少。随后,继续研究本发明极性探针在其他不同溶剂的混合体系中(如水-1,4-二氧六环、水-甲醇等)随着极性变化而产生的荧光变化,发现其均呈规律性变化。因此本发明极性探针分子非常有潜力运用于生物检测。为了排除环境pH值对本发明极性探针分子荧光变化情况的影响,取50μL的该母液于10mL容量瓶中,再用不同pH的水定容。单光子和双光子的激发波长和检测范围均同上,可以观察到当环境的pH值从4.0变化到8.0(生物系统中常见的pH范围)时,荧光探针的荧光强度基本没有变化,证明pH值的变化对探针的作用影响非常小,并且能够很好地在生物应用中反映极性的变化。本发明极性探针检测微环境极性变化的机理是在极性探针(Lyso-OC)分子吸收光子的过程中,由于整个探针分子各个部分偶极矩的不同而导致“溶剂致变色”现象。当溶剂分子包裹在探针分子周围,“溶剂致变色”现象会导致分子在基态和激发态稳定化能的不同。因此,当溶剂极性增加时,探针分子的激发态需要释放更多地能量来内部转换到一个比之前更稳定的激发态(即比之前激发态更低的能级),甚至可能在一些快速的内部转换之后进一步转换为另一种机理不同却更稳定的激发态(具体为ICT激发态转换为TICT激发态),这也具体表现为荧光强度减弱或荧光光谱红移。本发明荧光探针分子结构简单,易于合成,以荧光强弱和颜色的变化来检测微环境极性的变化,操作简单,快速灵敏,并且对细胞毒性很小,能够用于检测溶酶体内的极性变化。四、附图说明图1是5μM探针在不同极性的溶剂中的荧光光谱。图2是5μM探针在不同极性的溶剂中的紫外吸收光谱。图3是5μM探针在不同水含量的水-四氢呋喃混合体系中的荧光光谱。图4是5μM探针在不同水含量的水-四氢呋喃混合体系中的紫外吸收光谱。图5是5μM探针在不同水含量的水-四氢呋喃混合体系中量子产率随水含量变化线性关系。图6是5μM探针在不同水含量的水-四氢呋喃混合体系中的荧光寿命及其随水含量变化线性关系。图7是5μM探针在不同pH水中的荧光变化情况。图8是5μM探针在四氢呋喃中的双光子有效吸收截面积。图9是在不同含量(10μM、20μM、30μM)的探针分子的作用下的细胞存活率。图10是探针分子在HeLa细胞中的溶酶体定位成像。图11是用10μM探针分子培养HeLa细胞0.5小时后加入10μL溶酶体自噬诱导剂雷帕霉素后的荧光变化情况。五、具体实施方式实施例1:极性探针Lyso-OC的合成将7-((4-甲氧基苯基)乙炔)-3-羧酸-香豆素(1g,3mmol)、N,N-二异丙基乙胺(1.2g,9mmol)、1-羟基苯并三唑(0.65g,4.5mmol)、EDC·HCl(0.65g,3.3mmol)以及2-吗啡-1-乙胺(1.2g,9mmol)加入史莱克瓶中,在无水无氧条件下加入30mLN,N-二甲基甲酰胺,室温搅拌反应24h;反应结束后向反应液中加入50mL二氯甲烷将反应物溶解,再用30mL水萃取(3次),收集有机相,将有机相通过柱层析200-300目硅胶,洗脱液乙酸乙酯:石油醚=2:1(v/v),得到目标产物Lyso-OC0.3g,产率30%。1HNMR(400MHz,CDCl3)δ9.13(s,1H),8.86(s,1H),7.63(d,J=8.0Hz,1H),7.53(s,1H),7.50(s,1H),7.49(s,1H),7.46(s,1H),6.91(d,J=8.9Hz,2H),3.85(s,3H),3.78(s,4H),3.61(s,2H),2.61(d,J=31.8Hz,6H).13CNMR(101MHz,CDCl3)δ161.65,161.09,160.49,154.31,147.46,133.52,133.05,129.87,129.53,128.24,118.81,118.13,118.00,114.24,114.14,95.16,87.03,66.49,56.74,55.32,53.26,36.30.实施例2:极性探针Lyso-OC的双光子测试利用双光子测量技术,测试极性探针Lyso-OC的双光子吸收截面,从图8可以看出,极性探针的最大有效吸收截面是103GM,双光子激发波长在760nm。对极性探针Lyso-OC的双光子吸收进行验证,在760nm的双光子激发波长下,将电压从200w逐渐调至800w,双光子有效吸收截面成线性增长,线性斜率为2.01,证明此极性探针的确可以双光子激发。实施例3:细胞毒性测试MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)实验是根据已报道的文献,做细胞毒性测试。分别在同一批HeLa细胞中加入0,10,20,30μM的极性探针分子,此条件是在37℃、含5%CO2的细胞培养箱中孵育24小时,根据细胞存活度的公式:细胞存活率%=OD570(样品)/OD570(对照组)×100,可算得细胞存活率(图5)。从图5中我们可以看出,浓度为10μM时,细胞存活率为98%左右,当探针浓度达到30μM时,细胞存活率仍然有约82%,说明了本发明极性探针对细胞基本没有毒性作用,因此可以用来做细胞检测及监测溶酶体中的极性变化。实施例4:细胞定位测试HeLa细胞由DEME(invitrogen)培养液培养,成像前一天,HeLa细胞放于激光共聚焦皿中,成像时HeLa细胞和10μM的极性探针Lyso-OC的DMSO溶液于37℃、含5%CO2的细胞培养箱中孵育0.5小时,用中性的PBS缓冲溶液洗涤3次后,再往培养皿中加入1μM商品化溶酶体染色剂Lysosome@TrackerRed溶液继续孵育0.5小时,用中性的PBS缓冲溶液洗涤3次。用双光子荧光共聚焦成像,设置绿色通道tracker1,激发波长为760nm,发射波段为495-545nm,这个通道用来接受探针分子Lyso-OC发射的荧光。设置红色通道tracker2,激发波长为577nm,发射波长为580-600nm,这个通道用来接收商品化溶酶体染色剂Lysosome@TrackerRed发射的荧光。实施例5:细胞成像测试HeLa细胞由DEME(invitrogen)培养液培养,成像前24小时,HeLa细胞放于激光共聚焦皿中贴壁培养,成像时HeLa细胞和10μM的极性探针Lyso-OC的DMSO溶液于37℃、含5%CO2的细胞培养箱中孵育0.5小时,用中性的PBS缓冲溶液洗涤3次后进行细胞成像测试,设置通道tracker1,激发波长为760nm,发射波段为495-545nm,此时记录下正常状态下的细胞形态和荧光情况。往培养皿里面加入10μM的细胞溶酶体自噬剂雷帕霉素(rapamycin)溶液诱导细胞发生自噬,此时溶酶体的形态及微环境发生变化,随着时间的变化,分别记录下各个时间点的细胞形态及荧光变化情况,得图11。
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1