一类海洋真菌来源的茚酮衍生物及其制备方法和应用与流程
本发明属于医药技术领域。更具体地,涉及一类海洋真菌来源的茚酮衍生物及其制备方法和应用。
背景技术:
自由基是生物体内各种机体反应的一类副产物,并且在生物体疾病发生过程中起到关键的诱导作用。1956年英国科学家Harman提出的“自由基学说”认为体内过量的自由基会进攻生物大分子造成机体损伤,进而引起机体衰老。尽管人类和一些其他生物体都具有自身抗氧化防御功能以及修复机制来清除体内过多的自由基,从而使其达到动态平衡,但机体内各类抗氧化酶的活性会随着年龄的增长而降低,从而使其清除自由基能力下降。一旦这种动态平衡被打破,体内过量的自由基将会直接攻击和损害生物大分子,例如DNA和蛋白质,除此之外,多余的自由基还会造成多不饱和脂肪酸的脂质过氧化(LPO),最终生成丙二醛(MDA),进而使蛋白质、核酸、脑磷脂发生交联并丧失其活性。
大量研究表明,体内自由基失衡是导致老龄化疾病以及基因突变的重要原因,例如心脏病、关节炎、神经性疾病、糖尿病以及癌症等都与过量的自由基有密切关联。因此,寻找新型的外源抗氧化剂来清除生物体过量的自由基已经成为一个新的研究热点。
海洋真菌来源广泛,长时间处于高盐、高压、低氧等极端环境使得其在生长进化过程中形成了独特的代谢途径以及遗传基因,且能够产生大量结构新颖的活性次级代谢产物,药物筛选获得率高。与其它海洋生物相比,其最大的优势就是对环境友好,具有可持续发展性,是开发新型海洋药物以及功能食品的重要资源。从包括海洋真菌在内的海洋微生物中寻找新的药源已成为国内外研究的热点。
技术实现要素:
本发明要解决的技术问题是提供一种新的清除自由基、抗氧化的物质。本发明从一株海洋真菌Ascomycota sp.SK2YWS-L中分离到一类新型茚酮衍生物,该类化合物具有体外还原三价铁离子能力(FRAP),可以清除DPPH(二苯代苦味肼)自由基,在制备抗氧化药物以及保健品中具有远大的市场前景。
本发明的目的是提供一株海洋红树林内生真菌Ascomycota sp.SK2YWS-L。
本发明另一目的是提供一类从上述真菌中分离制备的新型茚酮衍生物。
本发明的再一目的是提供上述茚酮衍生物在制备抗氧化药物以及保健品中的应用。
本发明上述目的通过以下技术方案实现:
一株海洋红树林内生真菌Ascomycota sp.SK2YWS-L,该菌株已于2016年4月21日保藏于中国典型培养物保藏中心,保藏编号为CCTCC M 2016217。
一类茚酮衍生物,其结构式如下式(I)或式(II)所示:
式(I)中,R为H或Me。
另外,从上述真菌SK2YWS-L中制备茚酮衍生物的方法也在本发明的保护范围之内,所述方法为:将真菌Ascomycota sp.SK2YWS-L利用固体大米发酵培养基进行培养得到菌体,用甲醇提取,提取液浓缩后利用柱层析色谱分离;收集乙酸乙酯/石油醚洗脱液,再进行柱层析色谱分离,得到茚酮衍生物。
更具体优选地,所述茚酮衍生物的制备方法包括如下步骤:
S1.真菌的种子培养:挑取真菌Ascomycota sp.SK2YWS-L,接入斜面培养基,28~30℃培养3~5天;
S2.真菌的发酵培养:将步骤S1获得的种子菌株转接入固体大米发酵培养基中,于室温28~30℃静置32天;
S3.将步骤S2培养好的菌体用甲醇提取三次,浓缩提取液,将获得的浓缩浸膏利用柱层析色谱分离;收集50~60%乙酸乙酯/石油醚洗脱液,再以柱层析分离技术进行分离,得到茚酮衍生物。
其中,优选地,步骤S1所述斜面培养基是按照如下重量比配方制备培养基:酵母提取物0.1%,琼脂1.5%~2.5%,氯化钠1.5%~4%,蛋白胨0.1%~0.5%,水93~98%;葡萄糖0.3%;制成试管斜面。
优选地,步骤S2所述固体大米发酵培养基的配方为大米:海盐水=0.5~1.5:0.5~1.5。
更优选地,所述固体大米发酵培养基的配方为大米:海盐水=1:1。
更优选地,所述海盐水的海盐质量比含量为0.1~0.5%。
更优选地,所述海盐水的海盐质量比含量为0.3%。
优选地,步骤S3所述柱层析分离技术为硅胶柱层析分离技术、凝胶柱层析分离技术或C-18反相柱层析分离技术。
另外,由上述方法制备得到的茚酮衍生物也在本发明的保护范围之内。
所述茚酮衍生物属于二倍半萜类化合物,具有体外还原三价铁离子能力(FRAP),具有清除DPPH(二苯代苦味肼)自由基以及羟基自由基活性,可用于抗氧化药物或保健品的制备。
因此,上述茚酮衍生物在制备抗氧化药物或保健品中的应用,也在本发明的保护范围之内。
本发明具有以下有益效果:
本发明的茚酮衍生物具有体外还原三价铁离子能力,具有清除DPPH(二苯代苦味肼)自由基以及羟基自由基活性,在抗氧化药物或者保健品的制备方面具有很好的应用前景。
而且,本发明的海洋红树林内生真菌Ascomycota sp.SK2YWS-L稳定,易培养,利用上述真菌Ascomycota sp.SK2YWS-L制备茚酮衍生物的方法简单可行,成本低,适用于大规模工业应用,具有很好的推广应用前景。
附图说明
图1为茚酮衍生物1-3清除DPPH(二苯代苦味肼)自由基试验结果。
图2为茚酮衍生物1-3FRAP总抗氧化活性测定结果。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备;除非特别说明,所用试剂和均为市购。
实施例1真菌Ascomycota sp.SK2YWS-L的分离与鉴定
1、材料:从中国广西山口采集的红树植物Kandelia obovata的果实。
2、经过菌株的培养、分离、鉴定,获得一株目标菌株,经过鉴定为海洋红树林内生真菌Ascomycota sp.,并命名为SK2YWS-L,于2016年4月21日保藏于中国典型培养物保藏中心,保藏编号为CCTCC M 2016217,保藏地址:武汉武汉大学。
实施例2茚酮衍生物的制备
1、从真菌Ascomycota sp.SK2YWS-L中制备茚酮衍生物,步骤如下:
(1)真菌Ascomycota sp.SK2YWS-L的种子培养:
培养基组成按重量比为:琼脂2.5%,水98%;氯化钠3%,蛋白胨0.5%,葡萄糖0.3%,酵母提取物0.1%;
制成试管斜面,挑取菌株接入斜面,30℃培养3天;
(2)真菌Ascomycota sp.SK2YWS-L的发酵培养:
固体大米发酵培养基配方为大米:海盐水=1:1;
将种子中的菌株转接入发酵培养基中,于室温28~30℃静置32天;
(3)将上述培养好菌体用甲醇提取三次,浓缩提取液,将获得的浓缩浸膏利用株层析色谱分离;收集50~60%乙酸乙酯/石油醚洗脱液,再以硅胶、凝胶、C-18反相等柱层析分离技术进行分离,得到化合物1、2、3。
2、对得到的化合物1-3进行结构测试解析,,得到以下试验数据:
化合物1:C32H26O11;[α]=0;HRESIMS:585.1401[M-H]-(理论计算值586.1475);m.p.310–312℃;一维核磁共振数据见表1。
化合物2:C33H28O11;[α]=0;HRESIMS:599.1558[M-H]-(理论计算值600.1631);m.p.320–322℃;一维核磁共振数据见表1。
化合物3:C25H38O3;[α]=0;HRESIMS:567.1298[M-H]-(理论计算值568.1369);m.p.301–303℃;一维核磁数据数据见表1。
表1化合物1-3的NMR数据(CDCl3,125MHz/400MHz,ppm)
经过鉴定,化合物1-3为茚酮衍生物,其结构式如下所示:
实施例3茚酮衍生物1-3清除DPPH(二苯代苦味肼)自由基试验
1、材料
二苯代苦味肼(DPPH),购自aladdin试剂公司;维生素C,购自aladdin试剂公司;分析纯甲醇,购自广州化学试剂厂;iMark酶标仪。
2、试验方法
DPPH自由基清除实验
(1)将茚酮衍生物1-3以维生素C溶于甲醇溶液中,配制成不同浓度的待测样品。
(2)在96孔板微孔中分别加入180μL DPPH溶液(150μM甲醇溶液)与20μL不同浓度的待测样品至总体积200μL,维生素C作为阳性对照;200μL DPPH甲醇溶液(150μM)作DPPH空白对照;在避光条件下震荡反应30min。
(3)利用iMark酶标仪测定1中反应孔板在490nm下的吸光值为A1;空白对照空白对照吸光值为A0;重复测试三次取其平均值;
DPPH自由基清除率计算方式为:清除率%=(A0–A1)/A0。
3、试验结果如表2和附图1所示。
表2化合物1-3清除DPPH自由基活性结果
结果显示,化合物1-3均对DPPH自由基具有清除能力,其EC50分别为18、38以及52μM,其中化合物1具有比阳性对照Vc更强的清除活性。
实施例4茚酮衍生物1-3FRAP总抗氧化活性测定实验
1、材料
TPTZ(2,4,6-三吡啶基三嗪),购自aladdin试剂公司;醋酸缓冲液(pH 3.6),购自aladdin试剂公司;六水合三氯化铁,购自广州化学试剂厂;浓盐酸,购自广州化学试剂;iMark酶标仪。
2、试验方法
FRAP总抗氧化活性测定:
(1)将TPTZ溶解在缓冲液中,配置成10mM TPTZ溶液;再加入烟酸溶液至HCl终浓度为40mM。
(2)将六水合三氯化铁溶解在缓冲液至终浓度为20mM。
(3)将1与2溶液1:1混合,在37℃避光条件下温浴5min得到FRAP工作液。
(4)在96孔板微孔中分别不同浓度(25-100μM)的维生素E水溶物(Trolox)与180μL FRAP工作液避光反应30min。利用iMark酶标仪测定反应混合物在595nm下的吸光值A,绘制吸光值A对浓度c的标准曲线。
(5)将化合物1-3配制100μM甲醇溶液,照按(4)中方法进行反应。反应完测定其在595nm下的吸光值。
(6)将5中所测得吸光值与4中标准曲线对比,得出化合物1-3的还原能力。样品的还原能力用FRAP值表示,1FRAP单位=100μM Trolox,即100μM的样品的抗氧化能力相当于FRAPμM的Trolox。
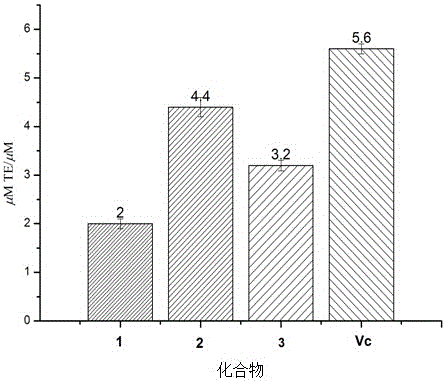
3、实验结果如表3和附图2所示。
表3化合物1-3的FRAP总抗氧化活性测定结果
结果显示,化合物1-3均显示较强的总抗氧化活性,其FRAP值分别为2、4.4以及3.2。相比于阳性对照Vc而言,化合物1-3也均显示了中等的总抗氧化活性。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于生产化学品及其衍生物的组合物和方法与制造工艺
- 7‑OH‑8‑[(1‑胺基‑1‑苯基衍生物)‑次甲基]‑黄酮化合物及其制备方法及其应用与制造工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制造方法与工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 一种白杨素氨基酸衍生物的制备方法与制造工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 吡唑衍生物及其作为大麻素受体介体的用途的制造方法与工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 水生态处理中淤泥及衍生物的再利用处理系统的制造方法与工艺
- Schiglautone A衍生物的组合物用于制备抗缺氧药物的制作方法
- Schiglautone A衍生物的组合物用于制备抗红细胞低下性贫血药物的制作方法