乙醛脱氢酶2基因的新用途的制作方法
本发明属于医学检测领域,具体涉及乙醛脱氢酶2基因的新用途。
背景技术:
胃癌是全球范围内的第四大癌症,第二大致死性疾病,东亚地区的病例占总体的一半以上,中国发病率占全球43%;死亡率占全球45%。而且中国胃癌患者发现时临床分期较晚,进展期胃癌比例约占70%,是关注度最高的一类人群。因为胃癌的异质性很强,胃癌部位、病例类型、年龄、性别等不同,预后与治疗转归都有不同。
胃癌的分型经历了大体形态分型,组织学分型,基于环境、遗传分型,分子分型。
肿瘤分子分型(molecular classification)由美国国立癌症研究所首次提出,通过分子分析技术为肿瘤进行分类,使肿瘤分类从传统的形态学转向以分子特征为基础的分子分型。早在2003年Kim B等人应用14K cDNA芯片将胃癌分为高度炎症浸润型和低度炎症浸润型,后者再分为3个亚型,即弥漫型及具有不同恶性特征的2个肠型。同期Tay ST等联合应用微卫星不稳定分析等技术根据基因表达差异将胃癌氛围3种亚型:肿瘤发生癌(tumorigenic)、反应性癌(reactive)和胃样癌(gastric-like),其中胃样癌患者具有更好的总体生存率。2011年Tan等用基因芯体技术分析了37个胃癌细胞系基因表达谱的差异,将胃癌分为肠型(G-INT)和弥漫型基因亚型(G-DIF)。2013年Lei等通过基因芯片研究胃腺癌基因表达谱,将胃癌分为间充质型、增值型和代谢型。
2014年7月23日癌症基因组图谱(The Cancer Genome Atlas,TCGA)在《Nature》在线发表的一篇论文提出了一种胃癌分子分型,将其分为四个亚型:1.EBV(Epstein-Barr,EBV)病毒阳型,其特征包括PIK3CA频发突变、DNA超甲基化和JAK2、CD274和PDCD1LG2扩增;2.微卫星不稳定(MSI)型,其特征是高突变率,包括编码癌基因信号通路蛋白的激活性基因突变;3.基因组稳定(GS)型,该型多发生于组织学弥漫型中,由RHOA突变或THO家族GTP酶活化蛋白基因融合现象;4.染色体不稳定(CIN)型,其具有标志性的异倍染色体和受体络氨酸激酶原位扩增。
随着胃癌分子分型体系的不断完善,从Tan的基因组分型(基因组肠型和弥漫型)、Lei的分子分型(增值型、代谢型及间充质型)、到2014年TCGA基因分型(EB病毒感染型、微卫星不稳定型、基因稳定型和染色体不稳定型)。
目前,进展期胃癌的治疗主要是以化疗联合靶向治疗为主的综合治疗,常用的药物和方案有:铂类(DDP、OXA等)联合氟尿嘧啶类(F-FU、XELODA、S-1等),紫杉醇联合卡培他滨;化疗联合曲妥珠单抗常应用于HER2阳性患者;还有VEGF2、PD-1/PD-L1等其它在研靶向药物。
从当前现状来看,可选化疗药物少(仅三大类),靶向治疗滞后(曲妥珠单抗仅适用于约15%患者),胃癌异质性高,这三项是进展期胃癌的主要治疗瓶颈。因此,基于临床特点,病理分型,分子分型的个体化疗对进展期胃癌非常重要。从分子生物学创立引起肿瘤治疗模式的变化,从分子水平重新认识疾病,未来的肿瘤治疗模式应该是分子分型指导的个体化治疗。
技术实现要素:
本发明的目的在于提供一种胃癌分子分型的新检测指标,以便于为今后的胃癌个体化治疗提供指导。
为此,本发明公开了乙醛脱氢酶2基因作为胃癌分子分型的检测指标的用途。更优选为乙醛脱氢酶2基因作为蒽环类药物敏感型胃癌的分子分型指标的用途。
另一方面,本发明还公开了蒽环类药物在制备乙醛脱氢酶2基因突变或缺失类型胃癌治疗药物中的用途;
进一步地,所述蒽环类药物为阿霉素、表阿霉素、吡柔比星、去甲氧柔红霉素或米托蒽醌。
另一方面,本发明还公开了蒽环类药物和乙醛脱氢酶2抑制剂在制备胃癌治疗药物中的用途。
另一方面,本发明还公开了蒽环类药物在治疗乙醛脱氢酶2基因突变或缺失类型胃癌方法,其包含给予乙醛脱氢酶2基因突变或缺失类型胃癌患者有效剂量的蒽环类药物;
另一方面,本发明还公开了蒽环类药物和乙醛脱氢酶2抑制剂治疗乙醛脱氢酶2基因突变或缺失类型胃癌的方法,其包含给予胃癌患者有效剂量的蒽环类药物和乙醛脱氢酶2抑制剂或它们的复合制剂。
本发明首次发现ALDH2基因缺失或突变导致胃癌细胞对肿瘤化疗药物表现出不同的敏感性,并在体内实验得到验证,提供了胃癌分子分型的新检测指标,同时还公开了蒽环类药物在制备乙醛脱氢酶2基因突变或缺失类型胃癌治疗药物中的用途,为胃癌个体化治疗提供新的选择。
附图说明
图1小干扰RNA对SGC-7901细胞ALDH2基因的敲低效果。
图2 ALDH2敲低SGC-7901细胞的对化疗药物的敏感性影响。
图3 LDH2敲低SGC-7901细胞的的克隆形成能力影响。
图4敲低ALDH2表达胃癌细胞DOX处理后的细胞凋亡流式细胞仪分析。
图5裸鼠移植瘤的ALDH2敲低SGC-7901细胞化疗敏感性分析。
具体实施方式
乙醛脱氢酶2(ALDH2)是NAD+依赖的乙醛脱氢酶超家族成员之一,目前已发现有19个乙醛脱氢酶家族成员,乙醛脱氢酶2是定位在线粒体内一种重要的醛类氧化酶,能将乙醇代谢中间产物乙醛氧化成乙酸。同时乙醛脱氢酶2可分解乙醛代谢产物4-羟壬烯醛,减轻乙醛及其代谢产物对细胞的氧化损伤。它是一个四聚体酶,大量表达在肝、肾和肺等组织,在线粒体功能活跃的心、脑组织等也有表达。近期有研究表明,该酶的激活对于心肌缺血再灌注导致的心肌细胞死亡有显著的保护作用。乙醛脱氢酶2基因具有多态性,其表达产物的487位氨基酸残基可以是谷氨酸(Glu487)或赖氨酸(Lys487),因此该基因可以有Glu487纯合子(乙醛脱氢酶2*1/1)、Glu487/Lys487杂合子(乙醛脱氢酶2*1/2)和Lys504纯合子(乙醛脱氢酶2*2/2)等几种等位基因。其中,乙醛脱氢酶2*1/2活性为正常的10%~45%,乙醛脱氢酶2*2/2活性为正常的1%~5%。东方亚洲人群中该基因突变率为40%以上。目前关于乙醛脱氢酶2与癌症关系方面的研究很少,基本都集中在统计学方面,有多项统计数据显示,携带ALDH2突变基因型者大量饮酒将显著增加患多种癌的危险性,包括肝癌,食道癌等。
乙醛脱氢酶2基因多态性的主要检测方法:限制性片段长度多态性(Restriction Fragment Length Polymorphism)、单链构象多态性、PCR-ASO探针法、PCR-SSO法、PCR-SSP法、PCR-荧光法、PCR指纹图法、基因芯片法、AFLP(Amplication Fragment Length Polymorphism)法:DGGE(denaturing gradinent electrophoresis)法、RAPD(Random amplified polymorphic DNA)法,包括但不限于如CN105177159A、CN102758008A、CN103184268A、CN104120180A所示方法和检测试剂盒。
蒽环类药物是一种抗瘤谱广且高效的抗肿瘤药,对乳腺癌、恶性淋巴瘤、肺癌、卵巢癌、软组织肿瘤、肝癌均具有很强的抗癌活性。蒽环类药物包括阿霉素、表阿霉素、吡柔比星、去甲氧柔红霉素和米托蒽醌等,属周期非特异性药,其主要毒副反应为骨髓抑制和心脏毒性。
蒽环类药物敏感型胃癌是蒽环类药物有治疗效果的胃癌,优选为ALDH2基因缺失或突变的胃癌,如乙醛脱氢酶2*1/2基因型胃癌、乙醛脱氢酶2*2/2基因型胃癌。
乙醛脱氢酶2抑制剂是指能特异性抑制乙醛脱氢酶2活性或下调乙醛脱氢酶2表达的物质,包括但不限于如daidzin。
药物或药物组合物
用于本发明或者含有本发明所述蒽环类药物的药物组合物。通常,当本发明药物组合物用于上述用途时,所述蒽环类药物可与一种或多种药学上可接受的载体或赋形剂混合制成不同给药途径的药物剂型,如片剂、胶囊、散剂、颗粒剂、糖浆剂、溶液剂、口服液、醑剂、酊剂、气雾剂、粉雾剂、注射剂、注射用无菌粉末、栓剂等。
“药学上可接受的”成分是适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应)即有合理的效益/风险比的物质。“药学上可接受的载体”是用于将本发明的融合体蛋白传送给动物或人的药学上或食品上可接受的溶剂、悬浮剂或赋形剂。载体可以是液体或固体。
本发明的蒽环类药物可经过口服、静脉内、肌内或皮下途径给药。
上述剂型中可经口服给药的剂型为:片剂、胶囊、散剂、颗粒剂、糖浆剂、溶液剂、醑剂。固态载体包括:淀粉、乳糖、磷酸氢钙、微晶纤维素、蔗糖、白陶土、微粉硅胶、滑石粉、低取代羟丙基纤维素、羧甲基淀粉钠、聚乙烯吡咯烷酮。而液态载体包括:无菌水、乙醇、聚乙二醇、非离子型表面活性剂和食用油(如玉米油、花生油和芝麻油)。在制备药物组合物的过程中通常使用的佐剂包括:调味剂、着色剂、防腐剂(如羟苯烷基丁酯、苯甲酸钠、山梨酸)和抗氧化剂(如维生素E、维生素C、焦亚硫酸钠和二丁基羟基甲苯)。
上述剂型中可用于注射途径给药的剂型包括:注射剂、注射用无菌粉末,它们是将药物与一种或多种药学上可接受的赋形剂混合制成以供注射给药的形式。溶剂包括:无菌水、乙醇、甘油、丙二醇、聚乙二醇。此外,还需加入抑菌剂(如苯甲醇、羟苯丁酯、硫柳汞)、等渗调节剂(如氯化钠、葡萄糖)、助悬剂(如羧甲基纤维素钠、甲基纤维素)、增溶剂(吐温-80、卵磷酯)、抗氧化剂(如维生素E、维生素C、焦亚硫酸钠)和填充剂(如乳糖、甘露醇)。
从易于制备和给药的立场看,优选的药物组合物是液态组合物。
本发明的药物组合物可根据熟知的及公认的制药生产要求的方法制备。药物组合物适宜包含本发明的蒽环类药物以及药学上可接受的载体,并适宜为单位剂量形式。
用途
公开了所述蒽环类药物或蒽环类药物和乙醛脱氢酶2抑制剂可用于治疗胃癌,优选为治疗乙醛脱氢酶2基因突变或缺失类型胃癌。
所用的活性成分的有效剂量可随给药模式和待治疗疾病的严重程度而变化。对大部分大型哺乳动物而言,每天施以有效成分的总剂量约为0.01-1000mg。通常,成人临床给药量的范围为0.01-200mg/日,优选为0.05-100mg/日。
通常,当本发明组合物用于上述用途时,它们可与一种或多种药学上可接受的载体或赋形剂混合制成不同给药途径的药物剂型,如片剂、胶囊、散剂、颗粒剂、糖浆剂、溶液剂、口服液、醑剂、酊剂、气雾剂、粉雾剂、注射剂、注射用无菌粉末、栓剂等。
“药学上可接受的”成分是适用于人和/或动物而无过度不良副反应(如毒性、刺激和变态反应)即有合理的效益/风险比的物质。“药学上可接受的载体”是用于将本发明的或蒽环类药物和乙醛脱氢酶2抑制剂传送给动物或人的药学上或食品上可接受的溶剂、悬浮剂或赋形剂。载体可以是液体或固体。
本发明的化合物可经过口服、静脉内、肌内或皮下途径给药。
本文提及的所有公开物中的公开内容,包括专利和专利申请说明书,通过引用并入本发明,达到明文记载所有这些公开物的程度。
以下通过下面的实施例更详细地描述本发明,但是,这些实施例并不限制本发明的范围。
材料与方法
1实验试剂
RPMI 1640培养液、DMEM培养液(Thermo Fisher公司,美国);小牛血清(Gibco,美国);Taq DNA Polymerase High Fidelity(Invitrogen,美国);5×Lane Marker Reducing Sample Buffer(Pierce,美国);RIPA Buffer(Beyotime,中国);胰酶消化液(Beyotime,中国);BamH I限制性核酸内切酶(Takara,日本);EcoR I限制性核酸内切酶(Takara,日本);琼脂糖(Sigma,美国);QIAGENPlasmid Mini Kit(QIAGEN,德国);EndoFree Plasmid Maxi Kit(QIAGEN,德国);Dako REALTMEnVisionTMDetection System,Peroxidase/DAB+,Rabbit/Mous(Dako,德国);T4DNA连接酶(TaKaRa,日本);DH-5α感受态细菌(上海博彩生物科技有限公司,中国);ACS级无水乙醇(阿拉丁试剂有限公司,中国);甲醇(上海振兴化工一厂,中国);异丙醇(上海振兴化工一厂,中国);牛血清白蛋白(鼎国公司,中国);嘌呤霉素(Sigma,美国);DOX(Sigma,美国);5-Fu(Sigma,美国);顺铂(Sigma,美国);4-HNE(Cayman,美国);PBS粉剂(上海博光生物科技有限公司,中国);结晶紫染色液(Beyotime,中国);DAPI染色液(Vector公司,日本);离心柱型大量DNA凝胶回收试剂盒(TIANGEN,中国);In Situ Cell Death Detection Kit(Roche,瑞士);CCK-8细胞活性检测试剂盒(Dojindo,日本);PageRulerTMPrestained Protein Ladder(Fermentas,美国);Alexa Fluor-555Donkey anti-mouse Ab荧光二抗(Invitrogen,美国);鼠抗人ALDH2单克隆抗体(ABGENT,美国);鼠抗人p53单克隆抗体(Santa Cruz Biotechnology,美国);鼠抗人PARP单克隆抗体(Santa Cruz Biotechnology,美国);
以下通过实施例对本发明的具体实施方式做进一步说明。
实施例1:ALDH2敲低表达的胃癌细胞株的建立
人胃癌细胞SGC-7901购自中科院上海细胞生物学研究所细胞库,胚胎肾细胞293T为本所自存。细胞培养条件:SGC-7901用含10%小牛血清的RPMI-l640细胞培养液,在37℃和5%CO2条件下培养,以处于对数生长期的细胞用于实验。
ALDH2敲低表达逆转录病毒载体构建,逆转录病毒包装方法步骤同前所述,利用逆转录病毒感染SGC-7901细胞48h,利用终浓度1μg/ml嘌呤霉素进行筛选得到稳定敲低表达细胞株,分别利用qRT-PCR、Western Blot和免疫荧光的方法对敲低效果进行验证。结果表明,小干扰RNA可以明显敲低ALDH2在SGC-7901细胞中的表达,qRT-PCR结果显示,ALDH2-shRNA1和ALDH2-shRNA2组的ALDH2mRNA表达明显低于对照组(2.47±1.36vs75.00±6.10,P<0.001;5.95±2.71vs 75.00±6.10,P<0.001))(图1)。
图1.A.Western Blot方法检测ALDH2-shRNA1、ALDH2-shRNA2细胞ALDH2表达低于对照组;B.qRT-PCR方法检测ALDH2-shRNA1、ALDH2-shRNA2细胞ALDH2表达低于对照组(***P<0.001);C.免疫荧光方法检测ALDH2-shRNA1、ALDH2-shRNA2小干扰RNA均可以明显敲低细胞内的ALDH2表达。
实施例2:ALDH2敲低表达的胃癌细胞对药物敏感性实验
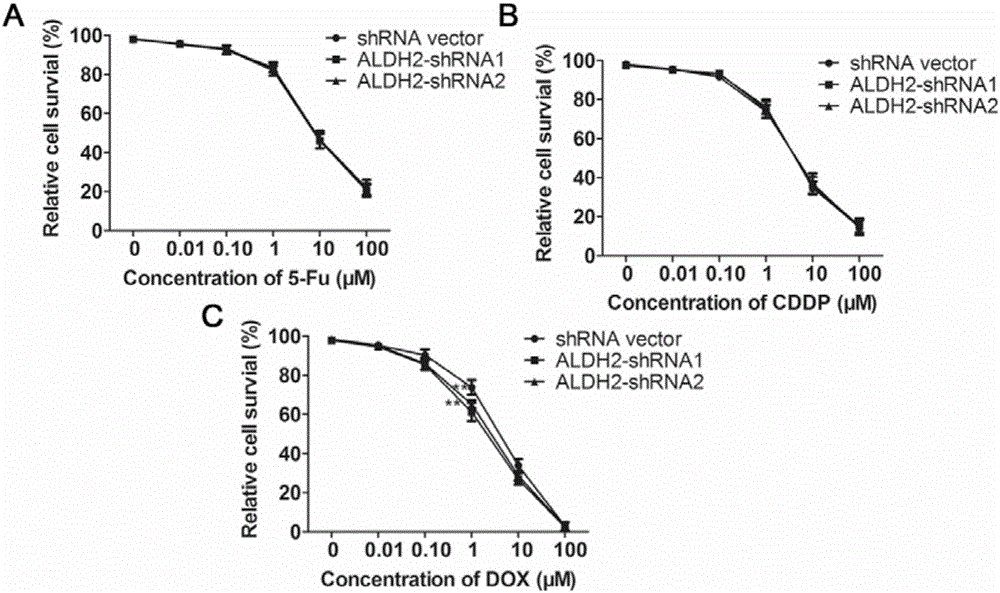
比较了胃癌细胞敲低ALDH2基因对化疗药物5-Fu、顺铂和DOX的敏感性差异。我们利用梯度浓度(0μM,0.01μM,0.1μM,1μM,10μM和100μM浓度)的几种化疗药物分别处理来自实施例1的ALDH2敲低表达胃癌细胞SGC-7901(ALDH2shRNA1和shRNA2细胞)与对照组胃癌细胞SGC-7901(shRNA空载体),比较各组细胞的相对存活率。
研究显示,利用DOX处理胃癌细胞24h,ALDH2shRNA1和shRNA2细胞相对存活率降低明显低于shRNA空载体组(P=0.0014,P=0.0082),提示ALDH2敲低的细胞对DOX处理的敏感性升高。用顺铂处理胃癌细胞24h,ALDH2-shRNA1和ALDH2-shRNA2细胞与shRNA空载体组相比,细胞对药物处理的敏感性无明显差异(P=0.9593,P=0.8200)。用5-Fu处理胃癌细胞24h,ALDH2-shRNA1和ALDH2-shRNA2细胞与shRNA空载体组相比,细胞对药物处理的敏感性无明显差异(P=0.9940,P=0.9907)(图2)。遂后,我们检测了DOX处理ALDH2-shRNA1和ALDH2-shRNA2以及shRNA空载体组的IC50,ALDH2-shRNA1和ALDH2-shRNA2实验组细胞的DOX药物处理的IC50明显低于shRNA空载体组(2.17±0.40vs.3.97±0.45,P<0.01;2.70±0.36vs.3.97±0.45,P<0.05),表明ALDH2基因表达缺失的胃癌细胞对于DOX药物的敏感性增加。
图2.A.5-Fu处理后各组细胞对药物敏感性无明显差异;B.顺铂处理后各组细胞对药物敏感性无明显差异;C.DOX处理后可见敲低ALDH2组对DOX药物敏感性明显高于空载体组(**P<0.01)。
此外,对于敲低ALDH2表达的SGC-7901细胞,我们进行了DOX处理后的胃癌细胞克隆形成能力检测。如图3所示,DOX终浓度为1μM处理胃癌细胞48小时,连续培养14天后拍照观察,ALDH2-shRNA1和ALDH2-shRNA2胃癌细胞的克隆形成能力均明显低于shRNA空载体组(4.47±1.29%vs.16.23±1.53%,P<0.01;7.87±0.75%vs.16.23±1.53%,P<0.01)。当DOX终浓度为2μM时处理胃癌细胞48小时,连续培养14天后拍照观察,ALDH2-shRNA1和ALDH2-shRNA2胃癌细胞的克隆形成能力明显低于shRNA空载体组(1.10±0.26%vs.5.37±1.00%,P<0.01;3.60±0.46%vs.5.37±1.00%,P<0.05)。
图3.A.1μM、2μM的DOX处理ALDH2-shRNA1和ALDH2-shRNA2以及shRNA空载体组48h,连续培养14天,观察克隆形成情况;B.克隆形成的统计结果(*P<0.05;**P<0.01)。
同时,我们利用终浓度为2μM的DOX处理ALDH2-shRNA1、ALDH2-shRNA2和shRNA空载体组24h,对照组细胞利用相同体积的DMSO溶剂处理24h,收集细胞进行流式细胞仪检测。DMSO处理胃癌细胞24h,ALDH2-shRNA1、ALDH2-shRNA2和shRNA空载体组之间凋亡无明显差异(5.22±0.69%,5.44±0.94%vs.5.19±0.67%);利用DOX处理胃癌细胞24h,ALDH2-shRNA1和ALDH2-shRNA2细胞凋亡率明显高于shRNA空载体组(18.01±1.52%vs.8.31±1.09%,P<0.01;14.79±1.32%vs.8.31±1.09%,P<0.01)(图4)。
图4.A.2μM的DOX处理ALDH2-shRNA1、ALDH2-shRNA2和shRNA空载体细胞24h,流式细胞仪检测结果代表性图片;B.流式检测统计结果(**P<0.01)
实施例3:敲低ALDH2基因胃癌细胞接种于裸鼠体内的移植瘤药物敏感性研究
为了评估ALDH2基因缺失胃癌细胞在活体内的药物敏感性差异,我们利用免疫缺陷裸鼠进行了移植瘤接种以及试验性治疗研究。我们总共采用14只4周龄BALB/C裸鼠,于裸鼠左右大腿皮下分别接种3×106ALDH2-shRNA1和shRNA空载体SGC-7901细胞,待移植瘤生长到150mm3,对实验组与对照组各7只分别给与2mg/Kg体重的DOX以及DMSO腹腔注射,每周注射2次,每次注射药物之前测量肿瘤大小,连续3周处理,末次注射药物后3天测量肿瘤大小并且处死小鼠,研究发现,ALDH2-shRNA1处理组给予DOX用药后皮下移植瘤肿瘤重量小于对照组(0.82g±0.56vs.1.38g±0.35,P<0.05),ALDH2-shRNA1组移植瘤的增殖速度明显低于对照组(P<0.05);而在DMSO溶解剂处理组,ALDH2-shRNA1组移植瘤重量也明显高与对照组(2.72g±0.63vs.1.74g±0.17,P<0.01),且移植瘤的增殖速度明显高于对照组(P<0.001)。同时,我们也对10只4周龄BALB/C裸鼠,分别于左右大腿皮下接种3×106ALDH2-shRNA1和shRNA空载体SGC-7901细胞,待移植瘤生长到150mm3。对实验组与对照组各5只分别给予40mg/Kg体重5-Fu以及PBS溶解剂腹腔注射后的肿瘤生长状况。每周注射2次,每次注射药物之前测量肿瘤大小,连续3周处理,末次注射药物后3天测量肿瘤大小并且处死小鼠。
结果发现,PBS处理组,ALDH2-shRNA1组移植瘤重量明显高于对照组(3.43g±0.53vs.1.88g±0.64,P<0.01)。而5-Fu处理组,ALDH2-shRNA1组移植瘤重量明显低于对照组(2.08g±0.53vs.0.65g±0.40,P<0.01)(图5)。以上发现表明,DMSO与PBS溶解剂处理组,在ALDH2-shRNA1组的生长速度均明显高于对照组,提示了ALDH2基因在胃癌生长中的抑癌基因作用。而在未进行ALDH2基因干预的shRNA空载体组,利用DOX和5-Fu药物处理后,5-Fu处理组的肿瘤重量明显低于DOX处理组(0.65g±0.40vs.1.38g±0.35,P<0.01),该结果提示:当ALDH2基因为野生型时,胃癌细胞对于5-Fu药物的敏感性优于DOX药物。而在对ALDH2基因的干预组(ALDH2-shRNA1SGC-7901细胞)分别给与DOX和5-Fu药物治疗后,DOX用药组的肿瘤重量明显低于5-Fu处理组(0.82g±0.56vs.2.08g±0.53,P<0.01)。上述结果提示:ALDH2基因功能缺失胃癌细胞对于DOX药物的敏感性优于化疗效果优于5-Fu(图5)。
图5.中A,B.2mg/kg DOX腹腔注射裸鼠,ALDH2-shRNA1组SGC-7901细胞皮下瘤重量低于shRNA空载体组;C.2mg/kg DOX腹腔注射裸鼠,ALDH2-shRNA1组SGC-7901细胞组皮下瘤增殖速度低于shRNA空载体组;D,E.40mg/kg 5-Fu腹腔注射裸鼠,ALDH2-shRNA1组SGC-7901细胞皮下瘤重量高于shRNA空载体组。由图A与图D的裸鼠瘤体积变化可知,当ALDH2基因处于野生型时,5-Fu处理的效果明显优于DOX处理效果。但当ALDH2基因缺陷后,则DOX抑制肿瘤效果优于5-Fu。
化疗是针对中晚期胃癌采取的主要治疗手段之一,5-Fu、顺铂和DOX均属于传统的肿瘤化疗药物,且5-Fu和顺铂被推荐为晚期胃癌患者的一线化疗药物。
我们首次发现,敲低ALDH2基因的胃癌细胞在DOX药物处理后细胞凋亡明显增加,这种生物学效应是通过DNA损伤增加进而诱导的。而平行开展的5-Fu与顺铂药物处理的ALDH2敲低胃癌细胞,与对照组相比并未发现细胞凋亡与DNA损伤发生显著性变化。
本研究的另外一个重要发现是,当我们分别采用DOX和5-Fu对裸鼠移植瘤给予治疗处理后显示,当ALDH2处于野生型时,裸鼠皮下移植瘤对于5-Fu药物的反应良好,裸鼠皮下移植瘤的体积与重量均较DOX处理组有明显下降;但当ALDH2基因受到干扰功能缺失后,则5-Fu药物对于肿瘤细胞的抑制作用远不及ALDH1野生型组。而ALDH2基因缺失组胃癌细胞对于DOX药物处理的敏感性增加。
通过本研究我们提出,当个体存在ALDH2基因功能缺陷时(比如“东方人变异”、基因突变或者表观遗传学失活),细胞对内源性与外源性DNA损伤的抵抗能力均明显下降,比如,对于环境诱变剂MNU以及细菌性致癌剂幽门螺杆菌导致的DNA损伤抵抗能力显著下降。其结果是携带ALDH2基因缺陷型个体的胃癌患病风险明显高于野生型个体。我们进一步分析又发现,ALDH2基因型缺陷个体在选择化疗药物时应当注意,携带ALDH2基因变异的个体对于传统的一线化疗药物并不敏感,但对蒽环类药物DOX的敏感性增加,故该发现结合东亚人群具有较高的ALDH2基因变异这一现象,对于指导今后胃癌患者个体化精准治疗具有一定参考价值。
- 还没有人留言评论。精彩留言会获得点赞!