一种苯并咪唑并苯并异喹啉酮类汞离子探针的制备及应用的制作方法
本发明涉及环境分析、生物分析检测技术领域,具体涉及一种反应型汞离子荧光分子探针的制备方法和该荧光分子探针在检测汞离子方面的应用。
背景技术:
汞具有很强的生物毒性,对人的内分泌系统、免疫系统、神经系统等都有不良影响。人体吸收汞的途经有三种,分别是消化道、呼吸道和皮肤。汞在生物体内有累积效应,不能通过代谢过程排出体外,进入人体后直接沉入肝脏,对大脑、神经、视力破坏极大。长期接触并摄入汞会出现很明显的病症,如严重的恶心、呕吐、腹痛以及肾功能损伤等,通过水俣病患者的肢体表现、精神状态就能看出汞对人体的危害程度。根据《中华人民共和国环境保护法》规定,生活饮用水和农田灌溉水汞含量不得超过0.001mg/L。汞在水体中产生毒性的范围大约是0.01-0.001mg/L,而汞在水体中通过积累后的毒性远大于此,生活在受汞污染水域的鱼体内甲基汞的含量可比水中的高上万倍,经食物链积累后受到最大危害的还是我们人类。汞对农作物有害而无利,但农作物却能轻易的吸收,土壤中汞的含量影响农作物的生长发育,直接关系到农作物的产量与质量。土壤中的微生物非但不能将汞降解,有的甚至可以通过生物甲基化作用转化为更具毒害性的化合物,这些东西经食物链富集后最终还是进入人的体内。可见,汞对土壤的污染与危害也是不可小觑。因此重金属汞的分析与检测也便成为了当今化学分析领域的一个重要课题。目前检测汞离子离子的方法有很多种,其中荧光分析法具有快速响应与高灵敏度的特点,因此利用荧光探针来定性与定量检测汞离子己成为研究的热点(CN201410555700.7,CN201410369075.7,CN201010166304.7,CN201410768327.3,CN201110122460.8,CN201410207062.X,CN201110421734.3,CN201210047116.1,CN201310273704.1,CN201210526466.6,CN201410400848.3等)。探针类型主要分为络合汞离子荧光探针和反应型汞离子荧光探针。其中由于汞离子具有非常强的嗜硫性,以嗜硫性为基础的反应型荧光探针具有高度专一性和环境适应性,可以更好的应用于汞离子的检测。
技术实现要素:
本发明的目的之一是提供一种苯并咪唑并苯并异喹啉酮类汞离子反应荧光探针及其制备方法,是以1,8-萘酐、3,4-二氨基苯甲酸、正丁胺和劳森试剂为原料,合成对汞离子具有高选择性、特异性识别的新型汞离子荧光探针。
本发明的目的通过如下技术方案实现。
一种汞离子荧光探针及其制备方法,其特征在于:
(1)一种反应型汞离子荧光探针,其特征是具有以下化学分子结构式:
图1化合物分子结构
(2)汞离子荧光探针其制备方法如下:
a. 苯并咪唑并苯并异喹啉酮-11-羧酸的制备:将1,8-萘二甲酸酐和3,4-二氨基苯溶于醋酸溶液中,加热回流12h;反应结束后,冷却到室温,抽滤并用醋酸进行洗涤,干燥得粗产品;粗产品溶解于5%的氢氧化钠溶液,过滤不溶物,使用浓盐酸调节pH值在2~3之间,析出黄绿色固体,抽滤,沸水洗涤,干燥得产品。
b. 苯并咪唑并苯并异喹啉酮-11-酰氯的制备:将苯并咪唑并苯并异喹啉酮-11-羧酸悬浮于二氯甲烷中,体系中加入草酰氯,室温搅拌5h,产生大量黄色悬浮物,将固体抽滤,二氯甲烷洗涤数次,干燥得黄色产品。
c. N-丁基-苯并咪唑并苯并异喹啉酮-11-羧酰胺的制备:将苯并咪唑并苯并异喹啉酮-11-酰氯悬浮于二氯甲烷中,体系中依次加入正丁胺,缚酸剂三乙胺,室温搅拌过夜;反应结束后,反应液5% NaOH洗涤,无水NaSO4干燥,无水乙醇重结晶得黄色产品。
d. 汞离子荧光探针的制备:将N-丁基-苯并咪唑并苯并异喹啉酮-11-羧酰胺和劳森试剂溶于甲苯溶剂中,氮气保护下回流12 h,反应结束后冷却至室温,浓缩溶剂,柱层析分离得到汞离子荧光探针。
本发明的另一个目的是提供一种选择性好、灵敏度高、水溶性好和荧光增强的检测汞离子的荧光探针:在缓冲溶液CH3CN-HEPES (0.02 M,pH=7.4) (7/3,v/v) 中,荧光探针的浓度为1μM,激发波长为367nm,进行汞离子检测测定。
本发明的优点及效果是:
(1)本发明获得高选择性汞离子荧光分子探针,以化学性质稳定的苯并咪唑并苯并异喹啉酮为荧光分子母体,硫代羧酰胺为汞离子识别基团。
(2)本发明所述的探针分子原料易得,制备过程简单,条件易于控制合成产率较高,光学性能稳定。
(3)本发明获得高选择性汞离子荧光分子探针,通过硫原子可以与汞离子的发生特异性反应,使荧光探针分子中的C=S双键转变为C=O双键,产生强荧光(荧光增强39.6倍)。该探针分子具有灵敏度较高,水溶性较好,对汞离子识别能力强,响应速度较快。因此该类型探针在生物化学、环境科学等领域具有实际的应用价值。
附图说明
图1化合物分子结构
图2 中间体1的合成路线
图3 中间体2的合成路线
图4 中间体3的合成路线
图5 化合物A的合成路线
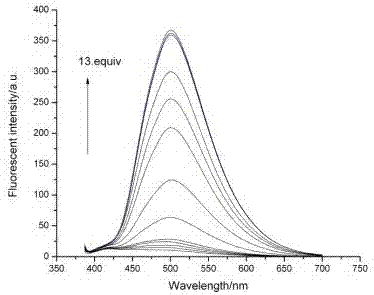
图6图7中,本发明的荧光探针的测试均在缓冲溶液CH3CN-HEPES (0.02 M, pH=7.4) (7/3, v/v) 中体系中进行。
图6为本发明的荧光探针(1uM)在加入不同浓度汞离子后荧光发射光谱变化随浓度的关系,横坐标为波长,纵坐标为荧光强度。
图7为本发明的荧光探针(1uM)分别加入10当量的不同金属离子Ni2+、Ba2+、Ag+、Cd2+、Mg2+、Cu2+、Mn2+、Fe3+、Zn2+、Co2+、Al3+、Ca2+、Pb2+、K+、Hg2+后的荧光光谱,横坐标为波长,纵坐标荧光强度。
具体实施方式
实施例1:中间体1的合成
图2 中间体1的合成路线
称取0.99g 1,8-萘二甲酸酐和0.76g 3,4-二氨基苯甲酸悬浮于50mL醋酸中,氮气保护下回流10h。待反应完全后冷却至室温,生成的草绿色化合物经减压抽滤并用醋酸洗涤数次,置于空气中晾干并溶解于100 mL 5%的氢氧化钠溶液中。将溶液中不溶物滤掉,在滤出液中加入浓盐酸调节pH值在2~3之间,溶液中有固体生成,抽滤并用沸水洗涤数次得黄绿色体1.1g(中间体1),产率63%。核磁质谱表征如下:1H NMR (400 MHz, DMSO) δ 8.77 (s, 1H), 8.47 (dd, J = 15.1, 7.6 Hz, 4H), 8.35 (dd, J = 7.8, 5.0Hz, 4H), 8.22 (dd, J = 17.6, 8.8Hz, 4 H), 8.14 (s, 1H), 7.92 (d, J = 8.4 Hz, 2H), 7.85-7.65 (m, 5H).
中间体2的合成
图3 中间体2的合成路线
称取中间体1(1.0g,3.2mmol)悬浮于40 mL二氯甲烷中,加入8mL草酰氯并滴入3-4滴DMF作为催化剂,室温搅拌5h,产生大量黄色悬浮物,将固体抽滤并用二氯甲烷洗涤数次,得黄色粗品1.02g,未经纯化直接用于下一步。
中间体3的合成
图4 中间体3的合成路线
称取0.66 g(2mmol)中间体2悬浮于20mL二氯甲烷中,依次加入0.83mL(8mmol)三乙胺和0.3mL(3mmol)正丁胺,三乙胺作为缚酸剂,室温搅拌过夜。用5% NaOH洗涤三次,再用水洗涤一次,最后用NaSO4干燥,旋干得黄色固体,用无水乙醇重结晶,得纯净黄色固体0.71g(中间体3),产率97.2%。1H NMR (400 MHz, DMSO) δ 8.93 (s, H), 8.73 (d, J = 4 Hz, 2H), 8.53 (d, J = 8 Hz, 1H), 8.38-8.45 (m, 2H), 7.89-7.92 (m, 3H), 2.52 (t, J= 4 Hz, 2H), 1.54-1.61 (m, 2H), 1.34-1.43 (m, 2H), 0.95 (t, J = 6 Hz, 3H). 13C NMR (100 MHz, CDCl3) δ 167.35, 160.53, 150.95, 145.84, 135.57, 135.48, 132.76, 132.35, 132.17, 132.13, 132.00, 131.91, 131.81, 131.42, 127.60, 127.45, 127.35, 127.06, 126.95, 126.88, 125.59, 124.31, 122.72, 120.13, 119.89, 118.55, 115.67, 113.89, 40.03, 31.86, 20.16, 13.87 HRMS-ESI (m/z) [M+H]+计算值370.1556, 实测值370.1535.
化合物A的合成
图5 化合物A的合成路线
称取中间体3(0.36g, 1mmol),劳森试剂(0.44g,1.1mmol)和10mL甲苯置于50mL圆底烧瓶中,氮气保护下回流12h。反应结束后冷却至室温,浓缩,柱层析(V二氯甲烷:V丙酮=10:1)分离得0.23g目标产物,产率60%。1H NMR (400 MHz, DMSO) δ 9.42 (s, 1H), 8.72 (d, J = 8.0 Hz, 1H), 8.53 (s, 1H), 8.44-8.52 (m, 3H), 8.02-8.08 (m, 4H), 7.82-7.93 (m, 4H), 7.49-7.65 (m, 6H), 3.93-3.97 (m, 4H), 1.87-1.93 (m, 4H), 1.53-1.64 (m, 4H), 1.09 (q, J = 8.0 Hz, 6H),. 13C NMR (100 MHz, CDCl3) δ 198.38, 160.17, 150.53, 148.03, 145.97, 145.23, 138.79, 135.58, 135.43, 134.79, 133.27, 131.89, 131.63, 131.44, 128.71, 127.86, 127.30, 127.12, 127.04, 126.69, 126.50, 126.14, 123.21, 120.20, 119.33, 119.26, 115.20, 112.69, 46.82, 30.31, 20.46, 13.93.5, 115.67, 113.89, 40.03, 31.86, 20.16, 13.87. HRMS-ESI (m/z) [M+H]+计算值386.1327, 实测值386.1312.
实施例2
在缓冲溶液CH3CN-HEPES (0.02 M,pH=7.4) (7/3,v/v) 中,荧光探针的浓度为1μM,激发波长为367nm。
在缓冲溶液中,以367nm光激发,荧光探针分子在400-700nm处无荧光发射峰当向溶液中滴加Hg2+(0-13equiv),体系在400-700nm处产生了强的荧光发射峰,且随Hg2+浓度的增加,荧光强度一直在增强,直到Hg2+浓度是探针浓度的12equiv时,荧光强度不再增强(如图6),很显然,这样的荧光增强是由于Hg2+与探针中的S原子反应,生成HgS,探针的C=S双键变为C=O双键。
实施例3
配置1μM荧光探针溶液,然后向溶液中分别加入10equiv的不同金属离子Ni2+、Ba2+、Ag+、Cd2+、Mg2+、Cu2+、Mn2+、Fe3+、Zn2+、Co2+、Al3+、Ca2+、Pb2+、K+,测定在各金属离子存在下,荧光探针分子的荧光发射光谱;
参照汞离子对探针分子的荧光光谱滴定实验,本发明通过竞争金属离子实验来判定探针对汞离子的选择性,在溶液中分别加入10equiv的不同金属离子Ni2+、Ba2+、Ag+、Cd2+、Mg2+、Cu2+、Mn2+、Fe3+、Zn2+、Co2+、Al3+、Ca2+、Pb2+、K+后,荧光光谱没有明显变化,在同样条件下,加入Hg2+(10equiv)后,荧光发射强度明显增强,通过对荧光发射强度的监测表明:本发明十分适合作为汞离子荧光探针(图7)。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种制备5-乙酰乙酰氨基苯并咪唑酮过程中物料分离粉碎装置的制造方法
- 制备5,6-二氨基苯并咪唑酮的即热式蒸汽热水发生器的制造方法
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗骨质疏松药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗缺氧药物的制作方法
- 二氮芴基芳香型二酸单体及其聚苯并咪唑聚合物的合成的制作方法
- 一种咪唑酮类化合物的合成方法
- 一种多苯并咪唑类配合物及其制备方法和用图
- 苯并咪唑酸性盐类化合物及其在催化合成混合二元酸二甲酯中的应用
- 一种具有阻燃功能的复合纱线的制作方法
- 一种具有阻燃功能的面料的制作方法
- 制动蹄自动铆压设备的密封橡胶圈的制作方法
- 一种混合脂肪基双(苯并咪唑啉季铵盐)及其制备方法与应用
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗骨质疏松药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗缺氧药物的制作方法
- 二氮芴基芳香型二酸单体及其聚苯并咪唑聚合物的合成的制作方法
- 一种苯并三唑基?亚烷基双酚化合物的制备方法
- 1?(5,6?二氯?1h?苯并[d]咪唑?2?基)?1h?吡唑?4?羧酸的葡甲胺盐制剂的制作方法
- 一种多苯并咪唑类配合物及其制备方法和用图
- 一种对氨基苯磺酰咪唑及其制备方法
- 苯并咪唑酸性盐类化合物及其在催化合成混合二元酸二甲酯中的应用
- Salviskinone A的苯并咪唑基和二(2-甲硫基乙基)胺基衍生物的组合物在抗缺氧药物中 ...的制作方法
- Salviskinone A的苯并咪唑基和二(2-甲硫基乙基)胺基衍生物的组合物在预防或治疗胰 ...的制作方法
- Salviskinone A的苯并咪唑基和二(2-甲硫基乙基)胺基衍生物的组合物在抗菌药物中的应用
- 一种含咔唑、苯并咪唑取代的喹啉衍生物及其制备方法和应用
- 一种3,7-二叔丁基-s-(三氟甲基)二苯并噻吩三氟甲磺酸盐的工业生产方法
- 一种晶型的苯并咪唑基喹啉亚铜配合物发光材料的制作方法
- 一种苯并咪唑衍生物镉配合物及其制备方法和应用
- 一种咪唑并吡啶巯乙酸类衍生物及其制备方法与应用
- 一种苯并咪唑类化合物的合成方法
- Artalbic acid的O?(苯并咪唑基)乙基与O?(二羟乙胺基)乙基衍生物的组合物在抗病毒 ...的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗骨质疏松药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备防治胰腺纤维化药物的制作方法
- 阿掏比克酸苯并咪唑基与二羟乙胺基衍生物的组合物用于制备抗缺氧药物的制作方法
- 一种含苯并烯氟菌唑和氟嘧菌酯的杀菌组合物的制作方法
- 一种苯并二氮杂卓类化合物作为杀菌剂的用图
- 一种氟唑菌苯胺和丁香菌酯的杀菌组合物的制作方法