一种降低水稻籽粒落粒性的分子改良方法与流程
本发明属于水稻生物技术育种领域,具体涉及一种利用CRISPR/Cas9系统靶向修饰qSH1降低水稻籽粒落粒性的分子遗传改良方法。
背景技术:
水稻(Oryza sativa L.)是世界上重要的粮食作物,世界上超过一半的人口以稻米为主要粮食。在我国,水稻也是最重要的粮食作物,作为第一大口粮作物,我国约65%的人口以稻米为主食。但是随着人口的增加和耕地面积的减少,粮食的供需不平衡的问题日益严重。因此,水稻产量与经济发展、社会稳定、国家安全息息相关,其在保障我国粮食安全起着举足轻重的作用。
水稻籽粒的落粒性是与水稻收获产量密切相关的重要农艺性状之一。对于野生稻而言,极易落粒有利于其正常的繁衍后代。但对于人类当今实际生产应用的普通栽培稻品种(组合),落粒性过强会因在收获时谷粒大量掉落在田间而造成收获产量的较大损失,因而不受欢迎。尽管经过人工驯化与改良后,大多数栽培稻品种的落粒性都较适中,但仍然有部分品种,特别是某些籼型杂交稻骨干亲本及其组合(如R1128、广两优1128等)因易掉粒而导致收获产量减少。因此,从遗传上改良这些品种的落粒性对提高水稻收获产量、保证水稻高产和稳产都具有十分重要的现实意义。
随着研究的深入,水稻易落粒特性的形成的生理、分子机制正在逐步明晰:水稻花支梗与护颖之间的离层(abscission layer)结构与水稻落粒性的产生直接相关。水稻的离层结构首先在其脱离器官的边缘形成,在抽穗前16至20d即配子体细胞在幼穗中开始分化的时期,枝梗组织中的离层结构开始形成。而当水稻籽粒成熟时,离层细胞的细胞壁会发生断裂并开始降解,使得成熟的谷粒很容易就从母体植株的枝梗上掉落下来(S Oba S,et a l.,1990,Japen.J.Breed;Watanabe N,et al.,2000,Euphytica;Zee S Y,et al.,1979,IRRN)。而qSH1是现已克隆的控制水稻落粒性的主效基因,其编码了一个BEL1型同源异型蛋白。功能研究分析表明,在水稻花器官分化期的qSH1在水稻小穗基部的离层持续表达从而促进离层的发育,导致水稻籽粒易落粒(Konishi S,et al.,2006,Sicence)。
技术实现要素:
为克服现有遗传改良技术的不足,本发明的目的在于提供一种利用CRISPR/Cas9系统靶向修饰水稻落粒性基因qSH1降低水稻落粒性的分子遗传改良方法。对于落粒性过强的水稻品种,可通过CRISPR/Cas9系统靶向修饰落粒性基因qSH1进行定向改良,培育出落粒性显著降低且不带转基因成分的水稻新品种及新组合。本发明具有方向性强、遗传背景改变小等优势,并可规避转基因可能带来的风险。
为解决上述问题,本发明所提供的技术方案是:一种利用CRISPR/Cas9系统靶向修饰水稻落粒性基因qSH1降低水稻落粒性的分子遗传改良方法,其包括如下步骤:
1)根据CRISPR/Cas9系统靶点设计要求,在qSH1或LOC_Os01g62920或Os01g0848400编码区和起始密码子5’端附近区域选择合适的靶点;
2)构建含靶点序列的pYLgRNA-U3、pYLgRNA-U6a载体;
3)利用上述的pYLgRNA-U3、pYLgRNA-U6a载体构建含有靶点序列的pCRISPR/Cas9重组载体;
4)将所获得的pCRISPR/Cas9重组载体导入受体水稻中,获得转基因阳性植株;
5)利用上述转基因阳性植株获得靶向突变的突变植株;
6)利用上述突变植株加代种植后获得不含转基因成分的纯合突变植株;
7)利用上述纯合突变植株经落粒性调查获得落粒性显著降低的植株作为落粒性改良株
本发明方法中,其中,步骤1)中所述靶点双链片段中的一条链具有以下结构:5’-(N)X-NGG-3’,N表示A,T,C和G中的任意一个,较好的靶点序列X为19或20且以A或G开头,并且靶标序列NGG上游的12bp应在水稻基因组中有较好的特异性。
上述方案中,步骤2)具体步骤为:先分别合成带有粘性末端的寡链靶点引物,将两条互补配对的寡链靶点引物变性后移至室温冷却完成退火形成双链靶点片段,将退火后的双链靶点片段连接到经酶切后的pU3-gRNA或pU6a-gRNA载体上并利用PCR扩增含有靶点的gDNA表达盒。
上述方案中,步骤3)具体步骤为:将PCR扩增后的gDNA表达盒连接到含Cas9表达盒的pCRISPR/Cas9载体上。
上述方案中,步骤4)具体步骤为:将含靶点的pCRISPR/Cas9重组载体转化水稻愈伤组织,经筛选、分化、生根和炼苗后,种植于温室;通过潮霉素基因分子检测鉴定获得阳性转基因水稻植株。
上述方案中,步骤5)具体步骤为:选择上述阳性转基因水稻的DNA,用核苷酸序列如SEQ ID NO.7和SEQ ID NO.8所示的引物扩增上述DNA,扩增产物纯化后送公司测序。测序结果与野生型序列比对,分析转基因植株是否在预期靶点区域发生突变,并分析突变类型、突变靶点基因型,获得T0代突变水稻植株。
上述方案中,步骤6)具体步骤为:收获T0代突变植株的种子,继续种植T1代分离群体,通过潮霉素分子检测、靶点扩增测序分析获得靶标位点基因型纯合且不带转基因成分的植株。
上述方案中,步骤7)具体步骤为:选择上述植株黄熟期的主穗或大分蘖穗通过仪器法测定籽粒落粒程度,获得落粒性显著降低的植株。
与现有技术相比,本发明具有以下有益效果:
1.传统降低水稻品种落粒性的方法多为利用难落粒的材料与受体材料杂交,再通过多代回交、自交,选择综合农艺性状基本不变、落粒性降低且能稳定遗传的后代材料,该方法存在选育工作量大、材料稳定速度慢等不足。而本发明利用CRISPR/Cas9系统,靶向修饰qSH1获得落粒性得到显著降低的水稻新品种的方法,一般只需2-3代即可完成对水稻落粒性的定向改良,大大提高了改良工作效率,加快了育种的进程,节省了时间和成本。
2.传统改良方法无论回交、自交多少代都会或多或少的渗入与目的基因紧密连锁的其他基因,导致受体材料遗传背景的改变甚至带入某些不良性状。本发明利用CRISPR/Cas9系统,靶向修饰qSH1获得落粒性得到显著降低的水稻新品种的方法,则不会改变受体材料的遗传背景。
3.本发明利用CRISPR/Cas9系统,靶向修饰qSH1获得落粒性得到显著降低的水稻新品种的方法,实现了水稻落粒性状的定向改良,且可筛选获得不含有转基因成分的改良品种,此方法一方面规避了转基因可能带来的安全风险,另一方面与物理诱变、化学诱变等方法相比该方法的方向性强、突变效率更高,并且由于是靶向突变,更有基因组DNA损伤小的优势。
附图说明
图1为本发明实施例中测量籽粒落粒性的方法,测得的拉力值越小表示该植株的籽粒落粒性越强。
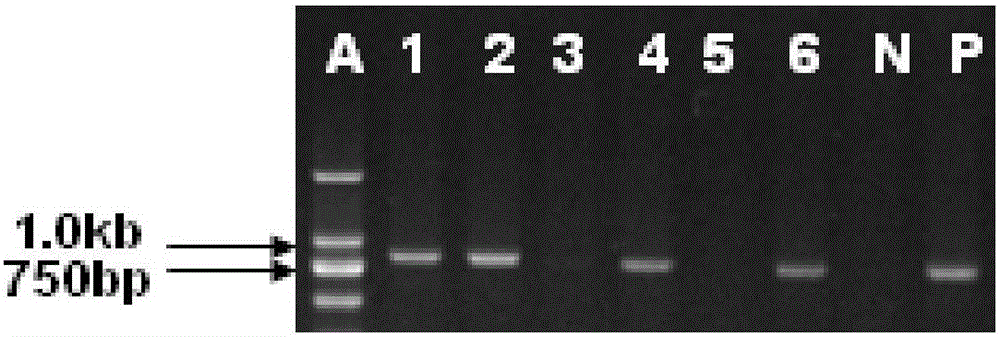
图2为本发明实施例中所获得的qSH1-339的T1代植株潮霉素分子检测结果,其中1-6分别为qSH1-339的T1代植株中的6株,N表示阴性对照,P表示阳性对照。
图3为本发明实施例中所获得的qSH1-339的T1代植株中第3号单株和R1128野生型对照于黄熟期主穗籽粒落粒性的测定结果,其中测得的拉力值越小表示该植株的籽粒落粒性越强。
图4为本发明实施例中所获得的qSH1-339-3加代繁殖后的改良株系和R1128野生型对照于黄熟期主穗的落粒情况。
具体实施方式:
下面通过具体实施方式的详细描述来进一步阐明本发明,但并不是对本发明的限制,仅仅作示例说明。
本发明利用CRISPR/Cas9系统靶向修饰水稻落粒性基因qSH1降低水稻(本实施例中为籼稻品种R1128)落粒性的分子遗传改良方法,其包括如下步骤:
1)根据日本晴qSH1参考序列,克隆籼稻R1128qSH1编码区双链片段并进行测序拼接;
2)根据上述测序拼接结果,在R1128qSH1编码区和起始密码子5’端上游区域设计两条靶点序列:
Target-qSH1-1(SEQ ID NO.1):GCGCCATGTCGTCCGCCGCT
Target-qSH1-5(SEQ ID NO.2):ACATGGCGCGCACGCACGTA
上述两条靶点序列均含有5’-(N)X-NGG-3’结构,加框部分为NGG结构,其中Target-qSH1-5为反向互补链。
3)构建含Target-qSH1-1、Target-qSH1-5双靶点的pYLgRNA-U3、pYLgRNA-U6a载体:首先分别合成带有粘性末端的寡链靶点引物Target-qSH1-1F(SEQ ID NO.3):GCCGCGCCATGTCGTCCGCCGCT,Target-qSH1-1R(SEQ ID NO.4):AAACAGCGGCGGACGACATGGCG,Target-qSH1-5F(SEQ ID NO.5):GGCACATGGCGCGCACGCACGTA,Target-qSH1-5R(SEQ ID NO.6):AAACTACGTGCGTGCGCGCCATG。将两对寡链靶点引物变性后冷却至室温完成退火,在将退火后的两个片段分别接连到pY LgRNA-U6a、pYLgRNA-U3载体上,并利用PCR分别扩增含有Target-qSH1-5、Target-q SH1-1靶点的gDNA表达盒。
4)构建含Target-qSH1-5、Target-qSH1-1靶点片段的pCRISPR/Cas9载体:利用上述经PCR扩增得到的含有Target-qSH1-5、Target-qSH1-1靶点的gDNA表达盒同时连接到含Cas9表达盒的pCRISPR/Cas9载体上。
5)转基因植株获得:
利用上述含双靶点的pCRISPR/Cas9载体通过农杆菌介导遗传转化至籼稻R1128愈伤组织中,经筛选、分化、生根和炼苗后,种植于温室。通过潮霉素基因分子检测鉴定获得阳性转基因水稻植株。
6)转基因突变植株及获得:
选择上述阳性转基因水稻植株DNA,用引物D-CqF9(SEQ ID NO.7):AGTTTCACGGCTTACCATTTCC和D-CqR7(SEQ ID NO.8):ACCATGAGGCGGTGGCGAGT扩增上述DNA样品,扩增产物经纯化后送公司测序,测序结果与未转化的野生型对照株序列比较,分析突变情况,具体参见SEQ ID NO.9-SEQID NO.15;
WT(SEQ ID NO.9)CCGTACGTGCGTGCGGG
Target-qSH1-T51-334(SEQ ID NO.10)CCGTACG--CGTGCGCGCCATGTCGTCCGCCGCTGGG
Target-qSH1-T51-336(SEQ ID NO.11)CCGTACTGTGCGTGCGCGCCATGTCGTCCGCCGCTGGG
Target-qSH1-T51-339(SEQ ID NO.12)CCG--------TGCGCGCCATGTCGTCCGCCAGCTGGG
Target-qSH1-T51-406(SEQ ID NO.13)CCGTACTAGTGCGTGCGCGCCATGTCGTCCGCCAGCTGGG
Target-qSH1-T51-408(SEQ ID NO.14)CCGTAC----GTGCGCGCCATGTCGTCCGC-GCTGGG
Target-qSH1-T51-422(SEQ ID NO.15)CCGTACTTGCGTGCGCGCCATGTCGTCCGCCGCTGGG
其中,WT为R1128野生型对照株系,WT中下划线靶点为Target-qSH1-5、加框靶点为Target-qSH1-1;Target-qSH1-T51-334,-336,-339,-406,-408,-422为不同的T0代转基因突变株系;相对于WT序列,序列中“-”代表碱基缺失,“”代表插入的碱基,有碱基的缺失和插入说明靶向修饰成功。
7)上述突变植株加代纯合,获得落粒性显著降低的改良植株:
收获T0代在预期靶点区域发生了定向突变的突变植株的种子,加代繁殖,于T1代分离群体,通过潮霉素分子检测(检测结果见图2)、靶点扩增测序分析获得靶点基因纯合且不带转基因成分的植株;选择上述植株黄熟期的主穗或大分蘖穗通过仪器法测定(请参见图1和图3)籽粒落粒程度,获得落粒性显著降低的植株,再经加代繁殖获得落粒性显著降低的改良株系,结果参见图4。
图2的结果表明,T1代植株中第3和5号植株是不含转基因成分的;图3的结果表明,第3号植株在黄熟期籽粒落粒性显著下降。
上述实施例仅为本发明的优选实施方式,不能以此来限定本发明保护的范围,本领域的技术人员在本发明的基础上所做的任何非实质性的变化及替换均属于本发明所要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!