一种水稻MSP1基因突变体及其分子鉴定方法和应用与流程
本发明属于植物分子生物学领域,具体涉及一种水稻MSP1基因突变体msp1-1972及其分子鉴定方法和应用。
背景技术:
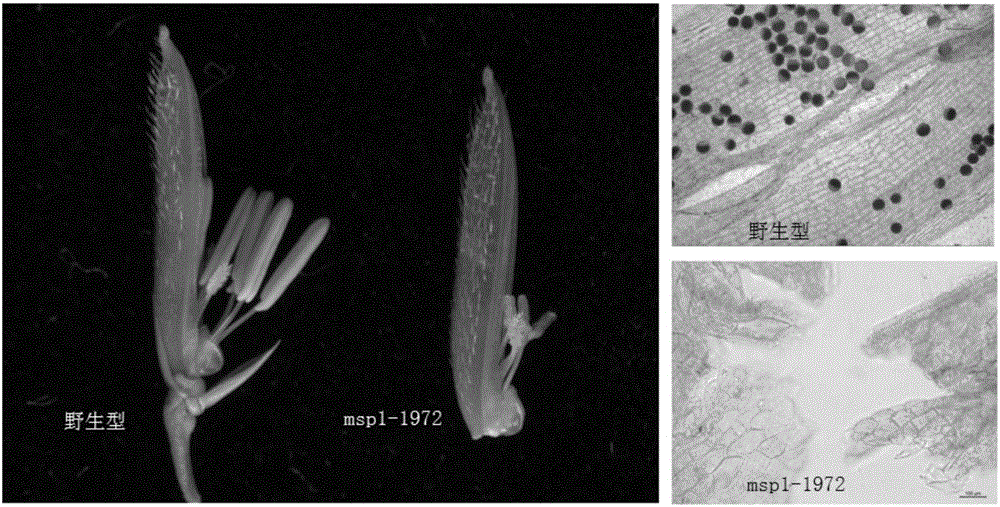
:植物雄性不育突变是自然界中十分普遍的现象,至少己在43个科、162个属的617个物种中发现了雄性不育突变体。在遗传上植物雄性不育分为细胞核雄性不育,细胞质雄性不育和细胞核细胞质互作雄性不育三大类:1)细胞核雄性不育由细胞核基因突变产生,有显性突变和隐性突变,有孢子体基因突变和配子体基因突变。显性突变和配子体基因突变只能通过雌配子遗传,隐性突变既可通过雌配子也可通过雄配子进行遗传,而且遵循孟德尔定律。目前已克隆了一些孢子体隐性核不育基因,如拟南芥的ms2,玉米的ms45和水稻的mil1等(Aarts等,1997,TheArabidopsisMALESTERILITY2proteinsharessimilaritywithreductasesinelongation/condensationcomplexes,PlantJournal,12:615-623;Albertsen,2006,Maletissue-preferredregulatorysequencesofMS45geneandmethodofusingsame,专利号:US7154024B2;Hong等,2012,Somaticandreproductivecelldevelopmentinriceantherisregulatedbyaputativeglutaredoxin,PlantCell,24:577-588);一些配子体隐性核不育基因也被克隆,如拟南芥的两个小孢子有丝分裂异常的突变体sidecarpollen和geminipollen(Oh等,2010,TheSIDECARPOLLENgeneencodesamicrospore-specificLOB/AS2domainproteinrequiredforthecorrecttimingandorientationofasymmetriccelldivision,PlantJournal,64:839-50;Park等,1998,TheArabidopsisthalianagametophyticmutationgeminipollen1disruptsmicrosporepolarity,divisionasymmetryandpollencellfate,Development,125:3789-99);玉米上还克隆了一个孢子体显性核不育基因MS44(CiganandAlbertsen,1998,Reversiblenucleargeneticsystemformalesterilityintransgenicplants,US5750868);2)细胞质雄性不育则是由细胞质基因控制,并没有相对应的核恢复基因,属母性遗传;3)细胞核细胞质互作雄性不育由细胞质基因和细胞核基因共同控制,其实质是细胞质与细胞核遗传物质不和的结果。不育细胞质是一些由突变线粒体基因引起,但有相对应的核恢复基因,能抑制不育细胞质基因。不育细胞质基因可产生一种新的蛋白质,够影响线粒体正常功能(ChenandLiu,2014,Malesterilityandfertilityrestorationincrops,AnnuRevPlantBiol,65:5.1-5.28)。在育恢复基因方面,目前水稻中已经克隆了Rf-1,Rf-2,Rf-4,Rf-5等基因(Komori等,2004,Map-basedcloningofafertilityrestorergene,Rf-1,inrice(OryzasativaL.),PlantJournal,37:315-325;Itabashi等,2011,Thefertilityrestorergene,Rf2,forLeadRice-typecytoplasmicmalesterilityofriceencodesamitochondrialglycine-richprotein,PlantJournal,65:359-367;Tang等,2014,ThericerestorerRf4forwild-abortivecytoplasmicmalesterilityencodesaPPRproteinthatfunctionsinreductionofWA352transcripts,MolecularPlant,7:1497-500;Hu等,2012,ThericepentatricopeptiderepeatproteinRF5restorersfertilityinHong-LianCytoplasmicmale-sterilelinesviaacomplexwiththeglycine-richproteinGRP162,PlantCell,24:109-22)。水稻是我国的民族产业,杂交水稻对提高我国粮食产量发挥了重要作用。目前,我国杂交水稻累计种植面积超过45亿亩,杂交水稻种植面积已经占到全国水稻种植面积的55%左右。杂种水稻是选用两个遗传背景不同,同时性状又能互补的水稻品种,通过杂交产生具有杂种优势的第一代杂交种用于生产。杂交水稻具有明显的杂种优势现象,主要表现在生长旺盛,根系发达,穗大粒多,抗逆性强等方面。杂交水稻比常规稻增产达30%。目前我国种植的杂交水稻可分为三系法杂交稻和两系法杂交稻。三系法杂交稻(三系杂交稻)就是生产这种杂交稻需要三个水稻品系来完成:水稻质核互作雄性不育系、水稻细胞质雄性不育保持系和水稻细胞质雄性不育恢复系。水稻质核互作雄性不育系(简称不育系,代号A)有野败型,红莲型等多种细胞质类型。水稻细胞质雄性不育保持系(简称保持系,代号B)是用来繁殖不育系一种水稻。其细胞核基因型与不育系相同,但含有可育细胞质基因,可产生可育花粉,能够自交结实。由于保持系的核基因不含恢复基因,因此它给不育系授粉产生的后代也是不育的。水稻细胞质雄性不育恢复系(简称恢复系,代号R)携带恢复基因,能够修复细胞质雄性不育性,与不育系杂交产生的杂种(即杂交稻)正常可育。三系育种法存在感病、品质差、育种效率低等问题。因受恢保关系的制约,95%的水稻资源不能用于杂交育种。两系法杂交稻利用光温敏核不育突变体,其在长日高温条件下表现雄性不育,可进行杂交制种,短日低温条件下表现雄性可育,可以自交繁殖。与三系法相比,两系法具有显著的优越性:不育系与恢复系配组自由,选配优良组合几率大;不育系可一系两用。但是两系法不育系易受光温环境影响,育种风险巨大。比如在制种期间遇上低温,不育系将转为可育,产生自交种子,影响杂交种子的纯度;有的两系杂交种遇上高温则不育,影响结实率,导致减产。因此,寻找新的雄性不育制种方法依然是作物育种上的重要研究课题。利用人工诱变比如物理辐射,化学处理,组织培养等方法,人们在水稻上获得了多种新的不育突变体。msp1-1突变体是其中之一,其花药不产生成熟花粉粒。该突变体由MSP1基因中插入Tos17引起;MSP1基因有1个外显子,编码一个1294个氨基酸的富亮氨酸膜受体样蛋白激酶;在减数分裂形成小孢子前后,在绒粘层和小孢子特异性表达,作为信号识别和转导的关键蛋白,参与绒毡层的形成并影响大孢子母细胞的数目;MSP1的突变,引起绒毡层缺失,影响早期小孢子母细胞的发育;小孢子母细胞数目增多,花药壁不正常形成,导致完全雄性不育。(Nonomura,2003,TheMSP1GeneIsNecessarytoRestricttheNumberofCellsEnteringintoMaleandFemaleSporogenesisandtoInitiateAntherWallFormationinRice.ThePlantCell,15:1728-39)。技术实现要素:本发明的目的是提供一种水稻MSP1基因突变体msp1-1972及其分子鉴定方法和应用。本发明首先对籼稻品种93-11种子(M0代)进行钴60辐射诱变处理,种植处理的种子获M1代植株;M1代植株自交产生种子(为M2代),种植M2代植株,对M2代植株进行形态学,组织学和遗传学鉴定,筛选不育植株;然后对不育植株进行基因测序和DNA序列分析,在分子水平上进行验证。最后获得纯合不育单株,并用于杂交育种和生物技术研究。本发明提供的水稻MSP1基因突变体msp1-1972,其为水稻MSP1基因编码区第1879位碱基T替换为碱基C,使第627个氨基酸由丝氨酸转变成脯氨酸,导致水稻雄性不育表型。进一步地,水稻MSP1基因突变体msp1-1972,其核苷酸序列如SEQIDNo.1所示,其氨基酸序列如SEQIDNO.14所示。本发明提供了含有本发明所述水稻MSP1基因突变体msp1-1972的表达载体。本发明提供了含有上述表达载体的宿主细胞。本发明提供了水稻MSP1基因突变体msp1-1972在制备转基因植物中的应用。本发明提供了水稻MSP1基因突变体msp1-1972在制备隐性雄性核不育的转基因水稻中的应用。本发明提供了水稻MSP1基因突变体msp1-1972在水稻改良育种、制种中的应用。本发明还提供了检测水稻MSP1基因突变体msp1-1972的分子标记,该分子标记是由以下引物对扩增和HaeIII酶切组合得到,所述引物对的核苷酸序列为:上游引物1972_F:ATTTTGTCTTCCAACCAGCGG(如SEQIDNO.2所示)下游引物1972_R:ACCATCACCATTGCACAGT(如SEQIDNO.3所示)。本发明提供了上述分子标记在制备隐性雄性核不育的转基因水稻中的应用。本发明提供了上述分子标记在水稻种质资源改良中的应用。一种水稻MSP1基因突变体msp1-1972的分子标记的方法,通过下述引物对扩增待检植物基因组DNA,扩增产物在37℃下用HaeIII酶切,并检测酶切产物:所述引物对的核苷酸序列为:上游引物1972_F:ATTTTGTCTTCCAACCAGCGG(如SEQIDNO.2所示)下游引物1972_R:ACCATCACCATTGCACAGT(如SEQIDNO.3所示);上述引物对样品DNA扩增的产物在HaeIII酶切后,如果比野生型93-11扩增后酶切产物片段短20bp,则该样品中存在突变基因msp1-1972。本发明提供的突变体msp1-1972优点如下:1)该突变体来源于籼稻骨干亲本品种93-11。该品种已完成了全基因组测序,对水稻分子育种十分有利。2)文献“Nonomura,2003,TheMSP1GeneIsNecessarytoRestricttheNumberofCellsEnteringintoMaleandFemaleSporogenesisandtoInitiateAntherWallFormationinRice.ThePlantCell,vol.15:1728-39”中的突变体是转座子Tos17插入突变,难以研究蛋白序列与功能之间的关系。而本发明的突变发生在一个MSP1基因的第1个外显子中1个T碱基替换为1个C碱基,使这一基因的第627个氨基酸由丝氨酸转变成脯氨酸,导致其所编码蛋白功能改变,表现完全雄性不育,表明这一突变位点为该蛋白功能的关键位点之一,对于研究蛋白结构与功能有重要价值。3)因辐射诱变造成单碱基替换,通过引物设计在突变位点添加酶切位点,在PCR和酶切组合下,采用实验室常用的琼脂糖或聚丙烯酰胺凝胶电泳就能开展分子检测,也适用于各种高通量长度片段检测技术。该突变位点本身是一个SNP,因此也适用于荧光探针杂交(如TaqMan)、高分辨溶解曲线法、基因芯片、单碱基测序和质谱法等常规或高通量SNP检测技术用于突变位点基因型鉴定。附图说明图1是实施例2中野生型93-11和1972突变体的株型与穗型照片。图2是实施例3中野生型93-11与1972突变体花药的体式显微镜照片,与花粉碘染的显微镜照片。图3是实施例6中1972突变体MSP1基因的突变位点及氨基酸残基改变示意图。图4是实施例7中野生型93-11、“1972×93-11”F2群体中可育株和不育株MSP1基因突变位点的PCR产物在HaeIII酶切后的电泳照片。图5是实施例8的杂交转育的技术路线图。具体实施方式以下实施例用于说明本发明,但不用来限制本发明的范围。在不背离本发明精神和实质的情况下,对本发明方法、步骤或条件所作的修改或替换,均属于本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。实施例1钴60辐射诱变突变体库的构建选用籼稻骨干亲本品种93-11作为辐射处理的材料,该品种已完成了全基因组测序,对水稻分子育种十分有利。2013年夏,于长沙钴60(60Co)辐射93-11种子(M0代)10公斤,7月种植于海南临高田间,分单株收获M1代种子,共收获约6500份种子。选取M1代种子3200个株系,每个株系种植50棵单株。2014年春季,种植于海南临高田间。移栽后,在分蘖期、孕穗期、抽穗期、开花期、灌浆期等经过仔细观察田间性状,筛查株型、穗型、育性、产量等各种类型突变体,对各类型突变体单株收种保存作为特殊突变体。每个株系收6个单株,作为突变体库资源保存。实施例2M2代种植与性状观察在M2代抽穗、开花期间,在田间对花药的形态进行观察,选取颜色浅白、形态小、花粉量小等表现异常的花药在显微镜下进行进一步镜检。在编号为1972的家系中发现1株育性异常的植株,该突变体在营养生长、抽穗期、穗型均与野生型没有明显区别,图1为该突变体植株与野生型植株的株型(图1左图)和穗型(图1右图)对比照片,但花药比野生型小,颜色浅黄,结实率很低,被选作候选突变体材料进行下一步研究。实施例3花粉镜检,自交和异交通过数碘染着色与不着色花粉比例,统计花粉育性。在体式显微镜下观察1972突变体小花形态,发现雌蕊与野生型无明显区别,花药比野生型小,颜色较浅(图2左图)。田间采集开花期小花,用镊子取出花药,在碘-碘化钾溶液(0.6%KI,0.3%I2,w/w)中轻轻挤压花药,滴在载玻片上,盖上盖玻片,在显微镜下观察花粉碘染情况并拍照(图2右图)。野生型花粉多而染成蓝黑色,而突变体则看不到花粉粒。同一家系野生型植株套袋自交后正常结实,而1972突变体不结实。以水稻品种93-11和中花11为父本给1972突变体授粉,均可结实得到F1代种子。表明该突变体为雄性不育突变体。对F1代自交得到F2代种子,种植F2代植株710株,将花药碘染后在显微镜下观察,其中524株花粉正常碘染,且正常自交结实,186株无花粉,自交不结实,符合3:1分离,表明该不育性状由单个隐性基因控制。实施例4叶片采样与DNA提取本项研究采用CTAB法提取水稻叶片DNA,具体方法如下:称取约0.1g叶片,放入离心管,加入600μLCTAB提取缓冲液,5μLRNaseA,震荡分散,65℃水浴0.5hr,其间轻摇2-3次;加入等体积氯仿/Tris-饱和酚(1:1,v/v),混匀,轻摇10min;4℃10000rpm离心20min;转移上清至新管,加入1/10体积的3M乙酸钠(pH值5.2)、0.6-1倍体积的冷异丙醇;轻摇混匀,至絮状沉淀出现;4℃10000rpm离心10min;弃去上清,用体积百分含量70%乙醇洗沉淀2次;风干,加入50μL1×TE溶解沉淀,-20℃保存。用Nanodrop2000检测DNA浓度,稀释至10ng/L用作PCR模板。实施例5PCR反应与产物回收用水稻MSP1基因的特异引物扩增93-11野生型和实施例2筛选到的编号为1972的突变体DNA。以水稻品种日本晴MSP1基因为参考序列,设计了5对引物用于扩增MSP1片段,然后拼接出野生型和1972突变体MSP1全长序列。所用5对引物的序列见表1,:表1用于扩增MSP1的引物对序列引物对名称正向引物反向引物MSP1_1GCTACTGACATGGTTAACCTCTTCCATTTCCTTCAGCATCTTCAGMSP1_2TCTGACTTCGGCCTTGCGATCAAGCAGAGAGCATTACATGMSP1_3CAAGCAGCAACCATTTCTCAGCAAGGCCGAAGTCAGAMSP1_4CATTTAAAGGGTGCACGAACTGAGAAATGGTTGCTGCTTGMSP1_5CTGAAGATGCTGAAGGAAATGGTTCGTGCACCCTTTAAATGPCR反应体系为:1μL10×反应缓冲液,0.25μLdNTP,0.25μL正向引物和0.25μL反向引物,0.5UTaq酶,1μL10ng/μL模板DNA,加超纯水将总体积补至10μL。PCR反应程序为:94-98℃变性1-3min,然后执行以下循环:95℃变性20s,53-58℃复性20s,72℃延伸30s,30-40个循环。循环结束后72℃补充延伸3-10min,结束反应。配置1.5%琼脂糖凝胶,在5V/cm电场下电泳30min;采用市面DNA凝胶回收试剂盒回收PCR产物。实施例6DNA序列分析将回收所得野生型与突变体的PCR产物DNA采用ABI3730测序仪进行测序,测序引物分别使用正向引物与反向引物。使用常见DNA序列分析软件DNAman6.0对双向测序结果进行拼接;将1972突变体的MSP1等位基因记为msp1-1972。对野生型和突变体序列进行比对发现,在MSP1基因的基因组序列第1879个碱基T替换为1个碱基C;蛋白序列分析比对显示,该突变引起了第627个氨基酸由丝氨酸转变为脯氨酸。实施例7突变位点分子标记设计与基因型-表型共分离鉴定根据实施例6中得到的突变位点两侧的序列设计基因特异引物:正向引物1972_F,其核苷酸序列如SEQIDNO.2所示;反向引物1972_R,其核苷酸序列如SEQIDNO.3所示。其中1972_F的3’端第二个碱基由基因原来的碱基T修改为G,在1972突变体的扩增产物中形成一个HaeIII酶切位点,而对野生型的扩增产物则没有。因此可通过该引物对扩增后,用HaeIII酶切,突变体1972的片段会比野生型短20个碱基对。在实施例5中所述PCR反应条件下,用上述引物对对93-11以及1972×93-11的F2群体的DNA模板进行扩增。扩增产物用HaeIII酶切,酶切方法如下:按照PCR扩增产物10μL,去核酸酶水18μL,10×Buffer2μL,HaeIII1-2μL,混合各反应物,微离心几秒钟,在37℃下孵育1-2小时,最后在80℃下20分钟以终止反应。酶切产物在6%聚丙烯酰胺凝胶上进行电泳分离。聚丙烯酰胺凝胶电泳方法如下:(1)聚丙烯酰胺胶的配制:6%PA胶80mL,10%过硫酸胺250μL(冬天)/125μL(夏天),四甲基乙二胺(TEMED)80μL。摇匀后灌胶。用洗涤剂把玻璃板反复擦洗干净,用酒精擦净、晾干。在通风橱中将凹板涂上2%的RepelSilane后,再用酒精擦净、干燥,将另一块平板涂上0.5%的BingdingSilane1.5mL(在1.5ml离心管中加入7.5μLBindingSilane和7.5μL冰醋酸,补足95%乙醇至1.5mL)。操作过程中,防止两块玻璃板相互污染,彻底干燥后再进行玻璃板组装、灌胶。(2)预电泳:待胶凝固后,取出梳子,洗掉上边凝胶尤其注意接缝处定要洗净。先在电泳槽下槽(阴极)装入1×TBE的电极缓冲液,将聚合的凝胶板装在电泳槽内,在上槽中注入0.5×TBE的电极缓冲液。恒定功率40W-65W,预电泳约30min。用吸管清除胶面上沉淀的尿素和气泡,插入梳子。(3)电泳:扩增产物中加入5μl5×LoadingBuffer混合后95℃变性5分钟,立刻转移到冰上冷却,吸取1.5-3μl加入上样孔;恒定功率40W-65W进行电泳,至溴酚蓝到达电泳槽底部结束。视SSR扩增产物分子量大小及差异带型的可辨程度调整电泳时间。(4)银染显色,将带胶的一块玻璃板放入10%的冰乙酸固定液中,65r/min振荡约30min,直至二甲苯腈全部脱色;蒸馏水冲洗2次,每次5min;将冲洗后的胶板放入新配制的染色液(2L水中加入2g硝酸银、3mL37%甲醛)中65r/min摇动30min;将染色后的胶板放入蒸馏水冲洗5s,立即拿出进行显影;将胶板快速转移到4℃预冷的显影液(2L水中加入30g氢氧化钠,10ml37%甲醛)轻轻摇动至带纹出现;将胶板置于10%的冰乙酸固定液中至无气泡产生为止;用蒸馏水冲洗2次,每次2min;室温下自然干燥后,拍照保存图像。电泳结果见图4,扩增产物有长、短两种片段,组成3种带型:亲本野生型93-11的扩增-酶切带型为较大的单一片段,F2中表型为野生型的个体带型为单一大片段或大、小杂合型;突变体扩增产物的电泳带型全部为单一短片段。这一结果一方面验证了实施例6中的突变位点,同时表明该突变位点与不育表型是共分离的。这一结果结合该突变体的突变表型和已发表文献中的表型描述,可推断1972突变体的雄性不育表型是由实施例6中所述的突变造成的。实施例8:突变基因的杂交转育可按图5的步骤将1972突变体的不育等位基因msp1-1972通过杂交转育到其它水稻遗传背景中:①杂交:以1972为母本,与受体水稻材料为父本杂交获得F1种子;②第一轮回交:F1播种后获得F1植株,将F1植株与轮回亲本进行杂交,获得BC1种子;③BC1不育基因选择(前景选择):播种BC1种子,获得不少于500株幼苗,在幼苗期采集各单株叶片,以实施例4中所述方法提取DNA,以实施例7中所列的引物对(1972_F和1972_R)进行扩增、HaeIII酶切和电泳,选取基因型为杂合的单株继续种植,弃去纯合野生型的单株;④BC1背景选择:采用一组(例如100个,或200个等)在1972和轮回亲本之间存在多态的,且在基因组上均匀分布的分子标记(可以是但不限于SSR、SNP、INDEL、EST、RFLP、AFLP、RAPD、SCAR等类型标记),对步骤③中选出的单株进行鉴定,选取与轮回亲本相似度高(例如大于88%相似度,或2%中选率等)的材料;⑤第二轮回交:用步骤④中选出的单株为父本,为轮回亲本授粉,获得BC2种子;⑥BC2的前景与背景选择:对选出的材料重复步骤③至步骤④的操作,选出与轮回亲本相似度高于选择标准(如相似度大于98%,或2%中选率等)的BC2代植株;⑦自交获得BC2F2种子:对步骤⑥中选出的BC2植株进行自交,获得BC2F2种子;⑧BC2F2的前景选择:将步骤⑦中获得的BC2F2种子播种,获得500株以上幼苗,在幼苗期采集叶片,以实施例4中所述方法提取DNA,以实施例7中所列的引物对(1972_F和1972_R)进行扩增、酶切和电泳,选出带型为纯合突变体和杂合型的单株继续栽培,丢弃纯合野生型的单株;⑨BC2F2的背景选择及应用:将步骤⑧中选出的单株按照步骤④的方法进行背景筛选,选出100%背景纯合的单株。如果中选单株的1972_F/1972_R引物对扩增后酶切带型为纯合突变体,则该单株为最终目标材料,可进一步与轮回亲本杂交保存材料,或与其它水稻材料进行杂交。如果中选单株是杂合带型,可直接用于保存种质,或通过自交获得不育株用于杂交育种或制种。以上所述仅是本发明的优选实施方式,应当指出,对于本
技术领域:
的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1