一株抗紫外线的高毒力金龟子绿僵菌诱变菌株MaUV‑1及其应用的制作方法
本发明涉及生物防治
技术领域:
,具体的,涉及一株抗紫外线的高毒力金龟子绿僵菌诱变菌株MaUV-1及其应用。
背景技术:
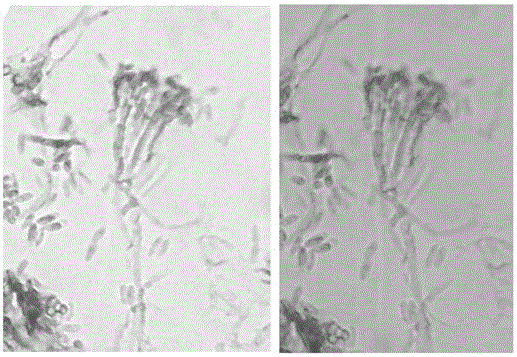
:小菜蛾、红火蚁等害虫可危害多种作物,造成巨大的经济损失。长期的化学农药使用造成害虫抗药性的产生,防治更加困难。在抗药性小菜蛾、红火蚁等害虫的防治上,多采用传统的大量使用化学农药的化学防治方法,但是,小菜蛾、红火蚁等害虫对常用的大多数化学农药产生了高水平的抗药性,而且红火蚁生活在土壤中,化学农药较难防治。生物防治是病害防治的较理想、环保的方法。在生物农药防治方面,有研究显示,金龟子绿僵菌可用于防治小菜蛾和红火蚁。但是,我国现有用于防治小菜蛾、红火蚁等害虫的金龟子绿僵菌(Metarhiziumanisopliae)菌株的毒力不强,而且对紫外线的耐受能力差,因而防治效果差。技术实现要素:本发明所要解决的技术问题是克服现有技术中抗药性小菜蛾、红火蚁等害虫防治技术的的缺陷和不足,提供一株抗紫外线的高毒力金龟子绿僵菌Metarhiziumanisopliae(Metsch.)Sorokin诱变菌株MaUV-1及其在防治抗药性小菜蛾、红火蚁等害虫方面的应用。本发明的金龟子绿僵菌诱变株MaUV-1是在野生菌株的基础上通过紫外线诱变、筛选而获得,具有高毒力,而且具有较强的抗紫外线能力。本发明的目的是提供一株抗紫外线的高毒力金龟子绿僵菌诱变菌株MaUV-1。本发明的另一目的是提供上述金龟子绿僵菌诱变菌株MaUV-1在防治小菜蛾和/或红火蚁等害虫方面的应用。本发明的再一目的是提供一种防治小菜蛾和/或红火蚁等害虫的生物制剂,所述制剂含有金龟子绿僵菌诱变株MaUV-1。本发明的上述目的是通过以下技术方案给予实现的。一株抗紫外线的高毒力金龟子绿僵菌(Metarhiziumanisopliae)诱变株MaUV-1,该菌株于2016年5月6日保藏于中国典型培养物保藏中心(CCTCC),菌种保藏号:CCTCCNO:M2016250;分类命名号为:MetarhiziumanisopliaeMaUV-1;保藏地址为中国武汉武汉大学。所述金龟子绿僵菌诱变株MaUV-1是对野生型金龟子绿僵菌进行紫外线照射诱变,从诱变菌株中筛选而纯化获得的,所述野生型金龟子绿僵菌是从西藏地区被自然侵染的金龟子幼虫上分离得到的。所述金龟子绿僵菌诱变株MaUV-1属肉座菌目,绿僵菌属。本发明所述金龟子绿僵菌诱变株MaUV-1的形态特征如下:在查氏培养基上菌落呈绒毛状至棉絮状,开始时为白色,产孢时呈黄绿色,菌落为不规则的放射状,菌落背面呈黄绿色,菌丝具有分隔和分枝,透明,直径1.5~2.0μm,分生孢子梗很难与菌丝区分开,直径2.0μm,其末端产生瓶形小梗,(8.0~16.4)μm×(1.5~2.0)μm,从瓶梗的末端以向基式连续形成长串链的分生孢子。分生孢子长椭圆形,两端钝圆或钝截形,大小变化甚大,(5.0~7.3)μm×(2.0~3.2)μm。上述金龟子绿僵菌诱变株MaUV-1对抗药性小菜蛾、红火蚁等多种害虫具有很好的防效,而且抗紫外线能力强,应用更方便、广泛、持久。因此,所述金龟子绿僵菌诱变株MaUV-1可应用于制备防治抗药性小菜蛾、红火蚁等害虫的药物。由上述的金龟子绿僵菌诱变菌株MaUV-1体内提取得到的可防治小菜蛾和/或红火蚁的毒素,也在本发明的保护范围之内。优选地,所述防治小菜蛾和/或红火蚁的毒素的提取方法为:将金龟子绿僵菌诱变菌株MaUV-1的分生孢子分别接入查氏培养液中培养发酵后,除去菌丝获得发酵液;将发酵液与等体积的乙酸乙酯(1:1)混合,收集有机相并浓缩(旋转蒸发仪RE-52A,上海亚荣生化仪器厂)获得到粗毒素。另外,一种包含有所述金龟子绿僵菌诱变菌株MaUV-1或上述毒素的防治抗药性小菜蛾和/或红火蚁等害虫的生物制剂,也在本发明的保护范围之内。优选地,所述生物制剂中金龟子绿僵菌诱变菌株MaUV-1孢子悬浮液的浓度为1×105~1×108孢子/mL。更优选地,所述生物制剂中金龟子绿僵菌诱变菌株MaUV-1孢子悬浮液的浓度为1×107孢子/mL。本发明具有以下有益效果:本发明公开的金龟子绿僵菌诱变株MaUV-1是通过对野生菌株进行紫外线诱变、从诱变菌株中筛选而获得,经侵染生物学研究和室内生物测定,该诱变菌株MaUV-1对抗药性小菜蛾、红火蚁等害虫具有较强的侵染杀虫效果,防效大大提升,而且具有很好的抗紫外线能力。与野生菌株相比,诱变株MaUV-1对小菜蛾的毒力提高了75%,对红火蚁的毒力提高了39%~78%。而且测试显示,在紫外线照射条件下,该诱变菌株MaUV-1的孢子萌发率比野生菌株提高了70%~189%,即表明诱变菌株MaUV-1的抗紫外线能力提高了70~189%。该菌株为中国本土的菌株,并非从国外引进,能适应本地的自然环境,应用方便且范围广泛。该金龟子绿僵菌是一种昆虫病原真菌,作为一种活体生物农药,具有不同于现有化学杀虫剂的全新的作用机理、对环境无污染、无残留的特征,适应了有机食品生产的要求。附图说明图1为金龟子绿僵菌诱变菌株MaUV-1在Czapek培养基上的菌落形态图;A:菌落正面;B:菌落背面。图2为金龟子绿僵菌诱变菌株MaUV-1菌丝和分生孢子形态。图3为金龟子绿僵菌诱变菌株MaUV-1和野生型金龟子绿僵菌在PDA培养基上26℃培养的菌株菌落形态图;A:菌落正面;B:菌落背面;UV代表金龟子绿僵菌诱变菌株MaUV-1,SM04代表野生菌株。图4为金龟子绿僵菌诱变菌株MaUV-1粗毒素的HPLC图谱。具体实施方式下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。实施例1野生菌株的诱变与分离鉴定1、材料金龟子绿僵菌诱变株是在野生菌株的基础上诱变而来,野生型金龟子绿僵菌菌株采集于西藏地区被自然侵染的金龟子(PhylloperthahorticolaL.)幼虫虫尸。查氏培养基(Czapek-Dox):NaNO32g,K2HPO41g,KCl0.5g,MgSO40.5g,FeSO40.01g,蔗糖30g,琼脂20g,加入水使总体积为1000ml并煮沸。后经高压灭锅灭菌(121℃,30min)。无菌操作条件:所有器皿和用具须经高压灭锅灭菌(121℃,30min),接种等操作均在超净工作台内进行。培养条件:置于25℃光照(14L:10D)恒温箱中培养,待菌落形成后,转移到PDA斜面,再转入4℃冰箱贮存。2.野生菌株的诱变取一定浓度的金龟子绿僵菌野生菌株的分生孢子悬浮液,置于紫外线下照射40分钟,将照射后的孢子悬浮液涂布在Czapek平板中,倒置于25℃恒温箱中培养,挑取新产生的单菌落、并转移到新的Czapek平板中培养,获得共50个左右的诱变株,连续传代培养10代以上。3.诱变株的初步筛选观察50个诱变株的培养特性,从中挑选培养性状稳定、菌丝生长快、菌落直径大的诱变株8个置于Czapek平板上培养,待产生分生孢子后放入4℃冰箱保存备用。4.诱变株的形态描述对诱变株的培养性状、菌丝、分生孢子和产孢器的形态进行描述。将获得的8个分离株接种到Czapek平板上,于25℃条件下培养。3~5天可观察见到有白色的菌丝长出,菌落呈绒毛状至棉絮状,开始时为白色,产孢时呈黄绿色,菌落为不规则的放射状,菌落背面呈黄绿色,如图1所示。菌丝具有分隔和分枝,透明,直径1.5~2.0μm,分生孢子梗很难与菌丝区分开,直径2.0μm,其末端产生瓶形小梗,(8.0~16.4)μm×(1.5~2.0)μm,从瓶梗的末端以向基式连续形成长串链的分生孢子。分生孢子长椭圆形,两端钝圆或钝截形,大小变化甚大,(5.0~7.3)μm×(2.0~3.2)μm,如图2所示。5、金龟子绿僵菌诱变株MaUV-1的筛选虫生真菌在遗传、生态及生物学等方面具有多样性,又存在有准性生殖现象,同种真菌的不同分离株对目标害虫的致病力差异显著,分离株不同,其LD50、LT50可相差数倍至数十倍。高产优质菌株的筛选与获得,是取得较好防治效果的首要前提。菌株筛选常用的指标分别为致病力、产孢量、孢子萌发率、菌落生长速率。本发明以这些指标为依据,从金龟子绿僵菌诱变株中筛选优势菌株。(1)供试菌株的处理随机挑选经诱变、纯化后性状稳定的金龟子绿僵菌诱变株A、B、C、D、E、F、G、H共8个,在Czapek平板于25±0.5℃的恒温箱(14L:10D)中培养。(2)供试昆虫与寄主植物小菜蛾,将网室中饲养在芥蓝上的小菜蛾成虫,接种到无虫的芥蓝幼苗上,产卵12h后,清除成虫,将芥蓝幼苗置于25±0.5℃的光照培养箱中,待小菜蛾发育至2龄若虫时待用。芥蓝BrassicacampestrisL.,购自广东省农科院蔬菜研究所,试验苗均采用4~6片展开叶的盆栽苗。(3)菌落生长直径和产孢量的测定将8个诱变株分别配制成1×106孢子/ml的分生孢子悬液,分别取1ml悬液滴入Czapek培养基上,用三角玻璃棒涂匀,待1~2d长出菌丝后用直径为5mm的打孔器取新鲜菌落,接种于Czapek平板上,然后置于培养箱中培养(L:D=14:10)。每个菌株5次重复。第12d测定菌落直径,第14d收集分生孢子用血球计数板记数测定产孢量。具体操作如下:测量菌落直径,并用直径为13mm的灭菌打孔器在培养皿中取菌丝生长均匀的菌块,然后放入加有20ml0.3%吐温-80无菌水中,用磁力搅拌器使孢子分散,制成孢子悬浮液,用血球记数板记数、测定产孢量。8个诱变株和野生菌株的菌落生长直径和产孢量如表1所示,诱变株的菌落生长直径与WT(野生菌株)相比差异显著,其中B诱变株的菌落生长直径最大,G诱变株的菌落生长直径最小。生长14d后,所有诱变株与WT相比产孢量差异显著,其中B诱变株的产孢量最高。表1金龟子绿僵菌8个诱变株和野生菌株的生长直径和产孢量菌株菌落生长直径M±SE(mm)(12d)产孢量(×109孢子/mL)(14d)A48.3±1.2ab2.47±0.12aB53.7±1.6a2.62±0.11aC47.7±0.8ab2.50±0.16aD50.3±0.4ab2.37±0.12aE44.3±0.4b2.10±0.08abF46.3±1.2ab2.13±0.12abG41.3±1.6b1.93±0.12bH47.3±1.2ab2.50±0.04aWT34.7±1.2c0.41±0.02c注:表中同列数字后字母相同者表示差异不显著(DMRT法)。A、B、C、D、E、F、G和H分别为诱变株,WT为野生菌株。(4)孢子萌发率的测定将8个诱变株分别培养14d后,用无菌水收集孢子并制成悬液,用载玻片萌发法试验。将孢子悬液滴在带有查氏培养基的无菌载玻片上,置于底部铺有滤纸的培养皿内,在皿内滴加3~4滴无菌水保湿(100,RH),培养24h后镜检。每个处理3次重复。8个诱变株中,B、E分别与WT野生菌株的孢子萌发率差异显著(见表2)。其中B分离株的孢子平均萌发率最高,E分离株的孢子萌发率最低。表2金龟子绿僵菌8个诱变株和野生菌株的孢子萌发率(24h)诱变株检测的孢子数量萌发率(%)(M±SE)A65363.3±0.4bB69874.3±2.2aC58268.3±1.5abD74363.8±1.1bE66355.1±0.8cF65161.0±0.3bG80169.2±1.1abH71560.0±1.7bcWT85765.7±0.7b注:表中同列数字后字母相同者表示差异不显著(DMRT法)。A、B、C、D、E、F、G和H分别为诱变株,WT为野生菌株。(5)诱变株对小菜蛾2龄幼虫的致病力测定将8个诱变株培养14d后,用无菌水收集孢子,配制成浓度为106分生孢子/mL的孢子悬液。将带有2龄小菜蛾幼虫的芥蓝叶片浸入悬液中,对照浸入无菌水中,10s后取出,自然晾干。每处理为6~8片叶,每叶5头若虫,3次重复。处理过的叶片置于透明的保鲜盒内。再置于25±0.5℃的光照培养箱中(L:D=14:10)。每日镜检并记录感染死亡率,连续观察8d。上述所有试验数据均在数据处理软件SAS系统中处理完成。致病力研究结果表明,所有诱变株对2龄小菜蛾幼虫的死亡率均高于野生菌株引起的死亡率,并与对照相比差异显著。8个诱变株在第3d开始表现出侵染症状,第3d、6d时8个诱变株与野生菌株对小菜蛾的死亡率差异显著。从总体而言,诱变株B对小菜蛾的死亡率较强,平均为90.6%(6d),H诱变株对小菜蛾的死亡率较低,为66.5%(6d)(表3)。与野生菌株相比,诱变株B对小菜蛾的毒力提高了61%以上。表3金龟子绿僵菌8个诱变株和野生菌株的致病力测定分离株侵染率(%)M±SE(3d)侵染率(%)M±SE(6d)A58.6±1.1ab85.2±0.2abB62.3±1.6a90.6±1.2aC55.7±0.6ab81.6±0.9bD50.7±0.4b72.9±1.5cE48.5±0.4bc78.9±0.5bcF45.3±1.7c83.6±0.6bG52.1±1.3b71.2±1.7cH45.9±1.7c66.5±0.8cdWT30.5±0.9d56.1±1.2dCK3.3±0.6e5.6±1.4e注:表中同列数字后字母相同者表示差异不显著(DMRT法)。A、B、C、D、E、F、G和H分别为诱变株,WT为野生菌株。(6)金龟子绿僵菌诱变株对紫外线的耐受性评估将野生菌株(WT)和诱变菌株(B)配制成1.0×106孢子/mL的悬浮液培养20h后,分成两组,一组紫外线照射40min,另一组不使用紫外线照射,然后将孢子悬浮液取5ml置于装有200ml的查氏培养液的三角瓶中,在25±1℃摇床内200rpm培养,分别在18、21、24、27h时观察并记录孢子萌发情况,以芽管长度超过孢子直径一半作为萌发标准。所有处理3次重复。野生菌株和诱变菌株孢子萌发率结果如表4所示。经紫外线照射0、40分钟后,诱变菌株和野生菌株在18、21、24、27h的孢子萌发率差异显著,诱变菌株孢子萌发率明显高于亲本菌株。经紫外线照射40分钟后,野生菌株萌发率明显降低,而诱变菌株孢萌发率变化不明显,表明诱变菌株的抗紫外线能力明显增强,与野生菌株相比增强了70~189%。表4供试菌株孢子萌发率(26℃)注:表中数据为平均值±标准误,同列中具有相同字母者表示差异不显著。(7)金龟子绿僵菌诱变株的筛选评估在评估优良诱变株时,对紫外线的耐受力、致病性和产孢量是重要的参考指标,孢子萌发率和菌落生长速率次之。综上研究结果显示,本发明从菌落生长速率、产孢量和致病性上看,诱变株B较为优良,具有致病性强、产孢量高、对紫外线的耐受力强等特点。综合比较各方面的因素,B诱变株为最佳菌株,将其命名为金龟子绿僵菌诱变菌株MaUV-1,并于2016年5月6日保藏于中国典型培养物保藏中心(CCTCC),菌种保藏号:CCTCCNO:M2016250;分类命名号为:MetarhiziumanisopliaeMaUV-1;保藏地址为中国武汉武汉大学。所述金龟子绿僵菌诱变菌株Metarhiziumanisopliae(Metsch.)Sorokin菌株MaUV-1,属肉座菌目,绿僵菌属。在查氏培养基上菌落呈绒毛状至棉絮状,开始时为白色,产孢时呈黄绿色,菌落为不规则的放射状,菌落背面呈黄绿色,菌丝具有分隔和分枝,透明,直径1.5~2.0μm,分生孢子梗很难与菌丝区分开,直径2.0μm,其末端产生瓶形小梗,(8.0~16.4)μm×(1.5~2.0)μm,从瓶梗的末端以向基式连续形成长串链的分生孢子。分生孢子长椭圆形,两端钝圆或钝截形,大小变化甚大,(5.0~7.3)μm×(2.0~3.2)μm。(8)金龟子绿僵菌诱变株的遗传稳定性评估将亲本菌株(WT)和诱变菌株(MaUV-1)的分生孢子分别接入含有PDA培养的同一平板中,通过比较第10、12、14代诱变菌株的形态特征等方面的差异,明确诱变株在遗传上的稳定性。第10、12、14代诱变菌株在菌落形态、颜色、菌丝生长状态与分生孢子的颜色、菌苔颜色等方面完全相同(如图3所示),表明诱变株在菌落形态上已经稳定。将诱变菌株的分生孢子分别接入查氏培养液中,在180rpm/min、26±1℃下振荡培养8d,离心除去菌丝获得发酵液。将发酵液与等体积的乙酸乙酯(1:1)混合,收集有机相并浓缩(旋转蒸发仪RE-52A,上海亚荣生化仪器厂)获得到粗毒素。将粗毒素用甲醇溶解、稀释,通过液-质联用(HPLC-MS)获得相应的图谱。通过比较第10、12、14代诱变菌株在次生代谢产物等方面的差异,明确诱变株在遗传上的稳定性。研究结果表明第10、12、14代诱变菌株的次级代谢产物的HPLC图谱(图4)完全一致,表明诱变株在生理代谢性能上已经稳定。将野生菌株(WT)和诱变菌株(MaUV-1)配制成1.0×106孢子/mL的悬浮液培养20h后,取经紫外线照射40min的孢子悬浮液5ml置于装有200mL的查氏培养液的三角瓶中,在25±1℃摇床内200rpm培养,分别在18、21、24、27h时观察并记录孢子萌发情况,以芽管长度超过孢子直径一半作为萌发标准。所有处理3次重复。通过比较第10、12、14代诱变菌株在抗紫外线方面的差异,明确诱变株在遗传上的稳定性。结果表明经紫外线照射40分钟后,诱变菌株第10、12、14代的孢子在18、21、24、27h的孢子萌发率差异不显著(表5)。表明所筛选的诱变菌株对紫外线的抗性能稳定遗传。表5诱变株不同繁殖世代的孢子萌发率(26℃)注:表中数据为平均值±标准误,同列中具有相同字母者表示差异不显著实施例2金龟子绿僵菌诱变株(MaUV-1)对小菜蛾的致病力测定1、生物测定是检测虫生真菌对目标害虫的致死程度和致死速率的有效手段之一,能为综合评价该真菌的生物防治潜力提供重要的参考依据。本发明就金龟子绿僵菌诱变株MaUV-1对小菜蛾的致病力进行测定,以筛选出用于防治的最佳浓度。供试昆虫与寄主植物:将网室中饲养在芥蓝上的小菜蛾成虫,接种到无虫的芥蓝苗上,产卵12h后,清除成虫,将芥蓝苗置于25±0.5℃的光照培养箱中,待小菜蛾发育至2龄幼虫时待用。芥蓝BrassicacampestrisL.,购自广东省农科院蔬菜研究所,试验苗均采用8~10片展开叶的盆栽苗。(1)供试菌株的处理取金龟子绿僵菌诱变株(MaUV-1)和野生菌株(WT)接种于Czapek平板,于25±0.5℃的恒温箱(14L:10D)中培养14天,待产孢后加入0.3%吐温-80的无菌水收集孢子,将孢子悬浮液在磁力搅拌器上打散均匀后,用医用纱布过滤去杂质,获得孢子悬浮液,用血球记数板记数、配成0、1×103、1×104、1×105、1×106、1×107孢子/mL共6个浓度梯度待用。(2)金龟子绿僵菌诱变株(MaUV-1)和野生菌株对小菜蛾的致病力测定将小菜蛾2龄幼虫浸入6个浓度梯度的绿僵菌孢子悬浮液中,10s后取出,自然晾干后放置于25±0.5℃的光照培养箱中(L:D=14:10)。每日镜检并记录感染死亡率,连续观察6d。每处理为30头虫,3次重复。上述所有试验数据均在数据处理软件SAS系统上处理完成。2、金龟子绿僵菌诱变株(MaUV-1)和野生菌株对小菜蛾的累计死亡率接种后的第2~3d,各处理区的小菜蛾幼虫开始表现出发病症状,如虫体上有少量白色的菌丝长出,几天后虫体表面出现孢子,随后小菜蛾幼虫死亡。金龟子绿僵菌诱变株MaUV-1和野生菌株处理小菜蛾后第3d、6d的累计死亡率如表6所示,结果表明随着孢子浓度的增加小菜蛾幼虫的死亡率也增加,同一浓度下随着时间的增加,小菜蛾2龄的死亡率也增加。在相同浓度与时间时,诱变株与野生菌株对小菜蛾幼虫的死亡率差异显著。在第6天诱变株与野生菌株对小菜蛾幼虫的LC50分别为1.3×103孢子/ml和5.3×103孢子/ml,诱变株的毒力提高了75%。表6金龟子绿僵菌诱变株和野生菌株对小菜蛾的累计死亡率注:表中同列数字后字母相同者表示差异不显著(DMRT法)。表中MaUV-1和WT分别表示金龟子绿僵菌诱变株和野生菌株。上述所有试验数据均在数据处理软件SAS系统上处理完成。实施例3金龟子绿僵菌诱变株MaUV-1对红火蚁的致病力测定1、供试昆虫:红火蚁,自广州大学城草坪,采集后在室内饲养一段时间,待种群稳定后挑选出大小一致的健康大型工蚁用于试验。(1)供试菌株的处理取金龟子绿僵菌诱变株(MaUV-1)和野生菌株(WT)接种于Czapek平板,于25±0.5℃的恒温箱(14L:10D)中培养14天,待产孢后加入0.3%吐温-80的无菌水收集孢子,将孢子悬浮液在磁力搅拌器上打散均匀后,用医用纱布过滤去杂质,获得孢子悬浮液,用血球记数板记数、配成0、1×103、1×104、1×105、1×106、1×107孢子/mL共6个浓度梯度待用。(2)金龟子绿僵菌诱变株(MaUV-1)对红火蚁的致病力测定将红火蚁大型工蚁浸入6个梯度的孢子悬浮液中,10s后取出,自然晾干。每处理为30头虫,3次重复。处理过的红火蚁大型工蚁放置于25±0.5℃的光照培养箱中(L:D=14:10)。每日镜检并记录感染死亡率,连续观察14d。上述所有试验数据均在数据处理软件SAS系统上处理完成。2、金龟子绿僵菌诱变株(MaUV-1)对红火蚁大型工蚁的累计死亡率接种后的第4~5d,各处理区的红火蚁大型工蚁开始表现出发病症状,如虫体上有少量白色的菌丝长出,几天后虫体表面出现孢子,随后红火蚁大型工蚁死亡。金龟子绿僵菌诱变株MaUV-1处理后红火蚁大型工蚁第7d、14d的累计死亡率如表7所示,结果表明随着浓度的增加红火蚁大型工蚁的死亡率也增加,同一浓度下随着时间的增加,红火蚁大型工蚁的死亡率也增加。第7d、14d时,所有不同浓度的处理区,红火蚁大型工蚁的累计死亡率差异显著。第7d时,诱变株与野生菌株对红火蚁大型工蚁的LC50分别为2.89x107孢子/ml和4.79x107孢子/mL;第14d时,诱变株与野生菌株对红火蚁大型工蚁的LC50分别为3.15x105孢子/ml和1.48x106孢子/mL;诱变株的毒力提高了39.67%~78.72%%。表7金龟子绿僵菌诱变株和野生菌株对红火蚁大型工蚁的累计死亡率注:表中同行数字后字母相同者表示差异不显著(DMRT法)。表中MaUV-1和WT分别表示金龟子绿僵菌诱变株和野生菌株。上述所有试验数据均在数据处理软件SAS系统上处理完成。上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,均应为等效的置换方式,都包含在本发明的保护范围之内。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1