不动杆菌及其应用的制作方法
本发明涉及一种不动杆菌属的菌株,常见淡水藻类,特别是涉及微生物与藻类协同共生技术,对淡水养殖富营养化水体起到净化作用。
背景技术:
江苏沿海滩涂密集养殖水体富营养化,氨氮和亚硝态氮含量常年偏高,对滩涂地区生态环境带来严重影响,筛选并利用高效硝化细菌调控水体氨氮浓度是可行之法。通过滩涂密集养殖水体富集培养、平板分离、硝化速率测定、驯化等过程,筛选高效硝化细菌,在废水生物脱氮过程中,氨氮的去除率是一个重要指标,而氨氮的转化依赖于硝化微生物的作用。长期以来,人们都认为在污水处理系统中执行硝化功能的是一群自养型微生物,因此现阶段污水脱氮工艺中的硝化作用单元完全是按自养硝化菌的生理特性来设计的。然而在实践中人们发现自养硝化菌在脱氮工艺中存在许多缺陷,如(1)自养硝化菌在有大量有机物存在条件下,对氧气和营养物的竞争不如好氧异养菌,从而导致其难以在系统中成为优势菌;(2)自养硝化菌增值速度慢,特别是在低温冬季,难以维持较高的生物浓度。自养型微生物作为生物菌剂进行水体脱氮劣势凸显出来。同时,根据传统的生物脱氮理论,硝化反应需要在有氧、缺少有机物的条件下进行,而反硝化反应则与之相反,需要在无氧、有机物存在的条件下完成,因此不可能同时进行硝化和反硝化过程。而近期的研究中,越来越多研究发现部分微生物具有同步硝化/反硝化功能。这些微生物能够通过氮循环过程,先将NH4+_N氧化为NO2-_N,再将NO2-_N氧化为NO3-_N,最终变成N2释放入空气中。
附图说明
图1协同系统脱NH4+-N的效率。柱状线显示三个重复的标准误差,ck:对照组,A6:Acinetobacter sp.A6
图2各实验组亚硝酸盐的生成量。柱状线显示三个重复的标准误差,ck:对照组,A6:Acinetobacter sp.A6
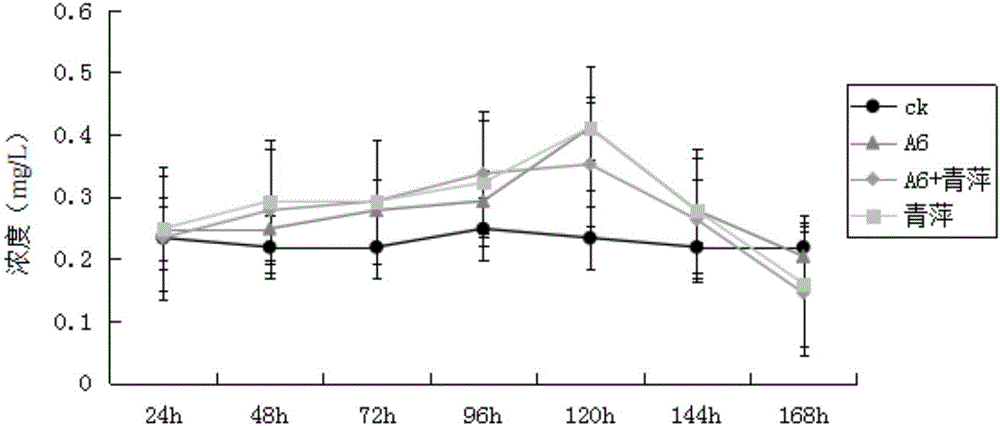
图3硝酸盐的生成量。柱状线显示三个重复的标准误差,A6:Acinetobacter sp.A6
图4不同浓度的A6细胞对食蚊鱼体长、体重的影响,食蚊鱼体长、体重的相关性,鱼缸水体中不同浓度的A6细胞浓度随培养时间的变化情况
技术实现要素:
Acinetobacter sp.A6菌株是从我国江苏省盐城大丰水产养殖塘底泥中分离、筛选出,其已于2015年7月2日在“中国微生物菌种保藏管理委员会普通微生物中心”保藏,保藏编号为CGMCC No.11033。菌株优点:①A6是一株具有同步硝化/反硝化功能的异养型微生物,可将水体中的NH4+_N大部分以N2释放入空气;②A6易于培养,最适培养温度为25℃,但其在4℃-33℃的环境下,均可发挥较好的脱氨氮效果;③A6菌株与青萍协同系统,可大幅提高A6抵抗水体中常见的重金属Pb2+、Cr6+、养殖水体中常见抗生素庆大霉素和土霉素的胁迫。
本申请一方面涉及一种不动杆菌,其特征在于所述的不动杆菌为保藏编号为CGMCC No.11033的不动杆菌或其直接传代物,保藏地址为中国微生物菌种保藏委员会普通微生物中心,北京市朝阳区北辰西路1号院3号。
本发明另一方面涉及上述不动杆菌的应用,所述的应用为污水处理。
优选的,所述的应用为对淡水养殖富营养化水体进行净化。
在本发明的另一个优选实施方式中,所述的不动杆菌与青萍协同作用于污水处理。
本发明采用菌藻联合使用及固定化生物强化技术提高硝化细菌在水体中的抗冲击负荷能力和生物数量;为相关养殖水体处理提供了绿色、无环境污染的生物途径。
具体实施方式
异养硝化培养基:(NH4)2SO4 0.5g,琥珀酸钠2.17g,维氏盐溶液50ml,加水溶解,补充蒸馏水至1000ml,维氏盐溶液:K2HPO4 5.0g,MgSO4.7H2O 2.5g,NaCl 2.5g,FeSO4.7H2O 0.05g,MnSO4.4H2O 0.05g,溶解后加水定容至1000ml。
菌株活化培养基(LB培养基):950ml去离子水中加入胰蛋白胨10g,酵母提取物5g,NaCl 10g,摇动容器直至溶质溶解,用5mol/LNaOH调pH至7.0用去离子水定容至1L,在15psi高压下蒸汽灭菌20min。
完全培养基:NH4NO30.02g/L,CaCO30.015g/L,MgSO4·7H2O0.05g/L,K2HPO40.04g/L,FeSO4·7H2O0.05g/L,Na2EDTA0.001g/L,H3BO31.42×10-3g/L,MnSO4·H2O1.42×10-3g/L,CuSO4·5H2O0.39×10-3g/L,ZnSO4·7H2O6.59×10-3g/L,Na2MoO4·2H2O2.52×10-3g/L,CoSO4·7H2O0.9×10-4g/L,其中CaCO3用1mol/LHCl溶解。调节pH值为7,在15psi高压下蒸汽121℃灭菌15min。
菌株活化:将菌株转至LB固体平板上,25℃倒置培养18-24h后,挑取单菌落转至LB液体培养基,25℃,120-150rpm振荡培养18-24h后制备种子液。以1%的接种量转至LB液体培养基中,25℃振荡培养18-24h后制备菌悬液。
菌悬液制备:取菌液转转至离心管,8000rpm离心10min,弃上清液,加无菌水混匀细胞备用。
青萍-菌株协同系统构建:取培养后的青萍用无菌水冲洗3-4遍后,置于完全培养基中,在体系中加入菌悬液,调整菌悬液至102-103cfu/ml,培养温度为23℃-25℃,光照强度为3000lux,光周期为18L:6Dh,培养4d后可投放至待净化水体中。
青萍-菌株协同系统投放方式:构建后的菌藻协同系统,水体中的投放量约为24-30g/m3。
图1显示,菌-藻协同系统对NH4+-N的去除效果明显高于单独生长的菌、藻,120h时去除率达到85%,随后趋于稳定,168h,菌藻协同系统对于富营养化水体的NH4+-N去除率达到了97%左右。水体中NH4+-N的浓度由最初的100mg/L降至3.07mg/L。
图2显示,在168h时,菌-藻协同系统在富营养化鱼缸水体中的亚硝酸盐累积含量下降至0.14mg/L。
图3显示,菌-藻协同系统在富营养化鱼缸水体中的NO3--N生成量低于其余实验组别,NO3--N的生成最终仅有33.76mg/L。
图4A显示不同浓度的A6对食蚊鱼体长的影响。从图中可以看出,食蚊鱼的体长无显著差异(P>0.05)。各个鱼缸中食蚊鱼的平均体长均保持在3cm左右。图4B显示不同浓度的A6对食蚊鱼体重的影响。从图中可以看出,食蚊鱼的体重无显著差异(P>0.05)。在测试浓度范围内(106cfu/mL、105cfu/mL、104cfu/mL),各个培养体系中食蚊鱼的平均体重分别分别增长了10%、23.3%和13.3%。图4C显示食蚊鱼体长、体重的相关性趋势,呈正相关,符合实际情况,说明A6细胞对食蚊鱼的生长无影响(没有使其产生畸形等情况)。图4D可知低浓度的A6细胞(104cfu/mL)比相对高浓度A6细胞(106cfu/mL、105cfu/mL)更适合用于污水脱氮。
菌株-青萍系统系统构建后,A6菌株对Pb2+、Cr6+、庆大霉素和土霉素耐受性提高。
监测鱼缸水体的pH值变化情况,发现不同细胞浓度的培养体系中,pH值基本没有变化,均保持在6.4左右。
该协同系统对于富营养化水体的脱氨氮效果明显,并将水体中的NH4+_N一部分转化为NO3-_N,大部分以N2形式释放至空气中,对环境无污染,对养殖水体中的水产动物生长无影响,并可以耐受水体中常见的一些重金属及抗生素。该发明是一种简单、易操作、成本低,对水体无污染的绿色环保生物途径。
以上所述是本发明的优选实施例,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明所述原理的前提下,还可以作出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!