一种细胞培养液及其应用和诱导骨骼肌干细胞向骨细胞分化的方法与流程
本发明涉及干细胞培养领域,尤其涉及一种细胞培养液及其应用和诱导骨骼肌干细胞向骨细胞分化的方法。
背景技术:
骨骼移植(植骨)是治疗骨缺损、骨折不连接和进行脊柱融合术的必需手段。传统植骨材料为自体骨骼、异体骨骼和人工骨材料,这些中除自体松质骨有少许成骨细胞外,均只能提供充填和支架作用;需肌体将其逐步吸收、成骨替代,过程缓慢,再出现骨不连、骨缺损或脊椎间假关节发生率高,影响了植骨效果。近年来组织工程技术的迅猛发展,为解决传统植骨术后骨形成缓慢和新骨形成不良等技术难点提供了一种有效解决途径。骨组织工程技术主要包括成骨支架、成骨细胞和调控成骨分化的细胞因子三个方面。目前研究表明,各类已发现的间充质干细胞等干细胞的研究和应用从很大程度上解决了骨组织工程人工骨的种子细胞来源问题。进而,如何促进细胞的增殖和成骨分化成为组织工程技术的关键环节和研究热点。
骨骼肌源性干细胞(muscle-derived stem cells)是成年动物或人肌肉组织中特有的干细做为中胚层起源的一种成体间充质干细胞,具有自我更新能力和多项分化的潜能,可在体外分化为血细胞、骨细胞、内皮细胞、神经细胞等系的细胞。骨骼肌干细胞这种功能特性极大地吸引了来自基础医学和临床医学的研究者,给基础科学的研究者们提供了一种研究发展生物学的模式,骨骼肌干细胞所具有的修复、替代和再生能力也为临床医学提供了一个发展新疗法的机会。
目前,对于MDSCs成骨分化诱导的研究主要集中于不同细胞因子对其生物学行为产生的不同影响,其诱导效果并不理想。因此,进一步开发MDSCs成骨分化的方法,能够进一步促进骨骼移植技术的发展。
技术实现要素:
有鉴于此,本发明要解决的技术问题在于提供一种细胞培养液及其应用 和诱导骨骼肌干细胞向骨细胞分化的方法,本发明提供的细胞培养液能够促进骨骼肌干细胞向骨细胞分化,其分化周期短,分化效率高。
本发明提供的细胞培养液,包括基础培养液、维生素C、地塞米松、β-甘油磷酸钠、IGF-1、BMP-2、PRP和FBS。
胎牛血清(fetal calf serum,简称FBS)是血清中的一种,能够提供维持细胞指数生长的激素,基础培养基中没有或量很少的营养物,以及主要的低分子营养物。
富血小板血浆(PRP)是血液经过离心得到的血小板浓缩物,富含各种生长因子,经激活后释放大量的生长因子,如血小板源性生长因子、血管内皮生长因子、胰岛素样生长因子等。这些生长因子已被证实,在单独应用或联合应用时能刺激细胞增殖、分化,对软组织和骨组织的愈合有促进作用。
骨成形蛋白(BMP)能诱导机体内的间充质细胞不可逆地分化为软骨和骨细胞。将BMP植入软组织内,可异位诱导新骨的形成。
类胰岛素一号增长因子(IGF-1)也被称作“促生长因子”,对维持与细胞分化有关蛋白质水平十分重要,与一些生长因子合用能促进细胞分化成熟。
维生素C、地塞米松、β-甘油磷酸钠是目前干细胞成骨诱导或称软骨诱导液中常见组分,其中,地塞米松通过促进Cbfal mRNA和Osterix mRNA的表达而促进骨髓基质细胞向成骨细胞分化。β-甘油磷酸钠可以为成骨细胞提供磷酸离子,同时促进生理性钙盐的沉积和钙化,是骨髓基质干细胞产生矿化结节的必要条件。维生素C(抗坏血酸)在体外能增加钙盐的沉积,促进矿化结节的形成,并通过间充质细胞间接调节破骨细胞的分化。
本发明以维生素C、地塞米松、β-甘油磷酸钠、IGF-1、BMP-2、PRP、FBS添加入基础培养基,作为骨骼肌干细胞成骨分化的诱导培养液。提高了骨骼肌干细胞向骨细胞分化的数量并缩短分化的时间。实验表明,以本发明提供的培养液诱导骨骼肌干细胞,能够在7d内即出现骨细胞的特性,细胞形态发生改变且茜素红染色细胞数目增多。诱导21天后,细胞中OPN和Col-I基因的表达量增加,且显著(p<0.05)高于对比例中的OPN和Col-I基因的表达量。
在本发明的实施例中,PRP的体积分数为8%~12%;FBS的体积分数为8%~12%。
在一些实施例中,PRP的体积分数为10%;FBS的体积分数为10%。
在一些实施例中,PRP的体积分数为12%;FBS的体积分数为8%。
在一些实施例中,PRP的体积分数为8%;FBS的体积分数为12%。
在本发明的实施例中,IGF-1的浓度为20μg/L~30μg/L;BMP-2的浓度为80μg/L~120μg/L。
在一些实施例中,IGF-1的浓度为20μg/L;BMP-2的浓度为120μg/L。
在一些实施例中,IGF-1的浓度为30μg/L;BMP-2的浓度为80μg/L。
在一些实施例中,IGF-1的浓度为25μg/L;BMP-2的浓度为100μg/L。
在本发明的实施例中,维生素C的浓度为40μg/L~60μg/L;地塞米松的浓度为1×10-7mol/L~1×10-9mol/L;β-甘油磷酸钠的浓度为8mol/L~12mol/L。
在一些实施例中,维生素C的浓度为40μg/L;地塞米松的浓度为1×10-7mol/L;β-甘油磷酸钠的浓度为12mol/L。
在一些实施例中,维生素C的浓度为60μg/L;地塞米松的浓度为1×10-9mol/L;β-甘油磷酸钠的浓度为8mol/L;
在一些实施例中,维生素C的浓度为50μg/L;地塞米松的浓度为1×10-8mol/L;β-甘油磷酸钠的浓度为10mol/L;
在一些实施例中,维生素C的浓度为50μg/L;
地塞米松的浓度为1×10-8mol/L;
β-甘油磷酸钠的浓度为10mol/L;
IGF-1的浓度为25μg/L;
BMP-2的浓度为100μg/L。
在一些实施例中,维生素C的浓度为40μg/L;
地塞米松的浓度为1×10-7mol/L;
β-甘油磷酸钠的浓度为12mol/L;
IGF-1的浓度为20μg/L;
BMP-2的浓度为120μg/L。
在一些实施例中,维生素C的浓度为50μg/L;
地塞米松的浓度为1×10-8mol/L;
β-甘油磷酸钠的浓度为10mol/L;
IGF-1的浓度为25μg/L;
BMP-2的浓度为100μg/L;
PRP的体积分数为10%;
FBS的体积分数为10%。
在本发明的实施例中,基础培养液为DMEM/F12无血清培养液。
本发明所用的基础培养液可为自制也可为购买获得,本发明对此不做限定,其实施皆在本发明的保护范围之内。本发明采用的人干细胞无血清培养基为DMEM/F12无血清培养液。本发明提供的培养液中不含有抗生素,而是通过更加适宜的培养条件,促进骨骼肌干细胞向骨细胞的分化,增强目标细胞的生长势,降低感染风险。
本发明提供的培养液能够诱导骨骼肌细胞相骨细胞的分化,分化效率高,速度快。实验表明,诱导培养14d后,碱性磷酸酶活性增高,成骨细胞标志性基因OPN、Col-I表达量增高,茜素红染色细胞数量增多。
本发明提供的细胞培养液在诱导骨骼肌干细胞向骨细胞分化中的应用。
本发明还提供了一种诱导骨骼肌干细胞向骨细胞分化的方法,骨骼肌干细胞以基础培养基培养至70%~80%融合后以本发明提供的细胞培养液诱导。
在本发明的实施例中,诱导的时间为7d~21d。
在本发明的实施例中,骨骼肌干细胞为3~5代的骨骼肌干细胞。
一些实施例中,骨骼肌干细胞为第3代的骨骼肌干细胞。
本发明中,骨骼肌干细胞的分离方法包括:
步骤1:将骨骼肌破碎后,经Dispase II和I型胶原酶消化后,以胰蛋白酶消化,获得细胞以培养基重悬;
步骤2:差速贴壁法对步骤1中所得细胞进行分离,获得骨骼肌干细胞。
在本发明中,骨骼肌为颞肌。
差速贴壁具体为:将细胞悬液接种于培养瓶中,放置于37℃、体积分数为5%的CO2培养箱中培养。2h后的贴壁细胞记为PP1,其中未贴壁细胞吸出后移入新的培养瓶中进行培养,并记为PP2。24h后将PP2中未贴壁的细胞吸出后移入新的培养瓶中培养,标记为PP3。以后每24h进行差速贴壁培养,直到获得PP6,记为骨骼肌干细胞。
骨骼肌干细胞培养3天后换液,以后每2-3天换液,待细胞生长融合至70-80%后传代培养。
骨骼肌干细胞(MDSCs)原代培养8-10天,待细胞长满80-90%,用吸管吸弃旧培养液,加入0.25%胰蛋白酶-EDTA,消化1-3分钟,镜下观察细胞收缩变圆时,加入含20%FBS的DMEM/F12培养液终止消化,收集细胞,1000r/min离心5min,弃上清。加入适量含20%FBS的DMEM/F12培养液,进行细胞记数,按8×104cell/mL密度接种于培养皿中进行传代培养,5%CO2培养箱37℃培养,每隔2-3天换液一次。
在本发明中,诱导骨骼肌干细胞向骨细胞分化前,骨骼肌细胞以基础培养基培养的接种密度为1×104cell/mL。
基础培养基为DMEM/F12培养液。
本发明提供的培养液中包括基础培养液、维生素C、地塞米松、β-甘油磷酸钠、IGF-1、BMP-2、PRP和FBS。本发明提供的培养液能够作为骨骼肌干细胞成骨分化的诱导培养液。提高了骨骼肌干细胞向骨细胞分化的数量并缩短分化的时间。实验表明,以本发明提供的培养液诱导骨骼肌干细胞,能够在7d内即出现骨细胞的特性,14d细胞形态发生改变且茜素红染色细胞数目增多。诱导21天后,细胞中OPN和Col-I基因的表达量增加,且显著(p<0.05)高于对比例中的OPN和Col-I基因的表达量。
附图说明
图1示MDSCs P2代形态;其中,图1-a的放大倍数为40×;图1-b的放大倍数为100×;
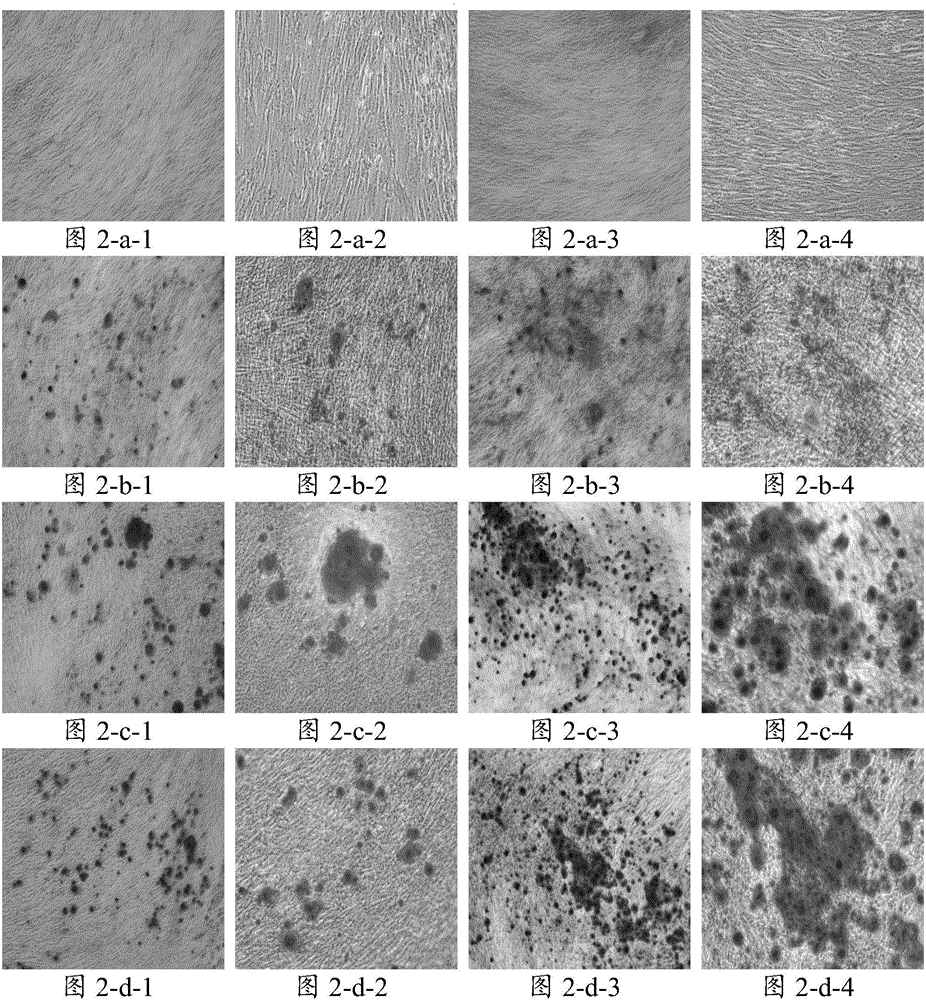
图2示各组细胞染色效果;其中,图2-a-1示对照组1细胞诱导14天放大40倍效果;图2-a-2示对照组1细胞诱导14天放大100倍效果;图2-a-3示对照组1细胞诱导21天放大40倍效果;图2-a-4示对照组1细胞诱导21天放大100倍效果;图2-b-1示对照组2细胞诱导14天放大40倍效果;图 2-b-2示对照组2细胞诱导14天放大100倍效果;图2-b-3示对照组2细胞诱导21天放大40倍效果;图2-b-4示对照组2细胞诱导21天放大100倍效果;图2-c-1示对照组3细胞诱导14天放大40倍效果;图2-c-2示对照组3细胞诱导14天放大100倍效果;图2-c-3示对照组3细胞诱导21天放大40倍效果;图2-c-4示对照组3细胞诱导21天放大100倍效果;图2-d-1示对照组4细胞诱导14天放大40倍效果;图2-d-2示对照组4细胞诱导14天放大100倍效果;图2-d-3示对照组4细胞诱导21天放大40倍效果;图2-d-4示对照组4细胞诱导21天放大100倍效果;图2-e-1示对照组5细胞诱导14天放大40倍效果;图2-e-2示对照组5细胞诱导14天放大100倍效果;图2-e-3示对照组5细胞诱导21天放大40倍效果;图2-e-4示对照组5细胞诱导21天放大100倍效果;图2-f-1示实验组1细胞诱导14天放大40倍效果;图2-f-2示实验组1细胞诱导14天放大100倍效果;图2-f-3示实验组1细胞诱导21天放大40倍效果;图2-f-4示实验组1细胞诱导21天放大100倍效果;图2-g-1示实验组2细胞诱导14天放大40倍效果;图2-g-2示实验组2细胞诱导14天放大100倍效果;图2-g-3示实验组2细胞诱导21天放大40倍效果;图2-g-4示实验组2细胞诱导21天放大100倍效果;图2-h-1示实验组3细胞诱导14天放大40倍效果;图2-h-2示实验组3细胞诱导14天放大100倍效果;图2-h-3示实验组3细胞诱导21天放大40倍效果;图2-h-4示实验组3细胞诱导21天放大100倍效果;
图3示各组细胞OCN基因、Col-I基因、Runx2基因表达水平比较;柱子从左至右依次示对照组1、对照组2、对照组3、对照组4、对照组5、实验组1、实验组2、实验组3;*示与对照组1存在显著性差异,p<0.05;**示与对照组1存在极显著性差异,p<0.01。
具体实施方式
本发明提供了一种细胞培养液及其应用和诱导骨骼肌干细胞向骨细胞分化的方法,本领域技术人员可以借鉴本文内容,适当改进工艺参数实现。特别需要指出的是,所有类似的替换和改动对本领域技术人员来说是显而易见的,它们都被视为包括在本发明。本发明的方法及应用已经通过较佳实施例进行了描述,相关人员明显能在不脱离本发明内容、精神和范围内对本文的方法和应用进行改动或适当变更与组合,来实现和应用本发明技术。
本发明采用的材料和仪器皆为普通市售品,皆可于市场购得。
下面结合实施例,进一步阐述本发明:
实施例1 MDSCs的分离和传代
1、取材:
取成人正常颞肌标本(取自于开颅手术患者),用含双抗的PBS缓冲液冲洗后转入无菌培养皿中,用眼科剪剪成1mm3左右大小的碎块,然后移入50mL离心管中,PBS缓冲液吹打冲洗3次,静置1分钟后弃上层液及漂浮组织。
2、酶解:
向上述获得的肌肉碎块加入2倍的体积的混合酶,包括2.4u/mLDispase II、1%I型胶原酶,2.5mmol/L CaCl2,混匀后置37℃恒温摇床中消化60min左右,直到试管中的肌肉碎块消化为肌糜,肉眼看不到肌块。消化结束后,1000r/min离心5min,弃上清。加入2~3倍体积的0.25%胰蛋白酶-EDTA,混匀后置37℃恒温摇床中消化15min,消化结束后,1000r/min离心5min,弃上清。加入适量PBS重悬,1000r/min离心5min,弃上清。加入约3倍肌糜体积的PBS反复吹打后经200目滤网过滤,收集的滤液1000r/min离心5min,弃上清。生长培养基(含20%FBS的DMEM/F12)重悬细胞。
3、分离与纯化:
采用差速贴壁分离技术对MDSCs进行分离。将细胞悬液接种于25mL培养瓶中,放置于37℃、体积分数为5%的CO2培养箱中培养。2h后的贴壁细胞记为PP1,其中未贴壁细胞吸出后移入新的培养瓶中进行培养,并记为PP2。24h后将PP2中未贴壁的细胞吸出后移入新的培养瓶中培养,标记为PP3。以后每24h进行差速贴壁培养,直到获得PP6,期间根据细胞的生长情况进行换液。PP6培养3天后换液,以后每2-3天换液,倒置显微镜下观察记录细胞生长以及形成集落后每日扩增情况,待细胞生长融合至70-80%后传代培养。
4、MDSCs的传代培养:
MDSCs原代培养8-10天,待细胞长满80-90%,用吸管吸弃旧培养液,加入适量0.25%胰蛋白酶-EDTA,消化1-3分钟,镜下观察细胞收缩变圆时,立即加入适量含20%FBS的DMEM/F12培养液终止消化,收集细胞,1000r/min离心5min,弃上清。加入适量含20%FBS的DMEM/F12培养液,进行细胞记数,按8×104cell/mL密度接种于培养皿中进行传代培养,5%CO2培养箱37℃培养,每隔2-3天换液一次。
5、MDSCs的鉴定:
1)细胞爬片制作:将无菌盖玻片放置于6孔培养板中,对数生长期细胞制备成细胞悬液,按5×104cell/mL密度接种于6孔培养板中,每孔2mL,生长培养基为含20%FBS的DMEM/F12,培养24-48小时,使细胞生长于盖玻片上。
2)Desmin、Sca-1免疫细胞化学染色:将放有盖玻片6孔培养板内培养液吸出,PBS缓冲液漂洗细胞铺片5分钟,重复3次。用4%多聚甲醛固定15分钟,PBS缓冲液漂洗后甩干,中性树胶粘附于载玻片上,4℃冰箱过夜。滴加3%过氧化氢孵育15分钟,消除内源性过氧化物酶的活性,PBS缓冲液漂洗5分钟,重复3次。分别滴加一抗兔抗人结蛋白(Desmin)抗体(1:200稀释)、兔抗人Sca-1抗体(1:100稀释),37℃湿盒内孵育1小时,4℃过夜。次日取出后PBS缓冲液漂洗5分钟,滴加二抗,37℃湿盒内孵育40分钟,PBS缓冲液漂洗5分钟,重复3次,滴加新鲜配制的DAB溶液显色5-10分钟,在光镜下观察,用自来水进行冲洗终止显色。将甩干片子后,苏木素复染1分钟,分化返蓝,梯度酒精脱水,二甲苯透明,中性树胶封片。在镜下观察,胞膜和/或胞浆内出现棕黄色颗粒,说明成功分离获得MDSCs(图1为MDSCsP2代形态图)。
实施例2 MDSCs的分化
富血小板血浆(PRP)的制备:采集志愿者外周血,于超净台内把血样转入15mL离心管,10mL每管,2500rpm/min,离心10min。离心结束后血样分为淡黄色上清层,中间白细胞层和红色细胞底层。吸取全部上清、白色细胞层及红色细胞层上部1-2mm,移入新15ml离心管,2500rpm/min,离心5min。离心结束后吸取上清层和白细胞层,移入新15mL离心管,1200g/min,离心5min。离心结束后弃上清,保留最下面的2.5mL,即富血小板血浆。移入含氯化钙的促凝管,4℃过夜,待血凝块充分收缩后,4000rpm/min,离心12min,吸取出促凝管内的全部上清,上清液即为激活的PRP,0.22μm过滤,滤液-20℃保存待用。
各受试组培养液的配方如表1:
表1实施例2~4
取实施例1制备的第3代MDSCs,按1×104cell/mL密度接种于6孔培养板内,培养至细胞达到60%~70%融合以上时,各受试组分别更换表1所示成骨诱导液。诱导分化培养14~21d后,检测各受试组细胞分化情况。
1、茜素红染色
对各组细胞进行茜素红染色,具体方法为:
弃培养液,用PBS清洗细胞2到3次;加入4%多聚甲醛固定10-15min;吸弃多聚甲醛,PBS清洗3次;加入2%茜素红,37℃孵育30min。孵育结束后吸弃残液,用37℃预热的去离子水清洗2到3次,每次20s;晾干后在倒置显微镜下观察并采集图像。各组细胞染色效果如图2。结果显示,实验组1~3的培养基诱导细胞成为骨细胞的数量更多。
2、矿化结节面积
使用图像分析软件Image-Pro-Plus 5.0(Media Cybernetics,美国)对各组3个复孔中的细胞进行矿化结节面积计算。矿化结节面积如表2所示。
表2矿化面积计算结果
注:**表示与各对照组相比,P<0.01。
由表2可知,对照组1不含诱导因子,不对细胞进行成骨分化诱导,因此,没有着色,矿化面积为零。实验组1与其他各组均有显著性差异(p<0.01);其他各对照组之间无显著性差异。实验组1中的矿化面积均值为90.45±0.78%,是对照组2矿化面积的2倍以上。其他实验组的效果也均显著优于对照组(p<0.01)。
3、碱性磷酸酶活性(ALP)测定
对各组MDSCs分别于诱导分化培养0d、7d、14d和21d对细胞进行碱性磷酸酶活性定量测定。具体测定方法为:
弃原培养液,PBS洗3次,每孔加200μL 0.2%TritonX-100,37℃孵育1h,镜下可见细胞裂解完全,吸出裂解液至新离心管,离心后取上清,留作备用。
对上述裂解液进行蛋白含量测定,于96孔板中进行。按BCA蛋白浓度测定试剂盒说明书要求设置测定孔、标准孔和空白孔,每组设3个复孔,每孔液体20μL,37℃孵育30min后检测562nmOD值,空白孔调零。根据标准孔OD值绘制蛋白浓度标准曲线,代入各孔OD值,算出各组的蛋白浓度。
对上述裂解液进行碱性磷酸酶活性测定,于96孔板中进行。按碱性磷酸酶测定试剂盒说明书要求设置测定孔、标准孔和空白孔,37℃孵育15min,每组设3个复孔,每孔加150μL显色液,轻轻震荡孔板混匀。检测520nmOD值,空白孔调零。根据以下公式计算碱性磷酸酶活性:
碱性磷酸酶活性(U/gprot)=(测定孔吸光度-空白孔吸光度)÷(标准孔吸光度-空白孔吸光度)×酚标准品浓度÷待测样本蛋白浓度(gprot/mL)。
表3不同时间点各组细胞碱性磷酸酶活性
注:*表示与各对照组相比,P<0.05;
**表示与各对照组相比,P<0.01;
如表3所示,细胞培养7d、14d、21d后,在同一时间内,各诱导组与未诱导组(对照组1)碱性磷酸酶的活性均有显著性差异(p﹤0.01,*),实验组1与对照组2-5均有显著性差异(p﹤0.01,**)。碱性磷酸酶活性随细胞培养时间增加而升高,但未诱导组(对照组1)上升不明显,实验组1显著升高。
4、效果实施例3成骨基因OCN、Col-I、Runx2的检测
各组MDSCs分别于诱导分化培养21d后,RT-PCR法检测成骨细胞标志性基因OCN、Col-I、Runx2的表达。按TRIzol试剂盒说明书进行细胞总RNA提取,M-MLV反转录试剂盒获得cDNA。按SYBR Green定量PCR试剂盒说明书对成骨细胞标志性基因OCN、Col-I、Runx2表达水平进行检测。β-actin作为内参基因。2-△△Ct法定量分析。
表4引物序列
实验结果如图3所示。由图3可知,细胞培养21d后,各诱导组与未诱导组(对照组1)比较,成骨细胞标志性基因OCN、Col-I、Runx2表达水平均有显著性差异(*,p<0.01),实验组1与其他各诱导组均有显著性差异(**,p<0.05)。
以上仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!