一种灯盏花乙素的合成方法与流程
本发明涉及天然药物活性成分的全合成,具体涉及一种灯盏花乙素的合成方法。
背景技术:
灯盏细辛俗称灯盏花,为菊科植物短亭飞蓬erigermbreviscapus(vant.)hand-mass的干燥全草,首见于明代医学家蓝止庵所著《滇南本草》,谓:“灯盏花,味苦,性温,能治风湿疼痛”。《云南中草药》明确说明灯盏花主治散寒、解表、活血舒筋、感冒头痛鼻塞、跌打损伤等。灯盏花素是从灯盏花中提取的黄酮类有效成分的总称。目前临床上使用的灯盏花类药品都是以灯盏花素为主要活性成分,其主要药理成分是灯盏花乙素(1-1,scutellarin,又名野黄芩苷,分子式:c21h18o12,分子量:462.37,cas:27740-01-8)。《中国药典》2015年版收载的灯盏花素质量标准中,供注射用的灯盏花素原料含野黄芩苷不低于98.0%,供口服用的灯盏花素原料含野黄芩苷不低于90.0%。现代药理研究表明,灯盏花乙素具有增加脑血流量,降低血管阻力,抗血小板、红细胞聚集,降低血液粘度等作用。
灯盏花乙素(1-1)结构
目前市售的灯盏花乙素类制剂的原料药都是从植物灯盏细辛中提取而得,制备过程如下:将灯盏细辛全株研磨成粗粉,采用一定浓度的乙醇水溶液加热回流提取,体系抽滤并浓缩,浓缩物用热水溶解,再分别用乙醚和乙酸乙酯除掉部分脂溶性有机化合物,水层加饱和醋酸铅,析出黄色固体,抽滤,滤饼加酸脱铅,得到的黄色固体再进行聚酰胺柱层析,分别得到灯盏花乙素和灯盏花甲素。市场灯盏花乙素都是依靠这种传统的提取方法得到的。
目前,市场对灯盏花乙素的需求量达到100吨/年,未来将更多,而从植物中提取率不到2.5%。因此,在我国西南地区每年要种植上万亩灯盏花来提取灯盏花乙素。植物提取灯盏花乙素存在的问题是:(1)种植灯盏细辛占用大量的土地资源,同时产品的质量受环境影响较大;(2)灯盏细辛中灯盏花乙素含量低,造成提取率低,成本高;(3)提取的质量不稳定。而目前化学合成的方法均存在原料制备困难、反应收率低、试剂价格昂贵、合成路线长等缺点,不适合于工业化生产。
现有技术对灯盏花乙素的合成进行过探索,但是现有的合成方法存在很多局限。
灯盏花乙素基本上都是通过其中间体灯盏花乙素苷元(1-2,scutellarien)合成的。
灯盏花乙素(1-1)和灯盏花乙素苷元(1-2)的化学结构
已报道的灯盏花乙素苷元的合成主要有如下所示的五条路线:
路线1:1974年,德国科学家l.farkas首次报道了灯盏花乙素苷元的合成,他们以2,5-二羟基-4,6-二甲氧基苯乙酮(1-3)为原料,通过与对羟基苯甲醛发生羟醛缩合成环、紫外照射下溴代、强碱性条件下脱氢溴酸以及脱甲基四步反应,得到化合物(1-2)。该合成路线的原料(1-3)价格昂贵、需要使用毒性较大的溴素、总收率仅为4%,因此无法应用于规模化生产。
路线2:1999年,mcgarrylyndaw等报道了合成路线2。他们利用3,4,5-三甲氧基苯酚(1-5)和对甲氧基苯丙炔酸为原料,通过o-michael加成和分子内环化得到中间体(1-11),然后脱甲基得到灯盏花乙素苷元(1-2)。该路线中使用的原料(1-5)和对甲氧基苯丙炔酸都不易购买且价格昂贵,反应总收率不到5%,同样不适合于大量生产。
路线3:2005年,吴松等报道了路线3。他们以2-羟基-4,5,6-三甲氧基苯乙酮(1-4)为原料,通过与对甲氧基苯甲酰氯依次发生baker-venkataraman反应、分子内关环反应和脱甲基反应,成功高效地制备了灯盏花乙素苷元(1-2),三步总收率达到了45%。但是,不足之处是原料(1-4)不易制备(由1-5为原料得到),价格昂贵。
路线4:2009年,杨健等人报道了路线4。他们是以2-羟基-4,5,6-三甲氧基苯乙酮(1-4)为原料,通过与对甲氧基苯甲醛发生claisen-schmidt反应得到化合物(1-10);然后氧化关环、脱甲基得到灯盏花乙素苷元(1-2),总收率达到70%,同样的,原料(1-4)不易制备(由1-5为原料得到),价格昂贵。
路线5:2012年,刘湘等人报道了路线5。以3,4,5-三甲氧基苯酚(1-5)和对甲氧基肉桂酰氯为原料,通过friedel-crafts反应、氧化合环、脱甲基三步反应,快速制得灯盏花乙素苷元(1-2),收率为54%。
现有技术中灯盏花乙素苷元(1-2)的5条合成路线
分析上述合成路线可以看出:路线1原料昂贵、反应条件苛刻而且收率极低,不可能用于规模化生产;路线2-5都以3,4,5-三甲氧基苯酚(1-5)为起始原料,经酰化得到关键中间体(1-4),虽然收率还可以,但是起始原料(1-5)价格昂贵、不易保存(易氧化),缺乏适合于工业化生产的合成方法。
目前化合物(1-5)的制备主要有如下所示的两种方法:
3,4,5-三甲氧基苯酚(1-5)的合成路线
方法1:以3,4,5-三甲氧基苯甲醛为原料,通过baeyer-villiger反应一步合成3,4,5-三甲氧基苯酚,但是由于底物3,4,5-三甲氧基苯甲醛的苯环上含有三个甲氧基,反应中更容易被氧化成3,4,5-三甲氧基苯甲酸和苯醌,使得反应收率只有20%,后处理麻烦,因而不适合工业化生产。
方法2:以3,4,5-三甲氧基苯甲酸为原料,通过酰化、氨化、hofmann降解、重氮化四步反应制备3,4,5-三甲氧基苯酚,总收率达到45%。但该方法仍不适合于工业化,因为:(1)使用socl2不但实验操作危险,而且会造成非常严重的环境污染;(2)重氮化反应重复性不好,收率不稳定,反应中间体是偶氮类爆炸性化合物,具有一定的危险性。
当然,现有技术中也有人绕开(1-5)而获得(1-4),但是路线都过长,且收率并不理想。
文献报道的灯盏花乙素的合成均以灯盏花乙素苷元(1-2)为原料,通过羟基全乙酰化、7位乙酰基选择性地被苄基置换、脱苄基、糖苷化、最后水解脱乙酰基得到灯盏花乙素(1-1),总收率不到20%。
现有技术灯盏花乙素(1-1)的合成路线
分析以上灯盏花乙素(1-1)的合成路线,存在以下几个缺点:(1)保护基策略的使用,明显增加了反应路线和实验操作的难度;(2)脱苄基需要使用0.25当量的pd/c,使成本大大增加;(3)糖苷化反应中,ag2o需要使用1-2个当量,成本很高。
综上分析,作为重要的治疗心脑血管疾病的中成药灯盏花乙素目前主要从植物中提取,没有适合于工业化生产的全合成方法。已有的灯盏花乙素全合成路线中存在的问题有:(1)关键中间体灯盏花乙素苷元的合成路线大多以化合物(1-5)为原料,而化合物(1-5)的合成存在收率低、污染严重或操作困难等问题,这也是目前灯盏花乙素全合成工艺中存在的关键问题;(2)灯盏花乙素苷元(1-2)通过5步反应得到灯盏花乙素,路线较长,且使用大量昂贵的试剂,生产成本太高,不适合于灯盏花乙素的大量制备。
因此,研发一条全新的、适合于工业化制备灯盏花乙素的全合成路线不仅能替代植物提取法,节约珍贵的土地资源,保证产品的质量,同时,也为灯盏花乙素的深入研究、发现治疗心脑血管类新药奠定基础。
技术实现要素:
为了解决以上问题,本发明提供了一种如式(ⅰ)所示的化合物及其制备方法,并提供了式(ⅰ)所示的化合物在制备灯盏花乙素苷元或灯盏花乙素中的应用,以及以式(ⅰ)所示的化合物为起始原料合成灯盏花乙素苷元或灯盏花乙素的方法。
本发明是通过以下技术方案实现的:
一方面,本发明提供了一种式(ⅰ)所示的化合物,
其中,r选自未取代或任意被一个苯基取代的c2~c5烷酰基、未取代或任意被c1~c5烷基取代的苯甲酰基;
优选地,所述r选自未取代或任意被一个苯基取代的c2~c3烷酰基、未取代或任意被c1~c3烷基取代的苯甲酰基;
优选地,所述r选自乙酰基、丙酰基、正丁酰基、异丁酰基、苯甲酰基、苯乙酰基或苯丙酰基。
优选地,所述式(ⅰ)为以下化合物:
其中,ac表示乙酰基,me表示甲基,et表示乙基,pr表示正丙基,i-pr表示异丙基,ph表示苯基。
优选地,所述式(ⅰ)化合物为如下式(2-7)所示:
其中,式(2-7)所示结构的化合物,其化学名称为(z/e)-4-羟基-2,6-甲氧基-3-(3-(4-甲氧基苯基)丙烯酰基)乙酸苯酯(在下方实施例中简称为查尔酮)。
另一方面,本发明提供了上述式(ⅰ)所示化合物的制备方法,所述方法包括式(2-6)所示化合物与式(2-2)所示化合物反应的步骤:
其中,r如上所定义。
优选地,化合物(2-2)的加入量为化合物(2-6)的0.6~3倍当量,优选1.2~3倍当量,更优选1.5倍当量。
优选地,所述反应在弱碱性条件下进行,所述弱碱选自吡啶、三乙胺、4-二甲氨基吡啶、六甲基磷酰三胺、na2co3、k2co3中的一种或多种,优选三乙胺;优选地,所述弱碱的加入量为化合物(2-6)的1.5~3倍当量,优选2倍当量。
优选地,所述反应在催化剂的存在下进行;优选地,所述催化剂选自苯丙氨酸、甘氨酸、脯氨酸中的一种或多种,优选脯氨酸;优选地,所述催化剂的加入量为化合物(2-6)的0.5~1.5倍当量,优选1倍当量;
优选地,所述反应在溶剂存在下进行,优选地,所述溶剂选自苯、甲苯、甲醇、乙醇、异丙醇中的一种或多种,优选甲醇。
优选地,所述反应中化合物(2-2)、弱碱、催化剂与化合物(2-6)之间的当量之比为1~3:1~3:1~3:1~3,优选为1.5:2:1:1。
优选地,所述方法包括在加入催化剂、化合物(2-2)、弱碱、溶剂后,再加入化合物(2-6);
优选地,在加入化合物(2-6)之前在5~40℃,优选25℃下搅拌5分钟至4小时,优选1小时;
优选地,在加入化合物(2-6)之后,在5~40℃,优选25℃下继续搅拌15~30小时,优选20小时;
优选地,所述方法还包括反应完成后加水、抽滤的步骤。
优选地,上述化合物(2-6)可以通过如下反应步骤制备:
(1)式(2-3)所示化合物经氧化反应制备得到式(2-4)所示化合物:
(2)化合物(2-4)经还原反应制备得到式(2-5)所示化合物:
(3)化合物(2-5)经傅克酰基化反应制备得到式(2-6)所示化合物:
其中,r如上所定义。
优选地,所述步骤(1)在溶剂中进行,所述溶剂选自丙酮、乙腈、水中的一种或多种,优选丙酮;
优选地,所述步骤(1)中氧化反应的的氧化体系为h2o2/k3fe(cn)6;优选地,所述h2o2的加入量为化合物(2-3)的1~6倍当量,优选3倍当量;
优选地,所述h2o2/k3fe(cn)6的当量比为30~60:1,优选42~43:1,最优选43:1;
优选地,所述步骤(1)包括以下步骤:将k3fe(cn)6溶解于水中,向其中加入溶剂和化合物(2-3),5~40℃优选25℃搅拌均匀后,加入h2o2,优选加入h2o2后于5~40℃优选25℃下继续搅拌20小时,析出黄绿色固体后,加水、抽滤;
优选地,所述步骤(2)在溶剂中进行,所述溶剂为水;
优选地,所述步骤(2)中需要加入还原剂,优选地,所述还原剂的加入量为不少于化合物(2-4)的1倍当量,优选1.5倍当量;优选地,所述还原剂选自连二亚硫酸钠、连二亚硫酸钾、硫酸亚铁、亚硫酸钠、亚硫酸氢钠中的一种或多种,优选连二亚硫酸钠;
优选地,所述步骤(2)包括以下步骤:依次加入水、化合物(2-4)后,加入还原剂,反应体系加热回流0.5~3小时,优选1小时,待反应体系由浑浊变澄清时进行冷却,析出白色固体后抽滤、真空干燥;
优选地,所述步骤(3)在溶剂中进行,所述溶剂选自二氯甲烷、氯仿、1,2-二氯乙烷中的一种或多种,优选为二氯甲烷;
优选地,所述步骤(3)在bf3·et2o/酰基化试剂存在下进行;优选地,bf3·et2o的加入量为不少于化合物(2-5)的3.5倍当量,优选3.5当量;优选地,加入的化合物(2-5)、bf3·et2o与ac2o的质量之比为1:2~5:2~8,优选为1:2.9~3:4.7~5,最优选为1:3:5;
优选地,所述步骤(3)包括以下步骤:依次加入化合物(2-5)、溶剂、催化体系后搅拌加热回流1~5小时,优选3小时,待大量黄色固体析出时,冷却,抽滤。
具体地,本发明提供了化合物(2-7)的制备方法,所述方法包括式(2-6’)所示化合物与式(2-2)所示化合物反应的步骤:
优选地,化合物(2-2)的加入量为化合物(2-6’)的0.6~3倍当量,优选1.2~3倍当量,更优选1.5倍当量。
优选地,所述反应在弱碱性条件下进行,所述弱碱选自吡啶、三乙胺、4-二甲氨基吡啶、六甲基磷酰三胺、na2co3、k2co3中的一种或多种,优选三乙胺;优选地,所述弱碱的加入量为化合物(2-6’)的1.5~3倍当量,优选2倍当量。
优选地,所述反应在催化剂的存在下进行;优选地,所述催化剂选自苯丙氨酸、甘氨酸、脯氨酸中的一种或多种,优选脯氨酸;优选地,所述催化剂的加入量为化合物(2-6’)的0.5~1.5倍当量,优选1倍当量;
优选地,所述反应在溶剂存在下进行,优选地,所述溶剂选自苯、甲苯、甲醇、乙醇、异丙醇中的一种或多种,优选甲醇。
优选地,所述反应中化合物(2-2)、弱碱、催化剂与化合物(2-6’)之间的当量之比为1~3:1~3:1~3:1~3,优选为1.5:2:1:1。
优选地,所述方法包括在加入催化剂、化合物(2-2)、弱碱、溶剂后,再加入化合物(2-6’);
优选地,在加入化合物(2-6’)之前在5~40℃,优选25℃下搅拌5分钟至4小时,优选1小时;
优选地,在加入化合物(2-6’)之后,在5~40℃,优选25℃下继续搅拌15~30小时,优选20小时;
优选地,所述方法还包括反应完成后加水、抽滤的步骤。
优选地,在化合物(2-7)的制备方法中,所述化合物(2-6’)通过如下反应步骤制备:
(1)式(2-3)所示化合物经氧化反应制备得到式(2-4)所示化合物:
(2)化合物(2-4)经还原反应制备得到式(2-5)所示化合物:
(3)化合物(2-5)经傅克酰基化反应制备得到式(2-6’)所示化合物:
所述步骤(1)在溶剂中进行,所述溶剂选自丙酮、乙腈、水中的一种或多种,优选丙酮;
优选地,所述步骤(1)中氧化反应的的氧化体系为h2o2/k3fe(cn)6;优选地,所述h2o2的加入量为化合物(2-3)的1~6倍当量,优选3倍当量;
优选地,所述h2o2/k3fe(cn)6的当量比为30~60:1,优选42~43:1,最优选43:1;
优选地,所述步骤(1)包括以下步骤:将k3fe(cn)6溶解于水中,向其中加入溶剂和化合物(2-3),5~40℃优选25℃搅拌均匀后,加入h2o2,优选加入h2o2后于5~40℃优选25℃下继续搅拌20小时,析出黄绿色固体后,加水、抽滤;
优选地,所述步骤(2)在溶剂中进行,所述溶剂为水;
优选地,所述步骤(2)中需要加入还原剂,优选地,所述还原剂的加入量为不少于化合物(2-4)的1倍当量,优选1.5倍当量;优选地,所述还原剂选自连二亚硫酸钠、连二亚硫酸钾、硫酸亚铁、亚硫酸钠、亚硫酸氢钠中的一种或多种,优选连二亚硫酸钠;
优选地,所述步骤(2)包括以下步骤:依次加入水、化合物(2-4)后,加入还原剂,反应体系加热回流0.5~3小时,优选1小时,待反应体系由浑浊变澄清时进行冷却,析出白色固体后抽滤、真空干燥;
优选地,所述步骤(3)在溶剂中进行,所述溶剂选自二氯甲烷、氯仿、1,2-二氯乙烷中的一种或多种,优选为二氯甲烷;
优选地,所述步骤(3)在bf3·et2o/ac2o存在下进行;优选地,bf3·et2o的加入量为不少于化合物(2-5)的3.5倍当量,优选3.5当量;优选地,加入的化合物(2-5)、bf3·et2o与ac2o的质量之比为1:2~5:2~8,优选为1:2.9~3:4.7~5,最优选为1:3:5;
优选地,所述步骤(3)包括以下步骤:依次加入化合物(2-5)、溶剂、催化体系后搅拌加热回流1~5小时,优选3小时,待大量黄色固体析出时,冷却,抽滤。
又一方面,本发明还提供了式(ⅰ)所示化合物在合成灯盏花乙素苷元或灯盏花乙素化合物中的应用。
再一方面,本发明还提供了一种灯盏花乙素苷元的合成方法,所述方法为具有式(ⅰ)结构的化合物经步骤(1)氧化关环反应生成具有式(2-8)所示结构的化合物,对具有式(2-8)所示结构的化合物将步骤(2)进行脱甲基即得目标化合物,如式(1-2)所示:
其中,r如上所定义。
优选地,所述步骤(1)在溶剂中进行,所述溶剂为非质子极性溶剂,优选地,所述溶剂选自二甲基亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n,n-二乙基甲酰胺、乙二醇二甲醚中的一种或多种,优选二甲基亚砜。
优选地,所述步骤(1)中的氧化剂为i2;优选地,所述i2的加入量为化合物(2-7)的0.1~0.5倍当量,优选0.3倍当量。
优选地,所述步骤(1)的反应温度为80~120℃,优选100℃。
优选地,所述步骤(1)包含以下步骤:依次加入化合物(ⅰ)(例如化合物2-7)、dmso、氧化剂,升温到80~120℃,优选100℃,搅拌反应8~12小时,优选8小时,冷却,将反应体系慢慢倒入亚硫酸钠水溶液中,优选亚硫酸钠水溶液的浓度为0.01-0.1g/ml,优选0.05g/ml,搅拌0.5~2小时,优选1小时后、抽滤、真空干燥。
优选地,所述步骤(2)的脱甲基试剂为hbr/hoac、盐酸吡啶或bf3·et2o中的一种或多种,优选hbr/hoac;优选地,所述hbr为48%hbr;优选地,所述脱甲基试剂中hbr与hoac的体积用量比为3:8~8:3,优选1:1;优选地,48%hbr、hoac相对于每16g化合物(2-8)的用量值分别为30~80ml,优选为50ml。
优选地,所述步骤(2)的反应温度为100~130℃,优选128℃;优选地,所述反应时间为10~48小时,优选15小时。
优选地,所述步骤(2)还包括反应后冷却,将反应体系倒入冰水中,析出固体后抽滤、重结晶的步骤;优选地,所述重结晶溶剂选自甲醇、乙醇、丙醇、异丙醇、正丁醇、乙酸乙酯中的一种或多种,优选地,所述重结晶试剂为乙醇。
优选地,所述步骤(2)包括以下步骤:依次加入化合物(2-8)和脱甲基试剂,升温至100~130℃,优选128℃反应10~48小时,优选15小时后冷却,将反应体系倒入冰水中,析出固体后抽滤、重结晶。
此外,本发明还提供了一种灯盏花乙素的合成方法,所述方法经步骤(1)由式(ⅰ)所示结构经氧化关环、脱甲基反应制备得到式(1-2)所示结构的化合物,再经步骤(2)由式(1-2)所示结构的化合物经乙酰化、一步糖苷化反应、水解反应制备生成目标化合物,如式(1-1)所示:
其中,r如上所定义。
优选地,式(ⅰ)所示结构的化合物通过步骤(1)中的氧化关环反应生成如下式(2-8)所示结构的化合物:
其中,r如前所定义。
优选地,式(1-2)所示结构的化合物通过步骤(1)中的脱甲基反应生成式(1-2)所示结构的化合物:
优选地,所述氧化关环反应在溶剂中进行,所述溶剂为非质子极性溶剂,优选地,所述溶剂选自二甲基亚砜、n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、n,n-二乙基甲酰胺、乙二醇二甲醚中的一种或多种,优选二甲基亚砜;
优选地,所述所述氧化关环反应的氧化剂为i2;优选地,所述i2的加入量为化合物(ⅰ)的0.1~0.5倍当量,优选0.3倍当量;
优选地,所述氧化关环反应的反应温度为80~120℃,优选100℃;
优选地,所述氧化关环反应包含以下步骤:依次加入化合物(ⅰ)、dmso、氧化剂,升温到80~120℃,优选100℃,搅拌反应8~12小时,优选8小时,冷却,将反应体系慢慢倒入亚硫酸钠水溶液中,优选亚硫酸钠水溶液的浓度为0.01-0.1g/ml,优选0.05g/ml,搅拌0.5~2小时,优选1小时后、抽滤、真空干燥。
优选地,所述脱甲基反应的脱甲基试剂为hbr/hoac、盐酸吡啶或bf3·et2o中的一种或多种,优选hbr/hoac;优选地,所述hbr为48%hbr;优选地,所述脱甲基试剂中hbr与hoac的体积用量比为3:8~8:3,优选1:1;优选地,48%hbr、hoac相对于每16g化合物(2-8)的用量值分别为30~80ml,优选为50ml;
优选地,所述脱甲基反应的反应温度为100~130℃,优选128℃;优选地,所述反应时间为10~48小时,优选15小时;
优选地,所述反应完成后还包括冷却,将反应体系倒入冰水中,析出固体后抽滤、重结晶的步骤;优选地,所述重结晶溶剂选自甲醇、乙醇、丙醇、异丙醇、正丁醇、乙酸乙酯中的一种或多种,优选地,所述重结晶试剂为乙醇;
优选地,所述脱甲基反应包括以下步骤:依次加入化合物(2-8)和脱甲基试剂,升温至100~130℃,优选128℃反应10~48小时,优选15小时后冷却,将反应体系倒入冰水中,析出固体后抽滤、重结晶。
优选地,式(1-2)所示结构的化合物经步骤(2)中的乙酰化反应生成如下式(1-12)所示结构的化合物:
优选地,式(1-12)所示结构的化合物与式(1-15)所示结构的化合物经步骤(2)中的一步糖苷化反应生成如下式(1-16)所示结构的化合物:
优选地,式(1-16)所示结构的化合物经步骤(2)中的水解反应脱保护基生成式(1-1)所示结构的化合物。
优选地,所述乙酰化反应的乙酰化试剂为乙酸钠-乙酸酐或吡啶-乙酸酐,优选乙酸钠-乙酸酐;优选地,所述乙酸酐与乙酸钠的用量摩尔比为2~5:1,优选为2:1;优选地,所述乙酸钠的加入量为化合物(1-2)的4~8倍当量,优选5倍当量;优选地,所述化合物(1-2)与乙酸酐、乙酸钠的摩尔用量比为1:10~20:4~8,优选为1:10:5;
优选地,所述乙酰化反应的反应温度为60~100℃,优选80℃;优选地,所述反应时间为8~10小时,优选10小时;
优选地,所述反应完成后,还包括将反应体系倒入冰水中,抽滤、重结晶的步骤;优选地,所述重结晶试剂为乙酸乙酯/甲醇;
优选地,所述乙酰化反应包括以下步骤:依次加入化合物(1-2)、乙酸酐、乙酸钠,将反应升温到60~100℃,优选80℃反应8~10小时,优选10小时,反应结束后,将反应体系倒入冰水中,抽滤、重结晶。
优选地,在所述一步糖苷化反应中,所述化合物(1-15)分1~5次加入到反应中;
优选地,化合物(1-15)的首次加入量为化合物(1-12)的2倍当量;
优选地,化合物(1-15)分3次加入到反应中,优选化合物(1-15)的第3次的加入量不少于第2次的加入量;优选地,第2次的加入量为化合物(1-12)的0.7倍当量;优选地,第3次的加入量为化合物(1-12)的0.7~1倍当量,优选0.7倍当量;
优选地,每次加入化合物(1-15)后反应12小时;
优选地,所述一步糖苷化反应在溶剂中进行,所述溶剂为ch3cn;
优选地,所述一步糖苷化反应在催化剂存在下进行,所述催化剂选自四丁基溴化铵、四丁基碘化铵、四丁基硫酸氢铵、5-氮杂[4.4]壬烷溴化物、5-氮杂[4.4]壬烷硫酸氢化物、聚乙二醇中的一种或多种,更优选为四丁基溴化铵或四丁基碘化铵,最优选为四丁基溴化铵;优选地,所述催化剂的加入量为化合物(1-12)的0.8~1.5倍当量,优选为1.2倍当量;
优选地,所述一步糖苷化反应在碱存在下进行,所述碱选自na2co3、nahco3、koh、khco3、k2co3中的一种或多种;优选地,所述碱为k2co3;优选地,所述碱的加入量为化合物(1-12)的2~5倍当量,优选3倍当量;
优选地,所述一步糖苷化反应的反应温度为30~45℃,优选为40℃;
优选地,所述一步糖苷化的反应中可以加入选自na2so4、mgso4、caso4中的一种或多种盐,优选caso4;优选地,所述caso4的加入量为化合物(1-12)的2~4倍当量,优选3倍当量;
优选地,所述反应结束后,还包括抽滤,洗涤、萃取水相优选萃取三次后合并有机相、干燥、浓缩、重结晶的步骤;优选地,所述萃取试剂选自乙酸乙酯、三氯甲烷、1,2-二氯乙烷或二氯甲烷中的一种或多种。
优选地,所述水解反应在溶剂存在下进行,所述溶剂为丙酮和/或水;
优选地,所述水解反应在碱存在下进行,所述碱选自naoh、nahco3、koh溶液中的一种或多种,优选地,所述碱溶液的浓度为1~3mol/l;
优选地,在水解反应中,所述碱溶液在冰浴下缓慢滴加,滴加完成后优选在冰浴下搅拌30分钟至1小时,优选1小时;
优选地,所述反应完成后,还包括调节ph、抽滤、重结晶的步骤;优选地,所述ph值调节至3~4;优选地,所述重结晶试剂选自乙醇、甲醇、异丙醇、丙酮、水中的一种或多种。
优选地,化合物(1-1)的合成包括以下步骤:
a)依次加入投料量的化合物(ⅰ)(例如化合物2-7)、环合反应溶剂、氧化剂,升温到80~120℃,优选100℃,搅拌反应8~12小时,优选8小时,冷却,将反应体系慢慢倒入亚硫酸钠水溶液中,优选亚硫酸钠水溶液的浓度为0.01-0.1g/ml,优选0.05g/ml,搅拌0.5~2小时,优选1小时后、抽滤、真空干燥后得到化合物(2-8);
b)依次加入投料量的化合物(2-8)(例如化合物2-8’,即r为乙酰基)、脱甲基试剂,升温至100~130℃,优选128℃反应10~48小时,优选15小时后冷却,将反应体系倒入冰水中,析出固体后抽滤、重结晶减压干燥后得到化合物(1-2);
c)依次加入投料量的化合物(1-2)、乙酰化试剂,将反应升温到60~100℃,优选80℃反应8~10小时,优选10小时,反应结束后,将反应体系倒入冰水中,进行抽滤、重结晶、干燥得到化合物(1-12);
d)依次加入投料量的化合物(1-12)、催化剂、碱、乙腈、分1~5次加入化合物(1-15),在固-液两相条件下于30~45℃,优选40℃下快速搅拌5~12小时,优选12小时,反应结束后,过滤,用溶剂洗至无色,蒸出溶剂,向剩余物中加入水,用萃取溶剂萃取3次,合并萃取液、干燥,浓缩、重结晶得到化合物(1-16);优选地,每次加入化合物(1-15)后搅拌12小时;
e)在氮气保护下,依次加入投料量的化合物(1-16)和反应溶剂,冰浴条件下缓慢滴加碱溶液,搅拌0.5~2小时,优选1小时,缓缓滴加酸液调节ph至3~4,继续搅拌0.5~2小时,优选30分钟、抽滤、重结晶得到化合物(1-1)。
与现有技术相比,本发明具有以下有益效果:
(1)关键中间体式(ⅰ)化合物的合成,以价格低廉、无毒的氨基酸作为催化剂,室温反应,收率高,后处理简单,便宜易得。
(2)灯盏花乙素苷元即化合物(1-2)的合成以化合物(ⅰ)为起始原料经氧化关环反应以及脱甲基反应的合成工艺,总收率最高可达80.4%。
(3)灯盏花乙素即化合物(1-1)的全合成以化合物(ⅰ)为起始原料,经5步反应完成,每步反应的收率均在80%以上,总收率高,且具有合成路线简洁、反应条件温和、操作简单(无需柱层析)、环境污染小、收率高、成本低等优点。
(4)与传统方案相比,在化合物(1-1)的合成中,化合物(1-12)通过选择性糖基化一步反应生成化合物(1-16),而传统方案中化合物(1-12)到(1-16)的合成需要三步即化合物(1-12)的7位选择性置换上苄基(1-13)、催化氢化脱苄基(1-14)和o-糖基化(1-16),这样就大大缩短了反应路线,节约了反应成本;此外,关键中间体(1-16)的合成采取相转移催化(ptc)一步糖苷化方法,也避免了传统方法中的保护和脱保护步骤和昂贵试剂的使用。
(5)与现有技术相比,比如中国专利申请cn201210114758.9与cn201210114894.8,由化合物(1-12)制备关键中间体(1-16)的方法,以乙腈为溶剂,采取多次定量的方式将溴糖(1-15)分批加入反应体系中,大大降低了试剂的使用量,反应收率也得到提升;此外,在后处理过程中,首先通过过滤除去固体碱,然后再萃取的方法,不仅使后处理更方便,而且,固体碱可以回收利用,达到了减少污染,降低成本的目的。
附图说明
以下附图用以辅助说明本发明的实施方案,其中:
图1为实施例4制备得到的式(2-7)所示化合物的1hnmr图谱;
图2为实施例4制备得到的式(2-7)所示化合物的13cnmr图谱;
图3为实施例5制备得到的式(2-8’)所示化合物的1hnmr图谱;
图4为实施例5制备得到的式(2-8’)所示化合物的13cnmr图谱;
图5为实施例4探索中得到的式(2-12)所示化合物的1hnmr图谱;
图6为实施例4探索中得到的式(2-12)所示化合物的13cnmr图谱;
图7为实施例6制备得到的式(1-2)所示化合物的1hnmr图谱;
图8为实施例6制备得到的式(1-2)所示化合物的13cnmr图谱;
图9为实施例7制备得到的式(1-12)所示化合物的1hnmr图谱;
图10为实施例7制备得到的式(1-12)所示化合物的13cnmr图谱;
图11为实施例9制备得到的式(1-15)所示化合物的1hnmr图谱;
图12为实施例9制备得到的式(1-15)所示化合物的13cnmr图谱;
图13为实施例10制备得到的式(1-16)所示化合物的1hnmr图谱;
图14为实施例10制备得到的式(1-16)所示化合物的13cnmr图谱;
图15为实施例8制备得到的式(1-19)所示化合物的1hnmr图谱;
图16为实施例8制备得到的式(1-19)所示化合物的13cnmr图谱;
图17为实施例11制备得到的式(1-1)所示化合物的1hnmr图谱;
图18为实施例11制备得到的式(1-1)所示化合物的13cnmr图谱;
图19为实施例11制备得到的灯盏花乙素合成品即式(1-1)所示化合物与灯盏花乙素标准品的hplc对比图,其中,a表示灯盏花乙素标准品,b表示灯盏花乙素合成品即实施例11制备得到的式(1-1)所示化合物。
具体实施方式
下面结合具体实施例对本发明进行进一步阐述。应当理解,本发明给出的实施例仅用于说明本发明,并不用于限制本发明的范围。
除非另行定义,文中所使用的所有专业与科学用语与本领域熟练人员所熟悉的意义相同,文中所述的较佳实施方法与材料仅作示范之用。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售可购得的化学纯或分析纯试剂,可经处理或不经处理直接使用。
仪器与设备
tlc:安徽良臣硅源材料厂薄层层析硅胶板gf254。
柱层析:青岛海洋化工厂硅胶200-300目。
熔点仪:x-4型显微熔点仪,温度计未经校正。
核磁共振仪:brukeraviii-400(400mhz)。
高分辨质谱:brukerapexiv质谱仪。
实施例1
2,6-二甲氧基苯醌(2-4)的合成
制备例1:
500ml锥形瓶中,将k3fe(cn)6(2.0g,7.0mmol)溶解于水(10.0g)中,向其中加入丙酮(100g)和1,3,5-三甲氧基苯(2-3)(16.4g,100mmol),25℃搅拌均匀后,向其中加入h2o2(30%,34g,300mmol),25℃下搅拌20h,析出黄绿色固体,向上述反应体系加入水(200ml),抽滤得到黄色固体13.8g,收率82%,m.p.252-255℃。
制备例2:
500ml锥形瓶中,将k3fe(cn)6(2.0g,7.0mmol)溶解于水(10.0g)中,向其中加乙腈(100ml)和1,3,5-三甲氧基苯(2-3)(16.4g,100mmol),5℃搅拌均匀后,向其中加入h2o2(30%,34g,300mmol),25℃下搅拌20h,析出黄绿色固体,向上述反应体系加入水(200ml),抽滤得到黄色固体12.4g,收率74%,m.p.252-255℃。
制备例3:
500ml锥形瓶中,将k3fe(cn)6(2.0g,7.0mmol)溶解于水(10.0g)中,向其中加水(100ml)和1,3,5-三甲氧基苯(2-3)(16.4g,100mmol),40℃搅拌均匀后,向其中加入h2o2(30%,34g,300mmol),40℃下搅拌20h,析出黄绿色固体,向上述反应体系加入水(100ml),抽滤得到黄色固体11.6g,收率69%,m.p.252-255℃。
制备例4:
500ml锥形瓶中,将k3fe(cn)6(2.0g,7.0mmol)溶解于水(10.0g)中,向其中加入丙酮(100g)和1,3,5-三甲氧基苯(2-3)(16.4g,100mmol),5℃搅拌均匀后,向其中加入h2o2(30%,34g,300mmol),5℃下搅拌20h,析出黄绿色固体,向上述反应体系加入水(200ml),抽滤得到黄色固体10.2g,收率61%,m.p.252-255℃
制备例5:
500ml锥形瓶中,将k3fe(cn)6(2.0g,7.0mmol)溶解于水(10.0g)中,向其中加入丙酮(100g)和1,3,5-三甲氧基苯(2-3)(16.4g,100mmol),30℃搅拌均匀后,向其中加入h2o2(30%,68g,600mmol),30℃下搅拌20h,析出黄绿色固体,向上述反应体系加入水(200ml),抽滤得到黄色固体13.3g,收率79%,m.p.252-255℃。
放大实验:按制备例1的步骤进行三批放大实验,收率稳定,如表1所示。
表1化合物(2-4)放大工艺实验结果
实施例2
2,6-二甲氧基-4-羟基苯酚(2-5)的合成
制备例1:
250ml单口瓶中,依次加入水(100ml)、2,6-二甲氧基苯醌(2-4,实施例1制备所得)(13.3g,80mmol),再向其中加入连二亚硫酸钠na2s2o4(20.1g,120mmol),体系加热回流1h(体系由混浊变澄清),冷却,析出大量白色固体,抽滤,真空干燥得产品11.7g,收率86%,m.p.160-162℃。
制备例2
250ml单口瓶中,依次加入水(100ml)、2,6-二甲氧基苯醌(2-4,实施例1制备所得)(13.3g,80mmol),再向其中加入硫酸亚铁feso4(18.2g,120mmol),体系加热回流1h(体系由混浊变澄清),冷却,析出大量白色固体,抽滤,真空干燥得产品9.3g,收率68%,m.p.160-162℃。
制备例3:
250ml单口瓶中,依次加入水(100ml)、2,6-二甲氧基苯醌(2-4,实施例1制备所得)(13.3g,80mmol),再向其中加入亚硫酸钠na2so3(17.1g,120mmol),体系加热回流1h(体系由混浊变澄清),冷却,析出大量白色固体,抽滤,真空干燥得产品8.5g,收率63%,m.p.160-162℃。
制备例4:
250ml单口瓶中,依次加入水(100ml)、2,6-二甲氧基苯醌(2-4,实施例1制备所得)(13.3g,80mmol),再向其中加入连二亚硫酸钠na2s2o4(20.1g,120mmol),体系加热回流0.5h(体系由混浊变澄清),冷却,析出大量白色固体,抽滤,真空干燥得产品9.0g,收率66%,m.p.160-162℃。
制备例5:
250ml单口瓶中,依次加入水(100ml)、2,6-二甲氧基苯醌(2-4,实施例1制备所得)(13.3g,80mmol),再向其中加入连二亚硫酸钾k2s2o4(20.1g,120mmol),体系加热回流3h(体系由混浊变澄清),冷却,析出大量白色固体,抽滤,真空干燥得产品11.0g,收率81%,m.p.160-162℃。
放大实验:按制备例1的步骤进行三批放大实验,收率稳定,如表2所示。
表2化合物(2-5)放大工艺实验结果
实施例3
2-羟基-4,6-二甲氧基-5-乙酰氧基苯乙酮络合物(2-6’)的合成
制备例1:
于250ml单口瓶中依次加入2,6-二甲氧基-4-羟基苯酚(2-5,由实施例2制备所得)(11.3g,66.5mmol)、二氯甲烷(80ml)、乙酸酐(54g)、bf3·et2o(33g,232mmol),搅拌加热回流3h,此时有大量黄色固体析出,冷却,抽滤,得黄色固体17.5g,收率87%,m.p.207-209℃。
制备例2:
于250ml单口瓶中依次加入2,6-二甲氧基-4-羟基苯酚(2-5,由实施例2制备所得)(11.3g,66.5mmol)、三氯甲烷(80ml)、乙酸酐(54g)、bf3·et2o(33g,232mmol),搅拌加热回流3h,此时有大量黄色固体析出,冷却,抽滤,得黄色固体16.7g,收率83%,m.p.207-209℃。
制备例3:
于250ml单口瓶中依次加入2,6-二甲氧基-4-羟基苯酚(2-5,由实施例2制备所得)(11.3g,66.5mmol)、1.2-二氯乙烷(80ml)、乙酸酐(54g)、bf3·et2o(33g,232mmol),搅拌加热回流3h,此时有大量黄色固体析出,冷却,抽滤,得黄色固体16.0g,收率80%,m.p.207-209℃。
制备例4:
于250ml单口瓶中依次加入2,6-二甲氧基-4-羟基苯酚(2-5,由实施例2制备所得)(11.3g,66.5mmol)、二氯甲烷(80ml)、乙酸酐(54g)、bf3·et2o(22g,232mmol),搅拌加热回流1h,此时有大量黄色固体析出,冷却,抽滤,得黄色固体13.5g,收率67%,m.p.207-209℃。
制备例5:
于250ml单口瓶中依次加入2,6-二甲氧基-4-羟基苯酚(2-5,由实施例2制备所得)(11.3g,66.5mmol)、二氯甲烷(80ml)、乙酸酐(54g)、bf3·et2o(56g,394mmol),搅拌加热回流3h,此时有大量黄色固体析出,冷却,抽滤,得黄色固体16.3g,收率81%,m.p.207-209℃。
制备例6:
于250ml单口瓶中依次加入2,6-二甲氧基-4-羟基苯酚(2-5,由实施例2制备所得)(11.3g,66.5mmol)、二氯甲烷(80ml)、乙酸酐(23g)、bf3·et2o(33g,232mmol),搅拌加热回流3h,此时有大量黄色固体析出,冷却,抽滤,得黄色固体13.2g,收率66%,m.p.207-209℃
制备例7:
于250ml单口瓶中依次加入2,6-二甲氧基-4-羟基苯酚(2-5,由实施例2制备所得)(11.3g,66.5mmol)、二氯甲烷(80ml)、乙酸酐(33g)、bf3·et2o(33g,232mmol),搅拌加热回流3h,此时有大量黄色固体析出,冷却,抽滤,得黄色固体15.2g,收率76%,m.p.207-209℃
放大实验:按制备例1所述步骤进行三批放大实验,收率稳定,如表3所示。
表3化合物(2-6’)放大工艺实验结果
制备例8:根据制备例1的方法,制备得到2-羟基-4,6-二甲氧基-5-丙酰氧基苯乙酮络合物。
制备例9:根据制备例1的方法,制备得到2-羟基-4,6-二甲氧基-5-正丁酰氧基苯乙酮络合物。
制备例10:根据制备例1的方法,制备得到2-羟基-4,6-二甲氧基-5-异丁酰氧基苯乙酮络合物。
制备例:11:根据制备例1的方法,制备得到2-羟基-4,6-二甲氧基-5-苯甲酰氧基苯乙酮络合物。
实施例4
查尔酮(2-7)的合成
制备例1:
500ml单口瓶中,依次加入脯氨酸(6.64g,58mmol)、对甲氧基苯甲醛(11.8g,87mmol)、甲醇(150ml)、三乙胺(11.7g,116mmol),25℃搅拌1h,然后向该体系加入络合物(2-6’)(17.5g,58mmol,由实施例3制备所得),25℃搅拌20h,析出大量黄色固体。向该体系加入水(300ml),抽滤,得到黄色固体20.5g,收率95%,m.p.122-124℃。
化合物式(2-7)的氢谱、碳谱如附图1、2所示:
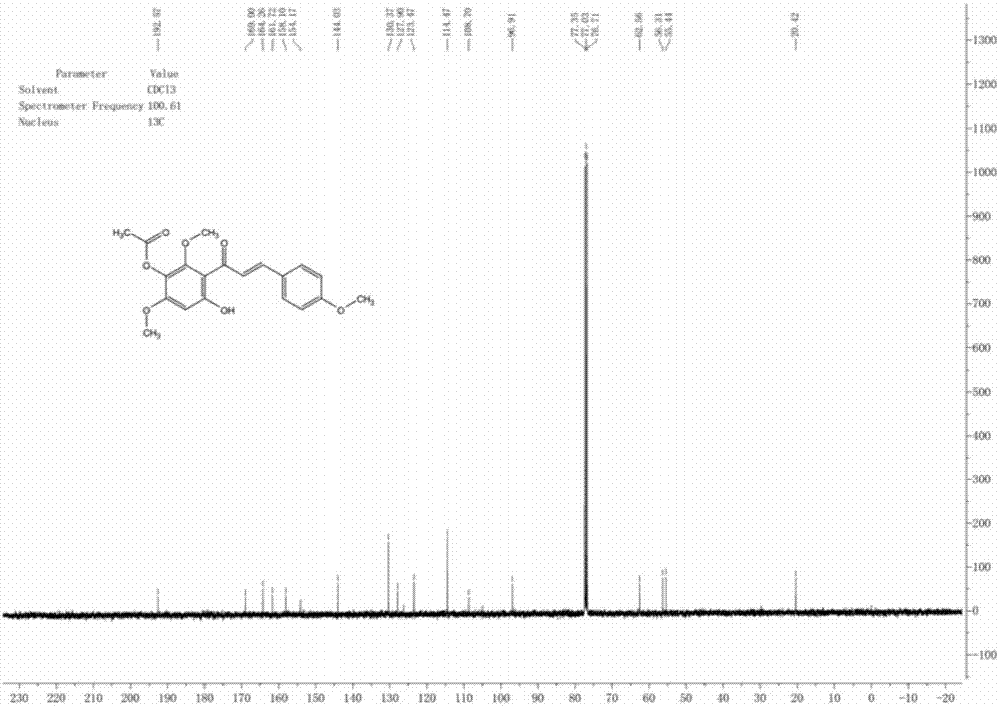
1hnmr(400mhz,cdcl3)δ:13.73(s,1h),7.86(q,j=14.9hz,2h),7.62(d,j=8.8hz,2h),6.95(d,j=8.8hz,2h),6.37(s,1h),3.89(s,3h),3.88(s,3h),3.82(s,3h),2.39(s,3h);13cnmr(100mhz,cdcl3)δ:192.6,169.0,164.3,161.8,158.0,154.2,144.0,130.4,127.9,123.5,114.5,108.7,96.9,62.6,56.3,55.4,20.4。
制备例2:
500ml单口瓶中,依次加入苯丙氨酸(9.58g,58mmol)、对甲氧基苯甲醛(15.8g,116mmol)、甲苯(150ml)、k2co3(16.03g,116mmol),25℃搅拌1h,然后向该体系加入络合物(2-6’)(17.5g,58mmol,由实施例3制备所得),25℃搅拌20h,析出大量黄色固体。向该体系加入水(300ml),抽滤,得到黄色固体18.5g,收率86%,m.p.122-124℃。
制备例3:
500ml单口瓶中,依次加入甘氨酸(4.35g,58mmol)、对甲氧基苯甲醛(15.8g,116mmol)、乙醇(150ml)、吡啶(13.76g,174mmol),25℃搅拌1h,然后向该体系加入络合物(2-6’)(17.5g,58mmol,由实施例3制备所得),25℃搅拌20h,析出大量黄色固体。向该体系加入水(300ml),抽滤,得到黄色固体17.0g,收率79%,m.p.122-124℃。
制备例4:根据制备例1的方法,制备得到4-羟基-2,6-二甲氧基-3-(3-(4-甲氧基苯基)丙烯酰基)丙酸苯酯。
制备例5:根据制备例1的方法,制备得到4-羟基-2,6-二甲氧基-3-(3-(4-甲氧基苯基)丙烯酰基)正丁酸苯酯。
制备例6:根据制备例1的方法,制备得到4-羟基-2,6-二甲氧基-3-(3-(4-甲氧基苯基)丙烯酰基)异丁酸苯酯。
制备例7:根据制备例1的方法,制备得到4-羟基-2,6-二甲氧基-3-(3-(4-甲氧基苯基)丙烯酰基)苯甲酸苯酯。
筛选试验:
1、反应条件筛选:
表4化合物(2-7)的合成一a
备注:表4中出现的上标a~d表示不同的反应条件:
a反应条件:化合物(2-6’)(0.2mmol,1当量),化合物(2-2)(1.2当量),酸或碱,溶剂(5ml),反应10小时;b分离产率;cnr=未反应;d将a中化合物(2-2)的用量调整为(1.5当量)。
2、催化条件筛选:
表5化合物查尔酮(2-7)的合成二a
备注:表5中出现的上标a~k表示不同的反应条件,其中a为反应条件,b~k为在a标示的反应条件的基础上进行对应项的替换或增加;
a反应条件:化合物(2-6’)(0.2mmol,1当量),化合物(2-2)(1.2当量),氨基酸,碱,溶剂(5ml),反应温度(r.t.室温下),反应20小时;
b分离产率;cnr=未反应;d未检测到;
e将a中反应时间变化为48小时;
f将a中反应温度变化为65℃;
g将a中化合物(2-6’)的用量调整为(2.0当量);
h将a中化合物(2-2)的用量调整为(3.0当量);
i反应条件:将a中反应条件调整为:化合物(2-2),三乙胺,l-脯氨酸溶解于ch3oh(5ml)中1小时,然后加入化合物(2-6’)反应20小时;
j化合物(2-2)(1.5当量);k化合物(2-2)(1.2当量)。
化合物(2-12)是当延长反应时间或提高反应温度时,发现的adol产品,其结构及结构鉴定数据如下所示:
化合物式(2-12)为淡黄色固体,m.p.131-133℃,其氢谱、碳谱如附图5、6所示:
1hnmr(400mhz,cdcl3)δ:7.40(d,j=8.4hz,2h),6.97(d,j=8.4hz,2h),6.40(s,1h),5.39(dd,j=2.4hz,j=9.2hz,1h),3.90(s,3h),3.86-3.84(m,2h),3.09-3.01(m,1h),2.80-2.75(m,1h),2.36(s,3h);13cnmr(100mhz,cdcl3)δ:189.0,169.0,161.8,160.1,157.8,153.4,130.5,128.3,127.8,114.2,109.0,96.5,79.2,62.0,56.3,55.4,45.2,20.4.
放大实验:按制备例1所述步骤进行了三批放大实验,收率稳定,如表6所示。
表6化合物(2-7)放大工艺实验结果
实施例5
5,7-二甲氧基-6-乙酰氧基-4-(4-甲氧基苯基)黄酮(2-8’)的合成
制备例1:
100ml单口瓶中加入化合物(2-7)(20.5g,55mmol,由实施例4制备所得)、dmso(40ml)、碘(4.2g,16.5mmol),升温到100℃,搅拌反应8h。冷却,将体系慢慢倒入200ml含有10g亚硫酸钠水溶液中,搅拌1h,抽滤,滤饼真空干燥得到产品(2-8’)20.0g,收率98%,m.p.181-183℃。
化合物式(2-8’)的氢谱、碳谱谱图如附图3、4所示:
1hnmr(400mhz,cdcl3)δ:7.83(d,j=6.8hz,2h),7.02(d,j=6.8hz,2h),6.85(s,1h),6.60(s,1h),3.95(s,6h),3.90(s,3h),2.39(s,3h);13cnmr(100mhz,cdcl3)δ:176.7,168.8,162.2,161.4,156.3,156.1,152.0,131.2,127.7,123.7,114.4,112.8,107.1,96.4,62.5,56.4,55.5,20.4.
制备例2:
100ml单口瓶中加入化合物(2-7)(20.5g,55mmol,由实施例4制备所得)、dmf(40ml)、碘(1.4g,5.5mmol),升温到80度,搅拌反应8h。冷却,将体系慢慢倒入200ml含有10g亚硫酸钠水溶液中,搅拌1h,抽滤,滤饼真空干燥得到产品(2-8’)16.5g,收率81%,m.p.180-183℃。
制备例3:
100ml单口瓶中加入化合物(2-7)(20.5g,55mmol,由实施例4制备所得)、乙二醇二甲醚(40ml)、碘(4.2g,16.5mmol),升温到120度,搅拌反应8h。冷却,将体系慢慢倒入200ml含有10g亚硫酸钠水溶液中,搅拌1h,抽滤,滤饼真空干燥得到产品(2-8’)15.0g,收率73.6%,m.p.181-183℃。
制备例4:根据制备例1的方法,制备得到5,7-二甲氧基-6-丙酰氧基-4-(4-甲氧基苯基)黄酮。
制备例5:根据制备例1的方法,制备得到5,7-二甲氧基-6-正丁酰氧基-4-(4-甲氧基苯基)黄酮。
制备例6:根据制备例1的方法,制备得到5,7-二甲氧基-6-异丁酰氧基-4-(4-甲氧基苯基)黄酮。
制备例7:根据制备例1的方法,制备得到5,7-二甲氧基-6-苯甲酰氧基-4-(4-甲氧基苯基)黄酮。
筛选试验:
碘的用量和反应温度的筛选试验:
表7化合物(2-8’)合成与优化a
备注:上标a~d标示反应条件:
a反应条件:化合物(2-7)(0.3mol),i2,dmso(5ml),反应温度100℃,反应时间8h;b分离产率;cnr=未反应;d80℃。
放大实验:按制备例1的步骤进行了三批放大实验,收率稳定,如表8所示。
表8化合物(2-8’)放大工艺实验结果
实施例6
灯盏花乙素苷元(1-2)的合成
制备例1:
250ml单口瓶中依次加入化合物(2-8’)(16g,43.2mmol,由实施例5制备所得)、醋酸(50ml)、48%hbr(50ml),反应升温到128℃反应15h。冷却后,将反应体系倒入冰水(300ml),析出大量固体,抽滤,滤饼用乙醇重结晶,得到淡黄色固体10.2g,收率82%,m.p.>250℃。
化合物式(1-2)的氢谱、碳谱如附图7、8所示:
1hnmr(400mhz,dmso-d6)δ:12.81(s,1h),10.49(s,1h),10.33(s,1h),8.75(s,1h),7.91(d,j=8.4hz,2h),6.92(d,j=8.4hz,2h),6.75(s,1h),6.59(s,1h);13cnmr(100mhz,dmso-d6)δ:182.5,164.0,161.5,153.8,150.1,147.5,129.6,128.8,121.9,116.4,104.4,102.7,94.3.
制备例2:
250ml单口瓶中依次加入化合物(2-8’)(16g,43.2mmol,由实施例1制备所得)、盐酸吡啶(30ml),反应升温到128℃反应48h。冷却后,将反应体系倒入冰水(300ml),析出大量固体,抽滤,滤饼用甲醇重结晶,得到淡黄色固体8.53g,收率69%,m.p.>250℃。
制备例3:
250ml单口瓶中依次加入化合物(2-8’)(16g,43.2mmol,由实施例1制备所得)、醋酸(50ml)、48%hbr(30ml),反应升温到100℃反应40h。冷却后,将反应体系倒入冰水(300ml),析出大量固体,抽滤,滤饼用异丙醇重结晶,得到淡黄色固体8.85g,收率72%,m.p.>250℃。
制备例4:
250ml单口瓶中依次加入化合物(2-8’)(16g,43.2mmol,由实施例1制备所得)、醋酸(80ml)、48%hbr(30ml),反应升温到125℃反应25h。冷却后,将反应体系倒入冰水(300ml),析出大量固体,抽滤,滤饼用乙酸乙酯重结晶,得到淡黄色固体8.30g,收率67%,m.p.>250℃。
制备例5:
250ml单口瓶中依次加入化合物(2-8’)(16g,43.2mmol,由实施例1制备所得)、醋酸(50ml)、48%hbr(80ml),反应升温到130℃反应25h。冷却后,将反应体系倒入冰水(300ml),析出大量固体,抽滤,滤饼用乙醇重结晶,得到淡黄色固体9.30g,收率75%,m.p.>250℃。
放大实验:按制备例1所述步骤进行了三批放大实验,收率稳定,如表10所示。
表10灯盏花乙素苷元(1-2)放大工艺实验结果
实施例7
5,6,7,4'-四乙酰氧基黄酮(1-12)的合成
制备例1:
250ml单口瓶中依次加入化合物(1-2)(8.0g,28.0mmol,由实施例6制备所得)、乙酸酐(28.3g,280mmol)、乙酸钠(19.05g,140mmol),反应升温到80℃反应10h。反应结束后,体系倒入冰水中(150ml),抽滤,滤饼用乙酸乙酯/甲醇重结晶得到化合物(1-12),质量11.4g,收率90%,m.p.251-253℃。
化合物式(1-12)的氢谱、碳谱如附图9、10所示:
1hnmr(400mhz,cdcl3)δ:7.89(d,j=8.8hz,2h),7.50(s,1h),7.27(d,j=8.8hz,2h),6.63(s,1h),2.46(s,3h),2.37(s,3h),2.36(s,6h);13cnmr(100mhz,cdcl3)δ:176.1,168.9,168.3,167.2,167.0,161.9,154.2,153.4,146.9,142.2,132.8,128.5,127.6,122.4,115.5,110.3,108.2,21.4,20.8,20.1,19.1.
制备例2:
250ml单口瓶中依次加入化合物(1-2)(8.0g,28.0mmol,由实施例6制备所得)、乙酸酐(57.2g,560mmol)、乙酸钠(30.5g,224mmol),反应升温到80℃反应10h。反应结束后,体系倒入冰水中(150ml),抽滤,滤饼用乙酸乙酯/甲醇重结晶得到化合物(1-12),质量8.4g,收率66%,m.p.251-253℃。
制备例3:
250ml单口瓶中依次加入化合物(1-2)(8.0g,28.0mmol,由实施例6制备所得)、乙酸酐(428.8.2g,420mmol)、乙酸钠(15.2g,112mmol),反应升温到100℃反应8h。反应结束后,体系倒入冰水中(150ml),抽滤,滤饼用乙酸乙酯/甲醇重结晶得到化合物(1-12),质量11.2g,收率88%,m.p.251-253℃。
制备例4:
250ml单口瓶中依次加入化合物(1-2)(8.0g,28.0mmol,由实施例6制备所得)、乙酸酐(28.3g,280mmol)、吡啶(11.1g,140mmol),反应升温到60℃反应10h。反应结束后,体系倒入冰水中(150ml),抽滤,滤饼用乙酸乙酯/甲醇重结晶得到化合物(1-12),质量8.8g,收率69%,m.p.251-253℃。
制备例5:
250ml单口瓶中依次加入化合物(1-2)(8.0g,28.0mmol,由实施例6制备所得)、乙酸酐(57.2g,560mmol)、吡啶(8.9g,112mmol),反应升温到100℃反应9h。反应结束后,体系倒入冰水中(150ml),抽滤,滤饼用乙酸乙酯/甲醇重结晶得到化合物(1-12),质量10.8g,收率85%,m.p.251-253℃。
放大实验:按制备例1所述步骤进行了三批放大实验,收率稳定,如表11所示。
表11化合物(1-12)放大工艺实验结果
实施例8
四-o-乙酰基-β-d-葡萄糖醛酸甲酯(1-19)的合成
250ml单口瓶中加入甲醇(100ml)、氢氧化钠(0.6g),搅拌溶解后加入17.6g(0.1mol)葡醛酸内酯(1-17),室温搅拌5h。减压蒸出全部甲醇,得黄色糖浆状粘稠物(1-18),直接进行下一步实验。
向上述浓缩的体系中加入乙酸酐(80ml),冰浴下慢慢加入高氯酸(0.8ml),加毕后,保持冰浴反应5h,有大量白色固体析出。抽滤得到部分化合物(1-19);向母液中加入冰水(250ml),置冰箱过夜,抽滤,得到另外部分化合物(1-19)。将得到的化合物(1-19)合并,用乙醇洗涤,抽滤得到化合物(1-19)共21.4g,收率57%,m.p.175-177℃。
化合物式(1-19)的氢谱、碳谱如附图15、16所示:
1hnmr(400mhz,cdcl3)δ:5.78(d,j=8.0hz,1h),5.34-5.23(m,2h),5.15(t,j=8.2hz,1h),4.19(d,j=9.2hz,1h),3.76(s,3h),2.13(s,3h),2.09-2.01(m,9h);13cnmr(100mhz,cdcl3)δ:169.9,169.4,169.2,168.8,166.8,91.4,73.0,71.8,70.2,68.9,53.0,20.8,20.5,20.5,20.4.
实施例9
三-o-乙酰基-α-d-葡萄糖醛酸甲酯(1-15)的合成
冰浴下,向100ml装有化合物(1-19)(8.0g,由实施例8制备所得)的单口瓶中加入33%氢溴酸-冰醋酸(30ml),保持冰浴反应1.5h,然后室温搅拌过夜。反应结束后,体系用饱和nahco3溶液中和至无气泡产生,二氯甲烷萃取体系两次,有机层用无水硫酸钠干燥,真空浓缩得浅黄色糖浆状粘稠物,加入20ml乙醚将其溶解,放入冰箱过夜,抽滤,得白色固体6.90g,收率82%,m.p.103-105℃。
化合物式(1-15)的氢谱、碳谱如附图11、12所示:
1hnmr(400mhz,cdcl3)δ:6.65(d,j=4.0hz,1h),5.62(t,j=9.6hz,1h),5.25(t,j=10.0hz,1h),4.87(dd,j=10.0,4.4hz,1h),4.59(d,j=10.4hz,1h),3.77(s,3h),2.11(s,3h),2.07(s,3h),2.06(s,3h);13cnmr(100mhz,cdcl3)δ:166.7,166.6,169.4,166.7,85.3,72.0,70.2,69.3,68.4,53.1,20.6,20.4.
实施例10
5,6,4'-三乙酰氧基黄酮-7-o-(2,3,4-三乙酰氧基-β-d-葡萄糖醛酸甲酯)(1-16)的合成
制备例1:
单口瓶中依次加入化合物(1-12)(8.0g,17.6mmol,由实施例7制备所得)、溴糖(1-15,由实施例9制备得到)(13.9g,35.2mmol)、四丁基溴化铵(即tbab)(6.83g,21.1mmol)、碳酸钾(7.2g,52.8mmol)、乙腈(50ml),40℃搅拌12h,再向体系加入溴糖(2.75g,7mmol)搅拌12h后,再加入溴糖(2.75g,7mmol)继续搅拌12h。反应结束后,过滤回收反应体系中的固体碱。向体系加入100ml二氯甲烷,抽滤,用二氯甲烷洗涤滤饼至无色,加入50ml水,水相用二氯甲烷萃取三次,合并有机相,硫酸钠干燥,浓缩得到紫褐色产品,用乙醇重结晶,析出白色固体,抽滤得到白色固体12.0g,收率90%,m.p.>250℃。
化合物式(1-16)的氢谱、碳谱如附图13、14所示:
1hnmr(400mhz,cdcl3)δ:7.87(d,j=8.4hz,1h),7.26(d,j=8.4hz,1h),7.06(s,1h),6.58(s,1h),5.38-5.29(m,4h),4.39(d,j=8.8hz,1h),3.78(s,3h),2.43(s,3h),2.36(s,3h),2.31(s,3h),2.09-2.05(m,9h);13cnmr(100mhz,cdcl3)δ:175.9,169.8,169.4,169.3,168.9,168.5,167.9,166.5,161.7,155.1,153.3,152.6,142.3,130.8,128.6,127.6,122.4,113.1,108.3,101.1,98.2,73.0,71.3,70.0,69.0,53.2,21.1,20.8,20.5,20.4,20.0.
制备例2:
单口瓶中依次加入化合物(1-12)(8.0g,17.6mmol,由实施例7制备所得)、溴糖(1-15,由实施例9制备得到)(13.9g,35.2mmol)、四丁基碘化铵(7.8g,21.1mmol)、氢氧化钾(2.9g,52.8mmol)、乙腈(50ml),38℃搅拌10h,再向体系加入溴糖(2.75g,7mmol)搅拌12h后,再加入溴糖(2.75g,7mmol)继续搅拌12h。反应结束后,过滤回收反应体系中的固体碱。向体系加入100ml的三氯甲烷,抽滤,用三氯甲烷洗涤滤饼至无色,加入50ml水,水相用三氯甲烷萃取三次,合并有机相,硫酸钠干燥,浓缩得到紫褐色产品,用乙醇重结晶,析出白色固体,抽滤得到白色固体10.3g,收率80%,m.p.>250℃。
制备例3:
单口瓶中依次加入化合物(1-12)(8.0g,17.6mmol,由实施例7制备所得)、溴糖(1-15,由实施例9制备得到)(13.9g,35.2mmol)、5-氮杂[4.4]壬烷溴化物(4.35g,21.1mmol)、碳酸氢钠(4.4g,52.8mmol)、乙腈(50ml),35℃搅拌12h,再向体系加入溴糖(2.75g,7mmol)搅拌12h后,再加入溴糖(2.75g,7mmol)继续搅拌12h。反应结束后,过滤回收反应体系中的固体碱。向体系加入100ml二氯甲烷,抽滤,用二氯甲烷洗涤滤饼至无色,加入50ml水,水相用二氯甲烷萃取三次,合并有机相,硫酸钠干燥,浓缩得到紫褐色产品,用乙醇重结晶,析出白色固体,抽滤得到白色固体11.1g,收率87%,m.p.>250℃。
制备例4:
单口瓶中依次加入化合物(1-12)(8.0g,17.6mmol,由实施例7制备所得)、溴糖(1-15,由实施例9制备得到)(13.9g,35.2mmol)、四丁基硫酸氢铵(7.2g,21.1mmol)、碳酸钠(3.7g,35.2mmol)、乙腈(50ml),30℃搅拌12h,再向体系加入溴糖(2.75g,7mmol)搅拌12h后,再加入溴糖(2.75g,7mmol)继续搅拌12h。反应结束后,过滤回收反应体系中的固体碱。向体系加入100ml乙酸乙酯,抽滤,用乙酸乙酯洗涤滤饼至无色,加入50ml水,水相用乙酸乙酯萃取三次,合并有机相,硫酸钠干燥,浓缩得到紫褐色产品,用乙醇重结晶,析出白色固体,抽滤得到白色固体9.98g,收率79%,m.p.>250℃。
制备例5:
单口瓶中依次加入化合物(1-12)(8.0g,17.6mmol,由实施例7制备所得)、溴糖(1-15,由实施例9制备得到)(13.9g,35.2mmol)、四丁基碘化铵(7.79g,21.1mmol)、碳酸钾(12.2g,88mmol)、乙腈(50ml),40℃搅拌5h,再向体系加入溴糖(2.75g,7mmol)搅拌12h后,再加入溴糖(2.75g,7mmol)继续搅拌12h。反应结束后,过滤回收反应体系中的固体碱。向体系加入100ml的1,2-二氯乙烷,抽滤,用1,2-二氯乙烷洗涤滤饼至无色,加入50ml水,水相用1,2-二氯乙烷萃取三次,合并有机相,硫酸钠干燥,浓缩得到紫褐色产品,用乙醇重结晶,析出白色固体,抽滤得到白色固体11.2g,收率88%,m.p.>250℃。
制备例6:
单口瓶中依次加入化合物(1-12)(8.0g,17.6mmol,由实施例7制备所得)、溴糖(1-15,由实施例9制备得到)(13.9g,35.2mmol)、四丁基碘化铵(7.79g,21.1mmol)、硫酸钙(7.2g,52.8mmol)、碳酸钾(7.2g,52.8mmol)、乙腈(50ml),40℃搅拌12h,再向体系加入溴糖2.75g,搅拌12h后,再加入2.75g溴糖继续搅拌12h。反应结束后,过滤回收反应体系中的固体碱。向体系加入100ml二氯甲烷,抽滤,用二氯甲烷洗涤滤饼至无色,加入50ml水,水相用二氯甲烷萃取三次,合并有机相,硫酸钠干燥,浓缩得到紫褐色产品,用乙醇重结晶,析出白色固体,抽滤得到白色固体12.0g,收率90%,m.p.>250℃。
筛选试验:
反应条件筛选试验
表12合成化合物(1-16)条件筛选a
备注:表12中出现的上标a~h表示不同的反应条件:
a反应条件:化合物(1-12)(0.1mmol,1当量),化合物(1-15)(2当量),碱,催化剂,溶剂(4ml)搅拌12h;然后加入(1-15)(0.7当量)搅拌12h;
b加入caso4(3当量);c加入h2o(0.2ml);
d再次加入(1-15)(0.7当量)搅拌12h;e再次加入(1-15)(1.0当量)搅拌12h;
h与a的区别在于一次性加入化合物(1-15)(2.7当量)。
放大实验:参照制备例1所述步骤进行了三批放大实验,收率稳定,如表13所示。
表13化合物(1-16)放大工艺实验结果
实施例11
灯盏花乙素(1-1)的合成
制备例1:
氮气保护下,250ml三口瓶中依次加入化合物(1-16)(8.0g,11mmol,由实施例10制备得到),丙酮(100ml),冰浴下慢慢滴加2.5m氢氧化钠水溶液(55ml),加毕,继续冰浴搅拌1h。缓缓滴加稀盐酸溶液至ph=3-4,继续搅拌30min,抽滤,滤饼用甲醇重结晶,得到浅黄色固体5.0g,收率98%,m.p.>250℃。
化合物式(1-1)的氢谱、碳谱如17、18所示:
1hnmr(400mhz,dmso-d6)δ:12.75(s,1h),10.38(s,1h),8.61(s,1h),7.93(d,j=4.8hz,2h),7.06-6.87(m,3h),6.82(s,1h),5.51(s,1h),5.38-5.16(m,2h),4.06(d,j=7.2hz,1h),3.56-3.24(m,6h);13cnmr(100mhz,dmso-d6)δ:182.8,170.5,164.5,161.7,151.5,149.5,147.3,131.0,128.9,121.8,116.5,106.4,103.1,100.5,94.1,76.0,75.7,73.3,71.8.
制备例2:
氮气保护下,250ml三口瓶中依次加入化合物(1-16)(8.0g,11mmol,由实施例10制备得到),水(100ml),冰浴下慢慢滴加1.5m氢氧化钾水溶液(55ml),加毕,继续冰浴搅拌1h。缓缓滴加稀盐酸溶液至ph=3-4,继续搅拌30min,抽滤,滤饼用甲醇重结晶,得到浅黄色固体4.5g,收率88%,m.p.>250℃。
制备例3:
氮气保护下,250ml三口瓶中依次加入化合物(1-16)(8.0g,11mmol,由实施例2制备得到),丙酮/水(50ml/50ml),冰浴下慢慢滴加3.0m碳酸氢钠水溶液(55ml),加毕,继续冰浴搅拌1h。缓缓滴加稀盐酸溶液至ph=3-4,继续搅拌30min,抽滤,滤饼用异丙醇重结晶,得到浅黄色固体4.8g,收率94%,m.p.>250℃。
制备例4:
氮气保护下,250ml三口瓶中依次加入化合物(1-16)(8.0g,11mmol,由实施例2制备得到),丙酮(100ml),冰浴下慢慢滴加1.0m氢氧化钠水溶液(150ml),加毕,继续冰浴搅拌1h。缓缓滴加稀盐酸溶液至ph=3-4,继续搅拌30min,抽滤,滤饼用乙醇重结晶,得到浅黄色固体4.0g,收率78%,m.p.>250℃。
制备例5:
氮气保护下,250ml三口瓶中依次加入化合物(1-16)(8.0g,11mmol,由实施例2制备得到),丙酮(100ml),冰浴下慢慢滴加3.0m氢氧化钠水溶液(46ml),加毕,继续冰浴搅拌1h。缓缓滴加稀盐酸溶液至ph=3-4,继续搅拌30min,抽滤,滤饼用甲醇重结晶,得到浅黄色固体4.6g,收率90%,m.p.>250℃。
放大实验:
按制备例1所述步骤进行了三批放大实验,收率稳定,如表14所示。
表14灯盏花乙素(1-1)放大工艺实验结果
此外,对于实施例11合成的灯盏花乙素即化合物(1-1)我们对其进行了hplc分析,纯度在99%以上,与标准品一致,详见附图19。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!