一种以恶臭假单胞菌为出发菌株构建三氯丙烷降解菌的方法与流程
本发明属于环境技术修复领域,具体涉及一种以恶臭假单胞菌为出发菌株三氯丙烷降解菌株的构建方法.。
背景技术:
人工合成物质1,2,3-三氯丙烷TCP在世界范围内的产量高达5000吨/年,被化学公司作为溶剂,上壤熏蒸剂的前体,及作为合成其他化合物的结构单元,例如二氯丙烯和聚砜类物质。TCP还是环氧氯丙烷合成过程中的副产品。在其大量的生产中,TCP经常在工业和有害废物的地点被发现。最近的一次加利福尼亚TCP污染引用水的事件表明亟需从环境中高效去除TCP这一有毒致癌物质的技术。目前还没有从环境中分离出有氧条件下利用TCP的菌株。
工程菌实际应用于有机物污染的修复必须具有遗传稳定、不含外源抗性等特点,将外源基因通过同源重组的方法整合到受体菌染色体上是一种理想的方法。另一方面,由于转基因微生物(基因工程菌)的复杂性和不确定性,其环境释放的安全性受到广泛关注,因此,工程菌在应用前必须进行环境释放安全性评价。人们所期望的结果是:投加的工程菌降解污中污染物以后,它们又会在污水中逐渐消亡,不会成为优势菌,也不会逃逸到释放区外,而且,工程菌的投加也不会对污水微生物数量和群落结构产生显著影响。
Pseudomonas putida是重要的环境微生物模式菌株,其基因组已在2002年被测序和解析。尽管Pseudomonas putida与致病的铜绿假单胞菌有极高程度的基因组保守性(分享85%的预测编码区域),但是不存在关键的毒力因子包括外毒素A和III型分泌系统。Pseudomonas putida是第一个被美国卫生部重组DNA委员会认定为对环境安全的革兰氏阴性细菌,并允许该菌株作为基因工程的宿主菌。基因组序列分析表明,Pseudomonas putida在生物催化、生物降解和PHA合成等领域具有潜在应用价值。
由于Pseudomonas putida是一种理想的用于水环境修复的菌株,因此以Pseudomonas putida作为底盘细胞,导入不同功能的降解基因并实现它们在宿主菌中的异源表达,有望构建出生长速度快、降解能力强、降解谱广的新型工程菌。
技术实现要素:
本发明的一个目的是提供一种三氯丙烷降解菌的构建方法,是以Pseudomonas putida为出发菌株进行构建的,出发菌株分类名为恶臭假单胞菌。
本发明构建的三氯丙烷降解菌,是对从土壤环境分离得到的恶臭假单胞菌进行基因工程改造获得的菌;所述基因工程改造为插入与三氯丙烷降解途径中相关的多个基因;所述与三氯丙烷降解途径相关的多个基因为卤代烷脱卤酶(DhaA31)编码基因,卤代醇脱卤酶(HheC)编码基因和环氧化物水解酶(EchA)编码基因。
上述卤代烷脱卤酶(haloalkane dehalogenase)DhaA31的核苷酸序列为SEQ ID NO.1中的dhaA31序列;卤代醇脱卤酶(halohydrin dehalogenase)HheC的核苷酸序列表为SEQ ID NO.2中的hheC序列;环氧化物水解酶(expoxide hydrolase)EchA的核苷酸序列表为SEQ ID NO.3中的echA序列。
本发明的第二个目的是提供三氯丙烷于高浓度三氯丙烷环境下在提高三氯丙烷污染地下水中三氯丙烷降解率的应用,所述的高浓度三氯丙烷环境为含三氯丙烷摩尔浓度为0~2mM/L的水。
附图说明
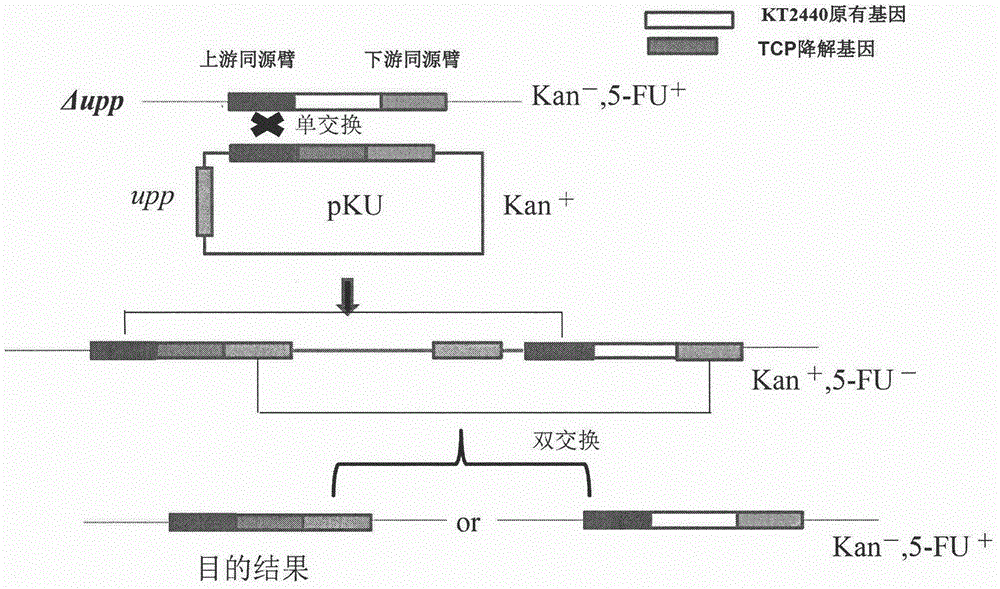
图1是插入Pseudomonas putida外源基因的读码框及插入位点的上下游同源臂;
图2是外源基因插入到Pseudomonasputida基因组上的筛选过程;
图3是Pseudomonas putida中优化后的组成型启动子和核糖体结合位点;
图4是dhaA31、hheC和echA在Pseudomonas putida中的正确转录;
图5是重组菌在250mL三角瓶中降解三氯丙烷的效果;
图6是2L有机玻璃小试降解装置的示意图;
图7是小试装置中三氯丙烷的持续降解效果。
具体实施方式
下面结合实施例对本发明进一步的描述,但是并不限制本发明的内容。下述实施例中所使用的实验方法如无特殊说明,均为常规方法;下述实施例中所使用的材料、试剂等,如无特殊说明,均可从商业途径得到。
实施例1、以恶臭假单胞菌为出发菌株的三氯丙烷降解菌的构建
实验中使用到的液体培养基:
Luria-Bertani(LB)培养基:胰蛋白胨10g、酵母提取物5g、氯化钠10g、水1L、pH7.0,121℃灭菌20分钟备用。
卡那霉素(Kan):称取1g卡那霉素于100mL烧杯中,加入90mL灭菌的ddH2O水,充分搅拌溶解,定容至100mL,过滤除菌,分装(0.5-1mL/份),-20℃保存,备用。
五氟尿嘧啶(5-FU):称取0.0375g五氟尿嘧啶于1.5mL的EP管中,将其溶解在500μL的二甲基亚砜溶液中,浓度为106μg/mL。
将三氯丙烷降解途径中的三个基因dhaA31、hheC和echA分别从宿主菌Rhodococcus rhodochrous NCIMB 13064(GenBank accession no.AF060871.1)和Agrobacterium radiobacter AD1(GenBank accession no.AF397296.1)克隆得到,通过Overlap Extension PCR的方法获得带有插入位点上下游同源臂的插入基因读码框(如图1所示),将读码框与线性化的带有反向筛选标记upp的自杀质粒pKU相连获得敲除质粒,通过点击转化将敲除质粒导入宿主菌株Pseudomonas putida,将转化子在添加Kan条件下培养,那些通过同源臂整合到染色体上的菌株能够得到富集,未整合菌株由于质粒丢失而被Kan杀死。此时得到的便是单交换菌株。将单交换菌株在无Kan条件下进行传代培养,此时染色体上同源臂可发生第二次同源重组,质粒从染色体上脱落。前者使菌株恢复野生型,而后者能得到目的敲除。两种菌株由于都失去了upp表达盒而对5-FU产生抗性,可在5-FU平板上进行筛选。未发生同源重组的单交换菌株被5-FU抑制。野生型与突变株可以通过PCR和DNA测序进行区分(如图2所示)。
将获得的重组菌株在LB培养基中传代50次。再次通过PCR和DNA测序的方法证明了外源基因在宿主菌中的稳定性。
RT-PCT检测:使用购于TaKaRa公司的Total RNA Isolation Kit提取在LB中过夜培养的重组菌的总RNA,再使用反转录试剂盒(PrimeScript RT Master Mix,Takara)将获得的总RNA反转录成cDNA,以cDNA为模板使用插入基因的特异性引物对目标序列进行PCR扩增以此来检测插入外源基因的转录水平。
直接从宿主菌Rhodococcus rhodochrous NCIMB 13064和Agrobacterium radiobacter AD1克隆得到dhaA31、hheC和echA三个基因在Pseudomonas putida中均不转录。
实施例2、优化三氯丙烷降解途径在宿主菌中的表达
鉴于实施例1中插入的三个基因均不转录,我们根据Pseudomonas putida的密码子偏好性优化了dhaA31、hheC和echA三个基因的密码子,优化后的密码子序列分别如SEQ ID NO.1,SEQ ID NO.2和SEQ ID NO.3所示,同时替换了原始菌株中的启动子和RBS,换成了可在Pseudomonas putida中高效启动的启动子和RBS(图3)。菌株构建和RT-PCR检测同实施例1。RT-PCR检测结果如图4所示,三个外源基因均得到了正确的转录。
实施例3、验证三氯丙烷降解工程菌的功能
实验中使用的液体培养基:
SMM培养基:Na2HPO4·12H2O 5.4g、KH2PO41.4g、(NH)2SO40.5g、MgSO4·7H2O 0.2g、2mL微量元素、水1L、pH7.0,121℃灭菌20分钟备用。
微量元素液成分:0.1M HCl 1000mL,MnSO4·4H2O 0.86g,ZnSO4·7H2O 0.2g,CoSO4·7H2O0.28g,CuSO4·5H2O 0.25g,FeSO4·7H2O 3.6g,配制后过滤除菌,121℃灭菌20分钟备用。
将实施例2中得到的正确转录的重组菌以OD600=0.05的接种量接入100mL SMM培养基中,并接有2mM/L三氯丙烷。2mM的三氯丙烷可以在24h内降解99%以上,证明三个外源基因在宿主菌Pseudomonas putida中的高效表达(图5)。
实施例4、三氯丙烷降解工程菌的小试应用
将实施例3中获得的三氯丙烷高效降解菌应用到体积为2L的小试装置中(图6),并填充陶瓷环做为填料。前4天不添加三氯丙烷只固定重组菌,第4和6天添加0.5mM/L三氯丙烷,第8和10天添加1mM/L三氯丙烷,第12天后每两天添加2mM/L三氯丙烷,如图7所示,20天后小试系统可稳定地降解2mM/L三氯丙烷,达到去除三氯丙烷污染的目的。
- 还没有人留言评论。精彩留言会获得点赞!