一种利用芽孢杆菌HS17发酵生产壳聚糖酶的方法及其应用与流程
本发明涉及一种利用芽孢杆菌HS17发酵生产壳聚糖酶的方法,及其在壳寡糖制备中的应用,属于生物技术领域。
背景技术:
壳寡糖是壳聚糖经水解后产生的一类聚合度在 2-20且可溶于水的氨基糖类化合物,具有独特的生理活性和优越的功能性质,在食品、工业、医药和化工领域具有重要应用。
壳聚糖酶(Chitosanase,EC 3.2.1.132) 是一类催化氨基葡萄糖间的 β-1,4-糖苷键断裂,专一性降解壳聚糖的糖苷水解酶,是在催化壳聚糖底物水解转化制备壳寡糖的产业化领域具有重要应用前景的酶类,尤其是在低分子量且高生理活性的壳寡糖制备方面的应用引人注目。根据其作用位点不同,壳聚糖酶可分为3类:1)水解 GlcN-GlcN 键及 GlcNAc-G1cN 键;2)只能水解 G1cN-GlcN 键;3)既可水解G1cN-GlcN 键又可水解 G1cN-GlcNAc 键。所有壳聚糖酶有一个共同催化性质就是要求糖苷键的一侧至少有1个G1cN 残基,而不能催化 GlcNAc-G1cNAc键的断裂,不同生物来源壳聚糖酶催化特性和酶解模式不同造成产物壳寡糖聚合度存在差异。
壳聚糖酶广泛分布于细菌、真菌、放线菌、蓝藻和植物等生物体中,而微生物是其最适的规模生产来源,选取产酶量高、易于培养且非致病来源生物体就显得尤为重要。本发明是在筛选获得一株促进海马健康养殖的芽孢杆菌(发明专利CN 104232541 A)的基础上,发现该菌株也高产壳聚糖酶,且其为益生菌,以此确定其培养方法,进一步应用于生物转化制造壳寡糖领域。
技术实现要素:
本发明针对上述技术存在的不足,提供一种芽孢杆菌HS17发酵生产高活性壳聚糖酶的培养方法及其应用,以解淀粉芽孢杆菌HS17为出发菌株,经液体发酵的方法生产壳聚糖酶,该酶可通过高效水解壳聚糖来生产高生理活性的壳寡糖。
所用的芽孢杆菌HS17具有高产壳聚糖酶的特性,其保藏名称为:HS17,保藏单位:中国微生物菌种保藏管理委员会普通微生物中心,保藏日期:2014年8月20日,保藏号为CGMCC No.9532,分类命名:解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。
本发明是通过如下技术方案来实现的:
(1)菌种活化:取试管斜面保存的菌种转接活化培养基中,于30℃、200rpm下活化24 h至菌体混浊,制得活化种子液;
进一步,所述的活化培养基(g/L):酵母粉3~6,蛋白胨8~12,磷酸二氢钾1~3,硫酸镁0.5~1.5,pH 7.0~7.5,121℃灭菌20min备用。
(2)发酵生产壳聚糖酶:
按照7~10%(v/v)的接种量在灭菌后的优选发酵培养基中接入活化种子液,在180rpm的旋转摇床中培养,控制温度为28~30℃,发酵2~4 d后培养完毕,发酵液经离心过滤除菌后直接作为壳聚糖酶液使用;或者在发酵罐中以65%的体积比例装入优选发酵培养基,经118℃蒸汽灭菌20min后,按照7~10%(v/v)的比例接入活化的菌种,控制发酵过程中的pH始终维持在pH 6~7,调节培养温度在28~30℃,溶解氧维持在5%以上,经发酵2~4 d后发酵完毕,经离心过滤除菌后直接作为壳聚糖酶液使用。
进一步,所述得优选发酵培养基:55~65 g/L甘露醇,3~6 g/L大豆蛋白胨,3~6 g/L牛肉膏,0.8~1.2 g/L NH4NO3,0.4~0.8 g/L (NH4)2SO4,1.5~2.5 g/L MnSO4,3~5 g/L MgSO4,1~3 g/L NaH2PO4,2~4 g/L K2HPO4,28 ℃,pH 6.5,2.5~5 g/L粉末壳聚糖,接种量7~10%(v/v)。
本发明的培养方法与现有技术相比的有益效果在于:
(1)壳聚糖酶的生物来源新型,制备壳寡糖的纯度高
本发明涉及的是解淀粉芽孢杆菌HS17来源壳聚糖酶,对底物选择性强,酶解壳聚糖底物生成的壳寡糖产品纯度高(附图3),在获得高纯度壳寡糖单体时可节省大量的纯化成本,市场前景应用广阔。
(2)培养方法简单
解淀粉芽孢杆菌HS17的培养方法简单,培养容易且过程不易染菌;发酵罐培养过程中不需要复杂的补料工艺,适合工厂化放大生产。
(3)培养方法切合实际,酶活提高幅度大
采用本发明的培养方法,在实际发酵生产过程中的壳聚糖酶活力值,与初期的培养方法比较,其酶产量提高了40多倍,培养方法的产量突出。
附图说明
图1为芽孢杆菌HS17平板培养的胶体壳聚糖降解圈;
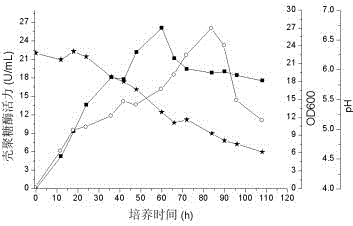
图2为实施例3中的发酵培养曲线,其中▇为壳聚糖酶活力,○为菌体浓度OD600, ★为发酵液的pH;
图3为实施例4中的薄层层析定性分析,其中标号1为氨基葡萄糖标准品,标号2为酶解产物。
具体实施方式
以下结合具体实施例对本发明做进一步详细描述,这些实施例用于理解而不是限制本发明的保护范围。
本发明所用的菌株为解淀粉芽孢杆菌HS17,其在添加壳聚糖的培养平板上能产生较大的降解圈(附图1),具有高产壳聚糖酶的能力。
所用的壳聚糖酶活力测定方法:发酵液经10000 rpm离心5 min得发酵上清酶液,取一定量的上清酶液加水稀释至1 mL,与1 mL的壳聚糖底物溶液混匀后水浴(40℃)保温20 min,再加DNS试剂3 mL,沸水浴5 min,定容至25 mL后取4 mL反应样液在5000 rpm下离心10 min。取离心后上清液以对照组作为空白在520 nm处测定OD值,根据DNS标准曲线,计算其酶活力。
所用的酶活力测定对照组处理:一定量的发酵上清酶液加水稀释至1 mL,沸水浴5 min灭活,再加入相同体积的壳聚糖溶液和DNS试剂,处理方法同样品组。
所用的酶活计算方法:以单位体积(mL)单位时间(min)水解产生的氨基葡萄糖的umol数为酶活力的定义单位。
所用的相对酶活力计算方法:每组中的样品酶活力/每组中的最大样品酶活力×100%。
实施例1:芽孢杆菌HS17发酵生产壳聚糖酶的单因素优化
菌种活化:取试管斜面保存的菌种转接活化培养基中,于30℃、200 rpm下活化24 h至菌体混浊,制得活化种子液;所用的活化培养基(g/L):酵母粉 5,蛋白胨10,K2HPO4 2,MgSO41,用陈海水配制,pH 7.2。
单因素优化:活化种子液按照2%(v/v)接种量接入不同的发酵培养基后,在30℃、180 rpm的摇床中发酵48 h后测定壳聚糖酶活力。
碳源对菌株产壳聚糖酶的影响见表1,可以看出甘露醇作为碳源发酵生产壳聚糖酶的效果最好。所用的发酵培养基配方(g/L):碳源20(其种类见表1),蛋白胨6,酵母粉4,氯化钠5,粉末壳聚糖5,陈海水配制,pH 7.0。
表1 碳源对菌株产壳聚糖酶的影响
氮源对菌株产壳聚糖酶的影响见表2,氮源种类对壳聚糖酶的表达具有一定影响,但是总体差异不大。考虑速效氮源有利于菌体快速生长,而有机氮源可在发酵后期持续发挥作用生产壳聚糖酶,故选取大豆蛋白胨、牛肉膏、NH4NO3和(NH4)2SO4作为后续菌株HS17发酵优化的氮源。所用的初始培养基组分(g/L):甘露醇20,氮源5(其种类见表2),NaH2PO4 2,K2HPO4 3,粉末壳聚糖5,陈海水配制,pH 7.0。
表2 氮源对菌株产酶的影响
金属盐对菌株产壳聚糖酶的影响见表3。由表3可以看出,Cu2+对壳聚糖酶活力具有强抑制作用,其表达量较低。Mn2+和Mg2+应是芽孢杆菌 HS17来源壳聚糖酶的激活因子,在此条件下的酶活值较高,故后续发酵优化添加MnSO4和MgSO4。所用的培养基(g/L):甘露醇20,大豆蛋白胨2,牛肉膏2,NH4NO3 1和(NH4)2SO4 1,NaH2PO4 2,K2HPO4 3,金属盐2(其种类见表3),粉末壳聚糖5,陈海水配制,pH 7.0。
表3 金属盐对菌株产酶的影响
实施例2:芽孢杆菌HS17发酵生产壳聚糖酶的多因素优化
菌种活化:取试管斜面保存的菌种转接活化培养基中,于30℃、200 rpm下活化24 h至菌体混浊,制得活化种子液;所用的活化培养基(g/L):酵母粉 5,蛋白胨10,K2HPO4 2,MgSO41,用陈海水配制,pH 7.2。
多因素优化:活化种子液按照2%(v/v)接种量接入不同的发酵培养基后,在30℃、180 rpm的摇床中发酵48 h后测定壳聚糖酶活力。根据对碳源、氮源和金属离子对芽孢杆菌HS17产壳聚糖酶的优化结果,选取甘露醇、大豆蛋白胨、牛肉膏、NH4NO3、(NH4)2SO4、MnSO4、MgSO4、NaH2PO4、K2HPO4、粉末壳聚糖、温度、pH和接种量进行13因素2水平的Plackett–Burman设计优化,其因素和水平见表4,优化结果见表5,其中在第15组时获得最大壳聚糖酶活性,为15.93 U/mL。
表4 Plackett–Burman 设计优化的因素水平
表5 Plackett–Burman 设计优化的结果
采用Design Expert软件对Plackett–Burman 设计进行优化分析,确定甘露醇、NaH2PO4和接种量是影响壳聚糖酶产量的最显著因素,提高甘露醇浓度和接种量、同时降低NaH2PO4浓度有利于提高壳聚糖酶产量。利用Plackett–Burman Design设计优化后各因素条件,爬坡试验结果见表6。由表6可以看出,在第4组时得到最大壳聚糖酶活力,为21.18 U/mL,因此以60 g/L甘露醇、0.8 g/L NaH2PO4和8% (v/v)接种量为中心点,进行中心组合设计和响应面分析优化。
表6 爬坡实验设计与结果
根据Plackett–Burman设计和爬坡试验结果,对甘露醇、NaH2PO4和 接种量这3个因素进行中心组合设计,其因素水平编码见表7。将甘露醇(A)、NaH2PO4(B)和接种量(C) 3个因素作为自变量,以壳聚糖酶活性(Y)作为响应值,设计20个响应面分析实验,其中6个中心实验用于估计试验误差,其余组为析因组,中心组合设计与结果与见表8。
采用Design Expert软件对所得数据进行回归分析,得到甘露醇(A)、NaH2PO4(B)和接种量(C)的二次多项回归方程:壳聚糖酶活性(Y,U/mL)= -126.42 + 3.78A + 114.68B – 1.93C -0.93AB + 0.07AC – 4.21BC -0.03A2 – 18.29B2 + 0.05C2;该回归模型的F=4.01,p=0.0206<0.05,表明模型显著,仅有2.06%的优化误差;失拟项F=3.15,p=0.1170 >0.05,即方程模型失拟不显著,说明该方程能较好的描述各发酵条件与壳聚糖酶活性的关系。
根据所建立的数学模型进行参数最优化,响应面分析确定在63.79 g/L甘露醇、0.6g/L NaH2PO4和9% (v/v) 接种量时,可获得壳聚糖酶最高活性值为22.54 U/mL。为检验方法的可靠性,采用得到的最优发酵培养条件进行发酵生产壳聚糖酶实验,在此条件下进行3次平行试验,实际得到壳聚糖酶活性平均值为22.72 U/mL,实际值与预测值之间的误差约为0.01% 。 因此采用响应面优化菌株HS17发酵生产壳聚糖酶的条件可靠。
表7 中心组合设计的水平和编码
表8中心组合设计与结果
实施例3:摇瓶培养芽孢杆菌HS17发酵生产壳聚糖酶
菌种活化:取试管斜面保存的菌种转接活化培养基中,于30℃、200 rpm下活化24 h至菌体混浊,制得活化种子液;所用的活化培养基(g/L):酵母粉 5,蛋白胨10,K2HPO4 2,MgSO41,用陈海水配制,pH 7.2。
发酵生产:采用实施例2中优化后的发酵培养基和培养条件:63.79 g/L甘露醇、0.6g/L NaH2PO4、4 g/L大豆蛋白胨、4 g/L牛肉膏、1 g/L NH4NO3、2 g/L (NH4)2SO4、2 g/L MnSO4、4 g/L MgSO4、3 g/L K2HPO4、3 g/L粉末壳聚糖、培养温度30℃、pH 6.5、9% (v/v)接种量,摇瓶培养芽孢杆菌HS17发酵生产壳聚糖酶,每500 ml三角烧瓶装100 ml发酵培养基,摇床转速180 rpm,定期取样测定酶活性,绘制发酵曲线,其结果见附图2。发酵60 h时获得最大酶活力,为26.08 U/mL。
实施例4:发酵罐培养芽孢杆菌HS17发酵生产壳聚糖酶
(1)对比例1
菌种活化:取试管斜面保存的菌种转接活化培养基中,于30℃、200 rpm下活化24 h至菌体混浊,制得活化种子液;所用的活化培养基(g/L):酵母粉 5,蛋白胨10,K2HPO4 2,MgSO41,用陈海水配制,pH 7.2。
发酵生产:采用优化后的发酵培养基:55 g/L甘露醇、0.4 g/L NaH2PO4、3 g/L大豆蛋白胨、3 g/L牛肉膏、0.8 g/L NH4NO3、1.5 g/L (NH4)2SO4、1.5 g/L MnSO4、3 g/L MgSO4、2 g/L K2HPO4、2.5 g/L粉末壳聚糖。在10 L发酵罐中以65%的体积比例装入发酵培养基,经118℃蒸汽灭菌20min后,按照7%(v/v)的比例接入活化的菌种,控制发酵过程中的pH始终维持在pH 6,调节培养温度在28℃,溶解氧维持在5%以上。定期取样测定壳聚糖酶活力,在发酵36 h时获得最大壳聚糖酶活力为34.65 U/mL,发酵液经10000 r/min离心过滤除菌后作为壳聚糖酶液使用。
(2)对比例2
菌种活化:取试管斜面保存的菌种转接活化培养基中,于30℃、200 rpm下活化24 h至菌体混浊,制得活化种子液;所用的活化培养基(g/L):酵母粉6,蛋白胨12,K2HPO4 3,MgSO41.5,用陈海水配制,pH 7.5。
发酵生产:采用优化后的发酵培养基:70 g/L甘露醇、0.8 g/L NaH2PO4、6 g/L大豆蛋白胨、6 g/L牛肉膏、1.2 g/L NH4NO3、2.5 g/L (NH4)2SO4、2.5 g/L MnSO4、5 g/L MgSO4、4 g/L K2HPO4、5 g/L粉末壳聚糖。在10 L发酵罐中以65%的体积比例装入发酵培养基,经118℃蒸汽灭菌20min后,按照10%(v/v)的比例接入活化的菌种,控制发酵过程中的pH始终维持在pH 7,调节培养温度在30℃,溶解氧维持在5%以上。定期取样测定壳聚糖酶活力,在发酵54 h时获得最大壳聚糖酶活力为41.27 U/mL,发酵液经10000 r/min离心过滤除菌后作为壳聚糖酶液使用。
(3)对比例3
菌种活化:取试管斜面保存的菌种转接活化培养基中,于30℃、200 rpm下活化24 h至菌体混浊,制得活化种子液;所用的活化培养基(g/L):酵母粉6,蛋白胨12,K2HPO4 3,MgSO41.5,用陈海水配制,pH 7.5。
发酵生产:采用优化后的发酵培养基:63.79 g/L甘露醇、0.6g/L NaH2PO4、4 g/L大豆蛋白胨、4 g/L牛肉膏、1 g/L NH4NO3、2 g/L (NH4)2SO4、2 g/L MnSO4、4 g/L MgSO4、3 g/L K2HPO4、3 g/L粉末壳聚糖。在50 L发酵罐中以65%的体积比例装入发酵培养基,经118℃蒸汽灭菌20min后,按照9%(v/v)的比例接入活化的菌种,控制发酵过程中的pH始终维持在pH 6.5,调节培养温度在30℃,溶解氧维持在5%以上。定期取样测定壳聚糖酶活力,在发酵48 h时获得最大壳聚糖酶活力为45.93 U/mL,发酵液经10000 r/min离心过滤除菌后作为壳聚糖酶液使用。
实施例5:芽孢杆菌HS17壳聚糖酶催化生产壳寡糖
称取20 g 脱乙酰度95%以上的壳聚糖,加水200 mL,逐渐滴加乙酸使其完全溶解,滴加4 mol/L的乙酸钠溶液调pH至6,定容至500 mL并于40℃水浴保温10 min。向保温的壳聚糖底物溶液中加入实施例4且对比例3中的壳聚糖酶液体酶液10 mL,混合均匀后进行酶解反应,整个反应过程中控制酶解反应温度为40℃,每个30 min取样一次,DNS法测定壳寡糖的含量,当酶解反应进行14.5 h时产物壳寡糖含量不再增加时终止反应。
酶解产物溶液经博层层析(TLC)进行定性分析,其结果见附图3,几乎为单一组分壳寡糖,酶解产物具有特定性,可减少后续分离纯化的操作成本和工序,具有工业规模化生产潜力。
酶解产物溶液添加无水乙醇,至终体积分数为30%以沉淀酶蛋白,离心去沉淀后的酶解产物溶液经过截留分子量10kDa 的超滤膜过滤,收集膜透过液组分,再补加无水乙醇至终体积分数为75%,以沉淀壳寡糖样品,最后经再次离心收集沉淀并冷冻干燥后获得成型的壳寡糖12.84 g,壳寡糖产品的实际得率为64.2%。
- 还没有人留言评论。精彩留言会获得点赞!