药用激肽原酶及其制备方法和应用与流程
本发明涉及蛋白类药物,特别是药用激肽原酶及其制备方法和其在药物制备中的应用。
背景技术:
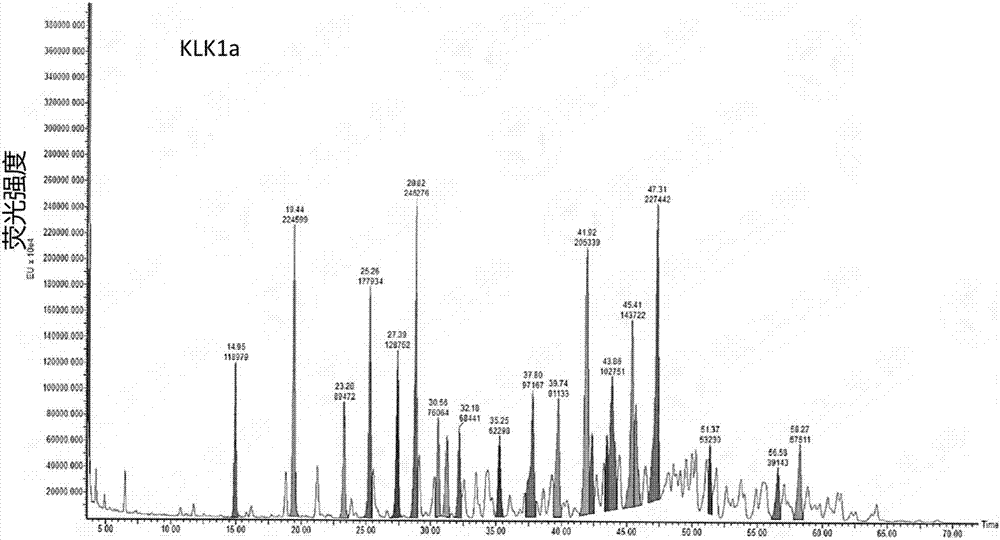
:激肽原酶,又称激肽释放酶(kininogenase)或血管舒缓素(kallidinogenase),它是属于丝氨酸蛋白酶的一种,存在于各种组织和生物液体中,催化大分子前体物(激肽原,kininogen)释放生物活性肽(激肽,kinin)。激肽原酶的生理效应包括使毛细血管和动脉血管舒张以及通透性增加,使冠状动脉、脑、视网膜处的血流供应增加,适用于高血压冠状血管以及动脉血管硬化等症,对心绞痛、血管痉挛、血栓性闭塞性脉管炎、冻疮以及创伤等症也有治疗作用。同时,激肽原酶也可以作为活化因子,使纤溶酶原激活成纤溶酶,将不溶性的纤维蛋白水解成可溶性的小肽,从而对脑梗塞、动脉粥样硬化等起到治疗作用,并用于治疗血栓、预防血栓再形成(g.m.yousef,e.p.diamandisclinbiochem,2003(36):443-452)。体外研究显示,激肽原酶对离体动脉具有舒张作用,并可抑制血小板聚集、增强血细胞变形能力和氧解离能力。动物试验显示,激肽原酶静脉注射可增加麻醉犬椎间、颈总和股动脉血流量,增加麻醉犬后肢、家兔肌肉血流量。因此,激肽原酶在人类微循环障碍及轻-中度急性血栓性脑梗死等疾病的治疗中具有较高的应用价值。国内市场上现有的激肽原酶药物分为两类:一类是从猪胰脏中提取的激肽原酶,它来源广泛。另一类是从新鲜人尿中提取精制的人尿激肽原酶。其中从猪胰脏提取的激肽原酶的相关产品目前市场上主要有丽珠医药、上海第一生化、沈阳济世、河南灵佑、南昌万华、济南维尔康,常州千红。但是市售猪胰激肽原酶注射液使用时注射部位常有红肿、疼痛的症状,并且,申请人也在大鼠急性缺血性脑卒中实验中发现有大鼠在用药后死亡的情况,因此,申请人推测在现有市售产品中有副作用较大的成分存在。技术实现要素:解决的技术问题:本发明主要解决了如何进一步提高猪胰脏来源激肽原酶产品质量的问题,提供了一种活性更高、稳定性更好的激肽原酶;同时解决了猪胰脏来源激肽原酶分离纯化困难,无法产业化的问题,提供了一种可以应用于大规模生产制备的分离纯化klk1b,klk1a和klk1c单组分的方法。技术方案:猪胰脏来源的激肽原酶是由3种不同糖基化程度的组分所组成,蛋白电泳分析是呈3条条带,依据分子量由大到小依次命名为klk1b、klk1a、klk1c。目的之一是提供一种激肽原酶(klk1),所述激肽原酶中不含有组分klk1c,所述klk1c是在猪胰脏来源的klk1的sds-page蛋白电泳时三条带中分子量最低的条带。优选的,上述激肽原酶(klk1),其由组分klk1b、klk1a中的一种或两种组成。所述组分klk1b是在猪胰脏来源的klk1的sds-page蛋白电泳时三条带中分子量最高的条带,所述klk1a是在猪胰脏来源的klk1的sds-page蛋白电泳时三条带中分子量第二的条带。最优选的,上述激肽原酶(klk1),其为klk1b。本发明的另一个目的是,提供一种激肽原酶klk1的精纯方法,包括如下步骤:步骤1,激肽原酶溶液用阴离子交换色谱柱纯化,梯度洗脱;步骤2,步骤1梯度洗脱分步收集的样品溶液继续用阴离子交换色谱柱纯化。所述阴离子交换色谱柱的填料为hpq。所述步骤1梯度洗脱条件为:首先以流动相:88%~90%a液与12%~10%b液,洗脱10个柱体积;然后梯度洗脱,洗脱30个柱体积,期间b液浓度逐渐增加至30%;流速5~10ml/min。所述步骤1中激肽原酶溶液的浓度是0.1~30mg/ml,由a液稀释而成。所述步骤2梯度洗脱条件为:首先以流动相:88%~90%a液与12%~10%b液,洗脱10个柱体积;然后梯度洗脱,洗脱20个柱体积,期间b液浓度逐渐增加至20%;流速5~10ml/min。a液为20~50mmtris-hcl,ph8.0~9.0;上述所述b液为含1mnacl的20~50mmtris-hcl。使用该方法进行纯化,产品的收率较高,单组分达到60%以上,操作简单,适用于规模放大,且产品的纯度较高,可达95%以上。所述ph8~9的调节缓冲液是tris-hcl、磷酸、硼酸硼砂等缓冲液。本发明的另一个目的是,提供一种上述所述激肽原酶在制备治疗脑卒中药物中的应用。本发明的另一个目的是,提供一种上述所述激肽原酶在制备治疗糖尿病引起的肾病的药物中的应用。本发明的另一个目的是,提供一种上述所属所述激肽原酶在制备治疗其它微循环疾病药物中的应用。本发明的另一个目的是,提供一种上述所述激肽原酶临床使用为静脉注射或肌肉注射型,剂量为10ug/m2~100ug/m2。本发明的另一个目的是,提供一种治疗脑卒中以及糖尿病引起的肾病药物,有效成分为上述激肽原酶及其药学上可接受的盐及其复合物。药学上可接受的盐在其被施用的量和浓度存在时是非毒性的。制备此类盐可通过改变化合物的物理特征而不妨碍其发挥生理学效果来促进药物应用。在物理特性方面有用的改变包括降低熔点以促进经粘膜施用、增加溶解性以促进施用更高浓度的药物等。上述所述的药学上可接受的盐包括酸加成盐,例如含有硫酸盐、盐酸盐、延胡索酸盐、马来酸盐、磷酸盐、醋酸盐、柠檬酸盐、乳酸盐、酒石酸盐、甲磺酸盐、苯磺酸盐等。上述所述的药学上可接受的盐可来自酸,包括盐酸、马来酸、硫酸、磷酸、乙酸、柠檬酸、乳酸、酒石酸等。药学上可接受的载体和/或赋形剂也可被掺入根据本发明的药物组合物中促进特定激肽原酶的施用。适于实施本发明的载体包括碳酸钙,磷酸钙,各种糖类(乳糖、葡萄糖、蔗糖),或各种淀粉,纤维素衍生物,明胶,植物油,聚乙二醇,以及生理学上相容的溶剂(包括用于注射的无菌水溶液,盐溶液和右旋糖)等。有益效果:本发明提供的猪胰脏来源激肽原酶,和现有市场上的猪胰脏来源激肽原酶比较,纯度更高去除了副作用最大的klk1c组分,生物活性及药效更高,副作用小,更具稳定性。由于klk1b,klk1a,klk1c这三个组分仅在糖基化程度上有微小差别,其蛋白的氨基酸序列完全一致,理化性质相似性较高,因此要把其中的单组分分离纯化出来并实现产业化具有较大难度。同时药效结果也显示糖基化修饰程度最低的klk1c是原产品产生安全性问题的主要原因。目前国内外未见有相关的klk1单组分纯化分离并对其药效进行研究的报道,而本发明很好地解决了klk1b,klk1a和klk1c分离困难、无法产业化的问题。附图说明图1a、1b:单组分klk1b的纯化色谱图其中图1a是经过第一步离子交换层析的色谱图,峰1的箭头部分区域为目的产物的收集范围。图1b是经过第二步离子交换层析的色谱图,图中的单个主峰即是目的产物klk1b。图2a、2b:单组分klk1a的纯化色谱图其中图2a是经过第一步离子交换层析的色谱图,峰2的箭头部分区域为目的产物的收集范围。图2b是经过第二步离子交换层析的色谱图,图中的箭头部分区域即是目的产物klk1a。图3a、3b:单组分klk1c的纯化色谱图其中图3a是经过第一步离子交换层析的色谱图,峰3的箭头部分区域为目的产物的收集范围。图3b是经过第二步离子交换层析的色谱图,图中的箭头部分区域即是目的产物klk1c的收集峰。图4:单组分klk1的蛋白电泳纯度分析图中第1-5泳道的样品分别是:蛋白marker,klk1,klk1b,klk1a,klk1c。图5:单组分klk1的westernblot鉴定图中第1-5泳道的样品分别是:蛋白marker,klk1,klk1b,klk1a,klk1c。从图中可以看出,klk1的单组分和klk1一样,都能和klk1的抗体很好的结合。图6a、6b:klk1糖型分析其中图6a:klk1b的糖型分析图。图6b:klk1a的糖型分析图图7a、7b:klk1质谱分析图其中图7a:klk1b质谱分析图。图7b:klk1a质谱分析图图8:klk1单组分的氨基酸覆盖谱图,由上至下分别为klk1b、klk1a、klk1c三个单组分的氨基酸覆盖谱图。图9:单组分klk1的热稳定性比较由图可知,在65℃水浴条件下,klk1b,klk1a的稳定性最高,放置2小时依然保留了75%以上的活性;含有klk1b和klk1a的混合物的稳定性和klk1b或klk1a基本无差别,均高于未精纯的klk1原蛋白及klk1c;而klk1c的热稳定性最差,在放置2小时后只保留了50%的活性。图10aklk1单组分静脉注射组药时曲线图10bklk1单组分肌肉注射组药时曲线具体实施方式定义:本发明使用以下缩写:klk1:猪胰脏中提取的激肽原酶,含有klk1b,klk1a,klk1c的混合物。klk1b:sds-page蛋白电泳中分子量最大的条带所代表的klk1组分;klk1a:sds-page蛋白电泳中分子量第二的条带所代表的klk1组分;klk1c:sds-page蛋白电泳中分子量第三的条带所代表的klk1组分;单组分klk1:即klk1b或klk1a或klk1c,根据以下实施例进一步分析确定,该三种单组分klk1都是猪胰脏激肽原酶,具有相同的氨基酸序列,klk1b、klk1a、klk1c,仅为分子量由高到底,糖基化修饰程度由高到低。实施例1不同介质纯化klk1单组分的比较为了纯化得到klk1中的单组分样品,进行了纯化条件的摸索,筛选了大量的介质。具体结果见表1所示。表1不同介质筛选介质名称纯化得到单组分klk1b的纯度总蛋白收率captoqimpres(ge)80%10%captoqadhere(ge)84%10%deaesepharoseff(ge)50%20%hpq(ge)98%30%qff(ge)90%20%sourceq(ge)88%10%captodeae(ge)60%25%superq650(tosh)86%18%q-600ar(tosh)80%15%通过大量的介质筛选结果得出,使用hpq介质(购自ge公司)的分离效果最好,单组分klk1b的纯度可达到98%,收率达85%。实施例2猪胰激肽原酶单一组分klk1b、klk1a以及klk1c分离纯化制备例1用a液将猪胰激肽原酶(来自常州千红生化制药股份有限公司)稀释成6mg/ml,用离子交换色谱层析进行纯化。纯化的色谱法条件:离子交换介质(qff),a液:50mm的tris-hcl(ph9.0),b液:含1mnacl的50mm的tris-hcl(ph9.0);流速10ml/min,检测波长为280nm。上样:上述猪胰激肽原酶稀释液,结合至qff离子交换柱。平衡:a液冲洗5个柱体积。洗脱:流动相配比为12%b,88%a,洗脱10个柱体积后,进行梯度洗脱。梯度条件为12%b~30%b,30个柱体积。收集:收集峰1前部分洗脱产物作为klk1b,如图1a所示;收集峰2后部分洗脱产物作为klk1a,如图2a所示,收集峰3后部分洗脱产物作为klk1c,如图3a所示。用a液将第一次分离纯化收集到的3种洗脱产物分别稀释2倍后,用离子交换色谱层析分别进行第二次纯化。纯化的色谱法条件:离子交换介质(hp-q),a液:50mm的tris-hcl(ph9.0),b液:含1mnacl的50mm的tris-hcl(ph9.0),流速10ml/min,检测波长为280nm。上样:上述收集产物稀释液,结合至hp-q离子交换柱。平衡:a液冲洗5个柱体积。洗脱:流动相配比为12%b,88%a,洗脱10个柱体积后,进行梯度洗脱。梯度条件为12%b~20%b,洗脱体积为20个柱体积。收集:收集洗脱峰,klk1b、klk1a、klk1c的洗脱峰,分别如图1b、2b、3b所示。制备例2、3为在制备例1调整部分参数的重复试验,如表2所示为调整的第一次分离纯化时的部分参数;如表3所示为调整的第二次分离纯化时的部分参数。表2调整第一次分离纯化的部分参数表3调整第二次分离纯化的部分参数后续纯度检测试验显示制备例1-3能够较好地分离出klk1b、klk1a,klk1c组分,纯度可达95%以上。实施例3猪胰激肽原酶单一组分klk1b、klk1a以及klk1c分离产物纯度检测sds-page法检测(1)电泳:制备12%的聚丙烯酰胺凝胶后,上样运行。80v运行30min,待溴酚蓝指示剂跑出浓缩胶后改为150v运行30min。(2)考马斯亮蓝染色:电泳结束后,将胶剥开置于考马斯亮蓝染液中,染色30min。(3)脱色:染色结束后,将胶置于脱色液中,过夜脱色。分析结果如图4所示。收率方面,klk1b的收率可达到85%以上,klk1a的收率可达到60%,而klk1c的收率较低,但是分离纯化后klk1各组分纯度均可达到95%。因此本实施例中的纯化方法,在用于纯化klk1b时,有较高的收率,产品的纯度较高。实施例4猪胰激肽原酶单一组分klk1b、klk1a以及klk1c的westernblot检测(1)电泳:制备12%的聚丙烯酰胺凝胶后,上样运行。80v运行30min,待溴酚蓝指示剂跑出浓缩胶后改为150v运行30min。(2)转膜(半干式电转印):电泳结束后,取出凝胶。按照以下顺序放置滤纸,凝胶和pvdf膜到半干槽中:滤纸→pvdf膜→胶→滤纸。转膜电流为膜面积的0.8~2倍,本实验室的6x9cm的膜所用电流一般为100ma,1h。(3)膜的封闭:加入封闭液(5%脱脂奶粉+tbst),室温,摇床摇1h。用tbst洗三次,每次5min。(4)一抗孵育:按照1:500比例用一抗稀释液稀释一抗,室温摇床上缓慢摇动孵育1h。tbst洗膜3次,每次5min。(5)二抗孵育:按照1:5000比例用2.5%脱脂奶粉稀释羊抗鼠的igg,常温摇床摇1h。tbst洗膜3次,每次5min。(6)显色:剪取适当大小的膜于保鲜膜上,将膜上的tbst溶液去尽,加显色液(0.5ml鲁米诺/强剂溶液+0.5ml稳定型过氧化物溶液,一张膜用量),显色1min,去尽显色液,置于凝胶成像系统曝光、显色。分析结果如图5所示。制备例1、2、3中各个条带的位置和各样品在蛋白电泳中的相同。说明纯化的单组分klk1均可以和klk1的抗体很好结合,说明不同的单组分klk1具有相同的氨基酸序列,而分子量的差异是由于糖基化修饰的不同产生的。实施例5:klk1单组分的糖型分析、质谱分析样品处理步骤大致如下:把klk1b,klk1a样品分别用超滤管进行缓冲液置换,置换至酶解缓冲液中,然后加入pngasef进行酶切。酶切结束后用hilic固相萃取柱去除溶液中的蛋白和盐,真空离心冻干。冻干后的样品用2-ab进行荧光标记。根据flr图谱(图6a、6b)结果可知,klk1b的糖型较复杂,多为三天线及四天线糖型结构。丰度最高的糖型比例为14.04%,大于5%的糖型种类仅占4种,且这四种糖总比例仅为36%,其余70%左右的几十种糖型的单个比例均在5%以下。质谱检测其分子量约为29kda。而klk1a中,丰度最高的糖型比例为10.3%,大于5%的糖型种类有七种,且这七种糖总比例占约50%,其余含量的十几种糖型单个比例均在5%以下。质谱检测其分子量约为27kda。由糖形分析的结果可知,猪胰脏来源的klk1不同组分的糖基化不同。由质谱图谱分析得出klk1b和klk1a的分子量分别为29427da和27046.87da。如图7a和7b所示。但由于猪胰激肽原酶的糖型会受到动物饲养环境,饲料等的影响而产生一定的变化,因此其分子量一般会有100da的上下浮动。klk1b的分子量比klk1a大2000da左右,主要是由于其糖基化水平显著高于klk1a造成的,这和蛋白电泳的分析结果以及糖型分析的结果是一致的。实施例6klk1单组分的氨基酸覆盖率比较为了比较分离纯化出的3种单组分的氨基酸序列是否一致,我们进行了氨基酸覆盖率的比较。3种单组分样品用胰蛋白酶酶解后,进行一定的处理然后用lc-ms(xevo-g2s-q-tof)进行肽图分析检测,最终用biopharmlynx,unifi,proteinlynx分析软件进行数据分析。最终分析的结果见图8所示,由图8可看出,3个单组分中75%左右的肽段被鉴定出,三者之间无差异,并且和猪胰激肽原酶的理论序列一致,进一步验证了三种单组分仅仅是糖基化不同,氨基酸一级序列完全一致。图8中没有覆盖的个别肽段,可能是由于胰酶切后肽段太小而不能有效检测,但n端和c端区域的肽段都已覆盖,三者无差异,和理论序列一致。实施例7:猪胰激肽原酶单一组分klk1b、klk1a以及klk1c的药效比较选择240~260g健康雄性sd大鼠作为实验动物,设置假手术组、溶媒对照组、klk1组、klk1b组、klk1a组以及klk1c组,动物随机分组,每组20只。大鼠麻醉后仰卧保定,分离右侧颈总动脉(cca)、颈外动脉(eca)和颈内动脉(ica),结扎cca近心端与eca,在ica处挂线备用;栓线经由ica插入20mm至中动脉,结扎血管,逐层缝合肌肉和皮肤,将线栓线头留于皮肤外;假手术组仅分离血管,不插入栓线。手术操作结束后,肌注一定量的抗生素。1.5h后,轻轻拔出线栓进行再灌注,同时肌注各组相应受试药物,剂量分别为klk1b组12μg/kg、klk1a组12μg/kg以及klk1c组12μg/kg,模型组和假手术组给予对应溶媒。给药24h后对大鼠进行采用改良型神经损伤严重程度评分(mnss);在整个试验过程中,进行一般情况观察,主要内容包括:死亡、昏迷、呼吸、大小便性状、毛色、精神状况、呕吐及呕吐物、出血、惊厥、抽搐等,剔除因意外因素导致异常的动物。mnss评分结束后用10%的水合氯醛麻醉大鼠,取脑,去除嗅球、小脑和低位脑干,用生理盐水冲洗大脑表面血迹,吸去表面残留水迹,于-20℃放置30min,取出后立即于视线交叉平面垂直向下作冠状切面,并向后每隔2mm切一片,将脑片置于2%ttc染液中温育20min,正常脑组织染成深红色,缺血脑组织则呈苍白色,用生理盐水冲洗后,4%甲醛溶液固定,吸干表面残留水迹,拍照,计算梗死面积。脑梗死面积的计算采用如下的方法进行。sd大鼠大脑用ttc(2,3,5-氯化三苯基四氮唑,sigma)染色后用图像分析软件对照片进行统计,按如下公式计算脑梗死面积的百分比。试验结果表明,在神经缺陷症状评分及脑梗死面积计算实验中,klk1c未有明显改善神经症状缺陷和脑梗死面积,并且死亡率比模型组更高;klk1b组和klk1a组相对于模型组均具有显著性差异,且死亡率较低。结果如表4所示。表4klk1b、klk1a、klk1c神经缺陷症状、脑梗死面积从实验结果可以看出,klk1b组,klk1a组在治疗脑梗时,能够显著缩小脑梗死面积,改善神经缺陷症状,且老鼠死亡率低,总体药效优于klk1对照组。而klk1c组分,没有显示出显著药效,同时,动物的死亡率较高,说明该组分副作用较大。klk1b组分和klk1a组分的成药性最好,和原有的klk1比较,有望开发出药效更好,副作用更小的药物。实施例8:klk1单组分的热稳定性为了比较不同klk1单组分的稳定性,本实施例分别检测了klk1b、klk1a、klk1c及原蛋白在65℃水浴放置一段时间后的活性。具体方法如下:把pbs缓冲液溶解的蛋白浓度为1mg/ml的klk1b、klk1a、klk1c、klk1b和klk1a的混合物(以下简称klk1b&klk1a)及原蛋白klk1置于65℃水浴中,分别于一定时间内取样并放入4℃冰箱备用。取样结束后采用实施例9中的方法(即2005版《中华人民共和国药典》第三部的附录ⅸf所述方法)检测其生物活性。检测结果如图9所示。由图9可以看出,与原蛋白klk1相比,klk1b,klk1a的热稳定性均有提高,含有klk1b&klk1a稳定性和klk1b或klk1a基本无差别,而klk1c组分的稳定性显著较弱。说明糖基化的不同对组分的热稳定性有明显的影响,去除了klk1c组分的猪激肽原酶稳定性较高。实施例9:猪胰激肽原酶单一组分klk1b、klk1a以及klk1c纯化样品等体外活性检测2010版药典第二部第850页所述方法进行。检测的样品分别是猪胰激肽原酶未分离纯化的klk1和单一组分klk1b、klk1a、klk1c纯化样品以及klk1b&klk1a,它们的活性比较结果如表5所示。由表中可以看出,klk1b较klk1原蛋白比活高400个单位;klk1a与klk1原蛋白比活相近;而klk1c纯化样品较klk1原蛋白比活低近250个单位,klk1b&klk1a介于单组分klk1b、klk1a之间。由此可见,虽然猪胰激肽原酶的klk1b、klk1a以及klk1c的氨基酸序列完全相同,但是由于其糖基化修饰程度的不同导致体外活性出现较大的差异。表5单组分klk1样品的比活样品klk1klk1bklk1aklk1cklk1b&klk1a比活(u/mg)1200163113349521489实施例10klk1及单组分的药代动力学比较本试验主要采用tca沉淀蛋白的方法结合hplc对经同位素(125i)标记的125i-klk1a、125i-klk1b和125i-klk1c在sd大鼠体内药代动力学特征及生物利用度进行了研究。动物共分6组,每组均6只动物,雌雄各半,3组动物静脉注射给药,3组动物肌肉注射给药。125i-klk1a、125i-klk1b和125i-klk1c静脉和肌肉给药剂量均为15μg/kg。根据分组前测定的动物体重,选择检疫合格、体重相近的72只动物,使用计算机系统将动物按性别区段随机分为6组。每组6只,雌雄各半。分组信息见表6。表6给药后,每隔一定时间取血,取血前大鼠采用异氟烷麻醉,各时间点大鼠眼眶静脉丛取血,约200μl。立即加入有肝素钠抗凝的ep管中,反复颠倒5~10次。血样采集后4000rpm离心5min分离出血浆。取50μl血浆,加入等体积的20%三氯乙酸(tca),涡旋混匀后,γ计数器计数1min测定总放射性。之后4500rpm,离心5min,弃上清,γ计数器计数1min测定沉淀部分放射性。浓度计算:所有动物在所有药代指标的血样留取后,采用3%戊巴比妥钠麻醉动物,然后用腹主动脉放血法将动物安乐死。使用代谢动力学数据分析软件winnonlin对血药物浓度数据进行分析。代谢参数计算使用理论采样时间点。利用非房室模型法(nca)对相关动力学参数进行计算,并计算生物利用度。利用microsoftexcel计算均值、标准差、变异系数等。从试验结果可以看出:125i-klk1a静脉和肌肉注射给药后半衰期分别为3.07h和3.79h,auc(0-t)分别为355.13和623.65hr*ng/ml,清除率cl分别为37.06和19.76ml/hr/kg,平均体内滞留时间分别为11.58和62.63hr;125i-klk1b静脉和肌肉注射给药后半衰期分别为4.78h和5.12h,auc(0-t)分别为336.21和564.76hr*ng/ml,清除率cl分别为38.09和22.1ml/hr/kg,平均体内滞留时间分别为12.27和68.72hr;125i-klk1c静脉和肌肉注射给药后半衰期分别为2.66h和2.74h,auc(0-t)分别为269.30和451.58hr*ng/ml,清除率cl分别为49.23和24.94ml/hr/kg,平均体内滞留时间分别为11.54和64.43hr。如图10a、10b和表7所示。表7klk1单组分大鼠体内药代动力学参数从药代动力学的结果可看出,klk1中三种单组分的药代动力学特性无显著差异,klk1b和klk1a组分略优,klk1c样品相对较差。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1