铜绿假单胞菌噬菌体裂解酶及应用的制作方法
本发明设计属于生物工程领域,特别涉及人工铜绿假单胞菌噬菌体裂解酶(endolysin或称为溶壁酶)及其作为杀菌活性成分在食品生物被膜中的应用。
背景技术:
生物被膜(bacterialbiofilm)是指菌体为了适应环境,粘附于不同材质界面,分泌大量的胞外多糖、蛋白质和核酸等不均一的胞外基质,将菌体自身包裹在其中而形成的大量菌体聚集膜样物。生物被膜为细菌提供了一种保护性生活方式,其形成有利于微生物持续定植、抵抗宿主免疫系统清除、提高对抗生素的耐受性以及遗传物质的交换。生物被膜黏附于接触表面,菌体嵌入聚合物保护层导致生物被膜一旦形成就难于清除,并且被膜菌的形态结构、生理生化特性、致病性以及对环境因子的敏感性等都与浮游细菌有显著的不同,其对抗生素的耐药性比浮游菌增加10~1000倍,成为一种潜在的交叉污染源,因此,食品行业中微生物生物膜形成机制以及生物被膜的抑制和去除成为近几年来研究的热点问题之一。
生物被膜主要存在于以下食品行业:乳制品、肉类、家禽、海鲜和蔬菜加工行业,根据食品加工行业的不同,细菌的种类和污染途径有所不同。在海鲜产品行业中,最容易形成生物膜的病原菌是弧菌属、嗜水气单胞菌、沙门氏菌、单核细胞增生李斯特氏菌。在新鲜农产品行业,存在于产品处理设备上的沙门氏菌、大肠杆菌o157:h7、李斯特菌、志贺氏菌、蜡状芽孢杆菌、产气荚膜梭菌和鼠疫等细菌能吸附到植物组织上形成生物膜。在乳品行业中,大多数污染来自清洗设备的不足和致病细菌的存在;在肉类工业中,大肠杆菌o157:h7能引起病原性污染。在家禽行业中,沙门氏菌和空肠弯曲菌是最常见的病原体。总的来说,食品行业中的生物被膜具有屏障作用,能抵抗外界抗菌剂对细菌的杀菌作用,对食品行业具有极其严重的危害。
目前,针对于生物被膜的危害,市场上已经出现具有一定的去除生物被膜作用的化学清洗剂。化学清洁剂可高效去除生物被膜,但其给人体带来一定的危害及潜在危害,给设备带来一定的腐蚀性,同时,还对环境造成一定的环保问题。例如,清洁剂中含有的氯,会改变水的滋味,对人体及环境造成一定的负面影响;噬菌体被认为是控制生物被膜的新型有效方法,但噬菌体使用的过程中存在很多劣势,例如,针对不同的生物被膜需要不同的噬菌体,噬菌体宿主范围窄,无法消除对噬菌体不敏感的菌体;裂解能力不强;对菌体有筛选作用;且噬菌体的使用过程中存在一定危险性。
噬菌体裂解酶是噬菌体病毒复制晚期合成的一类细胞壁水解酶,又称内溶素、溶胞壁酶,可以水解宿主菌的肽聚糖结构,属于一种自然酶。与抗生素治疗、噬菌体疗法相比,裂解酶具有很多噬菌体与抗生素所不具备的优势:菌体难以对裂解酶产生耐受性、裂解酶受抗体的裂解效率影响小、裂解酶的裂解谱比噬菌体的裂解谱广、裂解酶与抗生素具有协同作用、裂解酶对细菌的裂解能力更强、裂解酶与裂解酶之间存在协同作用、裂解酶对人体正常细胞无毒性作用、裂解酶不会转移毒力基因等。
技术实现要素:
本发明的一个目的是提供两种改造后的核苷酸序列,该两种核苷酸序列编码人工铜绿假单胞菌噬菌体裂解酶。
本发明的目的是通过以下技术方案实现的:
一种铜绿假单胞菌噬菌体裂解酶,其特征在于:其核酸序列如序列1或2所示。
一种铜绿假单胞菌噬菌体裂解酶基因,其特征在于:其基因序列如序列3或4所示。
一种编码有铜绿假单胞菌噬菌体人工裂解酶的质粒。
一种含有编码有铜绿假单胞菌噬菌体人工裂解酶的质粒的重组菌。
一种铜绿假单胞菌噬菌体裂解酶的制备方法,采用如序列5、序列6所示的引物和如序列7、序列8所示的引物,从铜绿假单胞菌噬菌体基因组dna中扩增铜绿假单胞菌噬菌体裂解酶基因;
具体步骤如下
⑴从铜绿假单胞菌噬菌体基因组中扩增人工铜绿假单胞菌噬菌体裂解酶基因;
⑵构建表达人工铜绿假单胞菌噬菌体裂解酶的重组表达载体;
⑶将重组表达载体转化大肠杆菌感受态细胞,筛选得到表达人工铜绿假单胞菌噬菌体裂解酶的工程菌;
⑷异丙基-β-d-硫代吡喃半乳糖苷诱导表达,获得重组基因表达产物;
⑸将重组基因表达产物,经镍柱亲和层析纯化分离,得到重组的人工铜绿假单胞菌噬菌体裂解酶。
铜绿假单胞菌噬菌体裂解酶用于抑制铜绿假单胞菌、芽孢杆菌生长的应用。
一种菌体裂解剂,包括铜绿假单胞菌噬菌体裂解酶与表面活性剂组合。
而且,所述表面活性剂为聚赖氨酸。
本发明的优点和积极效果是:
1、本专利采用基因工程菌株发酵生产的人工噬菌体裂解酶作为杀菌剂,该酶通过水解细菌细胞壁肽聚糖上糖与肽间的酰胺键或肽内氨基酸残基间的连键最终使宿主细胞裂解,该人工裂解酶相比于野生型裂解酶其具有安全无毒、水溶性好、抑菌谱广优点外其裂解酶的热稳定性以及杀菌活性有一定的提高。
2、本发明提供的铜绿假单胞菌噬菌体的人工裂解酶可以用于抑制铜绿假单胞菌、芽孢杆菌的生长,防治污染,本人工铜绿假单胞菌噬菌体裂解酶与表面活性剂lab-35以及聚赖氨酸具有协同作用,提高杀菌活性,作为杀菌剂中的优良混合,制备新型杀菌剂。
附图说明
图1为裂解酶hpp-gp57基因、pcnp-gp57的表达质粒的构建与鉴定。
图1a为hpp-gp57基因扩增,图1b为hpp-gp57表达质粒的酶切验证。
图1c为pcnp-gp57基因扩增,图1d为pcnp-gp57表达质粒的酶切验证。
图2为人工裂解酶hpp-gp57、pcnp-gp57表达产物的鉴定分析。
泳道1:纯化后的野生型裂解酶gp57。
泳道2:纯化后的改造裂解酶hpp-gp57。
泳道3:纯化后的改造裂解酶pcnp-gp57。
图3为裂解酶gp57及其人工裂解酶hpp-gp57、pcnp-gp57的热稳定性分析。
图3a为裂解酶gp57的热稳定性分析,图3b为裂解酶hpp-gp57的热稳定性分析。
图3c为裂解酶pcnp-gp57的热稳定性分析图。
图4为裂解酶gp57及其人工裂解酶hpp-gp57、pcnp-gp57的杀菌能力分析。
图5为裂解酶与表面活性剂的协同作用。
图5a为铜绿假单胞菌作为底物时裂解酶与表面活性剂的协同作用,图5b为芽孢杆菌作为底物时裂解酶与表面活性剂的协同作用。
图6为裂解酶对聚苯乙烯材质上单一生物被膜的影响。
图6a为裂解酶对聚苯乙烯材质上单一阳性菌生物被膜的影响,图6b为裂解酶对聚苯乙烯材质上单一阴性菌生物被膜的影响。
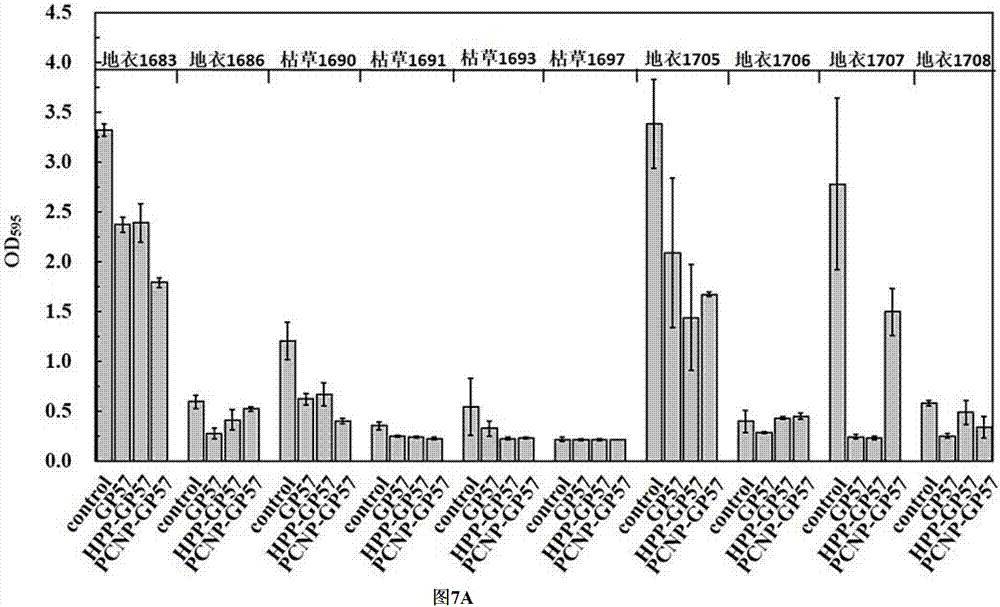
图7为裂解酶以及衍生裂解酶对聚苯乙烯材质上成熟细菌生物被膜的裂解作用图
图7a为对十株革兰氏阳性菌有不同程度的裂解作用,图7b为对十株革兰氏阴性菌中的sk98的生物被膜具有裂解作用
表1为裂解酶gp57的底物特异性的分析。
具体实施方式
下面结合实施例,对本发明进一步说明,下述实施例是说明性的,不是限定性的,不能以下述实施例来限定本发明的保护范围。
本发明提供一种铜绿假单胞菌噬菌体裂解酶,其核酸序列为seqidno.1所示的全部或部分核酸序列;或其核酸序列为seqidno.2所示的全部或部分核酸序列。
本发明提供一种制备铜绿假单胞菌噬菌体裂解酶的制备方法,采用引物5’-gagctcatgggatccttcttcgtagcaccgggctcctccgctctaactgagcaag-3’和引物5’-ctgcagttacttgaaggattgatagg-3’;5’-gcgggatccatgaaacgcaagaaacgtaagaacgcaaagctctaactgagcaag-3’和引物5’-cggggtaccttacttgaaggattgatagg-3’;从铜绿假单胞菌噬菌体基因组dna中扩增人工铜绿假单胞菌噬菌体裂解酶基因;具体步骤如下
⑴从铜绿假单胞菌噬菌体基因组中扩增人工铜绿假单胞菌噬菌体裂解酶基因;
⑵构建表达人工铜绿假单胞菌噬菌体裂解酶的重组表达载体;
⑶将重组表达载体转化大肠杆菌感受态细胞,筛选得到表达人工铜绿假单胞菌噬菌体裂解酶的工程菌;
⑷异丙基-β-d-硫代吡喃半乳糖苷诱导表达,获得重组基因表达产物;
⑸将重组基因表达产物,经镍柱亲和层析纯化分离,得到重组的人工铜绿假单胞菌噬菌体裂解酶。
上述过程具体操作通过以下几个实施例来具体说明。
实施例1噬菌体基因组的提取
(一)粗制噬菌体颗粒
⑴宿主菌的制备:从固体培养基上挑取铜绿假单胞菌单个菌落,接种于5mllb液体培养基中,
⑵噬菌体纯培养液的制备:挑取单个噬菌斑,接种于5ml对数期宿主菌培养液中,
⑶噬菌体粗制颗粒的制备:将过夜培养物转接到100ml液体lb培养基中,接种量为1%,扩增培养至对数期(od600约0.4),加入5ml噬菌体纯培养液,
(二)噬菌体基因组dna的制备
⑴在纯化的噬菌体颗粒中加入dnasei和rnasea,终浓度为1μg/ml,
⑵然后加入1mol/ledta(ph8.0)至终浓度50mmol/l,终止dnasei及rnasea活性;
⑶加蛋白酶k至终浓度为50μg/ml,加sds至终浓度为0.5%,混匀,
⑷加入等体积苯酚:氯仿:异戊醇(25∶24∶1)混匀,12000×g离心10min,收集上清;
⑸步骤4重复3次;收集上清,等体积氯仿,混匀,12000×g,10min,收集上清;
⑹加入1/10体积3mol/lnaac及2倍体积预冷的95%乙醇,混匀,12000×g,10min,沉淀dna;
⑺加70%乙醇(500μl)于沉淀中,并将盖紧的离心管颠倒数次,12000×g离心5min,回收dna。
⑻去掉上清液,除去管壁上的酒精液滴,将开口的离心管室温干燥10min,而后用双蒸水重悬dna。
实施例2重组质粒的构建
1、目的片段的获得
⑴引物设计
根据裂解酶基因序列(seqidno.2),设计引物:
hpp-lysgp57-f:5’-gagctcatgggatccttcttcgtagcaccgggctcctccgctctaactgagcaag-3’
hpp-lysgp57-r:5’-ctgcagttacttgaaggattgatagg-3’
pcnp-lysgp57-f:5’-gcgggatccatgaaacgcaagaaacgtaagaacgcaaagctctaactgagcaag-3’
pcnp-lysgp57-r:5’-cggggtaccttacttgaaggattgatagg-3’;
⑵50μl反应体系:
⑶pcr反应条件:
2、化学转化实验(t-easy重组载体的构建)
⑴将gp57基因pcr产物与t-easy载体进行连接,连接体系为:
10μl反应体系:
将反应体系混匀,
⑵大肠杆菌dh5a化学感受态细胞制备:
a、细菌培养:挑取大肠杆菌dh5a单个菌落于5ml液体lb培养基中,
b、0.1mol/l氯化镁处理溶液:将培养液于
c、0.1mol/l氯化钙处理溶液:10ml氯化钙溶液重悬沉淀后冰浴20min,而后
d、0.1mol/l氯化钙/15%甘油保存:用1ml混合溶液重悬沉淀,混匀后以100μl/管(离心管预先冰浴10min)分装,最终于
⑶取3μlpcr产物与质粒载体t-easy的连接产物和100μl大肠杆菌dh5a感受态细胞混匀。冰浴30min后于
挑取白色菌落至含有100μg/ml的氨苄青霉素和25μg/ml的lb液体培养基中过夜震荡培养,碱裂解法提取质粒,并用限制性内切酶进行酶切验证,如图1所示,大小与预期相符,表明构建正确。
3、表达质粒的构建
⑴大肠杆菌m15化学感受态细胞制备:
a、细菌培养:挑取大肠杆菌m15单个菌落于5ml液体lb培养基(含卡那霉素25μg/ml)中,
b、0.1mol/l氯化镁溶液处理:将培养液于
c、0.1mol/l氯化钙溶液处理:10ml氯化钙溶液重悬沉淀后冰浴20min,而后
d、0.1mol/l氯化钙/15%甘油保存:用2ml混合溶液重悬沉淀,混匀后以200μl/管(离心管预先冰浴10min)分装,最终于
⑵用bamhi对质粒pqe30以及克隆有裂解酶gp57基因的t载体质粒进行酶切,酶切体系如下:
gp57基因的100μl酶切反应体系:
将反应体系混匀,
⑶使用胶回收试剂盒对pqe30质粒以及裂解酶gp57基因片段进行回收.
⑷将pqe30质粒去磷酸化,并将质粒进行回收
⑸将gp57酶切回收产物与去磷酸化后的pqe-30质粒载体进行连接,连接体系如下:
gp57回收产物4μl
载体pqe-301μl
dna连接酶solutioni5μl
将反应体系混匀,
⑹取5μl连接产物和100μl大肠杆菌m15感受态细胞混匀。冰浴30min后于
⑺挑取菌落至5mllb液体培养基中过夜震荡培养,碱裂解法提取质粒进行双酶切验证,结果表明质粒载体中具有目的核苷酸序列。将鉴定正确的重组质粒载体命名为pcnp-gp57-pqe30、hpp-gp57-pqe30,并将载有重组质粒的工程菌命名为jzy16-01、jzy16-02。
挑取白色菌落至含有100μg/ml的氨苄青霉素和25μg/ml的lb液体培养基中过夜震荡培养,碱裂解法提取质粒,并用限制性内切酶进行酶切验证,如图1所示,大小与预期相符,初步表明构建正确,对重组质粒进行测序,测序结果表明重组质粒pcnp-gp57-pqe30、hpp-gp57-pqe30与设计序列一致,表明构建成功。
实施例3裂解酶在大肠杆菌中的高效表达
将冻存的重组菌jzy16-01、jzy16-02菌液接种单菌落于20mllb液体培养基(含氨苄青霉素100μg/ml、卡那霉素25μg/ml)中,
将粗酶液用his亲和层析镍柱(gehealthcare,sweden)纯化,具体按试剂盒说明步聚进行。获得蛋白命名为裂解酶hpp-gp57、pcnp-gp57。
sds-page分析结果如图2所示,纯化后的裂解酶gp57、hpp-gp57、pcnp-gp57泳道中分别出现22.73kda、23.67kda、23.97kda的融合蛋白条带,说明裂解酶均为可溶表达并且可通过ni2+-nta亲和层析纯化。通过quantityone软件(bio-rad)分析sds-page电泳图,结果发现,纯化的裂解酶蛋白的纯度均能够达到90%以上。
实施例4裂解酶gp57的底物特异性
1、将过夜培养物按3%接种量转接到20mllb培养基中,培养至od600=0.6-0.8;将菌液置于离心管中,4000g,15min,4℃离心。
2、革兰氏阴性菌去除细胞外膜后同革兰氏阳性菌一样用10mmol/l磷酸盐缓冲液(ph=7)洗2次;
3、取等体积的裂解酶加入96孔板至裂解酶终浓度为50μg/ml,用混匀的菌悬液170μl补至总反应体积为200μl;
4、以等体积缓冲液为阴性对照,设置3个平行,每隔3min测定吸光度od600,反应温度为室温。
结果如表1所示,表明裂解酶对铜绿假单胞菌、霍乱弧菌、恶臭假单胞菌、枯草芽孢杆菌、地衣芽孢杆菌有极其明显的裂解作用,这表明该裂解酶gp57不仅能裂解革兰氏阴性菌还能裂解革兰氏阳性菌,具有一定的广谱性。
实施例5裂解酶gp57、hpp-gp57、pcnp-gp57热稳定性的测定
1、铜绿假单胞菌去除细胞外膜。
2、取9份体积为100μl的裂解酶,分别置于20-100℃的水浴锅中处理15min,置于室温复性20min。
3、分别取经不同温度处理的裂解酶30μl加入96孔板,用混匀的菌悬液170μl补至总反应体积为200μl,裂解酶终浓度为0.05μg/ml;以等体积缓冲液为阴性对照,设置3个平行,每隔3min测定吸光度od600,反应温度为室温。
结果如图3所示,经不同温度处理后,裂解酶gp57、hpp-gp57、pcnp-gp57均仍能保持一定的裂解能力,40℃处理15min,gp57的酶活只是原来的10%,裂解酶hpp-gp57、pcnp-gp57分别还剩60%、80%以上,这表明衍生裂解酶hpp-gp57、pcnp-gp57的热稳定性较好。
实施例6裂解酶gp57以及衍生裂解酶hpp-gp57、pcnp-gp57的杀菌能力分析
1、将过夜培养物按3%接种量转接到100mllb培养基中,培养至od600=0.6-0.8
2、将菌液置于离心管中,4000×g,4℃,离心10min富集细胞,用0.9%的生理盐水重悬细胞,4000×g,4℃,离心15min,洗一次,再用适量0.9%的生理盐水将m15大肠杆菌、铜绿假单胞菌pak、枯草芽孢杆菌、地衣芽孢杆菌重悬至od600=0.8-0.9左右,备用。
3、用0.9%的生理盐水作阴性对照,不同裂解酶作为实验组,反应1h,用0.9%的生理盐水10梯度稀释,取合适浓度涂板,37℃,倒置静置过夜培养,计菌落数。裂解酶gp57、hpp-gp57、pcnp-gp57终浓度为200μg/ml。由涂板获得的数据带入公式抗菌活性(%)=(i0-ii)/i0%(i0:0h未处理的菌落数;ii:被处理1h后的菌落数)获得抗菌活性即杀菌率。
结果如图4a所示,以pak为指示菌时,衍生裂解酶pcnp-gp57的杀菌率是裂解酶gp57的1.33倍,如图4b所示,以地衣芽孢杆菌1686为指示菌时,衍生裂解酶pcnp-gp57的杀菌率是裂解酶gp57的1.24倍,说明衍生裂解酶pcnp-gp57的杀菌能力高于裂解酶gp57。
实施例7裂解酶与表面活性剂的协同作用
1、将过夜培养物按3%接种量转接到100mllb培养基中,培养至od600=0.6-0.8;
2、将菌液置于离心管中,4000×g,4℃,离心10min富集细胞,用0.9%的生理盐水重悬细胞,4000×g,4℃,离心15min,洗一次,再用适量0.9%的生理盐水将m15大肠杆菌重悬至od600=0.9左右,备用
3、用0.9%的生理盐水作阴性对照,裂解酶、lab-35、聚赖氨酸作为实验组,反应1h,用0.9%的生理盐水10倍梯度稀释后,取合适浓度涂板,37℃,倒置静置过夜培养,计菌落数。lab-35终浓度为0.004%,聚赖氨酸终浓度为10μg/ml,裂解酶终浓度为200μg/ml。由涂板获得的数据带入公式杀菌率=lg(i0/ii)时(i0:0h未处理的菌落数;ii:被处理1h后的菌落数)获得抗菌活性值,除去对照,与最高抗菌活性值相比获得相对酶活。
结果如图5所示,实验中,lab-35终浓度为0.004%,聚赖氨酸终浓度为10μg/ml,裂解酶终浓度为200μg/ml,裂解酶gp57、hpp-gp57、pcnp-gp57分别与lab-35、聚赖氨酸混合验证裂解酶与表面活性剂的协同作用时,发现以铜绿假单胞菌为底物时,阴性对照、gp57、hpp-gp57、pcnp-gp57、pl、lab-35、gp57+pl、hpp-gp57+pl、pcnp-gp57+pl、gp57+lab-35、hpp-gp57+lab-35、pcnp-gp57+lab-35的相对活细胞率(%)分别为100、37.5、56.4、16.9、96.8、94.2、11.2、40.2、6.9、51.6、53.4、25.6(图5a),可明显看出裂解酶与聚赖氨酸具有协同作用,与lab-35没有协同作用,以枯草芽孢杆菌为底物的情况下,阴性对照、gp57、hpp-gp57、pcnp-gp57、pl、lab-35、gp57+pl、hpp-gp57+pl、pcnp-gp57+pl、gp57+lab-35、hpp-gp57+lab-35、pcnp-gp57+lab-35的相对活细胞率(%)分别为100、13.8、44.4、12.7、11.6、69.2、5.6、5.6、5.2、11.4、11.4、11.2(图5b),证明裂解酶与聚赖氨酸、lab-35均具有协同作用,可进一步提高裂解酶对枯草芽孢杆菌的杀菌能力,为裂解酶的应用提供有效参考数据
实施例8
裂解酶以及衍生裂解酶对聚苯乙烯材质上细菌生物被膜形成的抑制作用
1、向96孔板中每孔加入200μl配制好的1/3液体培养基,分别按照3%、1%接种量将sk98、地衣芽孢杆菌接种到1/3液体培养基,以无菌生理盐水为阴性对照,将裂解酶加到96孔板中,至终浓度为500μg/ml,于37℃下孵育48h。
2、取出培养板,弃掉培养液与浮游菌,静态水洗3次去除生物被膜表面粘附的游离菌。每孔加200μl结晶紫染色15min后,静态水洗3次去结晶紫,每孔加200μl无水乙醇溶解15min,将含有生物被膜的无水乙醇移至新的96孔板中,测定od595。
结果如图6所示,对九株阳性菌有不同程度的抑制作用,最高可使生物被膜的形成量降低94.9%;只对sk98、pak、d1、e1、b12、b13、b15、tj45、tj54、6-5十株革兰氏阴性菌中的sk98的生物被膜具有明显抑制。
实施例9
裂解酶以及衍生裂解酶对聚苯乙烯材质上成熟细菌生物被膜的裂解作用
1、向96孔板中每孔加入200μl配制好的1/3液体培养基,按照1%接种量将菌接种到1/3液体培养基,以无菌生理盐水为阴性对照,于37℃下孵育48h。
2、取出培养板,弃掉培养液与浮游菌,静态水洗3次去除生物被膜表面粘附的游离菌。
3、将裂解酶加到96孔板中,至每孔的终浓度为500μg/ml,室温作用2h,弃掉裂解酶,静态水洗3次去除生物被膜表面被裂解的生物被膜,每孔加200μl结晶紫染色15min后,静态水洗3次去处结晶紫,每孔加200μl无水乙醇溶解15min,将含有生物被膜的无水乙醇移至新的96孔板中,测定od595。
结果如图7所示,对十株革兰氏阳性菌有不同程度的裂解作用,最高可去除91.2%的生物被膜量;只对sk98、pak、d1、e1、b12、b13、b15、tj45、tj54、6-5十株革兰氏阴性菌中的sk98的生物被膜具有裂解作用。
表1
sequencelisting
<110>天津科技大学
<120>铜绿假单胞菌噬菌体裂解酶及应用
<130>2017-04-07
<160>8
<170>patentinversion3.3
<210>1
<211>196
<212>prt
<213>铜绿假单胞菌噬菌体裂解酶
<400>1
metglyserphephevalalaproglyserseralaleuthrglugln
151015
asppheglnseralaalaaspaspleuglyvalaspvalalaserval
202530
lysalavalthrlysvalgluserargglyserglypheleuleuser
354045
glyvalprolysileleuphegluarghistrpmetphelysleuleu
505560
lysarglysleuglyargaspprogluileasnaspvalcysasnpro
65707580
lysalaglyglytyrleuglyglyglnalagluhisgluargleuasp
859095
lysalavallysmetaspargaspcysalaleuglnseralasertrp
100105110
glyleupheglnilemetglyphehistrpglualaleuglytyrala
115120125
servalglnalaphevalasnalaglntyralasergluglysergln
130135140
leuasnthrphevalargpheilelysthrasnproalailehislys
145150155160
alaleulysserlysasptrpalagluphealaargargtyrasngly
165170175
proasptyrlyslysasnasntyraspvallysleualaglualatyr
180185190
glnserphelys
195
<210>2
<211>195
<212>prt
<213>铜绿假单胞菌噬菌体裂解酶及应用
<400>2
metlysarglyslysarglyslysarglysalaleuthrgluglnasp
151015
pheglnseralaalaaspaspleuglyvalaspvalalaservallys
202530
alavalthrlysvalgluserargglyserglypheleuleusergly
354045
valprolysileleuphegluarghistrpmetphelysleuleulys
505560
arglysleuglyargaspprogluileasnaspvalcysasnprolys
65707580
alaglyglytyrleuglyglyglnalagluhisgluargleuasplys
859095
alavallysmetaspargaspcysalaleuglnseralasertrpgly
100105110
leupheglnilemetglyphehistrpglualaleuglytyralaser
115120125
valglnalaphevalasnalaglntyralasergluglyserglnleu
130135140
asnthrphevalargpheilelysthrasnproalailehislysala
145150155160
leulysserlysasptrpalagluphealaargargtyrasnglypro
165170175
asptyrlyslysasnasntyraspvallysleualaglualatyrgln
180185190
serphelys
195
<210>3
<211>591
<212>dna
<213>铜绿假单胞菌噬菌体裂解酶基因
<400>3
atgggatccttcttcgtagcaccgggctcctccgctctaactgagcaagacttccaatcg60
gctgccgatgatctcggagtcgatgttgccagtgtaaaggccgtcactaaggtagagagt120
cgtgggagcggctttctactttctggcgtccctaagattctattcgaaaggcactggatg180
ttcaagcttctcaaaaggaagctaggtcgtgaccctgaaataaacgacgtttgcaaccct240
aaagctggaggatacctcggcggacaagcggagcacgaacgtctagataaagcagtcaaa300
atggatagagactgcgcacttcaaagtgcctcttggggcctattccagattatgggattc360
cattgggaggcactaggttatgcgagtgttcaggcatttgtcaatgcccagtatgctagc420
gagggatcgcaactaaacacttttgtgcgcttcatcaagaccaacccggcaattcacaaa480
gctttaaagtctaaggactgggcagaattcgcaagaaggtataacgggccggattacaag540
aaaaacaactacgatgttaagctagcagaagcctatcaatccttcaagtaa591
<210>4
<211>588
<212>dna
<213>铜绿假单胞菌噬菌体裂解酶基因
<400>4
atgaaacgcaagaaacgtaagaaacgcaaagctctaactgagcaagacttccaatcggct60
gccgatgatctcggagtcgatgttgccagtgtaaaggccgtcactaaggtagagagtcgt120
gggagcggctttctactttctggcgtccctaagattctattcgaaaggcactggatgttc180
aagcttctcaaaaggaagctaggtcgtgaccctgaaataaacgacgtttgcaaccctaaa240
gctggaggatacctcggcggacaagcggagcacgaacgtctagataaagcagtcaaaatg300
gatagagactgcgcacttcaaagtgcctcttggggcctattccagattatgggattccat360
tgggaggcactaggttatgcgagtgttcaggcatttgtcaatgcccagtatgctagcgag420
ggatcgcaactaaacacttttgtgcgcttcatcaagaccaacccggcaattcacaaagct480
ttaaagtctaaggactgggcagaattcgcaagaaggtataacgggccggattacaagaaa540
aacaactacgatgttaagctagcagaagcctatcaatccttcaagtaa588
<210>5
<211>55
<212>dna
<213>hpp-lysgp57-f
<400>5
gagctcatgggatccttcttcgtagcaccgggctcctccgctctaactgagcaag55
<210>6
<211>26
<212>dna
<213>hpp-lysgp57-r
<400>6
ctgcagttacttgaaggattgatagg26
<210>7
<211>55
<212>dna
<213>pcnp-lysgp57-f
<400>7
cgcggatccatgaaacgcaagaaacgtaagaaacgcaaagctctaactgagcaag55
<210>8
<211>29
<212>dna
<213>pcnp-lysgp57-r
<400>8
cggggtaccttacttgaaggattgatagg29
- 还没有人留言评论。精彩留言会获得点赞!
- 检测水中铜绿假单胞菌和toxA的引物、试剂盒和方法与流程
- 一株可裂解多重耐药铜绿假单胞菌的噬菌体及其治疗感染的应用的制作方法与工艺
- 芪类化合物在抑制铜绿假单胞菌群体感应系统中的应用的制作方法与工艺
- 利用群体感应调控铜绿假单胞菌好氧反硝化以除废水中硝酸盐的方法与流程
- 适用于广泛耐药铜绿假单胞菌的筛查培养基及制备方法与流程
- 一株用于细菌病害防治的假单胞菌及应用的制造方法与工艺
- 一种利用高产鼠李糖脂的铜绿假单胞菌降解石油的方法与流程
- D‑色氨酸在抑制铜绿假单胞菌产弹性蛋白酶中的应用的制造方法与工艺
- 用于RPA快速检测携带喹诺酮类耐药基因的铜绿假单胞菌的引物及其应用的制造方法与工艺
- 铜绿假单胞菌噬菌体裂解酶及应用的制造方法与工艺