一组用于羊源性的实时荧光PCR检测的特异性引物和探针的制作方法
本发明属于食品检测技术领域,具体涉及一组用于羊源性实时荧光PCR检测的特异性引物和探针。
背景技术:
羊肉包括绵羊肉和山羊肉,因其具有天然的滋补功效,长期以来都受到广大消费者的青睐。随着市场流通的日益发达,羊肉经过冷冻、加工后再出售已成为现代市场营销的主要手段,但是羊肉一般经过冷冻,特别是经过加工后的熟羊肉通过感官检查已很难区分真伪,因为一些不法商贩在高额利润的驱使下,在肉制品的生产和销售中利用鸭肉或猪肉以假充真、以次充好,这引起了广大消费者的强烈愤慨。这不仅仅涉及到经济、营养等问题,更直接影响着消费者的健康,尤其是对某些食物过敏的消费者。此外,还会涉及到宗教信仰的问题,如在清真食品中掺杂进猪肉等。
目前许多国家已颁布法令禁止将羊源性成分作为蛋白质添加到饲料中。为避免此类事件的发生,人们开始用多种方法检测肉骨粉中的羊源性成分,其中主要包括显微镜检法、近红外光镜法、ELISA法和PCR方法。但随着PCR技术的不断发展,我们发现,科学研究中普遍使用的实时荧光定量PCR方法和普通PCR相比,在羊源性的检测工作中无论是在操作简便性还是反应灵敏度方面都具有更大的优势。
实时荧光定量PCR技术是在PCR反应体系中加入荧光基团,利用荧光积累实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析。在试验中使用了探针检测,随着PCR反应的进行,当合成的新链移动到探针结合位置时,Taq酶将探针切断,探针的完整性遭到破坏,荧光报告基团的荧光信号被释放出来。模板每复制一次,就有一个探针被切断,同时伴有一个荧光信号的释放。产物与荧光信号产生一对一的对应关系,随着产物的增加,荧光信号不断增强,从而对整个PCR反应过程进行实时和动态的监测分析。
本发明根据羊特异性线粒体DNA片段,设计合成一对引物,利用引物建立一种运用PCR技术鉴定真假羊肉的方法,并对大量市售羊肉制品进行羊源性成分检测,为保护广大消费者的利益和进一步落实食品质量安全市场准入制度提供了技术保障,也更好地为食品监管部门提供强有力的技术支持。
技术实现要素:
本发明目的在于设计一组羊源性特异性引物和探针序列,建立一种能广泛应用于动物饲料和羊肉中羊源性成分检测的快速、灵敏、特异性好的荧光定量PCR检测的方法。本发明采用基因克隆技术,将羊源性DNA的cytb基因种内保守片段插入到载体pMD18-T中,获得含有cytb基因片段的重组质粒,以此作为标准品。根据羊源性cytb的基因片段编码基因序列设计并合成一组特异性引物和探针,优化PCR反应条件,建立以实时荧光定量聚合酶链反应为平台的检测方法,并对所建立的方法进行评估。
本发明的第一个目的是提供了一组用于羊源性实时荧光PCR检测的特异性引物和探针,所述特异性引物和探针的核苷酸序列为(1)或(2)中的一种:
(1)、上游引物:5'- TTTGCGACAATAGCCACAGC -3'
下游引物:5'- ATCGGGTGAGGGTAGCTTTGT -3'
探针:5'- TCATTCTGAGGAGCAACAGTTATTACCAA -3'
所述引物和探针扩增的目标核苷酸序列为序列表中SEQ ID No.3;
(2)、与(1)所述序列互补的序列。
作为优选,所述探针的5’端荧光报告基团是FAM,3’端标记的是荧光淬灭基团TAMRA。
本发明的第二个目的是提供羊源性的PCR检测试剂盒,所述试剂盒为羊源性的定性或定量检测试剂盒;所述试剂盒包括权利要求1所述的引物和探针;
作为优选,所述定量检测试剂盒还包括标准品,所述标准品的制备方法为:将羊源性保守基因片段插入到载体pMD18-T中,转化至大肠杆菌中进行诱导表达,获得含有羊源性保守基因片段的重组质粒,以此作为标准品;所述羊源性保守基因片段为序列表中SEQ ID No.2;
作为进一步优选,所述羊源性保守基因片段是以序列表中SEQ ID No.1的核苷酸序列为模板,使用下述引物进行PCR扩增获得的:
上游引物:5'- CTAGAAACATGAAACATCGGAGTA -3'
下游引物:5'- AATGGTGTAATAAGGGTGGAA -3';
作为优选,所述PCR扩增的条件为:94℃预变性5min;94℃ 30s、55℃ 30s、72℃30s,35个循环;72℃ 10min。
本发明的第三个目的是提供上述特异性引物和探针在制备定性或定量检测羊源性的试剂盒中的应用。
作为优选,所述应用是分别以标准品和待测样品DNA为模板,利用特异性引物和探针进行实时荧光定量PCR,通过标准曲线和待测样品的Ct值判定结果。
作为优选,所述实时荧光定量PCR的反应条件为:94℃ 预变性2分钟,94℃ 15秒、60℃ 40s并收集荧光信号,40个循环。
本发明的第四个目的是提供羊源性的实时荧光定量PCR检测方法,所述检测方法不以有生命的人体或动物体为直接实施对象,步骤如下:
(1)制备标准品:将羊源性保守基因片段插入到载体pMD18-T中,转化至大肠杆菌中进行诱导表达,获得含有羊源性保守基因片段的重组质粒,以此作为标准品;所述羊源性保守基因片段为序列表中SEQ ID No.2;
(2)使用权利要求1所述的特异性引物和探针对待测样品和标准品采用相同的反应体系进行实时荧光PCR扩增;
(3)标准曲线绘制;
(4)通过标准曲线和待测样品的Ct值进行羊源性的快速定量检测。
作为优选,步骤(1)中所述羊源性保守基因片段是通过以下引物扩增得到的:
上游引物为5'- CTAGAAACATGAAACATCGGAGTA -3';
下游引物为5'- AATGGTGTAATAAGGGTGGAA -3';
作为优选,PCR扩增所述羊源性保守基因片段的条件为:94℃预变性5min;94℃ 30s、55℃ 30s、72℃ 30s,35个循环;72℃ 10min;
作为优选,步骤(2)中所述引物和探针的用量均为1.6μl;
作为优选,步骤(2)中所述实时荧光PCR扩增的反应条件为:94℃ 预变性2分钟,94℃ 15秒、60℃ 40s并收集荧光信号,40个循环。
本发明的第五个目的是提供羊源性的定性PCR检测方法,所述检测方法不以有生命的人体或动物体为直接实施对象,步骤如下:
(1)使用权利要求1所述的特异性引物和探针对待测样品进行实时荧光PCR扩增;
(2)通过待测样品的Ct值对羊源性进行定性检测:当Ct值小于38时,为阳性;否则,为阴性;
作为优选,步骤(1)中所述引物和探针的用量均为1.6μl;
作为优选,步骤(1)中所述实时荧光PCR扩增的反应条件为:94℃ 预变性2分钟,94℃ 15秒、60℃ 40s并收集荧光信号,40个循环。
本发明提供用于对羊源性进行定性、定量检测的引物和探针,通过提取待检测样品的DNA结合实时荧光定量PCR检测技术,可达到准确定量待测动物饲料和羊肉中羊源性含量的目的。本发明所提供的引物和探针可对动物饲料和羊肉的羊源性含量进行定性、定量分析,对判断动物饲料和羊肉中羊源性含量具有重要意义,本发明将在食品检测领域发挥重要作用。
附图说明
附图用来提供对本发明的进一步理解,并且构成说明书的一部分,与本发明的实施例一起用于解释本发明,并不构成对本发明的限制。在附图中:
图1为引物和探针体系优化实验结果;其中,a代表引物为1.6μl,探针为1.6 μl;b代表引物为1.0μl,探针为1.6 μl;c代表引物为1.0μl,探针为0.8 μl;d代表引物为2.0μl,探针为0.8 μl;e代表引物为1.6μl,探针为0.8 μl;f代表引物为2.0μl,探针为1.0 μl;g代表引物为1.0μl,探针为0.8 μl;h代表引物为1.0μl,探针为1.0 μl;i代表引物为2.0μl,探针为1.6 μl;
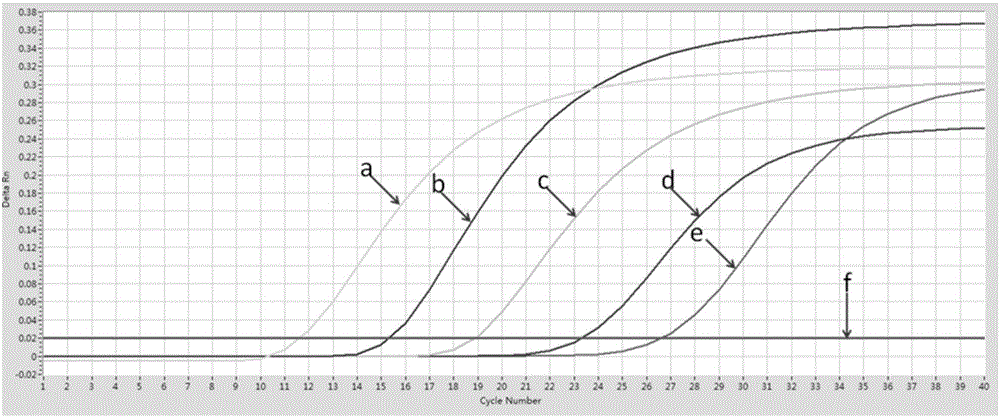
图2为灵敏度实验结果;其中,a代表质粒浓度为1.00×107copies/ml、b代表质粒浓度为1.00×106copies/ml、c代表质粒浓度为1.00×105copies/ml、d代表质粒浓度为1.00×104copies/ml、e代表质粒浓度为1.00×103copies/ml、f代表质粒浓度为1.00×102copies/ml和阴性对照;
图3为特异性实验结果;其中,出现标准扩增曲线的为羊,未出现标准扩增曲线的为猪、牛、狗、鱼、鸡、鸭、鹅、兔、驴、蛙、鼠、阴性对照。
图4为羊源性标准曲线。
具体实施方式
下面结合附图及具体实施方案对本发明做更详细阐述。以下的实施例便于更好地理解本发明,但并不限定本发明。下述实施例中的实验方法,如无特殊说明,均为常规方法。所用引物、探针和所用序列测定工作均由生工生物工程(上海)股份有限公司合成和完成。
实施例1 cytb基因标准品的制备
要建立实时荧光定量PCR方法,首先必须制备方法所需的外部标准品,标准品应包含高度保守、特异的序列,要保证反应的高特异性。动物线粒体DNA具有分子量小、结构保守、热稳定性好、不易降解的结构特点和母系遗传、拷贝数多、进化速度快、不发生重组的遗传特点,其中线粒体细胞色素b(cytb)基因序列最为保守型。cytb基因检测羊源性,有较高的敏感性和特异性。本发明主要采用PCR技术扩增羊源性cytb基因,利用基因重组技术将其连接到质粒载体pMD18-T中,构建出重组质粒pMD18-T-sheepcytb,并进行相应的PCR鉴定和测序鉴定,最后经定量作为待建立方法的标准品,为下一步的方法及评估奠定基础。
一、模板DNA的制备
1.提取羊肝脏组织基因组DNA,用作cytb基因PCR扩增的模板;提取基因组DNA的试剂盒为细胞/组织基因组DNA提取试剂盒(离心柱型)采购自百泰克生物技术有限公司;
(1)取1.5g新鲜羊肝脏组织用液氮研磨成粉末,加到5ml离心管中,加入4ml SE缓冲液,混匀,4500 r/mim离心15min;
(2)吸取上清,4℃ 12000 r/min离心20min,弃上清,收集沉淀;
(3)加入400μl Buffer Digestion,震荡混匀。65℃水浴1-3h至细胞完全裂解 (注意:1、水浴过程中,每10分钟颠倒混匀一次,可促进样品裂解。混合液变澄清透明为裂解完全。如溶液未变澄清,说明细胞裂解不彻底,应当延长水浴时间,否则将可能降低DNA的得率或导致提取的DNA不纯。2、如需得到无RNA的DNA,可在水浴后加入20μl的Rnase A,室温放置2-5分钟)加入200μl Buffer PA,充分颠倒混匀,置于-20℃冰箱放置5min;
(4)4℃ 10000rpm离心5分钟,将上清转移至新管中;
(5)加入等体积的异丙醇,颠倒5-8次使之充分混匀-20℃,放置20min;
(6)4℃ 10000rpm离心10分钟,弃上清;
(7)加入1ml预冷的75%的乙醇,漂洗1-3min,4℃ 10000rpm离心2分钟,弃上清;
(8)开盖室温倒置10-20min,至残留的乙醇完全挥发。得到的DNA用30-50μl纯净水溶解;
(9)提取的DNA可进行下一步实验或-20℃保存。
2. 动物饲料中羊源DNA的提取
(1)称取0.5-2g肉骨粉样品于10ml离心管中,加入适量含10% SDS (采购自百泰克生物技术有限公司)和10μg/ml蛋白酶K(蛋白酶K采购自百泰克生物技术有限公司)的裂解液,37℃保温过夜;
裂解液的配方为:7M Urea(60. 06) 4.2042 g
2M thiourea(76.12) 1.5224 g
100mM DTT 0.1543 g
4% CHAPS 0.4 g
0.5mM EDTA 0.00146 g
40Mm Tris 0.0485 g
2%(v/v) NP-40 0.2 ml
1%(v/v) Triton X-100 0.1 ml
5mM PMSF用前加 0.00871 g
2%pharmalyte 0.2ml;
(2)2000g离心5min。取离心上清液,加等体积酚/氯仿/异戊醇(25/24/1)(采购自大连宝生生物技术有限公司)混匀,静置5min;
(3)8000g离心5min。取离心上清液加0.65倍体积的异丙醇(异丙醇含量≥99%采购自国药集团化学试剂有限公司),混匀,12000g 4℃离心10min;
(4)弃上清液,加500μL 70%冰乙醇(采购自国药集团化学试剂有限公司);
(5)12000g 4℃离心5min。取沉淀,吹干。加50μL TE或ddH2O溶解白色沉淀,此即为DNA提取物。
二、cytb基因片段的PCR扩增
1、引物的设计与合成
本发明通过对NCBI数据库中羊cytb全序列进行生物信息学比对分析,选取适合设计引物和探针的保守片段序列为靶目标,应用Primer express 3软件、Primer Premier 5软件以及Oligo 7软件,设计了一组实时荧光定量PCR引物和探针以及一组相关序列的外围引物。
本发明选取的扩增序列如下:
该外围引物序列如下:
上游引物:sheepcytb328F:5'-CTAGAAACATGAAACATCGGAGTA -3'
下游引物:sheepcytb678R:5'-AATGGTGTAATAAGGGTGGAA-3'
扩增片段大小为:351bp。
2、PCR反应体系和反应条件
以DNA为模板,以上述外围引物sheepcytb328F / sheepcytb678R为扩增引物,采用下述体系和反应条件进行PCR扩增。
PCR反应体系:
10×PCR buffer 5μl
dNTP(2.5μM) 2μl
引物F(10μM) 2μl
引物R(10μM) 2μl
模板 2.4μl
Taq酶(5U) 1.6μl
ddH2O 35μl
总体积 50μl。
其中引物采用sheepcytb328F / sheepcytb678R,Taq酶采用北京百泰克Power Taq Plus DNA Polymerse,PCR扩增仪为北京百泰克iCycling系列96梯度PCR仪。
扩增程序/反应条件:
94℃预变性5min;94℃ 30s、55℃ 30s、72℃30s,35个循环;72℃ 10min,取5μL扩增产物进行1%琼脂糖电泳,检测PCR产物大小,然后采用Axygen公司生产的DNA凝胶回收试剂盒纯化回收剩余的PCR扩增产物。
三、重组质粒pMD18-T-sheepcytb的构建和转化
1、连接反应:将上述纯化得到的PCR扩增产物与pMD18-T(大连宝生物公司)进行连接,采用如下连接体系进行配制:
pMD18-T vector 1μL
回收DNA 2μL
SolutionⅠ 5μL
ddH2O 2μL
总体积 10μL。
配制完成后置于16℃进行过夜连接反应。
2、pMD18-T-sheepcytb质粒的转化以及PCR鉴定
(1)从-70℃的超低温冰箱中取出冻存的DH5α感受态细胞,置于冰盒上使其自然解冻;
(2)取连接产物10μL加入50μL的DH5α感受态细胞中,轻轻摇匀后置冰浴30分钟;
(3)42℃水浴中热休克90秒,热休克后立即置冰上冷却2min;
(4)向1.5ml EP管中加入预冷的400μl的LB液体培养基(不含氨苄青霉素)混匀后,37℃ 200转/分轻摇培养1h;
(5)将上述培养液摇匀后取100ul涂布于含100mg/ml Amp、24mg/ml IPTG、20mg/ml X-gal的LB平板上,正面向上放置30min,待菌液完全被培养基吸收后,倒置培养皿37℃恒温箱培养过夜;
(6)次日观察,从平板上挑取白色单克隆菌落于100μL LB液体培养基(含100mg/ml氨苄青霉素)的PCR管中,37℃振荡培养2-3小时。吸取2μL作为模板进行PCR鉴定,剩余的菌液加入到20ml的LB液体培养基中进行扩摇;
(7)用载体通用引物RV-M/M13-47扩增上述稀释菌液,PCR产物采用1%琼脂糖凝胶电泳,通过检测PCR产物大小鉴定阳性转化子。
引物RV-M/M13-47序列如下:
引物 RV-M: 5’-GAGCGGATAACAATTTCACACAGG-3’
引物 M13-47: 5’-CGCCAGGGTTTTCCCAGTCACGAC-3’
PCR反应体系如下:
10×PCR buffer 2.5μL
dNTP(2.5μM) 0.5μL
引物F(10μM) 0.5μL
引物R(10μM) 0.5μL
模板 2μL
Taq 酶(5U) 0.5μL
ddH2O 18.5μL
总体积 25μL。
扩增程序/反应条件:94℃预变性5min;94℃ 30s、55℃ 30s、72℃ 1min,35个循环;72℃ 10min。
(8)采用Axygen公司生产的质粒制备试剂盒提取阳性重组质粒,测定浓度和纯度,同时吸取一部分纯化质粒送至上海生物工程有限公司进行测序,确定插入片段的基因序列与目的序列一致。
四、标准品的获取和定量
1、将步骤三得到的含有重组质粒pMD18-T-sheepcytb的大肠杆菌DH5α100μL转种于5mL的LB液体培养基,37℃ 200rpm过夜摇培;
2、取1ml培养过夜的菌液转种于30ml LB液体培养基,200rpm 增菌培养2-3小时,然后采用Axygen公司生产的质粒制备试剂盒提取质粒;
3、利用北京百泰克生物科技有限公司超微量紫外可见分光光度计(ND5000)对提取的质粒进行测定,测定A260、A280,根据A260/A280判断质粒的纯度。
4、质粒pMD18-T-sheepcytb浓度(拷贝数)计算
(1)质粒的分子量=3043bp×660(每对碱基的平均分子量)
(2)测得质粒浓度为100.23ng/μl,质粒纯度A260/A280=1.94,A260/A230=2.01。因在进行实时荧光定量PCR时,需要以“拷贝数”为单位,因此需要将单位转换成copies/ml。
质粒 copies/ml=阿伏伽德罗常数×质粒摩尔数
其中阿伏伽德罗常数=6.02×1023copies/mol。
因此提取的质粒浓度copies/ml=100.23×10-9g/ml×6.02×1023copies/mol÷(3043bp×660g/bp·mol)=3.0×1010copies/m0l
10μl质粒+20μl的无菌水就得到浓度为1.00×1010copies/ml的质粒,再将该质粒进行10倍比稀释就可得到一系列浓度的质粒,作为系列标准品,并于-20℃保存备用。
实施例2 实时荧光定量PCR羊源性方法的建立
一、特异性引物和探针的设计与合成
以上述选取的羊的cytb基因的保守片段为靶目标,应用Primer express 3软件、Primer Premier 5软件以及Oligo 7软件,设计了一组实时荧光定量PCR引物和探针。
作为本发明的核心,一组用于羊源性实时荧光PCR检测的引物和探针核苷酸序列如下:
上游引物:sheepcytb361F:5’-TTTGCGACAATAGCCACAGC-3’
下游引物:sheepcytb512R: 5’-ATCGGGTGAGGGTAGCTTTGT-3’
探针:sheepcytb415P: 5’-TCATTCTGAGGAGCAACAGTTATTACCAA-3’
该引物和探针扩增目标核苷酸序列为:
探针5’端的荧光报告基团是FAM,3’端标记的是荧光淬灭基团TAMRA。
二、待测样本的制备
1、羊肉中羊源DNA的制备
羊肉中的羊源DNA提取采取的是羊肝脏部位,具体见实施例1步骤一“模板DNA的制备”,提取羊肝脏组织基因组DNA,用作cytb基因PCR扩增的模板。
2、动物饲料中羊源DNA的提取
1.称取0.5-2g肉骨粉样品于10ml离心管中,加入适量含10%SDS(采购自百泰克生物技术有限公司)和10μg/ml蛋白酶K(蛋白酶K采购自百泰克生物技术有限公司)的裂解液,37℃保温过夜;
2.2000g离心5min。取离心上清液,加等体积酚/氯仿/异戊醇(三者的体积比为25/24/1)(采购自大连宝生生物技术有限公司)混匀,静置5min;
3.8000g离心5min。取离心上清液加0.65倍体积的异丙醇(异丙醇含量≥99%,采购自国药集团化学试剂有限公司),混匀,12000g 4℃离心10min;
4.弃上清液,加500μL 70%冰乙醇(采购自国药集团化学试剂有限公司);
5.12000g 4℃离心5min。取沉淀,吹干。加50μL TE或ddH2O溶解白色沉淀,此即为DNA提取物。
三、实时荧光定量PCR条件优化
以浓度为1.00×106copies/ml的阳性质粒为模板,采用百泰克公司生产的2×real-time PCR Premixture(probe)实时荧光定量PCR试剂盒进行实验,实验采用的实时荧光定量PCR仪为苏州百源基因技术有限公司生产的ASA-9600实时荧光定量PCR仪。反应体系采用20μl 体系,其中引物和探针的量采用表1组合进行反应。
表1 PCR反应体系中引物和探针不同用量
反应条件:94℃ 预变性2分钟,94℃ 15秒、60℃ 40s并收集荧光信号,40个循环。结果参照图1,数据显示20μl 体系时,引物(5μM)和探针(5μM)分别加入1.6μl,Ct值最小,荧光信号最强。
四、方法评估
1、灵敏度实验
将实施例1制备得到的系列浓度的标准品进行实验,选取浓度为1.00×108copies/ml、1.00×107copies/ml、1.00×106copies/ml、1.00×105copies/ml、1.00×104copies/ml、1.00×103copies/ml、1.00×102copies/ml等作为梯度模板。反应体系如下:
2×premix 10μl
Primer F(5μM) 1.6μl
Primer R(5μM) 1.6μl
Probe(5μM) 1.6μl
模板 2μl
ddH2O补至 20μl。
反应条件:94℃ 预变性2分钟,94℃ 15秒、60℃ 40s并收集荧光信号,40个循环。根据仪器所检测到的荧光信号经软件处理获得荧光曲线,观察荧光曲线的信号,结果参照图2,数据显示当质粒浓度达到1.00×103copies/ml时依然有荧光信号,但质粒浓度达到1.00×102copies/ml时未检测到荧光信号,因此该方法的灵敏度为1.00×103copies/ml。
由图1和图2还可以看出,标准品的扩增曲线光滑。
2、特异性实验
为了证实本发明对羊源性检测的特异性,我们选取了常见的11种动物做特异性实验,选取的动物包括:猪、牛、狗、鱼、鸡、鸭、鹅、兔、驴、蛙、鼠。
该特异性试验包括用上述样本的基因组DNA为模板进行的试验。反应体系如下:
2×premix 10μl
Primer F(5μM) 1.5μl
Primer R(5μM) 1.5μl
Probe(5μM) 1.5μl
模板 2μl
ddH2O补至 20μl。
反应条件:94℃ 预变性2分钟,94℃ 15秒、60℃ 40s并收集荧光信号,40个循环。根据仪器所检测到的荧光信号经软件处理获得荧光曲线,观察荧光曲线的信号,分析特异性。结果参考图3,具体结果仅羊组织检测为阳性,其余动物均为阴性,表明本发明具有很好的特异性。检测结果如表2所示。
表2 特异性实验检测结果
3、标准曲线制备
以不同拷贝数的阳性模板的对数为横坐标,以PCR反应过程中到达荧光阈值的初始循环数(Ct)为纵坐标得到羊源性的标准曲线,作为待测样品定量测定的参照标准,结果参考图4。由图4可知,Ct值和拷贝数呈较好的线性关系;以模板初始拷贝数的对数为横坐标,Ct值为纵坐标,绘制出标准曲线方程,标准曲线原始方程为y=a+bx,本次标准曲线的方程为y=43.10-3.46x,所建立的标准曲线符合实时荧光PCR定量的要求。
4、待测样品的定量检测
以待测样品DNA和标准品的DNA为模板,用羊的特异性引物,以相同的体系同时进行羊cytb的基因片段的荧光定量PCR扩增。
PCR反应体系如下:
2×premix 10μl
Primer F(5μM) 1.6μl
Primer R(5μM) 1.6μl
Probe(5μM) 1.6μl
模板 2μl
ddH2O补至 20μl。
反应条件:94℃ 预变性2分钟,94℃ 15秒、60℃ 40s并收集荧光信号,40个循环。通过标准曲线和待测样品的Ct值进行动物饲料、植物油和羊肉中羊源性的快速定量检测。
5、待测样品的定性检测
以待测样品DNA为模板,用羊的特异性引物,对待测样品DNA进行羊cytb的基因片段的荧光定量PCR扩增。
PCR反应体系如下:
2×premix 10μl
Primer F(5μM) 1.6μl
Primer R(5μM) 1.6μl
Probe(5μM) 1.6μl
模板 2μl
ddH2O补至 20μl。
反应条件:94℃ 预变性2分钟,94℃ 15秒、60℃ 40s并收集荧光信号,40个循环。通过待测样品的Ct值对动物饲料、植物油和羊肉中中羊源性进行定性判断:当Ct值小于38时,为阳性;否则,为阴性。
最后应说明的是:以上所述仅为本发明的优选实施例而已,并不用于限制本发明,尽管参照前述实施例对本发明进行了详细的说明,对于本领域的技术人员来说,其依然可以对前述各实施例所记载的技术方案进行修改,或者对其中部分技术特征进行等同替换。凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
序列表
<110> 苏州百源基因技术有限公司
<120> 一组用于羊源性的实时荧光PCR检测的特异性引物和探针
<170> PatentIn version 3.5
<210> 1
<211> 1140
<212> DNA
<213> 人工序列
<400> 1
atgatcaaca tccgaaaaac ccacccacta ataaaaattg taaacaacgc attcattgat 60
ctcccagctc catcaaatat ttcatcatga tgaaactttg gctctctcct aggcatttgc 120
ttaattttac agattctaac aggcctattc ctagcaatac actatacacc tgacacaaca 180
acagcattct cctctgtaac ccacatttgc cgagacgtaa actatggctg aattatccga 240
tatatacacg caaacggggc atcaatattt tttatctgcc tatttatgca tgtaggacga 300
ggcctatact atggatcata taccttccta gaaacatgaa acatcggagt aatcctccta 360
tttgcgacaa tagccacagc attcataggc tatgttttac catgaggaca aatatcattc 420
tgaggagcaa cagttattac caacctcctt tcagcaattc catatattgg cacaaaccta 480
gtcgaatgaa tctggggagg attctcagta gacaaagcta ccctcacccg atttttcgcc 540
tttcacttta ttttcccatt catcatcgca gccctcgcca tagttcacct actcttcctc 600
cacgaaacag gatccaacaa ccccacagga attccatcgg acacagataa aattcccttc 660
cacccttatt acaccattaa agacatccta ggtgctatcc tactaatcct catcctcatg 720
ctactagtac tattcacgcc tgacttactc ggagacccag acaactacac cccagcaaac 780
ccacttaaca ctccccctca catcaaacct gaatgatact tcctatttgc gtacgcaatc 840
ttacgatcaa tccctaataa actaggagga gtcctcgccc taatcctctc aatcctagtc 900
ctagtaatta tacccctcct ccatacatca aagcaacgga gcataatatt ccgaccaatc 960
agtcaatgta tattctgaat cctagtagcc gacctattaa cactcacatg aattggaggc 1020
cagccagttg aacaccccta catcattatt ggacaactag catctattat atatttcctt 1080
atcattctag tcataatacc agtagctagc atcatcgaaa acaacctcct aaaatgaaga 1140
<210> 2
<211> 351
<212> DNA
<213> 人工序列
<400> 2
ctagaaacat gaaacatcgg agtaatcctc ctatttgcga caatagccac agcattcata 60
ggctatgttt taccatgagg acaaatatca ttctgaggag caacagttat taccaacctc 120
ctttcagcaa ttccatatat tggcacaaac ctagtcgaat gaatctgggg aggattctca 180
gtagacaaag ctaccctcac ccgatttttc gcctttcact ttattttccc attcatcatc 240
gcagccctcg ccatagttca cctactcttc ctccacgaaa caggatccaa caaccccaca 300
ggaattccat cggacacaga taaaattccc ttccaccctt attacaccat t 351
<210> 3
<211> 172
<212> DNA
<213> 人工序列
<400> 3
tttgcgacaa tagccacagc attcataggc tatgttttac catgaggaca aatatcattc 60
tgaggagcaa cagttattac caacctcctt tcagcaattc catatattgg cacaaaccta 120
gtcgaatgaa tctggggagg attctcagta gacaaagcta ccctcacccg at 172
- 还没有人留言评论。精彩留言会获得点赞!
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- 一种实时荧光定量PCR检测土壤西瓜枯萎病菌的方法及引物与制造工艺
- 一种基于反射镜的荧光定量PCR的检测系统的制造方法与工艺
- 一种基于荧光定量PCR鉴定啮齿类螺杆菌的引物、试剂盒及鉴定方法与流程
- 一种检测包含潜伏期结核感染的试剂盒及其引物对和探针的制造方法与工艺
- 用于甜瓜果实基因PCR表达分析的内参基因及该内参基因的稳定性验证方法与流程
- 一种特异性引物检测鼠源性成分的方法与制造工艺
- 一组用于驴源性的实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一组用于鸡源性实时荧光PCR检测的特异性引物和探针的制造方法与工艺
- 一种燕窝制品的实时荧光定量PCR鉴定试剂盒及其鉴定方法与制造工艺
- 一种具有移液功能的荧光定量PCR仪的制造方法与工艺
- 一种基于多灾种实时耦合的化工园区实时定量风险评估方法与制造工艺
- 一种实时荧光定量PCR检测方法及其标准品和检测试剂盒与制造工艺