一种检测DNA遗传标记的方法与流程
本发明涉及一种检测DNA遗传标记的方法,属于生物技术常染色体和Y染色体分型和鉴定领域。·
背景技术:
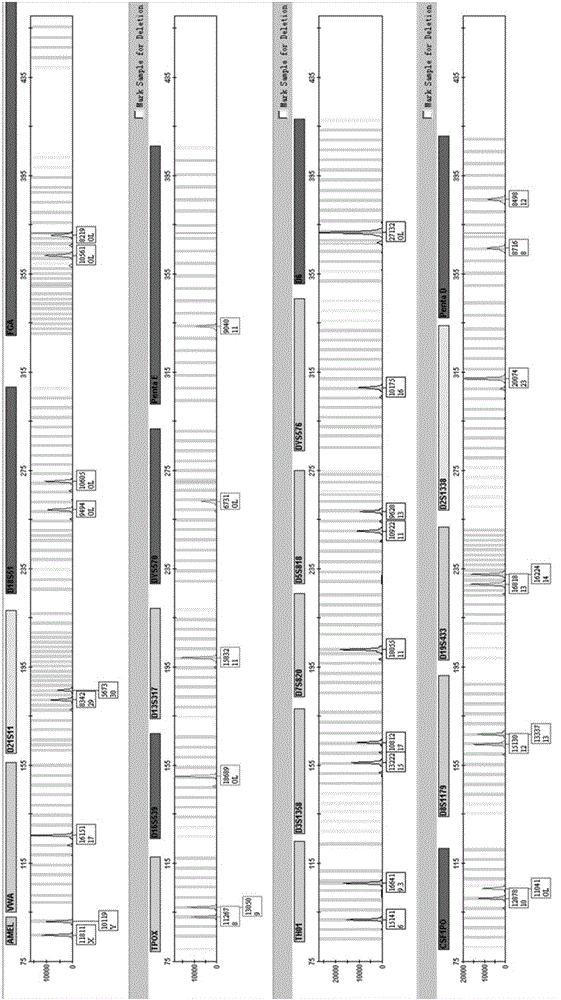
:人类基因组DNA中约有99.7%的DNA序列是相同的,因此在遗传水平上能够反映出个体之间差异的序列就需要在基因组中剩下的0.3%的DNA序列中去寻找。真核细胞中充满了重复的DNA序列,根据重复结构中核苷酸数目的多少可分为两类:数目可变串联重复序列(VariableNumberofTandemRepeats,VNTR)和短串联重复序列(ShortTandemRepeat,STR)。法医学的生物样本会发生严重降解,这给PCR扩增带来困难。而小片段STR的等位基因,在进行高分辨率毛细管电泳时容易达到单碱基的分辨率,因此STR已成为应用最广泛的重复序列标记。一般STR的核心序列重复单位数量为2到7个碱基,重复次数多达10~60次。STR重复序列以重复单位的长度来命名,根据碱基数的不同,分为二核苷酸重复、三核苷酸重复、四核苷酸重复、五核苷酸重复或六核苷酸重复。对于法医个体识别而言,使用多态性高的DNA遗传标记或者联合使用大量多态性较低的DNA遗传标记以获得足够的个体识别能力是非常重要的。四核苷酸重复比二核苷酸重复、三核苷酸重复更常使用,与它们相比具有以下优点:等位基因片段范围较小,可以进行多个基因座复合;等位基因片段范围较小,可减少小片段优势扩增造成的等位基因丢失;PCR扩增片段较小,有利于获得降解DNA的信息;滑移峰(stutter)产物比二核苷酸重复少,有利于混合样本的分析。因此,在过去的20年里,大量的四核苷酸重复STR基因被用于人类的个体识别。个体杂合子的两个等位基因,在大小上相似,因而都易于进行PCR扩增。而且STR基因座的高度多态性、分布广泛性和基因传递过程中遵循孟德尔共显性遗传规律等特点,使得STR已经成为应用最广的重复序列标记,让PCR-STR扩增荧光检测技术已经成为国际法医界不可或缺的重要技术手段,在各国的犯罪DNA数据库建设、个体识别及亲子鉴定等司法实践中发挥着越来越重要的作用。插入缺失多态性(Insertion/Deletion,InDel)是人类基因遗传的另一种类型。它作为一种特殊类型的二等位基因SNP,由于兼具SNP和STR的特征,并可直接采用现已广泛应用的STR分型技术平台,而受到国内外法医遗传学者的关注。Dawson等人于2001年调查了人22号染色体上多态性分布情况,发现InDel占据了全部多态性位点的18%。Chen等人在2009年对2个人类基因组的全基因组序列再一次对比,共鉴定出151,966个InDel,与SNP的比值为1:4.72。又如Pereira等人与Edelmann等人于2009年分别建立了一个包含38个常染色体InDel位点和26个X染色体InDel位点的可用于个体识别的复合扩增体系。该体系采用多色荧光标记,毛细管电泳,依靠插入缺失片段的大小就可以实现快速、准确的分型,体现出了InDel遗传标记在法医学应用中的优越性。单核苷酸多态性(SingleNucleotidePolymorphism,SNP),是指特定位点上单个碱基序列的变异。在全人类遗传突变中,SNP占据了约90%,每个个体内存在数百万个SNP,意味着它们可以用于区别不同的个体。SNP可以发生在基因组的编码区或者非编码区。其作为第三代遗传标记,由于自发突变率明显低于STR位点(10-8VS10-3),且位点多为二等位基因,而分型是定性问题,因此更易于实现自动化。此外,对于单个SNP位点,其扩增产物可以很短,容易实现多个位点复合扩增,应用于法医学实践的优越性已经越来越明显。上述的几种识别方法和类型,均依据体外聚合酶链式反应来获取相应片段进行分析。聚合酶链式反应(PolymeraseChainReaction,PCR)(又称:多聚酶链式反应)是一种基于生物体内DNA复制的特点,利用体外酶促进合成特定DNA片段的方法。PCR由高温变性、低温退火和适温延伸等反应组成一个循环周期,进行特定次数的循环使得目的片段迅速扩增。此方法特异性强、灵敏度高且操作简单,目前在生物起源、品种的鉴定、流行病的诊断和法医鉴别等方面有着重要的用途。PCR体系得到广泛的使用是由于它的方法简单、成功率高。通常使用的PCR体系由以下几种组分组成:MgCl2、dNTPs、DNA聚合酶、KCl、引物、缓冲液等。目前市场上的法医案件版本中多为液体PCR试剂。由于存在DNA聚合酶、dNTPs等温度敏感型成分,在存储时需要将试剂置于-20℃以下温度中,在使用时也需要先将试剂从-20℃的冰箱中取出,放置在室温至溶化后,打开管盖,按照要求分装到相应的体积到反应管中,再加入模板进行PCR扩增。对于这种试剂的使用模式,在不能保证操作环境绝对无污染的情况下,实验人员在开盖操作过程中就存在试剂被空气中残留的片段或人体所带的其他DNA污染的风险;其次,对于这种试剂,存在反复冻融和常温时间操作时间过长的问题,而这些对试剂中的DNA聚合酶和dNTPs等物质的稳定性都是一种考验。另外,DNA聚合酶在低温保存时,如果试剂中的水发生结晶,晶体可能会对DNA聚合酶的空间结构造成一定程度的破坏而导致活性下降,最终影响PCR的结果。长期保存、反复冻融和常温长时间操作,都会导致PCR的结果产生偏差,降低试剂的灵敏度。真空冷冻干燥技术(Vacuumfreezedrying)是一种能够使得这类温度敏感型物质在长期存储及常温长时间操作时保持一定灵敏度的有效方法,而且能够避免冻融过程。真空冷冻干燥技术,简称冻干,是一种利用水的升华特性,将含水物料在低温低压条件下直接脱去自由水和结晶水,获得低含水量冻干物料的技术。所述真空冷冻干燥技术相比于其他干燥技术具有如下优势:1)由于温度低,避免热敏性成分分解变质;低压缺氧,热敏性成分中易氧化部分不易氧化,如蛋白质、微生物等不会发生变性或失去生物活性。2)由于低温,试剂中大分子相互交叉形成稳定的网状结构,成为稳定的固体骨架。水分升华后形成的孔径会为其他的结晶水升华提供通道,最后可获得质地疏松、海绵状的结构。脱水后的物料置于低湿度的环境中,这种骨架结构的形状会长时间保持不变。3)海绵状多孔结构具有良好的速溶性,即加入水后能够迅速溶解,恢复试剂中各成分原有的活性。4)冻干试剂的含水量非常低,一般在1%~3%左右,有利于产品的长期保存。US005861251A公开了一种冻干PCR试剂,其通过冻干液体PCR反应混合物而获得。所述冻干PCR试剂可用于分析DNA序列或用于诊断疾病,简化了PCR操作步骤,增加了反应混合物的热稳定性,降低了污染的可能性并提高了检测的灵敏度。然而,目前冻干PCR试剂仅被一般性地公开可用于分析DNA序列,其在检测法医样本中的应用,具体地在检测DNA遗传标记中的应用,至今未被报道和研究过。·技术实现要素:本发明提供了一种检测DNA遗传标记的方法,包括以下步骤:a)获取液体基因组DNA样品;b)将液体基因组DNA样品加入到冻干PCR试剂中;c)运行PCR扩增程序;d)对PCR扩增产物进行分析;其中,所述冻干PCR试剂包含用于扩增DNA遗传标记的引物以及增强剂或抑制剂拮抗物。本发明的方法提高了检测基因组中DNA遗传标记的灵敏度和抗抑制性,并且操作简单、快速、准确。·附图说明图1是采用液体PCR试剂(5C)检测样本1的电泳图。图2是采用冻干PCR试剂(5C)检测样本1的电泳图。图3是采用液体PCR试剂(5C)检测样本2的电泳图。图4是采用冻干PCR试剂(5C)检测样本2的电泳图。图5是采用液体PCR试剂(5C)检测样本3的电泳图。图6是采用冻干PCR试剂(5C)检测样本3的电泳图。图7是采用液体PCR试剂(21G)检测样本1的电泳图。图8是采用冻干PCR试剂(21G)检测样本1的电泳图。图9是采用液体PCR试剂(21G)检测样本3的电泳图。图10是采用冻干PCR试剂(21G)检测样本3的电泳图。图11是采用液体PCR试剂(27Y)检测样本1的电泳图。图12是采用冻干PCR试剂(27Y)检测样本1的电泳图。图13是采用液体PCR试剂(27Y)检测样本2的电泳图。图14是采用冻干PCR试剂(27Y)检测样本2的电泳图。图15是采用液体PCR试剂(27Y)检测样本3的电泳图。图16是采用冻干PCR试剂(27Y)检测样本3的电泳图。图17是采用液体PCR试剂(Compass)检测样本1的电泳图。图18是采用冻干PCR试剂(Compass)检测样本1的电泳图。图19是采用液体PCR试剂(Compass)检测样本2的电泳图。图20是采用冻干PCR试剂(Compass)检测样本2的电泳图。图21是含增强剂或抑制剂拮抗物(由牛血清白蛋白、明胶和Tween-20组成)的冻干PCR试剂(5C)检测含有单宁酸的样本1的电泳图。图22是含增强剂或抑制剂拮抗物(由TRITON(R)X-100、海藻糖和噻吩烷砜组成)的冻干PCR试剂(5C)检测含有单宁酸的样本1的电泳图。图23是不含增强剂或抑制剂拮抗物的冻干PCR试剂(5C)检测含有单宁酸的样本1的电泳图。图24是含增强剂或抑制剂拮抗物(由牛血清白蛋白、明胶和Tween-20组成)的冻干PCR试剂(5C)检测含有靛蓝的样本1的电泳图。图25是含增强剂或抑制剂拮抗物(由TRITON(R)X-100、海藻糖和噻吩烷砜组成)的冻干PCR试剂(5C)检测含有靛蓝的样本1的电泳图。图26是不含增强剂或抑制剂拮抗物的冻干PCR试剂(5C)检测含有靛蓝的样本1的电泳图。图27是含增强剂或抑制剂拮抗物(由牛血清白蛋白、明胶和Tween-20组成)的冻干PCR试剂(5C)检测含有腐殖酸的样本1的电泳图。图28是含增强剂或抑制剂拮抗物(由TRITON(R)X-100、海藻糖和噻吩烷砜组成)的冻干PCR试剂(5C)检测含有腐殖酸的样本1的电泳图。图29是不含增强剂或抑制剂拮抗物的冻干PCR试剂(5C)检测含有腐殖酸的样本1的电泳图。图30是含增强剂或抑制剂拮抗物(由牛血清白蛋白、明胶和Tween-20组成)的冻干PCR试剂(5C)检测含有血红素的样本1的电泳图。图31是含增强剂或抑制剂拮抗物(由TRITON(R)X-100、海藻糖和噻吩烷砜组成)的冻干PCR试剂(5C)检测含有血红素的样本1的电泳图。图32是不含增强剂或抑制剂拮抗物的冻干PCR试剂(5C)检测含有血红素的样本1的电泳图。·具体实施方式如上所述,本发明提供了一种检测DNA遗传标记的方法,包括以下步骤:a)获取液体基因组DNA样品;b)将液体基因组DNA样品加入到冻干PCR试剂中;c)运行PCR扩增程序;d)对PCR扩增产物进行分析;其中,所述冻干PCR试剂包含用于扩增DNA遗传标记的引物以及增强剂或抑制剂拮抗物。在本发明的方法中,所述冻干PCR试剂是一种冻干的常用PCR反应混合物,其包含缓冲液、MgCl2、KCl、DNA聚合酶、dNTPs(dATP、dGTP、dTTP、dCTP)、引物等。在本发明的方法中使用的术语“增强剂或抑制剂拮抗物”是指能起到促进PCR扩增的化学物质,可以为大分子物质,亦可为小分子物质。所述增强剂或抑制剂拮抗物在冻干PCR试剂中起到骨架作用的同时,还能稳定试剂中的热敏成分冻干后的活性,可有效地提高冻干PCR试剂对于不同样本的兼容性以及提高冻干PCR试剂检测的灵敏度。在本发明中,所述增强剂或抑制剂拮抗物选自如下中的一个或多个:血清蛋白(如牛血清白蛋白)、高分子类物质(如聚乙烯吡咯烷酮、明胶或聚乙二醇)、非离子型表面活性剂(如Tween-20、Span-20、TRITON(R)X-100、NP-40或Brij58)、铵类(如硫酸铵或氯化铵)、大分子类物质(如乙氧基化壬基酚、脂肪醇聚氧乙烯醚、聚乙二醇油酸酯化合物、辛酰基-N-甲基葡萄糖胺、甜菜碱、山梨醇或甘露醇)和小分子类物质(如二甲基亚砜、四甲基氯化铵、噻吩烷砜、甲基嘧啶羧酸、左旋肉碱、肝素钠或四甲基氯化铵)。在一些实施方案中,所述增强剂或抑制剂拮抗物选自如下中的一个或多个:牛血清白蛋白、明胶、Span-20、Tween-20、硫酸铵、甜菜碱、山梨醇、四甲基氯化铵和噻吩烷砜。在一个优选的实施方案中,所述增强剂或抑制剂拮抗物由牛血清白蛋白、明胶和Tween-20组成。在本发明方法的一些实施方案中,通过电泳对PCR扩增产物进行分析。在一个具体的实施方案中,通过聚丙烯酰胺凝胶电泳或毛细管电泳对PCR扩增产物进行分析。在一个优选的实施方案中,通过毛细管电泳对PCR扩增产物进行分析。在本发明的方法中使用的术语“DNA遗传标记”是指可遗传的并可检测的代表生物体遗传组成,并且分布规律具有种群特征的DNA序列。在本发明的方法中,所述DNA遗传标记包括STR基因座、InDel位点和/或SNP位点。在一个实施方案中,所述DNA遗传标记为STR基因座。在一个具体的实施方案中,所述STR基因座为包含如下的STR基因座:vWA、D21S11、D18S51、FGA、TPox、D16S539、D13S317、DYS570、PentaE、Th01、D3S1358、D7S820、D5S818、D6、DYS576、CSF1PO、D8S1179、D19S433、D2S1338、PentaD以及Amel。在一个具体的实施方案中,所述STR基因座为包含如下的STR基因座:D3S1358、TH01、D21S11、D18S51、PentaE、D5S818、D13S317、D7S820、D16S539、CSF1PO、PentaD、Amel、vWA、D8S1179、TPOX、FGA、D19S433、D12S391、D6S1043、D2S1338和D1S1656。在一个具体的实施方案中,所述STR基因座为包含如下的STR基因座:DYS456、DYS576、DYS570、DYS481、DYF387S1、DYS627、DYS458、DYS460、DYS437、DYS439、DYS392、DYS385、DYS393、DYS391、DYS390、DYS635、DYS449、DYS533、DYS438、DYS389I、DYS448、DYS389II、DYS19、GATA_H4、DYS518。在另一个具体的实施方案中,所述STR基因座为包含如下的STR基因座:D3S1358、TH01、D21S11、D18S51、D19S433、DYS439、DYS438、DYS389I、DYS448、DYS389II、DYS19、GATA-H4、DYS458、Amel、D5S818、D13S317、D7S820、D16S539、CSF1PO、D2S1338、DYS437、vWA、D8S1179、TPOX、FGA、DYS456、DYS393、DYS391、DYS390、DYS635、DYS392、DYS385。在一个实施方案中,所述DNA遗传标记为InDel位点。在一个具体的实施方案中,所述InDel位点为Y-indel。以下通过具体实施例来说明本发明的内容。应理解,所述具体实施例仅为说明目的,并不意味着本发明的内容仅限于具体实施例。实施例1STR基因座的检测(5C)在本实施例中,采用PCR试剂(5C)对样本1、2和3进行检测。所述PCR试剂包含热启动DNA聚合酶、dNTPs(0.2mM)、Mg2+(3mM)、KCl(75mM)和引物,其中所述引物可扩增如下的STR基因座:vWA、D21S11、D18S51、FGA、TPox、D16S539、D13S317、DYS570、PentaE、Th01、D3S1358、D7S820、D5S818、D6、DYS576、CSF1PO、D8S1179、D19S433、D2S1338、PentaD以及Amel。所述样本1为低浓度阳性对照9948(购自苏州新海生物科技股份有限公司),样本2和样本3为本发明人采用磁珠法提取的疑难样本。所述磁珠法提取步骤如下:1)打开核酸提取仪(来自宁波海尔施基因科技有限公司)的紫外灯,照射30分钟,并开启核酸提取试剂仪;2)预热配套核酸提取试剂装置至45℃;3)小心撕开核酸提取试剂,在核酸提取试剂的第一列和第七列的每个孔中分别加入200μL来自两个男性的血样(来自宁波开发区中心医院);4)把核酸提取试剂板推入机器至机器导槽底部,并确认提取试剂板的缺角面向门板,关上核酸提取试剂仪门;5)设置程序至“BLOOD-AUTO”并启动;6)约40分钟后程序结束,蜂鸣器鸣叫。将蜂鸣器关掉后,取出提取试剂板。7)用移液器分别将纯化的核酸从提取试剂板的第6列和第12列的第一个孔中吸出并转移到1.5mL离心管中,然后做好标记,即为样本2和3。1.冻干PCR试剂检测体系的配制:a)利用真空冷冻干燥技术(采用0.5m2冻干机,购自上海东富龙)将液体PCR试剂转化成低含水量的冻干PCR试剂,并包装于含有干燥剂的铝箔袋中;b)取出铝箔袋中的冻干PCR试剂8连管(购自Axygen),轻放于已经紫外灭菌20min的超净工作台(购自苏州净化设备有限公司)里的96孔板架上;c)将冻干PCR试剂管放置迷你离心机(购自海门市其林贝尔仪器制造有限公司)上离心30s后放回超净工作台;d)打开冻干PCR试剂管盖;e)用Rainin移液器(购自梅特勒-托利多国际贸易(上海)有限公司)移取20μL液体样本1到每个孔中,并盖上管盖;f)将冻干PCR试剂管置于迷你离心机上,离心30s。对于样本2和3,依据上述相同的步骤进行处理。2.液体PCR试剂检测体系的配制:a)取出于-20℃冰箱中保存的液体PCR试剂管置于已经紫外灭菌20min的超净工作台里的96孔板架上,待其溶化;b)将液体PCR试剂管放置于迷你离心机中离心30s后放回超净工作台;c)打开液体PCR试剂管盖;d)用Rainin移液器(购自梅特勒-托利多国际贸易(上海)有限公司)移取1μL液体样本1到每个孔中,并盖上管盖;e)将冻干PCR试剂管置于迷你离心机上,离心30s。同样,对于样本2和3,依据上述相同的步骤进行处理。3.扩增热循环实验方案:1)将PCR试剂管置于9700热循环仪(购自美国ABI)上;2)选择表1推荐的程序进行扩增;3)扩增后的样品应避光保存;表1:热循环仪的扩增程序步骤温度时间195℃5分钟294℃10秒361℃1分钟470℃30秒5N/A重复2-4步骤27次(共28次)660℃20分钟74℃持续:直至收取PCR产物4.扩增产物在ABI3500遗传分析仪上检测由去离子甲酰胺与系统中分子量内标(Size-500)组成上样混合物{(1μLSize-500+12μL去离子甲酰胺)×(进样数)}。将9μL上样混合物与1μL扩增产物或系统中等位基因分型标准物(Allelicladder)混合,避免产生气泡,尽快电泳。用ABI3500遗传分析仪(购自美国ABI公司)检测分析,具体分析参数为进样电压:1.2kv,进样时间:15s,电泳时间1210-1500s。检测结果如图1-6所示。图1和图2分别示出了采用液体PCR试剂(5C)和冻干PCR试剂(5C)检测样本1的电泳图。从图1和图2中可看出,对于样本1,采用液体PCR试剂进行检测时存在以下问题:VWA出杂峰;D21S11丢峰;P18S51失衡;TPOX失衡;D16S539丢峰;DYS570峰太低;TH01丢峰;D3S1358丢峰和失衡;D5S818出现杂峰;PentaD出现杂峰;Amel峰型失衡。图3和图4分别示出了采用液体PCR试剂(5C)和冻干PCR试剂(5C)检测样本2的电泳图。从图3和图4中可看出,对于样本2,采用液体PCR试剂进行检测时存在以下问题:VWA出现丢峰和失衡;D21S11出现丢峰;FGA峰过低;DYS570出现丢峰;PentaE出现丢峰;D3S1358丢峰;D8S1179出现丢峰;D19S433出现丢峰;PentaD出现丢峰。图5和图6分别示出了采用液体PCR试剂(5C)和冻干PCR试剂(5C)检测样本3的电泳图。从图5和图6中可看出,对于样本3,采用液体PCR试剂进行检测时存在以下问题:P18S51出现失衡;D13S317出现失衡;TH01出现丢峰;D5S818出现失衡;D8S1179出现失衡;D2S1338出现失衡;Amel峰型失衡。由此可见,采用冻干PCR试剂检测样本时有利于提高DNA遗传标记峰的均衡性且灵敏度显著提高。实施例2STR基因座的检测(21G)在本实施例中,采用PCR试剂(21G)对样本1和3进行检测。所述PCR试剂包含热启动DNA聚合酶、dNTPs(0.33mM)、Mg2+(3mM)、KCl(50mM)和引物,其中所述引物可扩增如下的STR基因座:D3S1358、TH01、D21S11、D18S51、PentaE、D5S818、D13S317、D7S820、D16S539、CSF1PO、PentaD、Amel、vWA、D8S1179、TPOX、FGA、D19S433、D12S391、D6S1043、D2S1338、D1S1656。所述样本1为低浓度阳性对照9948(购自苏州新海生物科技股份有限公司),样本3为本发明人采用磁珠法提取的疑难样本DNA(提取步骤参见实施例1)。1.冻干PCR试剂检测体系的配制:a)利用真空冷冻干燥技术(采用0.5m2冻干机,购自上海东富龙)将液体PCR试剂转化成低含水量的冻干PCR试剂,并包装于含有干燥剂的铝箔袋中;b)取出铝箔袋中的冻干PCR试剂8连管(购自Axygen),轻放于已经紫外灭菌20min的超净工作台(购自苏州净化设备有限公司)里的96孔板架上;c)将冻干PCR试剂管放置迷你离心机(购自海门市其林贝尔仪器制造有限公司)上离心30s后放回超净工作台;d)打开冻干PCR试剂管盖;e)用Rainin移液器(购自梅特勒-托利多国际贸易(上海)有限公司)移取20μL液体样本1到每个孔中,并盖上管盖;f)将冻干PCR试剂管置于迷你离心机上,离心30s。对于样本3,依据上述相同的步骤进行处理。2.液体PCR试剂检测体系的配制:a)取出于-20℃冰箱中保存的液体PCR试剂管置于已经紫外灭菌20min的超净工作台里的96孔板架上,待其溶化;b)将液体PCR试剂管放置于迷你离心机中离心30s后放回超净工作台;c)打开液体PCR试剂管盖;d)用Rainin移液器(购自梅特勒-托利多国际贸易(上海)有限公司)移取1μL液体样本1到每个孔中,并盖上管盖;e)将冻干PCR试剂管置于迷你离心机上,离心30s。同样,对于样本3,依据上述相同的步骤进行处理。3.扩增热循环实验方案:1)将PCR试剂管置于9700热循环仪(购自美国ABI)上;2)选择表1推荐的程序进行扩增;3)扩增后的样品应避光保存;4.扩增产物在ABI3500遗传分析仪上检测由去离子甲酰胺与系统中分子量内标(Size-500)组成上样混合物{(1μLSize-500+12μL去离子甲酰胺)×(进样数)}。将9μL上样混合物与1μL扩增产物或系统中等位基因分型标准物(Allelicladder)混合,避免产生气泡,尽快电泳。用ABI3500遗传分析仪检测分析,具体分析参数为进样电压:1.2kv,进样时间:15s,电泳时间1210-1500s。检测结果如图7-10所示。图7和图8分别示出了采用液体PCR试剂(21G)和冻干PCR试剂(21G)检测样本1的电泳图。从图7和图8中可看出,对于样本1,采用液体PCR试剂进行检测时存在以下问题:TH01失衡且出现杂峰;D21S11峰高过低,电泳分析仪无法自动识别;D18S51失衡;CSF1PO失衡;D8S1179失衡;D12S391失衡;D8S1043失衡。图9和图10分别示出了采用液体PCR试剂(21G)和冻干PCR试剂(21G)检测样本3的电泳图。从图9和图10中可看出,对于样本3,采用液体PCR试剂进行检测时存在以下问题:D21S11峰过低,电泳分析仪无法自动识别;D18S51失衡;Amel失衡;TPOX失衡。由此可见,采用冻干PCR试剂检测样本时有利于提高DNA遗传标记峰的均衡性且灵敏度显著提高。实施例3STR基因座的检测(27Y)在本实施例中,采用PCR试剂(27Y)对样本1、2和3进行检测。所述PCR试剂包含热启动DNA聚合酶、dNTPs(0.33mM)、Mg2+(3mM)、KCl(50mM)和引物,其中所述引物可扩增如下的STR基因座:DYS456、DYS576、DYS570、DYS481、DYF387S1、DYS627、DYS458、DYS460、DYS437、DYS439、DYS392、DYS385、DYS393、DYS391、DYS390、DYS635、DYS449、DYS533、DYS438、DYS389I、DYS448、DYS389II、DYS19、GATA_H4和DYS518。所述样本1为低浓度阳性对照9948(购自苏州新海生物科技股份有限公司),样本2、样本3为本发明人采用磁珠法提取的疑难样本(提取步骤参见实施例1)。1.冻干PCR试剂检测体系的配制:a)利用真空冷冻干燥技术(采用0.5m2冻干机,购自上海东富龙)将液体PCR试剂转化成低含水量的冻干PCR试剂,并包装于含有干燥剂的铝箔袋中;b)取出铝箔袋中的冻干PCR试剂8连管(购自Axygen),轻放于已经紫外灭菌20min的超净工作台里的96孔板架上;c)将冻干PCR试剂管放置迷你离心机(购自海门市其林贝尔仪器制造有限公司)上离心30s后放回超净工作台;d)打开冻干PCR试剂管盖;e)用Rainin移液器(购自梅特勒-托利多国际贸易(上海)有限公司)移取20μL液体样本1到每个孔中,并盖上管盖;f)将冻干PCR试剂管置于迷你离心机上,离心30s。对于样本2和3,依据上述相同的步骤进行处理。2.液体PCR试剂检测体系的配制:a)取出于-20℃冰箱中保存的液体PCR试剂管置于已经紫外灭菌20min的超净工作台里的96孔板架上,待其溶化;b)将液体PCR试剂管放置于迷你离心机中离心30s后放回超净工作台;c)打开液体PCR试剂管盖;d)用Rainin移液器(购自梅特勒-托利多国际贸易(上海)有限公司)移取1μL液体样本1到每个孔中,并盖上管盖;e)将冻干PCR试剂管置于迷你离心机上,离心30s。同样,对于样本2和3,依据上述相同的步骤进行处理。3.扩增热循环实验方案:1)将PCR试剂管置于9700热循环仪(购自美国ABI)上;2)选择表1推荐的程序进行扩增;3)扩增后的样品应避光保存;4.扩增产物在ABI3500遗传分析仪上检测由去离子甲酰胺与系统中分子量内标(Size-500)组成上样混合物{(1μLSize-500+12μL去离子甲酰胺)×(进样数)}。将9μL上样混合物与1μL扩增产物或系统中等位基因分型标准物(Allelicladder)混合,避免产生气泡,尽快电泳。用ABI3500遗传分析仪检测分析,具体分析参数为进样电压:1.2kv,进样时间:15s,电泳时间1210-1500s。检测结果如图11-16所示。图11和图12分别示出了采用液体PCR试剂(27Y)和冻干PCR试剂(27Y)检测样本1的电泳图。从图11和图12中可看出,对于样本1,采用液体PCR试剂进行检测时存在以下问题:DYS576、DYS570、DYS481、DYF387S1、DYS627、DYS460、DYS437、DYS439、DYS392、DYS385、DYS635、DYS449、DYS389II、GATA_H4峰高太低,电泳分析仪无法自动识别。图13和图14分别示出了采用液体PCR试剂(27Y)和冻干PCR试剂(27Y)检测样本2的电泳图。从图13和图14中可看出,对于样本2,采用液体PCR试剂进行检测时存在以下问题:DYS391未能出峰。图15和图16分别示出了采用液体PCR试剂(27Y)和冻干PCR试剂(27Y)检测样本3的电泳图。从图15和图16中可看出,对于样本3,采用液体PCR试剂进行检测时存在以下问题:DYG387SI失衡;DYS458、DYS635和DYS389II峰高过低,电泳分析仪无法自动识别;DYS385失衡。由此可见,采用冻干PCR试剂检测样本时有利于提高DNA遗传标记峰的均衡性且灵敏度显著提高。实施例4STR基因座和InDel位点的检测(Compass)在本实施例中,采用PCR试剂(Compass)对样本1和2进行检测。所述PCR试剂包含热启动DNA聚合酶、dNTPs(0.33mM)、Mg2+(3mM)、KCl(50mM)和引物,其中所述引物可扩增如下的STR基因座:D3S1358、TH01、D21S11、D18S51、D19S433、DYS439、DYS438、DYS389I、DYS448、DYS389II、DYS19、GATA-H4、DYS458、Amel、D5S818、D13S317、D7S820、D16S539、CSF1PO、D2S1338、DYS437、vWA、D8S1179、TPOX、FGA、DYS456、DYS393、DYS391、DYS390、DYS635、DYS392和DYS385以及InDel位点Y-indel。所述样本1为低浓度阳性对照9948(购自苏州新海生物科技股份有限公司),样本2为本发明人采用磁珠法提取的疑难样本(提取步骤参见实施例1)。1.冻干PCR试剂检测体系的配制:a)利用真空冷冻干燥技术(采用0.5m2冻干机,购自上海东富龙)将液体PCR试剂转化成低含水量的冻干PCR试剂,并包装于含有干燥剂的铝箔袋中;b)取出铝箔袋中的冻干PCR试剂8连管(购自Axygen),轻放于已经紫外灭菌20min的超净工作台里的96孔板架上;c)将冻干PCR试剂管放置迷你离心机(购自海门市其林贝尔仪器制造有限公司)上离心30s后放回超净工作台;d)打开冻干PCR试剂管盖;e)用Rainin移液器(购自梅特勒-托利多国际贸易(上海)有限公司)移取20μL液体样本1到每个孔中,并盖上管盖;f)将冻干PCR试剂管置于迷你离心机上,离心30s。对于样本2,依据上述相同的步骤进行处理。2.液体PCR试剂检测体系的配制:a)取出于-20℃冰箱中保存的液体PCR试剂管置于已经紫外灭菌20min的超净工作台里的96孔板架上,待其溶化;b)将液体PCR试剂管放置于迷你离心机中离心30s后放回超净工作台;c)打开液体PCR试剂管盖;d)用Rainin移液器(购自梅特勒-托利多国际贸易(上海)有限公司)移取1μL液体样本1到每个孔中,并盖上管盖;e)将冻干PCR试剂管置于迷你离心机上,离心30s。同样,对于样本2,依据上述相同的步骤进行处理。3.扩增热循环实验方案:1)将PCR试剂管置于9700热循环仪(购自美国ABI)上;2)选择表1推荐的程序进行扩增;3)扩增后的样品应避光保存;4.扩增产物在ABI3500遗传分析仪上检测由去离子甲酰胺与系统中分子量内标(Size-500)组成上样混合物{(1μLSize-500+12μL去离子甲酰胺)×(进样数)}。将9μL上样混合物与1μL扩增产物或系统中等位基因分型标准物(Allelicladder)混合,避免产生气泡,尽快电泳。用ABI3500遗传分析仪检测分析,具体分析参数为进样电压:1.2kv,进样时间:15s,电泳时间1210-1500s。检测结果如图17-20所示。图17和图18分别示出了采用液体PCR试剂(Compass)和冻干PCR试剂(Compass)检测样本1的电泳图。从图17和图18中可看出,对于样本1,采用液体PCR试剂进行检测时存在以下问题:Y-indel无峰;D3S1358丢峰;TH01丢峰;D21S11未出目的峰,出现杂峰;D18S51峰高过低;D19S433丢峰;DYS439无峰;DYS438无峰;DYS389I无峰;DYS448无峰;DYS389II无峰;Amel无峰;D5S818无峰;D13S317无峰;D7S820;D16S539无峰;CSF1PO丢峰;D2S1338无峰;DYS437无峰、vWA无峰、D8S1179丢峰、TPOX丢峰、FGA丢峰、DYS456无峰、DYS391无峰、DYS390无峰、DYS635无峰、DYS392无峰;DYS385丢峰。图19和图20分别示出了采用液体PCR试剂(Compass)和冻干PCR试剂(Compass)检测样本2的电泳图。从图19和图20中可看出,对于样本2,采用液体PCR试剂进行检测时存在以下问题:Y-indel峰低;D3S1358丢峰;D18S51丢峰;DYS389II无峰;D13S317丢峰;vWA丢峰、D8S1179丢峰;DYS391无峰、DYS390无峰。由此可见,采用冻干PCR试剂检测样本时有利于提高DNA遗传标记峰的均衡性且灵敏度显著提高。实施例5增强剂或抑制剂拮抗物对检测DNA遗传标记的影响在本实施例中,分别采用不包含以及包含不同的增强剂或抑制剂拮抗物的PCR试剂(5C)对包含抑制剂的样本进行检测。所述PCR试剂包含热启动DNA聚合酶、dNTPs(0.2mM)、Mg2+(3mM)、KCl(75mM),其中所述引物可扩增如下的STR基因座:vWA、D21S11、D18S51、FGA、TPox、D16S539、D13S317、DYS570、PentaE、Th01、D3S1358、D7S820、D5S818、D6、DYS576、CSF1PO、D8S1179、D19S433、D2S1338、PentaD以及Amel。本实施例中所测试的加入到所述PCR试剂中的增强剂或抑制剂拮抗物由牛血清白蛋白(0.1mg/ml、购自生工生物工程(上海)股份有限公司)、明胶(0.01g/ml,购自国药集团化学试剂有限公司)和Tween-20(1.12%(v/v),购自阿拉丁)组成,或者由TRITON(R)X-100(1.6%(v/v),购自生工生物工程(上海)股份有限公司),海藻糖(0.04mg/ml,购自国药集团化学试剂有限公司)和噻吩烷砜(1%(v/v),购自国药集团化学试剂有限公司)组成。本实施例中所述的包含抑制剂的样本是为了模拟正常提取的生物样本——其通常都含有一定量的多种抑制剂成分。本实施例中使用的样本为实施例1-4中所述的样本1(即,高浓度阳性对照9948,购自苏州新海生物科技股份有限公司),在其中加入的抑制剂为单宁酸(1mg/ml,购自生工生物工程(上海)股份有限公司)、靛蓝(2mM,购自国药集团化学试剂有限公司)或腐殖酸(20ng/μl,购自Sigma)或血红素(300μM,购自生工生物工程(上海)股份有限公司)。1.冻干PCR试剂检测体系的配制:a)利用真空冷冻干燥技术(采用0.5m2冻干机,购自上海东富龙)将含增强剂或抑制剂拮抗物(由上述牛血清白蛋白、明胶和Tween-20组成)的液体PCR试剂转化成低含水量的冻干PCR试剂,并包装于含有干燥剂的铝箔袋中;b)取出铝箔袋中的冻干PCR试剂8连管(购自Axygen),轻放于已经紫外灭菌20min的超净工作台里的96孔板架上;c)将冻干PCR试剂管放置迷你离心机(购自海门市其林贝尔仪器制造有限公司)上离心30s后放回超净工作台;d)打开冻干PCR试剂管盖;e)用Rainin移液器(购自梅特勒-托利多国际贸易(上海)有限公司)移取16μL液体样本1到4个孔中,分别是第1个孔、第2个孔、第3个孔、第4个孔,并盖上管盖;f)将冻干PCR试剂管置于迷你离心机上,离心30s。g)在8连管的第1个孔到第4个孔中,分别加入4μL的单宁酸、靛蓝、腐殖酸和血红素。对于不含增强剂或抑制剂拮抗物的液体PCR试剂和含增强剂或抑制剂拮抗物(由上述TRITON(R)X-100、海藻糖和噻吩烷砜组成)的液体PCR试剂,依据上述相同的步骤进行处理。2.扩增热循环实验方案:1)将PCR试剂管置于9700热循环仪(购自美国ABI)上;2)选择表1推荐的程序进行扩增;3)扩增后的样品应避光保存;3.扩增产物在ABI3500遗传分析仪上检测由去离子甲酰胺与系统中分子量内标(Size-500)组成上样混合物{(1μLSize-500+12μL去离子甲酰胺)×(进样数)}。将9μL上样混合物与1μL扩增产物或系统中等位基因分型标准物(Allelicladder)混合,避免产生气泡,尽快电泳。用ABI3500遗传分析仪检测分析,具体分析参数为进样电压:1.2kv,进样时间:15s,电泳时间1210-1500s。检测结果如图21~32所示。图21-23分别示出了包含由牛血清白蛋白、明胶和Tween-20组成的、由TRITON(R)X-100、海藻糖和噻吩烷砜组成的、以及不含增强剂或抑制剂拮抗物的冻干PCR试剂(5C)检测含有单宁酸的样本1的电泳图。从所述图可以看出,只有加入包含由牛血清白蛋白、明胶和Tween-20组成的增强剂或抑制剂拮抗物的冻干PCR试剂(5C)才能够有效地抑制单宁酸,获得样本的STR分型图。图24-26分别示出了包含由牛血清白蛋白、明胶和Tween-20组成的、由TRITON(R)X-100、海藻糖和噻吩烷砜组成的、以及不含增强剂或抑制剂拮抗物的冻干PCR试剂(5C)检测含有靛蓝的样本1的电泳图。从所述图中可以看出,只有加入包含由牛血清白蛋白、明胶和Tween-20组成的增强剂或抑制剂拮抗物的冻干PCR试剂(5C),才能有效地抑制靛蓝,获得样本的STR分型图。图27-29分别示出了包含由牛血清白蛋白、明胶和Tween-20组成的、由TRITON(R)X-100、海藻糖和噻吩烷砜组成的、以及不含增强剂或抑制剂拮抗物的冻干PCR试剂(5C)检测含有腐殖酸的样本1的电泳图。从所述图中可以看出,只有加入包含由牛血清白蛋白、明胶和Tween-20组成的增强剂或抑制剂拮抗物的冻干PCR试剂(5C),才能有效地抑制腐殖酸,获得样本的STR分型图。图30-32分别示出了包含由牛血清白蛋白、明胶和Tween-20组成的、由TRITON(R)X-100、海藻糖和噻吩烷砜组成的、以及不含增强剂或抑制剂拮抗物的冻干PCR试剂(5C)检测含有血红素的样本1的电泳图。从所述图中可以看出,只有加入包含由牛血清白蛋白、明胶和Tween-20组成的增强剂或抑制剂拮抗物的冻干PCR试剂(5C),能够有效地抑制血红素,获得样本的STR分型图。上述结果表明,采用含有增强剂或抑制剂拮抗物(由牛血清白蛋白、明胶和Tween-20组成)的冻干PCR试剂检测生物样本,可提高冻干PCR试剂的抗抑制能力,从而显著提高检测的灵敏度。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1