查尔酮衍生物及其在调节11β‑HSD1和代谢综合征防治中的应用的制作方法
本发明涉及一种芳香族化合物,尤其涉及一种查尔酮衍生物及其药学上可接受的盐,对11β-HSD1的催化方向具有双重调节作用,能明显降低糖皮质激素皮质醇水平,能明显降低血糖和血脂水平,具有防治代谢综合征和II型糖尿病的作用。
背景技术:
天然查尔酮属于黄酮类化合物,广泛存在于水果蔬菜和天然药物中,并且具有抗炎、抗肿瘤、镇痛、抗溃疡和抗菌作用,以及抗疟疾等多种生物学活性,且毒性非常低。
糖尿病是由于体内胰岛素分泌不足或者胰岛素抵抗引起的以高血糖和糖尿为特征的内分泌代谢疾病,常伴有动脉粥样硬化性心血管疾病、糖尿病肾病、神经系统病变、下肢溃疡、眼部病变如白内障、视网膜病变等多种并发症。因此,糖尿病已经成为继心脑血管、癌症之后的严重危害人类健康的第三大疾病。
糖尿病是由于体内胰岛素分泌不足或者胰岛素抵抗引起的以高血糖和糖尿为特征的内分泌代谢疾病,常伴有动脉粥样硬化性心血管疾病、糖尿病肾病、神经系统病变、下肢溃疡、眼部病变如:白内障、视网膜病变等多种并发症。因此,糖尿病已经成为继心脑血管、癌症之后的严重危害人类健康的第三大疾病。
胰岛素是调节葡萄糖和脂质代谢的激素。糖尿病分为两类:I型糖尿病和II型糖尿病。I型糖尿病(即胰岛素依赖型糖尿病)由于胰岛素分泌减少引起。II型糖尿病(即非胰岛素依赖型糖尿病)由于胰岛素抵抗引起。通常,II型糖尿病患者中胰岛素水平升高(即,高胰岛素血症),但这种代偿性增加不足以克服胰岛素抵抗。I型和II型糖尿病持续或不受控制的高血糖增加大血管和微血管并发症,包括动脉粥样硬化、冠状动脉心脏疾病、周围血管疾病、中风、肾病、神经病和视网膜病变的发生率。
胰岛素抵抗,即使在高血糖临界可以发生,是代谢综合征的一个组成部分。最近,代谢综合征的诊断标准已经建立。下列五个条件必须满足三个就可以诊断为代谢综合症:(1)血压高于130/85毫米汞柱;(2)空腹血糖超过110毫克/分升;(3)腹型肥胖腰围大于40″(男性)或35″(女性);(4)甘油三酯高于150毫克/分升;(5)高密度脂蛋白胆固醇低于40毫克/分升(男性)或50毫克/分升(女性)。
世界上大约有1.2亿的糖尿病患者。据WHO估计,到2020年,全球糖尿病患者将接近3亿。
II型糖尿病的治疗方法有限。饮食和身体锻炼对II型糖尿病患者有益,但依从性差。需要其他方式的治疗,以进一步提高葡萄糖和脂质代谢。I型糖尿病的治疗采用胰岛素。II型糖尿病糖尿病的治疗采用一些药物,如:二甲双胍和苯乙双胍,可改善糖尿病患者中胰岛素敏感性和葡萄糖代谢,然而,作用机理还不很清楚,两种化合物可导致乳酸性酸中毒和胃肠道副作用(例如,恶心或腹泻)。α-葡萄糖苷酶抑制剂(例如,阿卡波糖)可以从肠道饭后延缓碳水化合物的吸收,反过来降低血糖水平。像双胍类,这些化合物也可以引起胃肠道的副作用。格列酮类是一种较新的治疗2型糖尿病的化合物,通过修改过PPARγ亚型的活性,格列酮类副作用包括体重增加和外周水肿。其他药物有胰高血糖素样肽-1(GLP-1)类似物、Exendin-4和二肽基肽酶IV(DPPIV)的抑制剂,其增加胰岛素的分泌,参与肝葡萄糖产生和分泌的关键酶的抑制剂(例如:果糖1,6-二磷酸酶抑制剂)。
从目前的II型糖尿病药物研制趋势来看,从内分泌失调和代谢紊乱机制入手研制II型糖尿病治疗药物的正在逐渐起步。
其中一种方法是使用11β-羟基类固醇脱氢酶1(11β-HSD1)抑制剂。糖皮质激素皮质醇控制葡萄糖和脂质代谢,过度皮质醇作用可导致胰岛素抗性、II型糖尿病、血脂异常、增加腹部肥胖和高血压。糖皮质激素包括血液中循环的活性皮质醇(人)和非活性形式(即:可的松)。11β-HSD1在肝脏和脂肪组织中高度表达,其还原酶转换可的松到皮质醇导致皮质醇局部浓度增高。11β-HSD1还原酶的抑制可防止或减小糖皮质激素皮质醇作用(Curr Med Chem.,17,412~22)。
11β-HSD包括两种酶:11β-HSD1和11β-HSD2,有两个不同的基因表达。它们的作用也不同。其中,11β-HSD1是氧化还原酶,含有还原酶和氧化酶两种酶活性形式,其中在肝脏和脂肪以还原酶占主要地位,促进非活性糖皮质激素可的松向活性糖皮质激素皮质醇的转化。而氧化酶的作用方向相反,占次要地位。而11β-HSD2在肾脏,保护盐皮质激素的作用,11β-HSD2的抑制或失变异可造成高血压和低血钾(Curr Med Chem.,17,412~22)。11β-HSD2促进活性糖皮质激素向非活性糖皮质激素的转化。国外已有多家大型药物公司开始了11β-HSD1还原酶抑制剂的研究,如:BVT 7702(Diabetologia 2002,45,1528~32)、NCB13793(IDmgs 2010,13,266~75)和BMS-770767(J Labelled Comp.Radiopharm,2016)等。其中,Incyte公司的11β-HSD1选择性抑制剂NCB13793正在进行II期临床研究。11β-HSD1还原酶的主要作用是促进非活性糖皮质激素可的松向活性糖皮质激素皮质醇的转化(Curr Med Chem.,17,412~22)。这些11β-HSD1还原酶抑制剂大多不抑制11β-HSD2活性,以免造成高血压和低血钾的副反应,所以是11β-HSD1还原酶抑制剂选择性抑制剂。
目前所报道的11β-HSD1抑制剂,表观上体现出对11β-HSD1还原酶的抑制,但均同时抑制11β-HSD1氧化酶和还原酶两种活性。11β-HSD1氧化酶有着与11β-HSD2相同的作用,在肝脏和脂肪组织中可以降低糖皮质激素皮质醇的浓度、增加胰腺胰岛素合成,降低肝糖输出和血糖水平,增强胰岛素敏感性,抵抗糖尿病发生发展。虽然在已报道的11β-HSD1抑制剂对11β-HSD1的混合抑制中,抑制氧化酶所产生的影响小于抑制还原酶所产生的影响,但势必会抵消抑制剂的部分药效。而且,抑制11β-HSD1还原酶只能预防和阻止氢化可的松的生成,阻止血糖浓度生高,但是却无法降低已经升高的皮质醇浓度。局部组织中已经升高的皮质醇水平仍将维持刺激肝糖输出和胰岛素抵抗。
技术实现要素:
本发明的一个目的在于提供一种查尔酮衍生物,能够同时降低11β-HSD1还原酶活性并增加11β-HSD1氧化酶活性。
本发明的另一个目的在于提供一种查尔酮衍生物,能显著降低糖皮质激素皮质醇水平。
本发明的再一个目的在于提供一种查尔酮衍生物,能显著降低血糖水平。
本发明的又一个目的在于提供一种查尔酮衍生物,能显著降低血脂水平。
本发明的又一个目的在于提供一种查尔酮衍生物,在制备防治代谢综合征药物中的应用。
本发明的又一个目的在于提供一种查尔酮衍生物,在制备防治II型糖尿病药物中的应用。
本发明的又一个目的在于提供一种药物组合物,含有查尔酮衍生物。
本发明的又一个目的在于提供一种低剂量药物组合物,含有查尔酮衍生物。
本发明的又一个目的在于提供一种药剂盒,含有查尔酮衍生物。
本发明提供的另一种查尔酮衍生物,其结构如式I所示:
其中:Y选自于卤素、C1~C6烷氧基、羟基和羧基,Z选自于C1~C6烷氧基和NR1R2,R1和R2独立地选自于H和C1~C6烷基。
本发明提供的另一种查尔酮衍生物,其结构如式II所示:
其中:Y选自于卤素、C1~C6烷氧基、羟基和羧基。
本发明提供的另一种查尔酮衍生物,其结构如式III所示:
其中:Y选自于卤素、C1~C6烷氧基、羟基和羧基。
本发明提供的另一种查尔酮衍生物,其结构如式IV所示:
其中:Y选自于卤素、C1~C6烷氧基、羟基和羧基。
本发明提供的另一种查尔酮衍生物,其结构如式V所示:
其中:Y选自于卤素、C1~C6烷氧基、羟基和羧基。
本发明提供的另一种查尔酮衍生物,具有如下结构:
RS02:2-氯-4’-氨基查尔酮(化学式:C15H12ClNO);
RS03:2-氟-4’-氨基查尔酮(化学式:C15H12FNO);
RS04:2-氯-4’-甲氧基查尔酮(化学式:C16H13ClO2);
RS05:4-甲氧基-4’-甲氧基查尔酮(化学式:C17H16O3);
RS06:4-羟基-4’-甲氧基查尔酮(化学式:C16H14O3)。
本发明提供的各种查尔酮衍生物,还包括其药学上可接受的盐。
本发明提供的各种查尔酮衍生物,能够同时降低11β-HSD1还原酶的活性并增加11β-HSD1氧化酶的活性,能显著降低糖皮质激素皮质醇水平,显著降低血糖水平和血脂水平。因此非常有效于治疗或预防代谢疾病和II型糖尿病。
本发明还提供的一种组合物,包含以查尔酮衍生物为活性成分。
此外,组合物还包括各种与所含化合物或组合物相适应的药物辅料,以制成有利于给药(drug delivery)的剂型,如:但不仅限于水溶液注射剂、粉针剂、丸剂、散剂、片剂、贴剂、栓剂、乳剂、霜剂、凝胶剂、颗粒剂、胶囊剂、气雾剂、喷雾剂、粉雾剂、缓释剂和控释剂等。这些药用辅料既可以是各种制剂中常规使用的,如:但不仅限于等渗剂、缓冲液、矫味剂、赋形剂、填充剂、粘合剂、崩解剂和润滑剂等;也可以是为了与所述物质相适应而选择使用的,如:乳化剂、增溶剂、抑菌剂、止痛剂和抗氧剂等,这类辅料能有效提高组合物所含化合物的稳定性和溶解性或改变化合物的释放速率和吸收速率等,从而改善各种化合物在生物体内的代谢,进而增强组合物的给药效果。此外,还可以为实现特定的给药目的或方式,如:缓释给药、控释给药和脉冲给药等,而使用的辅料,如:但不仅限于明胶、白蛋白、壳聚糖、聚醚和聚酯类高分子材料,如:但不仅限于,聚乙二醇、聚氨酯、聚碳酸酯及其共聚物等。所称的“有利于给药”的主要表现有:但不仅限于提高治疗效果、提高生物利用度、降低毒副作用和提高患者顺应性等。
在水溶液注射剂中,辅料一般包括等渗剂和缓冲液,以及必要的乳化剂(如:Tweeen-80、Pluronic和Poloxamer等)、增溶剂和抑菌剂等。此外,还包括含有药学上可接受的其它药用辅料,如:抗氧剂、pH调节剂和止痛剂等。
用于制取口服液体制剂的辅料一般包括溶剂,以及必要的矫味剂、抑菌剂、乳化剂和着色剂等。
用于制取片剂的辅料一般包括填充剂(如:淀粉、糖粉、糊精、乳糖、可压性淀粉、微晶纤维素、硫酸钙、磷酸氢钙和甘露醇等)、粘合剂(如:乙醇、淀粉浆、羧甲基纤维素钠、羟丙基纤维素、甲基纤维素、乙基纤维素、羟丙基甲基纤维素、明胶溶液、蔗糖溶液和聚乙烯吡咯烷酮的水溶液或醇溶液等)、崩解剂(如:干淀粉、羧甲基淀粉钠、低取代羟丙基纤维素、交联聚乙烯吡咯烷酮和交联羧甲基纤维素钠)和润滑剂(如:硬脂酸镁、微粉硅胶、滑石粉、氢化植物油、聚乙二醇4,000、聚乙二醇6,000和月桂醇硫酸镁等)等。
用于制取乳剂的辅料一般为水、油(如:脂肪酸)、乳化剂,以及必要的防腐剂和矫味剂等。
用于制取颗粒剂的辅料与片剂类似,但造粒过程不同。根据需要,将制得的颗粒剂与助流剂混合后装入胶囊即得胶囊剂。
本发明所称的“C1~C6”表示碳原子个数为1~6。其中,字母C表示碳原子,其后数字为正整数,如:1、2或3,表示基团所含的碳原子个数,如:1、2、3、4、5和6等。
本发明所称的“烷基”作为一基团或一基团的一部分时是指直链或者带有支链的饱和脂肪烃基团,如:但不仅限于甲基、乙基、正丙基、2-丙基、正丁基、异丁基、叔丁基、正戊基、异戊基、新戊基和己基等。
本发明所称的“烷氧基”为烷基与氧原子连结后而成的基团,如:但不仅限于甲氧基、乙氧基、丙氧基和丁氧基等。
本发明所称的“生物体”、“动物”或“患者”是指人、野生动物和家畜(Livestock)。野生动物为自然状态下未经人工驯化的动物。家畜是为了提供食物来源而人工饲养的动物,如:但不仅限于狗、猫、鼠、大鼠、仓鼠、猪、兔、奶牛、水牛、公牛、绵羊、山羊、鹅和鸡等。给予治疗的“患者”或“生物体”优先选择哺乳动物,尤其是人。
本发明所称的“预防”是指在未被临床标准认定的疾病前,各种用于防止疾病发生或发展的手段或措施,包括医学、物理或化学的方法,以阻止和降低疾病各种症状的发生或发展。
本发明所称的“预防糖尿病”是指将本发明组合物用于还未符合“糖尿病”临床指标的,随着时间的延续将慢慢发展成为临床上定义为“糖尿病”的潜在患者,从而改善这些患者对葡萄糖的耐受,促进肌体对糖代谢的能力,增加肌体对胰岛素的敏感性。这类潜在的患者通常患有“代谢综合症(Metabolic Syndrome)”(Annnu.Rev.Nutri.,2005,25,391-406;Annnu.Rev.Med.,2005,56,45-62;Nat.Rev.Drug.Disc.,2006,5,295-309;Nat.Rev.Endocri.,2006,2,335-348),如:肥胖、胰岛素抵制、葡萄糖不耐受、高血压、动脉硬化证(antherosclerosis)、血脂异常症(dyslipidemia)(即血液中的甘油三酯水平偏高,高密度脂蛋白同时偏低)等。
本发明所称的“治疗”是指为了阻止和降低疾病的发生或发展,使疾病病程的发展或加重得以抑制、遏制、减轻、改善、减缓、停止、延迟或反转,所描述的保持和/或用药时的疾病的、紊乱的或病理学状态的各种指标包括减轻或减少症状或并发症,或治愈或消除疾病、紊乱或状况。
本发明所称的“治疗糖尿病”是指将本发明组合物用于临床诊断为“糖尿病”的患者,改善这些患者对葡萄糖的耐受,促进肌体对糖代谢的能力,增加肌体对胰岛素的敏感性。进而使得患者的餐后和空腹血糖得以控制在正常的水平。由于对葡萄糖代谢的能力得以提高,从而减缓了因长期高血糖而产生的各种心血管疾病、慢性肾衰竭、视网膜病变、神经病变及微血管病变的发生和发展。
本发明所称的“食品”是指包括本发明提供的各种化合物、组合物或提取物制成可食用的单一化合物或组合物。该种单一化合物或组合物的生产和制造应当符合相关食品安全标准,但是这些食品安全标准不得限定本发明。
本发明所称的“保健品”是指将包括本发明提供的各种化合物、组合物或提取物制成可食用的单一化合物或组合物以施于患者,起到对疾病进行预防和治疗的目的。其属于本发明所称的食品,但其生产、制造和销售还应当符合各种相关的要求、标准和规范。
本发明所称的“药物”是指可以用于预防或治疗某种疾病的单一化合物、多种化合物形成的组合物、中药材及其提取物,或指以单一化合物为主要活性成分的组合物或制剂(formulation),还指由多种化合物为活性成分的组合物或制剂。“药物”应理解为不仅指根据一国之法律规定,通过其设立的行政机构审批并准予生产的产品,还指在为了获得通过审批和准予生产的过程中,所形成的含单一化合物为活性成分的各类物质形态。“形成”应理解为通过化学合成、生物转化或购买等途径获得。
优选在一方面中,代谢疾病和II型糖尿病相对于健康或正常个体、器官、组织或细胞报道,具有11β-HSD1还原酶活性增加和/或11β-HSD1氧化酶活性降低的症状,更优选具有11β-HSD1还原酶活性增加和11β-HSD1氧化酶活性降低的症状。更优选,代谢类疾病是由于11β-HSD1还原酶活性增加和/或11β-HSD1氧化酶活性降低造成。由于本发明提供的各种查尔酮衍生物,尤其是化合物RS02~RS06能够同时降低11β-HSD1还原酶活性并增加11β-HSD1氧化酶活性,所以本发明第一方面中更优选代谢疾病和II型糖尿病是由于11β-HSD1还原酶活性增加和11β-HSD1氧化酶活性降低造成的。
优选在另一方面中,代谢疾病和II型糖尿病是可通过降低11β-HSD1还原酶活性和/或增加11β-HSD1氧化酶活性而治疗或预防代谢疾病和2型糖尿病,更优选代谢疾病和II型糖尿病是可通过降低11β-HSD1还原酶活性和增加11β-HSD1氧化酶活性而治疗或预防代谢疾病和2型糖尿病。经本发明人研究发现,由于提供的各种查尔酮衍生物,尤其是化合物RS02~RS06能够同时降低11β-HSD1还原酶活性并增加11β-HSD1氧化酶活性,所以本发明另一方面中更优选代谢类疾病可通过降低11β-HSD1还原酶活性和增加11β-HSD1氧化酶活性中之任一途径(优选同时通过这两个途径)而治疗或预防的。例如:代谢疾病和II型糖尿病选自糖尿病、肥胖症、动脉粥样硬化症、肝硬化、脂肪肝、高血糖、高血脂和高血压。在本发明的具体实施方式中,代谢类疾病选自糖尿病、脂肪肝、高血糖和高血脂。在本发明优选的具体实施方式中,代谢类疾病是糖尿病,如:I型糖尿病和II型糖尿病。
优选在另一方面中,经制备过程,药物含有有效剂量的本发明各种查尔酮衍生物,尤其是化合物RS02~RS06等之一个或者多个。有效剂量可以是单位给药剂量形式(如:一片、一针、一丸或一剂)的药物中的含量,也可以是所需治疗/预防的患者的单位剂量(如:单位体重剂量)。药物制造商能够很容易地通过所需治疗/预防的患者群体的平均体重将所需治疗/预防的患者的单位体重剂量换算成单位给药剂量形式的药物中的含量。
本发明技术方案实现的有益效果:
本发明提供的查尔酮衍生物,能够同时降低11β-HSD1还原酶的活性并增加11β-HSD1氧化酶的活性,能显著降低糖皮质激素皮质醇水平,显著降低血糖水平和血脂水平。因此非常有效于治疗或预防代谢疾病和II型糖尿病。
经验证,本发明提供的查尔酮衍生物,未观察到给药动物的异常行为和情况,具有安全性。也未观察到给药动物的异常行为和情况,说明毒性低,无测量LD50值。
附图说明
图1为制取本发明查尔酮衍生物的化学合成示意图;
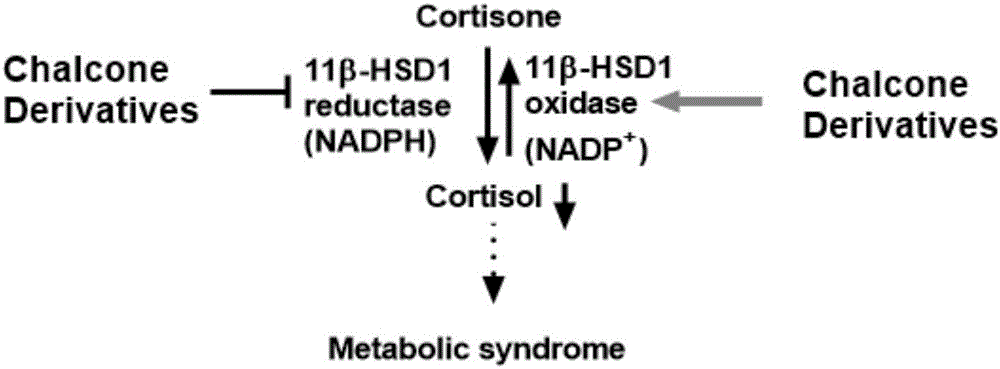
图2为本发明双重调节11β-HSD1机制的示意图;
图3A为本发明化合物RS02对11β-HSD1还原酶抑制的作用(Mean±SEM,n=4);
图3B为本发明化合物RS02对11β-HSD1氧化酶激活的作用(Mean±SEM,n=4);
图4为本发明化合物RS02对大鼠血糖水平和酯质代谢的影响(Mean±SEM,n=10),其中,A图为血糖(Glucose),B图为三酰甘油(TG),C图为总胆固醇(Cholesterol),D图为低密度脂蛋白(LDL),相同字母间无统计学差异(P<0.05);
图5A为本发明化合物RS02~RS06体外对大鼠肾微粒体11β-HSD2活性的影响;
图5B为本发明化合物RS02~RS06体外对人肾微粒体11β-HSD2活性的影响。
具体实施方式
以下结合附图详细描述本发明的技术方案。本发明实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围中。
实施例1
参见图1的方式,即通过取代的苯乙酮和取代或未取代的苯甲醛之间在5℃~8℃,5~7.5eq NaOH条件下进行Claisen-Schmidt缩合反应合成,获得化合物RS02~RS06,其合成通法为:在Fisher-约翰斯熔点装置测定熔点。在600MHz的光谱仪记录1H NMR光谱。在HCT光谱仪以正模式Electrospray电离质谱(LC-ESI-MS)记录数据。经硅胶60(Merck)进行柱层析纯化化合物。
(E)-2-氯-4′-氨基查尔酮(RS02):黄色粉末,收率81.1%,熔点132.3~135.7℃。1H核磁共振(CDCl3),δ:8.132(d,J=15.6Hz赫兹,1H,H-β),7.926(d,J=8.4Hz赫兹,2H,H-2′,H-6′),7.733(d,J=9.6Hz赫兹,1H,H-6),7.490(d,J=15.6Hz赫兹,1H,H-α),7.431(d,J=9赫兹,1H,H-3),7.307(m,1H,H-5),7.302(m,1H,H-3),6.700(d,J=8.4Hz赫兹,2H,H-3′,H-5′),4.190(brs,2H,NH2-4′)。ESI-MS m/z:258.3(M+1)+;计算C15H12ClNO,257.71。
(E)-2-氟-4′-氨基查尔酮(RS03):黄色粉末,收率92.3%,熔点38.7~140.4℃。1H核磁共振(CDCl3),δ:7.936(d,J=7.8Hz,2H,H-2,H-6),7.863(d,J=15.6Hz,1H,H-β),7.653(d,J=15.6Hz,1H,H-α),7.6197.647(m,1H,H-6),7.345~7.362(m,1H,H-4),7.170~7.196(m,1H,H-5),7.105~7.138(m,1H,H-3),6.704(d,J=7.8Hz,2H,H_3,H_5),4.185(brs,2H,NH2_4)。IR(cm-1):3216,3329(NH2),1650(C=0),1485,1557,1587(Ar),1602(C=C)。ES1-MS m/z:240.2(M-I);计算C15H12FNO,241.26。
(E)-2-氯-4′-甲氧基查尔酮(RS04):白色粉末,收率94.0%。1H-WR(CDCl3),δ:8.159(d,J=16.2Hz,1H,H-β),8.038(d,J=9Hz,2H,H_2,H_6),7.742(d,J=6.6Hz,1H,H-3),7.495(d,J=15.6Hz,1H,H-α),7.442(d,J=9Hz,1H,H-6),7.326(t,1H,H_4),7.314(t,1H,H-5),6.989(d,J=8·4Hζ,2H,H-3,H-5),3.896(s,3H,0CH3_4)。ESI-MS m/z:274.2(M+1)+;计算C16H13ClO2,272.73。
(E)-4-甲氧基-4′-甲氧基查尔酮(RS05):收率65.0%。1H NMR(δ/ppm):8.02(d,2H,J=8.7Hz)-7.77(d,1H,J=15.6Hz)-7.69(d,2H,J=8.7Hz)-7.42(d,1H,J=15.6Hz)-6.97(d,2H,J=9Hz)-6.93(d,2H,J=8.7Hz)-3.88(s,3H)-3.85(s,3H)。13C NMR(δ/ppm):55.46-55.54-113.83-114.83-119.59-127.85-130.15-130.75-131.40-143.86-161.55-163.31-188.82;计算C17H16O3,268.307。
(E)-4-羟基-4′-甲氧基查尔酮(RS06):淡黄粉末,收率14.7%,熔点170.4~171.0℃。1H NMR(CDCl3),δ:10.048(s,1H,OH-4),8.122(d,J=8.4Hz,2H,H-2′,H-6′),7.721(d,J=8.4Hz,2H,H-2,H-6),7.720(d,J=15.6Hz,1H,H-β),7.641(d,J=15.6Hz,1H,H-α),7.070(d,J=9.0Hz,2H,H-3,H-5),6.834(d,J=8.4Hz,2H,H-3′,H-5′),3.860(s,3H,OCH 3-4′).ESI-MS m/z:253.0(M-1)-,计算C16H14O3,254.28。
实施例2 RS02~RS06体外双重调节11β-HSD1活性
图2所示,目前所报道的11β-HSD1抑制剂都仅指对11β-HSD1还原酶(11β-HSD1 reductase)选择性,尚未涉及到对11β-HSD1还原酶(reductase)和氧化酶(oxidase)两个催化方向之间的选择性。所报道的11β-HSD1抑制剂同时抑制11β-HSD1还原酶和氧化酶,但由于还原酶占主要地位,因而表观上体现为抑制还原酶,降低机体和局部的皮质醇(cortisol)浓度。目前尚未见对11β-HSD1还原酶和氧化酶分别筛选测试和具有11β-HSD1方向选择性药物的报道。虽然目前的抑制剂抑制氧化酶所产生的影响小于抑制还原酶所产生的影响,但其缺陷在于:(1)势必会抵消抑制剂的部分药效;(2)双向抑制11β-HSD1只能阻止可的松(cortisone)向皮质醇的转化,但是却无法降低已经升高的皮质醇浓度,组织中已经升高的皮质醇水平仍将维持刺激肝糖输出和胰岛素抵抗;已有的皮质醇浓度需要通过刺激11β-HSD1氧化酶使其转化为无活性的可的松。理想的11β-HSD1双重调节剂(本发明的查尔酮化合物(Chalcone derivative)即为11β-HSD1双重调节剂),它能抑制11β-HSD1还原酶同时激活11β-HSD1氧化酶,更大幅度地降低糖皮质激素(cortisol)活性,最终发挥更好的抑制代谢综合征型和2型糖尿病的效果,形成理想的通过11β-HSD1→糖皮质激素→胰岛素→血糖通道发挥抗糖尿病作用的药物。
本实施例大鼠间质细胞分离:用CO2窒息法处死大鼠后,摘除睾丸以提取和纯化间质细胞,方法参考(J Androl,2001,22,665~71)。间质细胞的纯度通过3β-羟甾脱氢酶活性组织化学染色法测定(以0.4mM本胆烷醇酮为甾体底物),该方法可以95%纯度以上的成熟间质细胞。
针对整体间质细胞11β-HSD1氧化酶和还原酶活性检测:利用检测[3H]-可的松或[3H]-11-氢化可的松的浓度分别表征11β-HSD1氧化酶或还原酶活性。每个11β-HSD1活性检测管中加入25nM[3H]-可的松(该浓度在可的松生理学活性浓度范围之内)。50000个原代间质细胞在含有25nM[3H]-可的松的培养液中培养30min后,[3H]-可的松或[3H]-11-氢化可的松的浓度表征11β-HSD1氧化酶或还原酶活性。反应在一定时间后用2ml冰乙醚终止。然后,用有机溶剂提取孵育液中的甾体,氮气气流中干燥后,以氯仿/甲醇(9∶1,v/v)为流动相,通过薄层层析法分离甾体,[3H]-可的松或[3H]-11-氢化可的松的放射性通过扫描辐射仪检测(System AR2000,Bioscan Inc.,Washington,USA),可的松和氢化可的松之间的转化率由它们本身的放射性标准数计算确定。
表1:RS02~RS06对间质细胞11β-HSD1氧化酶和还原酶方向影响(Mean±SEM,n=4)
实施例3 RS02在大鼠间质细胞中对11β-HSD1还原酶和氧化酶的双重调节作用。
参见图3A和图3B,氧化酶活性通过50000个间质细胞加入皮质醇(10-9~10-5M)处理30分钟后测量。11β-HSD1还原酶通过在50000个间质细胞加入可的松(10-9~10-5M)处理30分钟后测量。RS02对11β-HSD1还原酶抑制的IC50是98nM,而其对11β-HSD1氧化酶激活的EC50是54nM。
实施例4 RS02~RS06体外对间质细胞和人肝细胞微粒体11β-HSD1还原酶活性
大鼠间质细胞和人肝细胞微粒体蛋白的制备:大鼠间质细胞和人肝细胞微粒体制备参考Ge RS等报道的方法进行制备(Endocrinology 1997,138,435~42)。
化合物处理与检测:对于微粒体中的11β-HSD1活性检测,微粒体(10μg蛋白)与11β-HSD1底物0.2mM NADPH、1mM G6P一起孵育,反应在一定时间后用2ml冰乙醚终止。然后,用有机溶剂提取孵育液中的甾体,氮气气流中干燥后,以氯仿/甲醇(9∶1)为流动相,通过薄层层析法分离甾体,[3H]-可的松或[3H]-11-氢化可的松的放射性通过扫描辐射仪检测(System AR2000,Bioscan Inc.,Washington,USA),可的松和氢化可的松之间的转化率由它们本身的放射性标准数计算确定。11β-HSD2的检测方法如11β-HSD1氧化酶的检测方法。
表2
RS02~RS06对间质细胞和人肝细胞微粒体11β-HSD1还原酶的影响(Mean±SEM,n=4)
实施例5 RS02~RS06体外对大鼠和人肾微粒体11β-HSD2活性
大鼠肾微粒体和人肾微粒体蛋白的制备:大鼠肾微粒体制备参考Ge RS等报道的方法进行制备(Endocrinology 1997,138,435~42)。
化合物处理与检测:对于微粒体中的11β-HSD2活性检测,微粒体(10μg蛋白)与11β-HSD2底物0.2mM NAD+一起孵育,反应在一定时间后用2ml冰乙醚终止。然后,用有机溶剂提取孵育液中的甾体,氮气气流中干燥后,以氯仿/甲醇(9∶1)为流动相,通过薄层层析法分离甾体,[3H]-可的松和[3H]-11-氢化可的松的放射性通过扫描辐射仪检测。氢化可的松转化可的松的转化率由它们本身的放射性标准数计算确定。
如图5A和图5B所示,RS02-RS06对大鼠和人肾微粒体11β-HSD2活性的无抑制作用。
实施例6 RS02对动物模型血糖水平和酯质代谢的影响
雄性成年SD大鼠30只,每组10只分别用正常饮食喂养(CON,对照组)和高脂饮食喂养(HFD,高脂模型组),灌胃给药RS02(2mg/kg组),对照组和高脂模型组给溶媒(1%羧甲基纤维素),RS02悬浮于1%羧甲基纤维素,灌胃给药2个月。
各种指标通过生化分析仪检测血糖(Glucose)三酰甘油(TG)、总胆固醇(Cholesterol)和低密度脂蛋白(LDL)。
如图4所示,化合物RS02明显降低血糖、三酰甘油、总胆固醇和低密度脂蛋白作用。
实施例7 RS02的安全性实验:低剂量亚急性毒性试验
将RS02悬溶于1%的羟甲基纤维素钠溶液中,取15~18g的雄性Balb/C小鼠,分为4组,每组10只,普通饮食喂养,分别是阴性组(正常饲养,不灌胃)、溶剂组(灌胃相同量的%羟甲基纤维素钠溶液)、400mg/kg的RS02组、800mg/kg的RS02组,灌胃给药,每天一次,连续灌胃14天。
14天内没有小鼠因毒性死亡,也未观察到给药小鼠的异常行为和情况,说明安全。
实施例8RS02的安全性实验:急性毒性试验
将RS02悬溶于1%的羟甲基纤维素钠溶液中,取15-18g的Balb/C雄性小鼠20只,普通饮食喂养,以4g/kg的剂量灌胃RS02,每天一次,连续灌胃7天,然后再观察7天。
14天内没有小鼠因毒性死亡,也未观察到给药小鼠的异常行为和情况,说明毒性低,无测量LD50值。
结论:RS02显著的降低血糖的作用,毒性低。
- 还没有人留言评论。精彩留言会获得点赞!
- 一类水溶性含双苯并三氮唑‑查尔酮二联体的有机磺酸盐衍生物合成与应用的制作方法与工艺
- 一种从甘草渣制备甘草查尔酮A的方法与流程
- 一种氟化查尔酮的制备方法与流程
- 一类具抗肿瘤活性的甘草查尔酮A二氢氨基嘧啶类化合物及其合成方法与流程
- 一类具抗肿瘤活性的甘草查尔酮A硫脲嘧啶类衍生物及其合成方法与流程
- 一种具抗肿瘤活性的甘草查尔酮A二氢吡唑甲酰胺类化合物及其合成方法与流程
- 3‑去氧苏木查尔酮在制备预防和治疗结直肠癌药物中的应用的制作方法与工艺
- 具有2’‑羟基查尔酮结构Diels‑Alder产物的制备方法与流程
- 一种海南龙血树查尔酮异构酶DcCHIL1及其编码基因和应用的制造方法与工艺
- 一类具抗肿瘤活性的甘草查尔酮A二氢嘧啶类化合物及其合成方法与流程