一种多孔磁性铜离子金属螯合载体及其制备方法、利用载体固定化木瓜酶的方法及其应用与流程
本发明属于化学技术领域,特别涉及一种多孔磁性铜离子金属螯合载体及利用该载体固定化酶。
背景技术:
磁性载体是最近几年迅速发展起来的用于固定化酶的新型材料载体。以其作载体的各种生物检测技术已经渗透到免疫学、微生物学、生物化学、分子遗传学、电化学以及酿酒发酵工业等各个领域,展现出广阔的应用前景。它是指通过适当方法使有机高分子与磁性材料相结合所形成的具有一定磁性和特殊结构的微球载体。与非磁性材料相比,其具有一些新的优点:(1)磁性材料制得的固定化酶可通过外加磁场来控制其在底物中的运动方向和方式,进一步提高催化效率;(2)能进行连续反应,可用于大规模生产;(3)便于与产物分离,简化提纯工艺,降低生产成本;(4)固定化酶可以回收重复利用。
固定化金属亲和层析(Immobilized metal affinity chromatography,IMAC)是利用金属螯合配体与蛋白质表面的供电子氨基酸-组氨酸的咪唑基,半胱氨酸的巯基和色氨酸的吲哚基,可以与一些过渡态的金属离子Cu2+、Zn2+等以配位作用的原理形成稳定的螯合物,从而可以对蛋白质进行分离、纯化。金属螯合载体和蛋白质通过过渡金属离子形成配位键结合,与传统固定化载体和方法相比,其结合牢固,不易被洗脱,结合位点少,可以实现酶的定向固定,不使用交联剂,避免了对酶分子造成的化学损伤,很大程度上保持了酶分子的天然构象,有效减少酶活的损失。金属螯合载体对固定到表面的蛋白质构象影响较小,若将这种技术应用于固定化酶,有望克服目前常用固定化酶载体和方法的一些不足。
大豆分离蛋白常作为一种食品添加剂应用到食品工业中,是以低温脱溶大豆粕为原料生产的。其营养丰富,不含胆固醇,是植物蛋白中为数不多的可替代动物蛋白的品种之一。蛋白质是人体必不可缺少的营养元素,在人体的生长和代谢过程中起着非常重要的作用。然而由于不同蛋白质的氨基酸组成与空间结构不同,在人体内的消化吸收率也大不相同。当蛋白质被水解为小肽和游离氨基酸后,其吸收利用率可以增加。
但目前尚没有稳定合适的载体来固定化酶,在大豆蛋白的分离水解中达到很好的反映效果。
技术实现要素:
本发明针对以上缺点,提供了一种环氧基密度高,结构合理的磁性载体,以达到利用该载体固定化酶,酶的催化效率高的目的。
为实现上述目的,本发明采取下述技术方案来实现:
本发明提供一种多孔磁性铜离子金属螯合载体,所述载体为以壳聚糖粉末为原料,Fe3O4作为磁性材料,SiO2为致孔剂,环氧氯丙烷为交联剂进行反应,合成多孔磁性壳聚糖微球;多孔磁性壳聚糖微球以环氧氯丙烷为活化剂,以亚氨基二乙酸为螯合配基,再与过渡态的金属铜离子进行螯合,制备的得到多孔磁性铜离子金属螯合载体。
本发明还提供一种多孔磁性铜离子金属螯合载体的制备方法,所述方法以壳聚糖粉末为原料,Fe3O4作为磁性材料,SiO2为致孔剂,环氧氯丙烷为交联剂进行反应,合成多孔磁性壳聚糖微球;然后,以环氧氯丙烷为活化剂,以亚氨基二乙酸为螯合配基,再与过渡态的金属铜离子进行螯合,制备得到多孔磁性铜离子金属螯合载体。
进一步,所述制备方法包括以下步骤:
步骤a,多孔磁性壳聚糖微球载体的制备,向壳聚糖粉末中,加入乙酸溶液,室温下缓慢搅拌至壳聚糖完全溶解后;加入纳米Fe3O4,搅拌至均匀,加入致孔剂SiO2,搅拌几分钟后,加入液体石蜡,搅拌后升温至50℃,滴加Span80作为乳化剂,乳化至形成壳聚糖液滴,随后升温70℃至温度恒定,调节溶液pH值为9-11,保持为碱性,缓慢的逐滴滴加环氧氯丙烷进行反应;反应后对产物进行洗涤,直至pH值为中性,然后加入NaOH的溶液,80℃的加热2h,停止加热后,反复使用蒸馏水进行洗涤,再用稀盐酸洗涤一次,最后蒸馏水洗至中性,得到多孔磁性壳聚糖微球载体,烘干后备用;
步骤b,多孔磁性壳聚糖微球载体的活化,向步骤a中制得的多孔磁性壳聚糖微球中,加入NaOH溶液和环氧氯丙烷,以及二甲亚砜和硼氢化钠,在40℃恒温反应4h;活化反应后,用去离子水洗涤,去除未反应的环氧氯丙烷和氢氧化钠;
步骤c,多孔磁性铜离子金属螯合载体的制备,向活化好的多孔磁性壳聚糖微球载体中,加入Na2CO3溶液,再加入亚氨基二乙酸,40℃恒温反应10h;然后将反应产物分散于CuCl2溶液中,25℃恒温反应24h,得到多孔磁性铜离子金属螯合载体。
进一步,步骤a中乙酸溶液的质量分数为4%。
进一步,步骤b中二甲基亚砜的体积分数为6%。
进一步,步骤b中氢氧化钠溶液的浓度为0.6mol/L。
进一步,步骤b中环氧氯丙烷的体积分数为45%。
本发明还提供一种利用多孔磁性铜离子金属螯合载体固定化木瓜酶的方法,向多孔磁性铜离子金属螯合载体中,加入木瓜蛋白酶溶液,室温下振荡3h,用PBS洗涤数次至上清中检测不到酶活,得到固定化的木瓜蛋白酶。
本发明还提供一种利用上述方法制得的固定化木瓜酶在大豆分离蛋白水解中的应用。
进一步,所述应用为将大豆分离蛋白溶于水中,形成底物浓度为4%的水分散液,在80℃水浴锅中保温20min。迅速冷却至酶解温度,搅拌30min,调节pH至8,按底物比例加入6000-9000U/g的固定化木瓜蛋白酶,缓慢搅拌反应至少4h。
总之,本发明的有益效果为:本发明的载体结构稳定,利用此载体制得的固定化酶催化效率高,还可用于大规模生产,制得的固定化酶可以回收重复利用,大大降低生产成本,同时本发明利用该载体制得的固定化木瓜酶在大豆蛋白的分离水解中效果很好。
附图说明
图1是二甲基亚砜对环氧基密度的影响。
图2是反应温度对环氧基密度的影响。
图3是反应时间对环氧基密度的影响。
图4是环氧氯丙烷体积分数对环氧基密度的影响。
图5是NaOH溶液浓度对环氧基密度的影响。
图6是温度对木瓜蛋白酶固定化的影响。
图7是给酶量对木瓜蛋白酶固定化的影响。
图8是pH对木瓜蛋白酶固定化的影响。
图9是固定化时间对酶固定化的影响。
图10是温度对水解度的影响。
图11是pH对水解度的影响。
图12是时间对水解度的影响。
图13是底物浓度对水解度的影响。
图14是给酶量对水解度的影响。
具体实施方式
下面结合附图对本发明进行详细描述。
一、多孔磁性铜离子金属螯合载体的制备
1.多孔磁性壳聚糖微球载体(PCMM)的制备
称取1g的壳聚糖粉末于250mL的四颈瓶中,加入25mL的质量分数为4%的乙酸溶液,室温下缓慢搅拌至壳聚糖完全溶解后,加入0.3g纳米Fe3O4,搅拌至均匀,加入致孔剂Si02,搅拌几分钟后,加入100mL的液体石蜡,打开搅拌器(300r/min),搅拌一段时间后升温至50℃,滴加几滴Span80作为乳化剂,乳化一定的时间,直至形成细小的壳聚糖液滴,随后升温70℃至温度恒定,滴加2mol/L的NaOH溶液,使溶液pH调至9-11的范围,保持为碱性,缓慢的逐滴滴加4mL的环氧氯丙烷(ECH)。反应5h后,停止反应,待温度冷却到室温,再依次用石油醚、无水乙醇、丙酮洗涤多次,最后用蒸馏水反复洗至pH值为中性。加入适量的质量分数10%NaOH的溶液,放入80℃的水浴锅中,加热2h,停止加热后,反复使用蒸馏水进行洗涤,再用适量的稀盐酸洗涤一次,最后蒸馏水洗至中性。将制得的多孔磁性壳聚糖微球(PCMM)放于50℃的真空干燥箱中至恒重、备用。
2.多孔磁性壳聚糖微球(PCMM)活化工艺研究
称取0.5g多孔磁性壳聚糖微球(PCMM)放入锥形瓶中,加入适量的1mol/L的NaOH溶液和一定量的体积分数45%的环氧氯丙烷(ECH),以及适量的体积分数为6%的二甲亚砜(DMSO)和一定量的硼氢化钠,在40℃的恒温水浴摇床中反应4h。
PCMM经活化反应后,用大量的去离子水进行洗涤,去除未反应的环氧氯丙烷和氢氧化钠。洗涤液中残留的环氧基和氢氧根用以下方法进行检测:量取约2mL洗涤液,加入1滴酚酞指示剂,振荡后溶液不变红,则氢氧根已清洗干净;量取约2mL洗涤液,加入1滴酚酞指示剂,再加入2mL 1.3mol/L硫代硫酸钠溶液,剧烈振荡后溶液不变红,则表明残留的环氧基已被清洗干净。
2.1多孔磁性壳聚糖微球(PCMM)环氧基活化密度的测定
多孔磁性壳聚糖微球(PCMM)的环氧基活化密度通常采用硫代硫酸钠滴定法测定,将活化好的微球用布氏漏斗抽干,称取0.5g的微球于25mL的锥形瓶中,并加入适量的1.3mol/L硫代硫酸钠和酚酞指示剂1-2滴,在室温下放在恒温震荡器中反应0.5h,再用盐酸标准溶液(0.1mol/L)进行滴定,直至溶液由红色变为无色,停止滴定,并记录滴定前后消耗的盐酸标准溶液的体积。根据环氧基与硫代硫酸钠反应并释放出OH-,以标准HCl溶液中和滴定OH-,即可得出每克多孔磁性壳聚糖微球(PCMM)上包含的环氧基的量,即环氧基密度。环氧基活化密度计算公式如下:
式中:
S-环氧基修饰密度,mmol·g-1;
CHCl-标准HCl溶液浓度,mol·L-1;
Va-滴定前标准HCl的体积,mL;
Vb-滴定后标准HCl的体积,mL;
M-活化微球质量,g。
2.2多孔磁性壳聚糖微球(PCMM)最佳活化工艺条件的确定
(1)二甲基亚砜(DMSO)体积分数对微球环氧基活化密度的影响
固定活化温度30℃,NaOH溶液浓度为0.4mol·L-1,环氧氯丙烷(ECH)体积分数35%,活化反应时间3h,按上述方法活化后计算环氧基密度值,结果如图1所示PCMM活化反应的最佳二甲基亚砜的体积分数为6%。
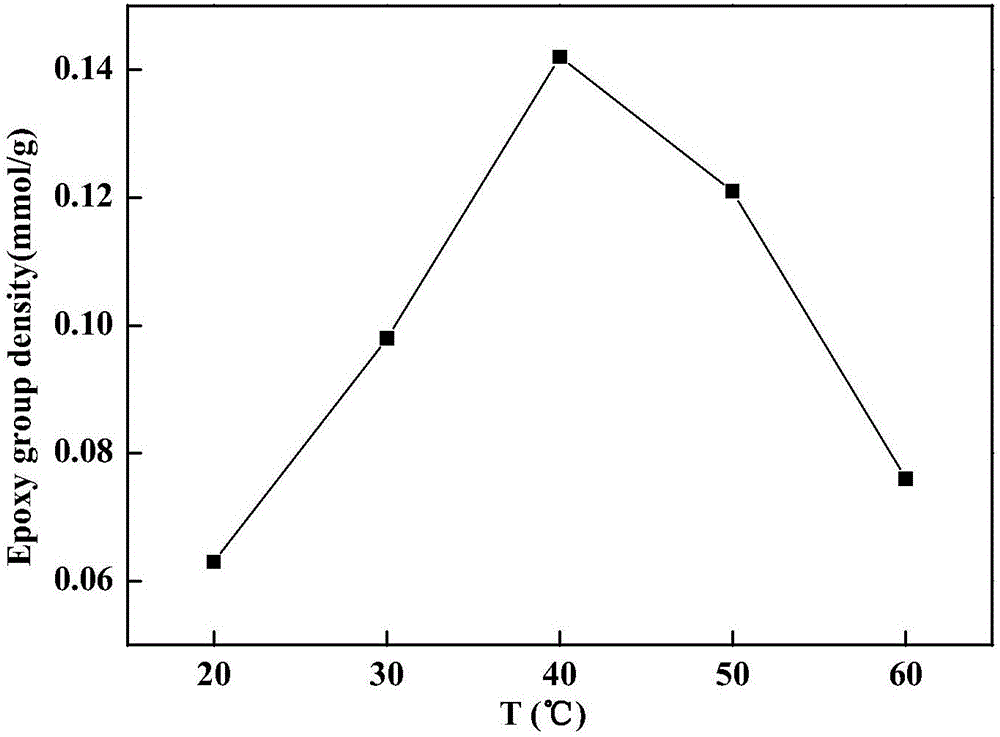
(2)反应温度对微球环氧基活化密度的影响
固定环氧氯丙烷体积分数为35%,二甲亚砜(DMSO)体积分数6%,活化时间为3h,NaOH溶液浓度为0.4mol·L-1,测定方法同上,如图2所示PCMM活化反应的最佳温度为40℃。
(3)活化时间对微球环氧基活化密度的影响
固定活化温度40℃,环氧氯丙烷(ECH)体积分数为35%,二甲亚砜(DMSO)体积分数6%,NaOH溶液浓度为0.4mol·L-1,测定方法同上,结果如图3所示PCMM活化反应的最佳时间为4h。
(4)环氧氯丙烷体积分数对微球环氧基活化密度的影响
固定活化温度40℃,NaOH溶液浓度为0.6mol.L-1,二甲亚砜(DMSO)体积分数4%,活化反应时间4h,测定方法同上,结果如图4所示PCMM活化反应的最佳环氧氯丙烷体积分数为45%。
(5)氢氧化钠溶液浓度对微球环氧基活化密度的影响
固定活化温度40℃,环氧氯丙烷(ECH)体积分数为45%,二甲亚砜(DMSO)体积分数6%,活化反应时间4h,测定方法同上,结果如图5所示PCMM活化反应的最佳NaOH溶液浓度为0.6mol·L-1。
选取上述最优条件活化后的多孔磁性壳聚糖微球(PCMM)表面上的环氧基密度最高0.268mmol·g-1。
3.PCMM-IDA-Cu2+金属螯合载体的制备
称取0.5g活化好的PCMM放入锥形瓶里,加入50mL2mol/L Na2CO3溶液,再加入0.4g的IDA,放入40℃的恒温水浴摇床中反应10h。反应结束后,用大量的蒸馏水冲洗,浸泡过夜,再水洗,用磁铁进行分离收集产物,放入50℃的烘箱中烘干、备用。称取15mg的PCMM-IDA分散于30mL 0.5mg/mL的CuCl2溶液中,放入25℃ 250r/min的恒温振荡器反应24h。反应结束后,用大量的蒸馏水反复冲洗,即制得PCMM-IDA-Gu2+载体。
二、固定化木瓜酶
称取一定量的PCMM-IDA-Cu2+多孔磁性金属螯合载体,置于50mL的碘量瓶中,加入适量的1mg/mL的木瓜蛋白酶溶液(溶于0.1mol/L磷酸缓冲液,pH=7.0),室温下振荡4h,用0.1mol/LPBS洗涤数次至上清中检测不到酶活,即得固定化的木瓜蛋白酶,放于4℃的冰箱中保存,备用。
固定化过程如下:
1.酶蛋白固载量的测定
用0.1mol/L的PBS缓冲液(pH=7.0)配制1mg/mL的木瓜蛋白酶标准液,取7支25mL的比色管并编号,按表3-1加入1mg/mL的木瓜蛋白酶标准液和蒸馏水,配制成不同浓度的木瓜蛋白酶溶液。
表3-1不同浓度的木瓜蛋白溶液
Tab.3-1 Papain solution of different concentration
用蒸馏水定容至25mL,充分摇匀,静置10min,以0号比色管为参比,通过紫外分光光度计扫描测得其最佳波长λ为278nm。在此波长下测定吸光度OD278。以木瓜蛋白酶浓度为横坐标,吸光值OD278为纵坐标,绘制木瓜蛋白酶标准曲线,得到的线性方程为y=1.416x+0.0037(R2=0.9999)
样品中木瓜蛋白酶固载量的测定:酶固载量是原始加入的酶量减去剩余酶液(上清液和洗脱液的混合液)的酶量得到的。取适量的样品待测液,在波长为278nm处用测其吸光度,通过木瓜蛋白酶溶液的标准曲线,确定待测液中的酶蛋白的浓度。根据下式计算木瓜蛋白酶的固载量Qe:
式中,Qe:酶固定量(mg/g);C0:固定前溶液中酶含量(mg/mL);
Ce:固定后溶液中酶含量(mg/mL);C1:PBS洗涤液中酶含量(mg/mL);
V0:固定化所用酶溶液体积(mL);V1:所用PBS洗涤液体积(m L);
m:用于固定化酶多孔磁性金属螯合载体的质量(g,干重)
2.酶活性的测定方法
游离酶活性的测定方法:将一定量的木瓜蛋白酶溶于0.1mol/L PBS(pH=7.0)的缓冲溶液中,配成1mg/mL的酶液。在碘量瓶中加入1mL的木瓜蛋白酶溶液,再加入5mL的酶激活剂(内合5mmol/L的L-半胱氨酸和2mmol/L 乙二胺四乙酸),在37℃水浴中,预热10min后,再加入5mL的5%的底物酪蛋白溶液,在37℃水浴中,反应10min,然后迅速加入10mL5%的三氯乙酸溶液(TCA),终止反应,剧烈摇动混合均匀后,在37℃水浴中放置30min后,进行离心分离,然后用紫外分光光度计在275nm处测定吸光值,并计算木瓜蛋白酶活力。空白对照组在加入木瓜蛋白酶溶液之前,先加入10mL 5%TCA,其余步骤相同。
固定化酶活力测定方法:取等当量的固定化木瓜蛋白酶加入5mL的酶激活剂(内含5mmol/L的L-半胱氨酸和2mmol/L 乙二胺四乙酸),在37℃水浴中,预热10min后,再加入5mL的5%的底物酪蛋白溶液,在37℃水浴中,反应10min,然后迅速加入10mL 5%的三氯乙酸溶液(TCA),终止反应,剧烈摇动混合均匀后,在37℃水浴中放置30min后,进行离心分离,然后用紫外分光光度计在275nm处测定吸光值,并计算固定化木瓜蛋白酶活力。空白对照组在加入木瓜蛋白酶溶液之前,先加入10mL 5%TCA,其余步骤相同。酶活力的计算公式为:
式中:
A:样品溶液中的吸光度值;
AO:对照溶液的吸光度值;
V:反应溶液的总体积mL;
t:反应时间min;
N:稀释倍数;
K:L-酪氨酸标准曲线的斜率;
M:样品的重量(mg)。
3.固定化条件优化
(1)固定化温度对酶固定化的影响
平行取多孔磁性金属螯合载体15.0mg多份,在其它固定化条件相同的情况下,改变固定化温度分别为15℃、20℃、25℃、30℃、35℃和40℃,然后制备固定化酶,探讨温度对酶固定化的影响。
结果如图6所示,PCMM-IDA-Cu2+载体的最佳酶固定化温度为30℃。
(2)给酶量对酶固定化的影响
平行取多孔磁性金属螯合载体15.0mg多份,在其它固定化条件相同的情况下,分别加入不同量的木瓜蛋白酶,使给酶量为0.5mg/15.0mg载体、1.0mg/15.0mg载体、1.5mg/15.0mg载体、2.0mg/15.0mg载体和2.5mg/15.0mg载体,然后制备固定化酶,探讨给酶量对酶固定化的影响。
结果如图7所示PCMM-IDA-Cu2+载体的最佳给酶量是1.5mg/15mg。
(3)pH对酶固定化的影响
配置一系列浓度为0.1mg/mL的木瓜蛋白酶溶液,用不同pH缓冲液(pH=4.0、5.0、6.0、7.0、8.0、9.0),平行取多孔磁性金属螯合载体15.0mg多份,分别加入25mL上述不同pH值的木瓜蛋白酶溶液,在其它固定化条件相同的情况下,然后制备固定化酶,探讨pH对酶固定化效果的影响。
结果如图8所示,PCMM-IDA-Cu2+载体最佳的缓冲溶液pH值为7。
(4)固定化时间对酶固定化的影响
平行取多孔磁性金属螯合载体15.0mg多份,改变固定化时间分别为1h、2h、3h、4h、5h和6h,在其它固定化条件相同的情况下,然后制备固定化酶,探讨固定化时间对酶固定化的影响。
结果如图9所示,PCMM-IDA-Cu2+载体对木瓜蛋白酶最佳的固定化时间为4h。
在如上述最佳的固定化条件下进行3次重复批次试验进行酶的固定化活性验证,得到PCMM-IDA-Cu2+载体的平均固定化酶活为7.885U/mg,测得的酶的固载量94.18mg/g,酶活力回收率达到87.21%。
三、大豆分离蛋白水解的应用
将适量的大豆分离蛋白溶于水中,形成不同底物浓度的水分散液,在85℃水浴锅中保温20min。迅速冷却至酶解温度,搅拌30min,调节pH至一定值,加入一定量的固定化木瓜蛋白酶,缓慢搅拌反应一定的时间。反应过程中以0.1
mol/L NaOH标准溶液进行滴定,保持溶液pH变动范围在±0.1内,同时记录水解过程消耗的碱液量。水解结束后,酶解液在沸水中维持10min进行灭酶,然后迅速冷却至室温,在10000r/min下离心分离10min。倾倒出上清液,记录总体积。
大豆分离蛋白水解度的测定方法
由于pH-stat法操作简单,快速,可重复性高等优点,本实验采用pH-stat法,测定大豆分离蛋白的水解度,公式如下[130]:
式中:V:NaOH消耗量,mL;C:NaOH浓度,mol/L,α:大豆分离蛋白氨基的平均解离度,α=10pH-pK/(1+10pH-pK),pK大豆分离蛋白α-氨基的pK值;m:样品中蛋白质的重量;htot:每克蛋白质底物具有的肽键毫摩尔数,大豆分离蛋白htot=7.75。
(1)温度对大豆分离蛋白水解度的影响
先取适量的大豆分离蛋白溶液质量分数5%,进行预处理(85℃、20min),pH 8,固定化木瓜蛋白酶添加量5000U/g,温度分别为50℃、60℃、70℃、80℃、90℃的条件下,进行酶解试验,反应2h时间,之后分别对水解产物离心分离,取上清液,采用pH-stat法,测定上清液的水解度。结果如图10所示。
(2)pH对大豆分离蛋白水解度的影响
先取适量的大豆分离蛋白溶液质量分数5%,进行预处理(85℃、20min),固定化木瓜蛋白酶添加量5000U/g,温度70℃,pH分别调至6.5、7.0、7.5、8.0、8.5、9.0,进行酶解试验,反应2h时间,之后分别对水解产物离心分离,取上清液,采用pH-stat法,测定上清液的水解度。结果如图11所示。
(3)水解时间对大豆分离蛋白水解度的影响
取适量的大豆分离蛋白溶液质量分数5%,进行预处理(85℃、20min),固定化木瓜蛋白酶添加量5000U/g,温度70℃,pH 8.0,水解时间分别为1h、2h、3h、4h、5h、6h进行酶解试验,之后分别对水解产物离心分离,取上清液,采用pH-stat法,测定上清液的水解度。结果如图12所示。
(4)底物浓度对大豆分离蛋白水解度的影响
取适量的大豆分离蛋白溶液质量分数分别为2%、3%、4%、5%、6%,进行预处理(85℃、20min),固定化木瓜蛋白酶添加量5000U/g,温度70℃,pH 8.0,水解时间2h,进行酶解试验,之后分别对水解产物离心分离,取上清液,采用pH-stat法,测定上清液的水解度。结果如图13所示。
(5)给酶量对大豆分离蛋白水解度的影响
取适量的大豆分离蛋白溶液质量分数为5%,进行预处理(85℃、20min),温度70℃,pH 8.0,固定化木瓜蛋白酶添加量分别为3000U/g、4000U/g、5000U/g、6000U/g、7000U/g、8000U/g、9000U/g,水解时间2h,进行酶解试验,之后分别对水解产物离心分离,取上清液,采用pH-stat法,测定上清液的水解度。结果如图14所示。
本发明虽然已以较佳实施例公开如上,但其并不是用来限定本发明,任何本领域技术人员在不脱离本发明的精神和范围内,都可以利用上述揭示的方法和技术内容对本发明技术方案做出可能的变动和修改,因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做出的任何简单修改、等同变化及修饰,均属于本发明技术方案的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!