Bola型槲皮素衍生物及其制备方法和应用与流程
本发明属于化学药物合成领域,涉及bola型槲皮素衍生物及其制备方法和应用。
背景技术:
槲皮素(quercetin)是一种从天然植物中提取的黄酮醇类化合物,它具有抗氧化、抗癌、抗菌和抗炎等多种生物学活性。大量研究表明槲皮素能靶向多个和癌症相关的信号转导通路,抑制这些通路中多种蛋白激酶的表达是其产生抗癌活性的重要原因。最近的研究表明,槲皮素不仅能有效地抑制热休克蛋白hsp27和hsp70的表达,还能抑制热休克因子hsf1的表达。槲皮素对热休克蛋白和热休克因子的抑制拓宽了该药物的靶点谱,也为其抗癌活性提供了新的作用机制。然而从结构上看,槲皮素具有分子堆砌较紧密的平面结构,因此水溶性和脂溶性都较差,生物利用度较低并具有一定的毒性,这就极大地限制了它在临床治疗上的应用。为了改善槲皮素的物理化学性质并提高其生物活性,人们对其进行了结构改造来增强其水溶性或脂溶性并改善其生物利用度。常见的槲皮素衍生物包括槲皮素醚类衍生物,酯类衍生物,糖苷类衍生物和氨基酸衍生物等,这些结构修饰在一定程度上改善了该类化合物的溶解性,并得到了新的活性化合物,其中氨基酸衍生物qc12已经作为水溶性抗癌药物进入了i期临床研究。最近有报道表明向槲皮素的羟基上引入不同长度的烷基时,所得到新化合物在部分癌细胞中较母体分子展示了更好的抗增殖活性。因此我们认为槲皮素类脂化合物应该是一类有潜力的抗癌药物。但即便如此,目前被报道的大部分槲皮素衍生物依然面临起效剂量大和生物利用度不高的问题,使得其进入临床研究的可能性受到影响。另外,作为小分子药物,在癌症治疗中对正常组织和肿瘤缺乏选择性,难以真正作用于病变部位也是制约该类药物疗效,并导致药物毒副作用的根本原因。因此发展新型的槲皮素衍生物来提高其水溶性和生物利用度,并基于其结构通过小分子自组装将其转化为纳米药物是改善这类化合物的物理化学性质,增强其靶向病灶组织的能力,进而减少药物对正常组织和细胞伤害的重要途径。
bola型两亲分子是将两个极性头基用疏水链连接起来,这种特殊结构赋予了bola型分子独特的性质,如在质膜中具有更好的稳定性和兼容性等。目前bola型两亲分子被广泛应用于表面活性剂,其形成的囊泡结构也是作为一种理想的载体用于药物传递。为了改善槲皮素的水溶性和脂溶性差,生物利用度低,且对肿瘤组织缺乏靶向性的缺点,发明人利用bola型分子这种特殊的结构制备出一种bola型槲皮素衍生物。
技术实现要素:
有鉴于此,本发明的目的在于提供一种bola型的槲皮素衍生物的合成及其通过自组装形成纳米颗粒的方法。
为达到上述目的,本发明提供如下技术方案:
bola型槲皮素衍生物,其结构如通式i~v所示:
式中:
r独立表示为-ch2-,-s-s-或
n表示为1~10的正整数。
进一步,通式i~vbola型槲皮素衍生物制备纳米颗粒,其制备方法为:取通式i~v中任一化合物加四氢呋喃溶解,剧烈搅拌下,将其滴加入蒸馏水中,继续搅拌24-72小时后用0.45μm滤膜过滤,再稀释并超声得bola型槲皮素衍生物纳米颗粒。
进一步,当通式i~v中r为-ch2-的bola型槲皮素衍生物制备方法为:按摩尔比为2:1分别取通式vi化合物和通式vii二溴烷烃,加碳酸铯,并以二甲基甲酰胺为溶剂,18~25℃反应4~12小时后经柱层析得到苄基保护的bola型槲皮素衍生物,将该反应中间体溶于甲醇,在钯碳/氢气的条件下,18~25℃反应1-5小时后过滤,旋干溶剂并分离得到通式i~v中r为-ch2-的bola型槲皮素衍生物,所述碳酸铯与通式vi化合物摩尔比为1:2~6;
通式vi中,当其中任一r1为h时,其余r1为苄基;
通式vii中,n表示为1~10的正整数;
化合物i-1~v-1的通式为:
n表示为1~10的正整数。
进一步,当通式i~v中r为-s-s-的bola型槲皮素衍生物制备方法为:按摩尔比为1:2~5分别取通式vi化合物和通式vii二溴烷烃,加碳酸铯,并以二甲基甲酰胺为溶剂,18~25℃反应4~12小时后经柱层析得到通式viii化合物,将通式viii化合物溶于甲醇,在钯碳/氢气的条件下,搅拌2小时,过滤,旋干溶剂后分离得到通式ix化合物,将通式ix化合物溶于乙腈,加入硫代乙酸钾,搅拌2-10小时后柱层析分离得到通式x化合物,将通式x化合物溶于甲醇中,加入磷酸钾,空气中搅拌2-10小时后滴加1mol/l盐酸,然后过滤并通过柱层析分离得到通式i~v中r为-s-s-的bola型槲皮素衍生物,所述碳酸铯与通式vi化合物摩尔比为1:2~6;
通式vi中,当其中任一r1为h时,其他r1为苄基;
通式vii中,n表示为1~10的正整数;
通式viii中,其中任一r2为
n表示为1~10的正整数;
通式ix中,其中任一r3为
n表示为1~10的正整数;
通式x中,其中任一r4为
n表示为1~10的正整数;
化合物i-2~v-2的通式为:
n表示为1~10的正整数。
进一步,当通式i~v中r为
通式xi中,ar为任意芳香基团;
通式ix中,其中任一r3为
n表示为1~10的正整数;
化合物i-3~v-3的通式为:
进一步,通式i~vbola型槲皮素衍生物或纳米颗粒在制备抑制细胞生长药物中的应用。
进一步,所述细胞为癌细胞。
进一步,所述癌细胞为前列腺癌细胞pc-3、肝癌细胞hepg2、宫颈癌细胞hela、卵巢癌
细胞skov3、胰腺癌细胞bxpc-3和panc-1。
本发明的有益效果在于:基于槲皮素进行结构优化所制备的bola型槲皮素衍生物均具有潜在的抑制癌细胞增殖的活性。在相同浓度下,这一类化合物的抑制癌细胞增殖的活性均远优于槲皮素本身,同时对多种癌细胞增殖的抑制效果都优于相应的临床用药或与其效用相当,因此本发明提供一类新型的抗肿瘤药物先导。另外,这类化合物有在水溶液中自组装形成纳米尺度颗粒的能力,也使其能因为实体瘤的高通透性和滞留效应(enhancedpermeabilityandretentioneffect,epr)更易聚集在肿瘤组织内部实现靶向给药,同时作为纳米药物载体还可以包封其他小分子药物而达到联合用药的效果。
附图说明
为了使本发明的目的、技术方案和有益效果更加清楚,本发明提供如下附图进行说明:
图1为动态光散射表征本发明化合物i-1-1自组装形成的纳米尺度的颗粒;
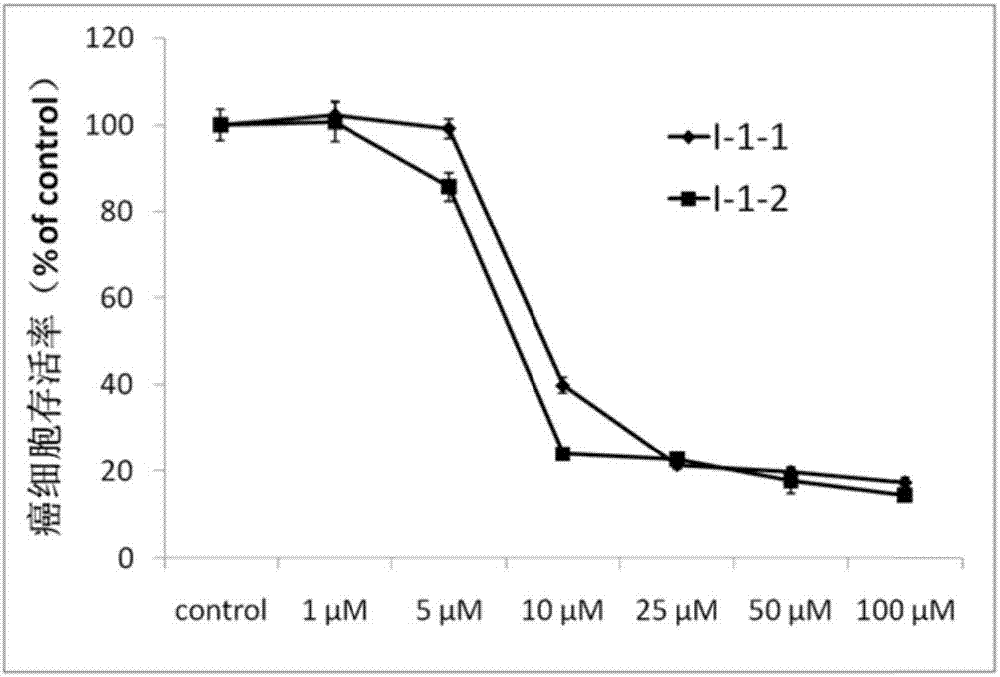
图2为本发明化合物i-1-1和i-1-2随浓度升高对前列腺癌pc-3细胞增殖的抑制能力;
图3为本发明化合物i-1-1和i-1-2随浓度升高对肝癌细胞hepg2增殖的抑制能力;
图4为本发明化合物i-1-1和i-1-2随浓度升高对卵巢癌细胞skov3增殖的抑制能力;
图5为本发明化合物i-1-1和i-1-2随浓度升高对胰腺癌细胞panc-1增殖的抑制能力;
图6为本发明化合物i-1-1和i-1-2随浓度升高对胰腺癌细胞bxpc-3增殖的抑制能力;
图7为本发明化合物i-1-1随浓度升高对宫颈癌hela细胞增殖的抑制能力;
图8为本发明化合物i-3对前列腺癌pc-3细胞,肝癌细胞hepg2,卵巢癌细胞skov3,胰腺癌细胞panc-1和bxpc-3增殖的抑制能力。
具体实施方式
下面将结合附图,对本发明的优选实施例进行详细的描述。
实施例1
制备化合物i-1-1
1)反应中间体vi-1的制备
取2.0g芦丁置于圆底烧瓶中,加入4.8g碳酸铯以及3.4g溴化卞,而后加40ml二甲基甲酰胺搅拌溶解。加热至60-90℃。48小时后,滴加醋酸水溶液,固体析出。过滤后将滤饼溶于盐酸的乙醇溶液中,加热回流约2小时,过滤后分离得到化合物vi-1。
vi-1:1hnmr(400mhz,cdcl3):δ7.88(s,1h),7.76(d,1h,j=4hz),7.32-7.61(m,20h),7.03(d,1h,j=4hz),6.58(s,1h),6.48(s,1h),5.24-5.26(m,6h),5.12(s,2h).
2)化合物i-1-1的制备
取化合物vi-1(按照1.0eq计),加入3.0eq碳酸铯以及3.0eq1,12-二溴十二烷,以二甲基甲酰胺作溶剂,搅拌8小时。柱层析得到化合物i-1-1a。将化合物i-1-1a溶于甲醇,在钯碳/氢气的条件下,搅拌2小时,过滤,旋干溶剂并分离得到化合物i-1-1。
i-1-1:1hnmr(400mhz,dmso-d6):δ7.47(s,2h),7.40(s,2h),6.86(d,2h,j=4hz),6.36(d,2h,j=4hz),6.16(s,2h),3.90(t,4h,j=8hz),1.60(t,4h,j=8hz),1.19-1.28(m,16h);13cnmr(100mhz,dmso-d6):δ178.41,164.65,161.72,156.78,156.36,149.09,145.60,137.14,121.32,121.12,115.94,104.54,98.96,93.97,72.40,46.16,31.59,29.84,29.42,29.20,25.83;esi-ms(m/z):771.41[m+h]+,793.40[m+na]+.
实施例2
制备化合物i-1-2
按照与实施例1类似的方法,只是把反应中的1,12-二溴十二烷变成1,8二溴辛烷,得到化合物i-1-2。
i-1-2:1hnmr(400mhz,dmso-d6):δ7.49(s,2h),7.40(s,2h),6.85(d,2h,j=4hz),6.35(d,2h,j=4hz),6.16(s,2h),3.89(t,4h,j=8hz),1.60(t,4h,j=8hz),1.19-1.28(m,8h);13cnmr(100mhz,dmso-d6):δ178.42,164.60,61.71,156.77,156.37,149.03,145.58,137.17,121.37,121.13,115.97,104.57,98.95,93.97,72.42,36.21,31.20,29.85,25.81;esi-ms(m/z):715.36[m+h]+.
实施例3
制备化合物i-2
取化合物vi-1(按照1.0eq计),加入3.0eq碳酸铯以及3.0eq1,8-二溴辛烷,以二甲基甲酰胺作溶剂,搅拌8小时。柱层析得到化合物viii-1。将化合物viii-1溶于甲醇,在钯碳/氢气的条件下,搅拌2小时,过滤,旋干溶剂后分离得到化合物ix-1。将化合物ix-1溶于乙腈,加入硫代乙酸钾,搅拌5小时后柱层析分离得到化合物x-1。将化合物x-1溶于甲醇中,加入磷酸钾,空气中搅拌5小时后滴加1mol/l盐酸,然后过滤并通过柱层析分离得到化合物i-2。
i-2:1hnmr(400mhz,dmso-d6):δ7.52(s,2h),7.43(d,2h,j=4hz),6.90(d,2h,j=4hz),6.44(s,2h),6.20(s,1h),3.90(s,4h),2.66(d,4h,j=4hz),1.60(s,8h),1.23-1.30(m,16h);13c-nmr(100mhz,dmso-d6):δ178.41,161.62,156.69,156.34,149.03,145.60,137.12,121.33,121.08,116.07,104.50,94.00,72.34,38.30,29.80,29.05,28.95,28.10,25.75;esi-ms(m/z):914.41[m+na]+.
实施例4
制备化合物i-3
取20mg化合物xi-1和碳酸钾40mg,以甲醇做溶剂,在无氧条件下搅拌半小时后,旋干甲醇,加入108mg化合物ix-1的二甲基甲酰胺溶液,无水无氧条件下,继续室温反应5小时。然后旋干溶剂,并加入甲醇和少许稀盐酸,在溶液澄清后除去溶剂,通过柱层析分离得到化合物i-3。
i-3:1h-nmr(400mhz,dmso-d6)δ12.75(s,2h),10.84(s,2h),9.76(s,2h),9.36(s,2h),7.52-7.57(m,3h),7.43(t,2h,j=4hz),7.24(t,2h,j=8hz),6.88(d,2h,j=4hz),6.39(s,2h),6.18(s,2h),5.76(s,1h),3.90(t,4h,j=4hz),2.81(t,4h,j=8hz);1.61-1.64(m,4h),1.48(t,4h,j=8hz),1.23-1.31(m,16h).
实施例5
化合物i-1-1通过自组装形成纳米颗粒。
实施方法:取2mg化合物i-1-1加0.5mlthf溶解,剧烈搅拌下,将上述溶液滴加入蒸馏水中,继续搅拌48小时。再将上述溶液用0.45μm滤膜过滤,稀释后超声5分钟,用动态光散射仪测量该化合物如图1所示,结果显示化合物i-1-1在水溶液自组装形成的颗粒的粒径在80nm左右。
实验例6
本发明化合物i-1-1用于抗癌活性实验
前列腺癌细胞pc-3用含10%fbs的f12k培养基培养,肝癌细胞hepg2和宫颈癌细胞hela用含10%fbs的dmem培养基培养,卵巢癌细胞skov3用含10%fbs的mccoy's5a培养基培养,胰腺癌细胞panc-1和bxpc-3用含10%fbs的rpmi1640培养基培养,然后在96孔观察板上均以10000每孔的密度种植上述细胞。细胞经过24h增殖后,加入不同浓度的待测化合物,以未加任何药物为负对照,槲皮素为以上所有细胞的正对照,同时pc-3选取多西紫杉醇作为正对照,hepg2选取五氟尿嘧啶为正对照,hela和skov3选取顺铂为正对照,bxpc-3和panc-1选取吉西他滨为正对照。在37℃以及5%co2条件下经过48小时培养后,用比色法测定存活的细胞数目(染色剂为3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-h-tetrazoliumbromide,mtt,又称噻唑蓝)。化合物i-1-1及上述正对照药物在同样浓度下(25μm)对各种癌细胞的抑制率如表1所示,化合物i-1-1随浓度升高对前列腺癌pc-3细胞增殖的抑制能力如图2所示;化合物i-1-1随浓度升高对肝癌细胞hepg2增殖的抑制能力如图3所示;化合物i-1-1随浓度升高对卵巢癌细胞skov3增殖的抑制能力如图4所示;化合物i-1-1随浓度升高对胰腺癌细胞panc-1增殖的抑制能力如图5所示;化合物i-1-1随浓度升高对胰腺癌细胞bxpc-3增殖的抑制能力如图6所示;化合物i-1-1随浓度升高对宫颈癌hela细胞增殖的抑制能力如图7所示。
表1化合物i-1-1及各种抗癌临床用药在同样浓度下对不同癌细胞的抑制率。
na:noactivity.
实验例7
本发明化合物i-1-2用于抗癌活性实验
前列腺癌细胞pc-3用含10%fbs的f12k培养基培养,肝癌细胞hepg2用含10%fbs的dmem培养基培养,卵巢癌细胞skov3用含10%fbs的mccoy's5a培养基培养,胰腺癌细胞panc-1和bxpc-3用含10%fbs的rpmi1640培养基培养,然后在96孔观察板上均以10000每孔的密度种植该细胞。细胞经过24h增殖后,加入不同浓度的待测化合物,以未加任何药物为负对照,槲皮素为以上两种细胞的正对照,同时pc-3选取多西紫杉醇作为正对照,hepg2选取五氟尿嘧啶为正对照,skov3选取顺铂为正对照,bxpc-3和panc-1选取吉西他滨为正对照。在37℃以及5%co2条件下经过48小时培养后,用比色法测定存活的细胞数目(染色剂为3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-h-tetrazoliumbromide,mtt,又称噻唑蓝)。化合物i-1-2及上述对照药物在同样浓度下(25μm)对各种癌细胞的抑制率如表2所示,化合物i-1-2随浓度升高对前列腺癌pc-3细胞增殖的抑制能力如图2所示;化合物i-1-2随浓度升高对肝癌细胞hepg2增殖的抑制能力如图3所示;化合物i-1-2随浓度升高对卵巢癌细胞skov3增殖的抑制能力如图4所示;化合物i-1-2随浓度升高对胰腺癌细胞panc-1增殖的抑制能力如图5所示;化合物i-1-2随浓度升高对胰腺癌细胞bxpc-3增殖的抑制能力如图6所示。
表2化合物i-1-2及各种抗癌临床用药在同样浓度下对不同癌细胞的抑制率
na:noactivity.
实验例8
本发明化合物i-3用于抗癌活性实验
前列腺癌细胞pc-3用含10%fbs的f12k培养基培养,肝癌细胞hepg2用含10%fbs的dmem培养基培养,卵巢癌细胞skov3用含10%fbs的mccoy's5a培养基培养,胰腺癌细胞panc-1和bxpc-3用含10%fbs的rpmi1640培养基培养,然后在96孔观察板上均以10000每孔的密度种植该细胞。细胞经过24h增殖后,加入不同浓度的待测化合物,以未加任何药物为负对照,槲皮素为以上细胞的正对照,同时pc-3选取多西紫杉醇作为正对照,hepg2选取五氟尿嘧啶为正对照,skov3选取顺铂为正对照,bxpc-3和panc-1选取吉西他滨为正对照。在37℃以及5%co2条件下经过48小时培养后,用比色法测定存活的细胞数目(染色剂为3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-h-tetrazoliumbromide,mtt,又称噻唑蓝)。化合物i-3及上述对照药物在同样浓度下(50μm)对各种癌细胞的抑制率如表3所示,化合物i-3对前列腺癌pc-3细胞,肝癌细胞hepg2,卵巢癌细胞skov3,胰腺癌细胞panc-1和bxpc-3增殖的抑制能力如图8所示。
表3化合物i-3及各种抗癌临床用药在同样浓度下对不同癌细胞的抑制率
na:noactivity.
实验例9
本发明化合物ix-1用于抗癌活性实验
卵巢癌细胞skov3用含10%fbs的mccoy's5a培养基培养,胰腺癌细胞bxpc-3用含10%fbs的rpmi1640培养基培养,然后在96孔观察板上均以10000每孔的密度种植该细胞。细胞经过24h增殖后,加入不同浓度的待测化合物,以未加任何药物为负对照,槲皮素为以上两种细胞的正对照,同时skov3选取顺铂为正对照,bxpc-3选取吉西他滨为正对照。在37℃以及5%co2条件下经过48小时培养后,用比色法测定存活的细胞数目(染色剂为3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-h-tetrazoliumbromide,mtt,又称噻唑蓝)。化合物ix-1及上述对照药物在同样浓度下(50μm)对两种癌细胞的抑制率如表4所示。
表4化合物ix-1及各种抗癌临床用药在同样浓度下对不同癌细胞的抑制率
综上,从表1-4的结果可以看出,本发明所制备的bola型槲皮素衍生物i-1-1、i-1-2和i-3均具有明显的抗癌细胞增殖的活性,在同样浓度条件下,对肿瘤细胞生长的抑制效果要远优于槲皮素,同时也比部分抗癌临床用药的活性要好,因此是一类极有潜力的抗肿瘤药物先导。而非bola型的槲皮素类脂衍生物ix-1在测试的skov3和bxpc-3细胞上都没有特别显著的抑制活性,进一步说明了bola型结构对提高该类化合物生物活性的重要性。
最后说明的是,以上优选实施例仅用以说明本发明的技术方案而非限制,尽管通过上述优选实施例已经对本发明进行了详细的描述,但本领域技术人员应当理解,可以在形式上和细节上对其作出各种各样的改变,而不偏离本发明权利要求书所限定的范围。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于生产化学品及其衍生物的组合物和方法与制造工艺
- 7‑OH‑8‑[(1‑胺基‑1‑苯基衍生物)‑次甲基]‑黄酮化合物及其制备方法及其应用与制造工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制造方法与工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 一种白杨素氨基酸衍生物的制备方法与制造工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺