一种5位,7位双取代的橙皮素衍生物及其制备和作为抗类风湿关节炎的药物中的应用的制作方法
本发明属于药物化学和药物治疗学领域,公开了一种5位和7位双取代的橙皮素衍生物的合成及其作为治疗类风湿关节炎的药物中的应用。
背景技术:
类风湿性关节炎(rheumatoidarthritis,ra)是一种以滑膜异常增生,骨和软骨进行性破坏为特征的慢性、系统性和破坏性的自身免疫性疾病,常引起关节骨质损坏和功能障碍。我国ra患病率约为0.4%,是造成我国人群丧失劳动力与致残的主要原因之一。目前临床用于ra治疗的药物有非甾体抗炎药、甾体激素类、疾病修调药和生物制剂等,但因抗炎镇痛效果不佳或毒副作用太大而限制其使用,目前缺乏真正有效而毒副作用小的治疗药物。
野菊花(chrysanthemumindicuml.)系一种常用的清热解毒中药,本课题组在跟踪研究野菊花黄酮类抗炎免疫作用活性成分的过程中,发现橙皮苷(又名橙皮素)是野菊花抗炎免疫作用的活性成分之一。橙皮苷来源广泛,主要分布在柑橘类植物中。橙皮苷具有抗炎、抗氧化、抗菌、抗癌、免疫调节、防辐射、保护心血管系统等药理活性,国内外研究者对橙皮苷的研究兴趣日益增加。对人和动物实验表明,橙皮苷不会在任何器官中积累,安全、有效、无明显副作用。本实验室的前期研究发现橙皮苷灌胃给药能可提高免疫低下小鼠的脏器指数、碳廓清指数和吞噬指数,改善免疫抑制小鼠低下的脾淋巴细胞增殖反应,恢复小鼠迟发型变态反应能力并能提高cd4+、cd8+细胞数;表明橙皮苷对小鼠的非特异性免疫和特异性细胞免疫反应有促进作用。此外,我们在前期研究中证实橙皮苷灌胃给药能抑制佐剂性关节炎(adjuvantarthritis,aa)大鼠的继发性炎症,与guardia和kawaguchi等的报道一致,该作用与其调节aa大鼠异常的免疫功能和恢复细胞因子的网络平衡密切相关。
文献报道,黄酮等多酚类化合物都具有生物利用度较低和半衰期短的缺点,本课题组在前期药物代谢动力学研究中发现,橙皮素主要通过7位羟基与体内葡萄糖醛酸等形成葡萄糖醛酸酯或硫酸酯复合物进行代谢,导致其半衰期多(<1h)。另外通过1hnmr实验发现橙皮素4位羰基和5位酚羟基形成稳定的分子内氢键,是否影响其与受体结合,影响生物活性,通常橙皮素的上述生物活性只有在大剂量(≥100mg/kg体重/天)才起显效。利用橙皮素直接作为治疗药物比较困难,有必要对橙皮素结构进行结构修饰,寻找生物利用度高、半衰期长、活性更高的橙皮素衍生物。
技术实现要素:
为实现上述目的,本发明合成了一系列5位,7位双取代的橙皮素衍生物,通过抗类风湿关节炎活性筛选,发现本发明的式i化合物具有很强的抗类风湿关节炎的活性。
本发明的一个目的在于提供5位和7位双取代橙皮素类衍生物及其制备方法。
本发明另一个目的在于考察该橙皮素衍生物的化合物毒性和抗类风湿关节炎的作用机制研究。
本发明是通过以下技术方案实现的:
一种5位,7位对氯苯乙胺双取代的橙皮素衍生物,其结构式为:
所述的5位,7位对氯苯乙胺双取代的橙皮素衍生物的制备方法,包括以下步骤:
(1)将橙皮素与2倍量的溴乙酸乙酯在弱碱作用下室温搅拌后得到7-oh取代产物;
(2)将步骤(1)所得产物与5-6倍量对氯苯乙胺,在加热条件下,进行胺解和缩合反应,得到终产物是5位和7位对氯苯乙胺双取代的橙皮素衍生物(式i)。所述的5位和7位双取代橙皮素类衍生物物的制备方法,其特征在于:步骤(1)中弱碱为k2co3,室温搅拌,搅拌时间为20min,反应溶剂为dmf,步骤(2)中溶剂为乙醇;胺解反应和缩合反应温度为77-79℃。
所述的5位,7位双取代的橙皮素衍生物或其药学上可以接受的盐的应用,其特征在于作为制备抗类风湿关节炎的药物中的应用。
所述的药物为注射剂、片剂、丸剂、胶囊剂、悬浮剂或乳剂。
本发明所述的该酰胺基取代的橙皮素类衍生物的制备方法,主要合成路线为:
本发明的有益效果:通过体外抗类风湿性关节炎活性筛选,发现5位和7位对氯苯乙胺双取代的橙皮素衍生物具有较强的抗类风湿关节炎的活性,降低炎症因子tnf-α和il-1β的水平,显著降低il-6的水平。本发明用成纤维样滑膜细胞考察该化合物毒性,通过mtt实验计算出其ic50值为161μmol·l-1;而抗炎活性在药物浓度药物浓度为10μmol·l-1时,就能显著降低il-6含量。药理作用机制研究表明,5位和7位对氯苯乙胺双取代的橙皮素衍生物通过抑制ptch1基因启动子的甲基化,使ptch1蛋白表达上调,gli1和shh蛋白表达降低,并且炎症因子il-6的分泌降低。表明5位和7位对氯苯乙胺双取代的橙皮素衍生物能够发展成为治疗类风湿性关节炎的药物。
附图说明
图1为正常组、模型组及不同的药物浓度组(400μmol·l-1,200μmol·l-1,100μmol·l-1,50μmol·l-1,25μmol·l-1,12.5μmol·l-1)fls的增殖速率示意图,其中,1-8依次为正常组、模型组及不同的药物浓度组(400μmol·l-1,200μmol·l-1,100μmol·l-1,50μmol·l-1,25μmol·l-1,12.5μmol·l-1),由图可以看出模型组的fls的增殖速率大于正常组。根据抑制率计算出ic50值为161μmol·l-1。
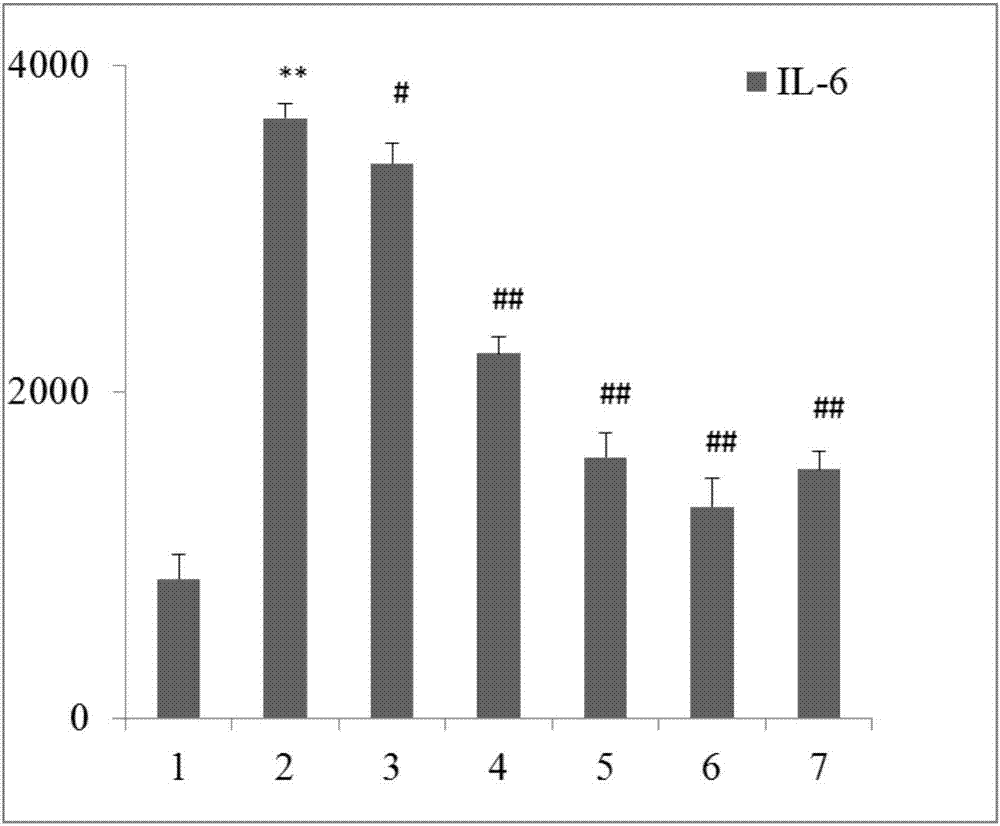
图21~7依次为正常组、模型组、五个浓度给药组(80μmol·l-1,40μmol·l-1,20μmol·l-1,10μmol·l-1,5μmol·l-1)的fls细胞上清中il-6值。由图2可以看出模型组中的il-6分泌水平明显高于正常组(p<0.01),且具有统计学差异。给药组的il-6要低于模型组(p<0.05,p<0.01),当药物浓度为10μmol·l-1时,含量最低,为最佳药物作用浓度。
图3为根据图2elisa筛选的结果,在模型组fls上加药刺激,刺激浓度为10μmol·l-1。如图3所示,与正常组fls相比,模型组fls中ptch1的表达下降(p<0.01),mecp2,gli1和shh蛋白表达升高(p<0.01),并具有统计学差异。加入药物以10μmol·l-1浓度刺激48h后,相比较模型组fls,加药组中ptch1蛋白表达升高(p<0.01),mecp2,gli1和shh蛋白表达下降(p<0.01),具有统计学意义。
图4为以10μmol·l-1的浓度,在模型组fls上加药刺激,分正常组,模型组,模型加药组。刺激48h后,提取fls的基因组dna,用焦磷酸测序进行检测,结果如图4。每组均检测了4个位点,正常组ptch1基因启动子4个位点pos.1,pos.2,pos.3,pos.4甲基化程度分别为0%,9%,41%,0%;模型组ptch1基因启动子4个位点pos.1,pos.2,pos.3,pos.4甲基化程度分别为63%,67%,62%,63%;模型加药组ptch1基因启动子4个位点pos.1,pos.2,pos.3,pos.4甲基化程度分别为28%,32%,48%,26%。根据文献指出[12],50%以上定义为高甲基化,20%~50%定义为低甲基化,20%以下定义为无甲基化。正常组pos.1,pos.2,pos.4位点的甲基化程度分别为0%,9%,0%,视为无甲基化;模型组pos.1,pos.2,pos.3,pos.4位点均高于50%,视为高甲基化;模型加药组pos.1,pos.2,pos.3,pos.4位点均在20%~50%,视为低甲基化。说明模型组fls甲基化程度高于正常组(p<0.05),经药刺激后,模型组甲基化程度降低(p<0.05)。
图5为在模型fls中转染gv230-mecp2过表达质粒,对照模型fls组转染gv230空载体,转染组均加入药物,药物的终浓度为10μmol·l-1。分组如图5,结果显示成功转染gv230-mecp2,mecp2表达上升,且与模型组mecp2表达无差异,但与模型加药组相比具有统计学差异(p<0.01),说明过表达成功。成功过表达mecp2后,相比较模型加药组,ptch1蛋白表达下降(p<0.01),gli1和shh蛋白表达增加(p<0.01),并且炎症因子il-6,il-1β,tnf-α的分泌也增加(p<0.01),并具有统计学差异。
具体的实施方式:
下面结合具体实施例进一步详细说明本发明。除非特别说明,本发明采用的试剂、设备和方法为本技术领域常规市购的试剂、设备和常规使用的方法。
实施例一:5位,7位对氯苯乙胺双取代的橙皮素衍生物的合成
其具体步骤为:
(1)将橙皮素
(2)将上述橙皮素衍生物溶于乙醇中,加入6倍量的对氯苯乙胺,在78℃加热反应6h后,终止反应,冷却,有黄色固体析出,抽滤,固体用乙醇和乙酸乙酯重结晶,得到淡黄色固体,产率66%。即为终产物5,7位对氯苯乙胺双取代橙皮素类衍生物z-1。1hnmr(400mhz,dmso)δ15.61(s,1h,5-oh),9.05(s,1h,3’-oh),8.06(t,j=5.7hz,nh,1h),7.31(ddt,j=7.5,4.1,2.1hz,6h,ar-h),7.20(d,j=8.4hz,2h,ar-h),6.91(dd,j=13.1,5.2hz,2h,ar-h),6.82(dd,j=8.3,2.0hz,1h,ar-h),5.76(d,j=2.4hz,1h,8-h),5.72(d,j=2.4hz,1h,6-h),4.98(dd,j=11.8,3.0hz,1h,2-h),4.38(s,2h,c=och2o),3.78(s,3h,och3),3.71(m,2h,=nch2),3.36–3.31(m,2h,ch2nc=o),3.04(dd,j=17.1,3.1hz,1h,3-h),2.96–2.90(m,2h,ch2-ar),2.88(dd,j=17.0,11.7hz,1h,3-h),2.72(t,j=7.1hz,2h,ch2-ar).13cnmr(101mhz,dmso)δ170.58,167.22,167.14,163.25,159.27,147.79,146.48,138.31,138.12,131.67,130.99,130.77,130.77,130.71,130.52,130.52,128.24,128.24,128.17,128.17,117.51,113.99,111.93,100.17,96.52,91.23,76.13,66.57,55.69,46.60,39.73,34.87,34.25,32.02.tof-hrmsm/z:657.1529[m+na]+.
化合物z-1的化学式如下:
实施例二:
方法同实施例一,所不同的是用对甲氧基苯乙胺代替对氯苯乙胺,得白色固体z-2。1hnmr(400mhz,dmso)δ15.68(s,1h,5-oh),9.04(s,1h,3’-oh),8.03(t,j=5.8hz,1h,nh),7.19–7.15(m,2h,ar-h),7.12–7.08(m,2h,ar-h),6.92(d,j=8.4hz,1h,4’-h),6.88–6.77(m,6h,ar-h,2’-h,5’-h),5.75(d,j=2.4hz,1h,8-h),5.70(d,j=2.4hz,1h,6-h),4.93(dd,j=11.8,3.0hz,1h,2-h),4.38(s,2h,c=och2o),3.77(s,3h,och3),3.72(s,3h,och3),3.70(s,3h,och3),3.69–3.63(m,2h,=nch2),3.30–3.25(m,2h,ch2nc=o),2.96(dd,j=17.1,3.2hz,1h,3-h),2.90–2.76(m,3h,ch2-ar,3-h),2.66(t,j=7.3hz,2h,ch2-ar).tof-hrmsm/z:649.2519[m+na]+.
化合物z-2的化学式如下:
实施例三:化合物毒性考察
考察5位,7位对氯苯乙胺双取代的橙皮素衍生物(代号z-1,下同)对大鼠原代成纤维样滑膜细胞的毒性,用mtt法检测,结果用ic50值表示。所有的测试均在powerwavexs2型全波长酶标仪上进行,在37℃的条件下测定。数据分析利用软件origin进行处理。
实验步骤:
1)模型制备以及原代细胞提取:
将实验动物随机分为正常组,模型组,每组15只。适应性喂养1周后,每只大鼠左后足趾皮内注射0.2mlfca,制备aa大鼠,即模型组大鼠。左后足趾皮内注射等量的pbs,作为正常对照组大鼠。
造模24天后将大鼠处死,在新洁尔灭溶液中浸泡约15min,沿膝关节正中纵行切开并分离肌肉,关节囊的滑膜层和纤维层,取出滑膜组织,每只大鼠可采集约15~20mg。将取出的滑膜组织用hank’s液反复洗3次,洗至白色再在dmem中清洗2~3次。剪成1mm3的小块,剪的过程中保持组织块的湿润。将细胞培养瓶底板浸润dmem培养基,用吸管分别将剪成小块的组织均匀地平铺在底板上。培养瓶倒置于37℃,5%co2培养箱中培养h6~8后,正置继续培养,3天后可观察到个别组织周围出现稀少的滑膜细胞,此时换液。6天后个别组织周围细胞生长紧密,即可除去组织。9天后传代,为第一代fls细胞,消化细胞并进行培养,实验所用fls为3代~5代。
2)mtt法检测的ic50值:
实验分组:正常组(与模型组做对照);模型组(与各处理组作对照);z-1处理组(400μmol·l-1,200μmol·l-1,100μmol·l-1,50μmol·l-1,25μmol·l-1,12.5μmol·l-1)。
将对数生长期的fls消化成细胞悬液,以2×104个/孔的密度接种于96孔板中,37℃过夜。细胞贴壁后各浓度组加入hdnd-14刺激,作用48小时后将孔内液体换成无血清的培养基,加入mtt(5mg/ml),每孔20μl,37℃作用4小时。然后将孔内液体吸净,每孔加入150μldmso,室温震荡后,将96板放在酶标仪上检测吸光度(a),波长为490nm。
采用spss16.0软件进行统计分析,数据以均数±标准差
3)实验结果见图1所示:
图1中1~8依次为正常组、模型组、不同的药物浓度组(400μmol·l-1,200μmol·l-1,100μmol·l-1,50μmol·l-1,25μmol·l-1,12.5μmol·l-1)fls的增殖速率适宜图,fls的增殖速率模型组大于正常组。根据抑制率计算出ic50值为161μmol·l-1。
实施例四5位,7位对氯苯乙胺双取代的橙皮素衍生物抗类风湿性关节炎作用机制研究
1)elisa分析il-6水平
将对数生长期fls消化成细胞悬液并接种于24孔板内,每孔1×106个,待细胞长满至80%,分别加入不同浓度的z-1进行刺激,每组三个复孔。实验分组为正常组,模型组,加药组(80μmol·l-1,40μmol·l-1,20μmol·l-1,10μmol·l-1,5μmol·l-1)。药物作用24小时后,吸取细胞培养基上清,3000rpm/min离心1min,收集上清液,elisa法检测炎症细胞因子il-6的含量。
2)westernblot检测mecp2,ptch1,gli1和shh
将对数生长期fls接种于六孔板中,待24小时贴壁后,每孔内加入2mldmem,并在模型组上加药刺激,分正常组,模型组,加药组(10μmol·l-1)。作用48小时后,每孔加250μlripa裂解液(每ml裂解液中加10μlpmsf),冰上裂解30min,将裂解的混合物移到ep管中。12000rpm/min,4℃,离心30min,离心结束后移取上清至新的ep管中,加入蛋白上样缓冲液,100℃恒温10min使蛋白变性。将提取的蛋白样品每孔上样15μl,进行电泳分离,并转膜到pvdf膜上。在体积分数为0.05的脱脂奶粉下封闭2小时,tbst漂洗3次后,于4℃中孵一抗过夜。一抗稀释的比例为:ptch1(1:200),mecp2(1:1000),gli1(1:200),shh(1:1000),β-actin(1:1000)。在tbst漂洗3次后,加入和一抗匹配的二抗(1:10000),孵育1小时,再在tbst中漂洗3次,用ecl发光试剂盒进行显影。3)焦磷酸测序分析
使用axygendna提取试剂盒提取出基因组dna,并用亚硫酸盐对dna进行修饰。ptch1引物序列上游引物:5′-agttgggagttttttagatgatagg-3′,下游引物:5′-ccaaaaaaccccaccttaatctctttca-3′,ptch1测序引物:5′-ggagttttttagatgataggttta-3′,扩增后,使用qiagen焦磷酸测序仪测序。
4)过表达质粒gv230-mecp2的转染
使用脂质(lipofectamine2000)转染过表达质粒gv230-mecp2入fls,对照组转染空载体gv230。转染前一天,将fls接种于六孔板中,加入dmem培养基,在37℃,5%co2中培养。待长满至60%~80%,即可用于实验。取5μl质粒与200μlopti-mem轻柔混合,温室孵育5min,同时另取5μl脂质体同样与200μlopti-mem轻柔混合并孵育5min。将上述两种混合液轻柔混合,并在室温孵育25min,形成复合体。取出六孔板,弃去原培养基并用pbs清洗三次,每孔加入1.6mlopti-mem,将上述孵育好的复合体,轻揉的加入相应的孔中并混合均匀,置于37℃,5%co2中培养6小时后,换成含20%fbs的dmem培养基继续培养。对照组操作方法同上。
5)实验结果见图2,
图2为不同组中的fls细胞上清中il-6值,其中1~7依次为正常组、模型组、五个浓度给药组(80μmol·l-1,40μmol·l-1,20μmol·l-1,10μmol·l-1,5μmol·l-1)的fls细胞上清中il-6值。模型组中的il-6分泌水平明显高于正常组(p<0.01),且具有统计学差异。给药组的il-6要低于模型组(p<0.05,p<0.01),当药物浓度为10μmol·l-1时,含量最低,为最佳药物作用浓度。
图3与正常组fls相比,模型组fls中ptch1的表达下降(p<0.01),mecp2,gli1和shh蛋白表达升高(p<0.01),并具有统计学差异。加入hdnd-14以10μmol·l-1浓度刺激48小时后,相比较模型组fls,加药组中ptch1蛋白表达升高(p<0.01),mecp2,gli1和shh蛋白表达下降(p<0.01),具有统计学意义。
图4正常组pos.1,pos.2,pos.4位点的甲基化程度分别为0%,9%,0%,视为无甲基化;模型组pos.1,pos.2,pos.3,pos.4位点均高于50%,视为高甲基化;加药组pos.1,pos.2,pos.3,pos.4位点均在20%~50%,视为低甲基化。模型组fls甲基化程度高于正常组(p<0.05),经z-1(10μmol·l-1)作用48h后,甲基化程度降低(p<0.05)。
图5加药后转染gv230-mecp2,mecp2表达上升,且与模型组mecp2表达无差异,但与加药组相比具有统计学差异(p<0.01),说明过表达成功。成功过表达mecp2后,相比较加药组,ptch1蛋白表达下降(p<0.01),gli1和shh蛋白表达增加(p<0.01),并且炎症因子il-6的分泌也增加(p<0.01)。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于生产化学品及其衍生物的组合物和方法与制造工艺
- 7‑OH‑8‑[(1‑胺基‑1‑苯基衍生物)‑次甲基]‑黄酮化合物及其制备方法及其应用与制造工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制造方法与工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 一种白杨素氨基酸衍生物的制备方法与制造工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 吡唑衍生物及其作为大麻素受体介体的用途的制造方法与工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 水生态处理中淤泥及衍生物的再利用处理系统的制造方法与工艺
- Schiglautone A衍生物的组合物用于制备抗缺氧药物的制作方法
- Schiglautone A衍生物的组合物用于制备抗红细胞低下性贫血药物的制作方法
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺
- 水生态处理中淤泥及衍生物的再利用处理系统的制造方法与工艺
- 一种新型罗汉果醇衍生物单体的制作方法
- Schiglautone A衍生物的组合物用于制备抗鼻炎药物的制作方法
- Schiglautone A衍生物的组合物用于制备防治肾纤维化药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗心衰药物的制作方法
- Artalbic acid衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Schiglautone A 衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备抗慢性阻塞性肺病药物的制作方法
- Artalbic acid的衍生物的组合物用于制备防治胰腺纤维化药物的制作方法