iPS细胞分化成外胚层祖细胞的无血清诱导培养基及诱导方法与流程
本发明涉及组织工程领域,尤其是涉及一种iPS细胞分化成外胚层祖细胞的无血清诱导培养基及诱导方法。
背景技术:
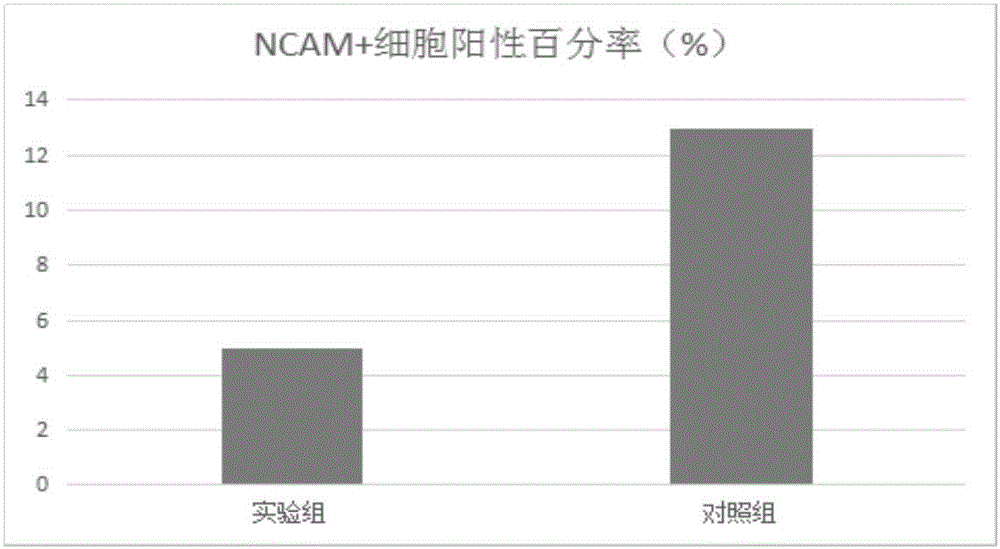
:皮肤组织工程是近几年的研究热点,但是皮肤的相关细胞都属于终末分化细胞,很难在体外进行大规模的培养扩增。种子细胞来源问题阻碍了组织工程的发展,自体的种子细胞来源有限,异体的种子细胞存在排斥反应,胚胎干细胞又存在伦理问题。因此从尿液中收集尿液细胞,将尿液细胞诱导成为iPS细胞(诱导性多能干细胞),iPS细胞再诱导成为角质形成细胞、成纤维细胞、汗腺细胞、毛乳头细胞等即可解决皮肤组织工程的种子来源问题。从尿液中获得细胞,方便快捷,不用通过创伤获取,来源广泛。目前iPS细胞诱导分化为皮肤的各个细胞诱导方案主要有单纯细胞因子诱导、共培养诱导、拟胚体诱导等。然而单纯细胞因子诱导效率低,共培养诱导存在免疫原性,拟胚体存在不定向诱导特点,最终形成三个胚层,不能高效获某一个胚层。技术实现要素:基于此,有必要提供一种iPS细胞分化成外胚层祖细胞的无血清诱导培养基及诱导方法。一种iPS细胞分化为外胚层祖细胞的无血清诱导培养基,所述无血清诱导培养基是通过在每500mlDMEM/F12基础培养基中添加终浓度为5-10μM的吲哚美辛、体积百分比1%的谷氨酰胺、体积百分比1%的非必需氨基酸、5-20μM的SB431542、5-18ng/ml的EGF、0.05-0.2mmol/mlβ巯基乙醇、0.1-1μg/ml的氢化可的松、20-100μg/ml的胰岛素、50-150μg/ml的转铁蛋白、4-15ng/ml的亚硒酸钠、0.05-0.1mg/ml的青霉素以及0.05-0.1mg/ml的链霉素制备得到。在其中一个实施例中,所述无血清诱导培养基是通过在每500mlDMEM/F12基础培养基中添加终浓度为8-10μM的吲哚美辛、体积百分比1%的谷氨酰胺、体积百分比1%的非必需氨基酸、8-12μM的SB431542、10-15ng/ml的EGF、0.08-0.12mmol/mlβ巯基乙醇、0.1-0.5μg/ml的氢化可的松、50-80μg/ml的胰岛素、80-120μg/ml的转铁蛋白、8-12ng/ml的亚硒酸钠、0.08-0.1mg/ml的青霉素以及0.08-0.1mg/ml的链霉素制备得到。在其中一个实施例中,所述无血清诱导培养基是通过在每500mlDMEM/F12基础培养基中添加终浓度为8μM的吲哚美辛、体积百分比1%的谷氨酰胺、体积百分比1%的非必需氨基酸、10μM的SB431542、12ng/ml的EGF、0.1mmol/mlβ巯基乙醇、0.4μg/ml的氢化可的松、60μg/ml的胰岛素、100μg/ml的转铁蛋白、10ng/ml的亚硒酸钠、0.1mg/ml的青霉素以及0.1mg/ml的链霉素制备得到。一种iPS细胞分化为外胚层祖细胞的诱导方法,使用上述无血清诱导培养基对iPS细胞进行诱导分化培养。在其中一个实施例中,所述诱导分化培养的时间为7-10天。在其中一个实施例中,所述iPS细胞分化成外胚层祖细胞的诱导方法还包括在诱导分化之前,将iPS细胞通过培养板和离心的方法形成单细胞团拟胚体的步骤。在其中一个实施例中,所述将iPS细胞通过培养板和离心的方法形成单细胞团拟胚体的步骤是按照每个培养板孔加入0.5-1×106个iPS细胞,添加EB形成培养基,再以400-700r/min低速离心5分钟后,放入5%CO2、37℃环境中培养30-50小时,形成所述单细胞团拟胚体。在其中一个实施例中,所述培养板为AggreWellTM800培养板。在其中一个实施例中,所述iPS细胞分化成外胚层祖细胞的诱导方法还包括如下iPS细胞复苏及单细胞形成的步骤:将P30的iPS细胞进行复苏,用mTeSR1无基质细胞培养,在70-80%汇合度时,用Accutase消化液消化为单细胞,再将所述单细胞按照每个培养板孔0.5-1×106个iPS细胞加入所述培养板孔中以形成所述单细胞团拟胚体。通过使用上述特定成分和浓度的iPS细胞分化成外胚层祖细胞的无血清诱导培养基及诱导方法,该无血清诱导培养基中各成分协同配合可以将iPS细胞定向诱导分化为外胚层祖细胞,从而为iPS诱导分化为成体的各个细胞,尤其是皮肤相关细胞提供了技术支持。同时该无血清诱导培养基及诱导方法均没有用到血清,从而有效地避免了动物源性病原体带来的风险,提高了临床应用的安全性。并且较之传统的含胎牛血清的拟胚体培养基等,显著提高了iPS细胞向外胚层祖细胞的诱导分化效率,可靠性高,适用范围广。并且通过进一步优化该无血清诱导培养的各成分浓度,可以取得更为显著的诱导iPS细胞向外胚层祖细胞分化的效率和效果。附图说明图1为实验组与对照组的外胚层祖细胞的基因表达水平比较结果,对于每个基因,图中左侧的为实验组,右侧的为对照组;图2为实验组与对照组的外胚层祖细胞表面NCAM蛋白的表达率比较结果。具体实施方式为了便于理解本发明,下面将参照相关附图对本发明进行更全面的描述。附图中给出了本发明的较佳实施例。但是,本发明可以以许多不同的形式来实现,并不限于本文所描述的实施例。相反地,提供这些实施例的目的是使对本发明的公开内容的理解更加透彻全面。除非另有定义,本文所使用的所有的技术和科学术语与属于本发明的
技术领域:
的技术人员通常理解的含义相同。本文中在本发明的说明书中所使用的术语只是为了描述具体的实施例的目的,不是旨在于限制本发明。本文所使用的术语“和/或”包括一个或多个相关的所列项目的任意的和所有的组合。本实施例提供了一种高效诱导多能性干细胞分化为外胚层祖细胞的无血清诱导培养基及诱导方法。先将iPS细胞通过AggreWellTM800培养板和离心的方法形成单细胞团拟胚体,实验组用无血清诱导培养基培养单细胞团拟胚体,对照组是继续用拟胚体培养基进行培养。然后通过荧光实时定量PCR和流式细胞仪对两组的细胞进行检测,比较实验组和对照组的外胚层基因和蛋白的表达水平。具体过程如下。一、无血清诱导培养基成分及其含量1.实验组用的无血清诱导培养基名称工作浓度DMEM/F12500ml吲哚美辛8uM谷氨酰胺1%非必需氨基酸1%SB43154210μMEGF12ng/mlβ巯基乙醇0.1mmol/l氢化可的松0.4μg/ml胰岛素60μg/ml转铁蛋白100μg/ml亚硒酸钠10ng/ml青霉素0.1mg/ml链霉素0.1mg/ml2.对照组用的诱导培养基名称工作浓度EB培养基500ml可理解,在其他实施例中,实验组的无血清诱导培养基的成分不限于上表中所述,所述无血清诱导培养基只要满足是通过在每500mlDMEM/F12基础培养基中添加终浓度为5-10μM的吲哚美辛、体积百分比1%的谷氨酰胺、体积百分比1%的非必需氨基酸、5-20μM的SB431542、5-18ng/ml的EGF、0.05-0.2mmol/mlβ巯基乙醇、0.1-1μg/ml的氢化可的松、20-100μg/ml的胰岛素、50-150μg/ml的转铁蛋白、4-15ng/ml的亚硒酸钠、0.05-0.1mg/ml的青霉素以及0.05-0.1mg/ml的链霉素制备得到的即可,或者进一步只要满足是通过在每500mlDMEM/F12基础培养基中添加终浓度为8-10μM的吲哚美辛、体积百分比1%的谷氨酰胺、体积百分比1%的非必需氨基酸、8-12μM的SB431542、10-15ng/ml的EGF、0.08-0.12mmol/mlβ巯基乙醇、0.1-0.5μg/ml的氢化可的松、50-80μg/ml的胰岛素、80-120μg/ml的转铁蛋白、8-12ng/ml的亚硒酸钠、0.08-0.1mg/ml的青霉素以及0.08-0.1mg/ml的链霉素制备得到的即可。二、步骤(1)实验组培养基的配制按500ml基础培养基DMEM/F12加入胰岛素30mg、氢化可的松0.2mg、转铁蛋白50mg、亚硒酸钠5μg、β巯基乙醇0.05mmol、EGF6μg、SB43154210μM(小分子抑制剂)、吲哚美辛8uM、非必需氨基酸5ml(购买自:北京百奥莱博科技有限公司,产品编号:BL1266)、谷氨酰胺5ml、青霉素50mg以及链霉素50mg。(2)对照组培养基EB培养基(主要成分:拟胚体(EB)形成基础培养基、拟胚体(EB)形成专用胎牛血清、谷氨酰胺、双抗、非必需氨基酸、2-巯基乙醇,厂家:赛业生物科技有限公司,产品编号:MUXES-90051)。(3)复苏细胞:选择P30的iPS细胞(来源中国科学院广州生物医药与健康研究院)进行复苏,用mTeSR1无基质细胞培养,80%汇合度时,用Accutase消化液消化为单细胞,计数。(4)单细胞团拟胚体的形成:按每个AggreWellTM800培养板孔中加入1×106个细胞,加入EB形成培养基,按产品使用操作手册,将AggreWellTM800培养板以700r/min低速离心5min后,放入5%CO2、37℃培养箱中培养,培养48h后形成单细胞团拟胚体。(5)诱导分化:将形成单细胞团拟胚体的转移至低吸附24孔板中,24孔板分为两组,实验组和对照组,每组12孔,隔天换液,培养到7天后,对外胚层祖细胞的基因表达水平和表面蛋白表达水平进行检测。(6)外胚层祖细胞的鉴定:将细胞用含0.25%胰蛋白酶和0.02%EDTANa2的消化液处理1-3分钟,使细胞脱离培养基质并成为单细胞,加入含10%胎牛血清的培养基进行中和消化,1200rpm离心5分钟,用冷PBS缓冲液润洗细胞,将细胞沉淀收集于1.5mlEP管中,使用细胞总RNA提取试剂盒(RneasyMiniKit,QIAGEN74104),按其使用说明裂解细胞并提取细胞内总RNA,利用紫外分光光度计测定RNA浓度和纯度后,使用反转录试剂盒(ReverTraAceqPCRRTMasterMix,TOYOBOFSQ-201)将1μg总RNA反转录为cDNA。将cDNA、引物同qPCR反应预混试剂(THUNDERBIRDSYBRqPCRMix,TOYOBOQPS-201)混合,通过Bio-Rad公司的opticon2荧光实时定量PCR仪对目的基因进行扩增,以人GAPDH基因表达量为参照。每个样本反应独立重复三次以消除系统误差。用上述方法对诱导细胞基因mRNA表达水平进行鉴定,鉴定外胚层祖细胞分化基因GBX2、HoxA1、SOX1及ZIC1的表达情况,结果如图1所示。(7)流式细胞术对细胞表面标志蛋白检测鉴定:利用流式细胞术对细胞表面标志蛋白检测鉴定,具体操作如下:取1×106个细胞用含0.25%胰蛋白酶和0.02%EDTANa2的消化液处理1-3分钟,使细胞脱离培养基质并成为单细胞,加入含10%胎牛血清的培养基进行中和消化作用,1200rpm离心5分钟,用冷PBS缓冲液润洗细胞,再次离心后将细胞重悬于100μlPBS缓冲液中,加入携带荧光标记的NCAM抗体(荧光成分:FITC,厂家:碧云天生物科技有限公司,产品编号:A0562)并混匀,4℃避光孵育45分钟。抗体孵育后将细胞用冷PBS缓冲液润洗两遍以除去未结合抗体,而后将细胞重悬入400μlPBS缓冲液中,利用流式细胞分析仪对细胞表面NCAM蛋白的表达率进行检测。结果如图2所示。三、结果结果表明,外胚层祖细胞分化基因GBX2、HoxA1、SOX1及ZIC1的高表达率说明了iPS细胞的定向分化,利用实验组的细胞向外胚层祖细胞分化的效率显著高于对照组,说明利用本实施例的方法可以高效诱导多能性干细胞分化为外胚层祖细胞。同时整个过程没有用到血清,有效的避免了动物源性病原体带来的风险,提高了临床应用的安全性。以上所述实施例的各技术特征可以进行任意的组合,为使描述简洁,未对上述实施例中的各个技术特征所有可能的组合都进行描述,然而,只要这些技术特征的组合不存在矛盾,都应当认为是本说明书记载的范围。以上所述实施例仅表达了本发明的几种实施方式,其描述较为具体和详细,但并不能因此而理解为对发明专利范围的限制。应当指出的是,对于本领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干变形和改进,这些都属于本发明的保护范围。因此,本发明专利的保护范围应以所附权利要求为准。当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1