自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法及试剂盒与流程
本发明属于细胞
技术领域:
,尤其涉及一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法及试剂盒。
背景技术:
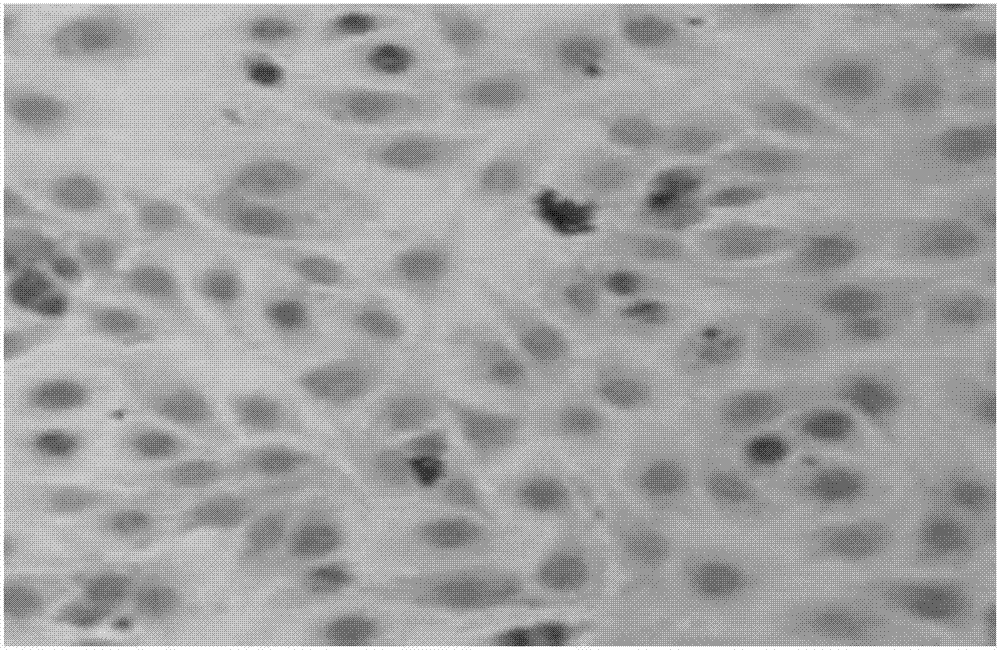
:人体的粘膜是指口腔、鼻腔、肠管、阴道、肠道等与外界相通的体腔内衬,是人体吸收、消化和交换营养物质的重要场所,具有防御、消化、免疫、神经内分泌等功能,构成机体抵抗创伤和病原体入侵的第一道免疫屏障,一旦受损就会引起相应的功能障碍,严重的甚至会导致死亡。鼻粘膜是呼吸道粘膜的第一道防线,是空气调节和粘液纤毛清除、滤过作用的基础。手术或其他损伤导致的鼻粘膜渐进性的功能衰退所导致的空鼻综合症(emptynosesyndrome,ens),就是由于鼻粘膜功能障碍,吸入鼻腔的气体未经过加温,加湿等作用,直接进入肺部,使得气流不能进行正常的气体交换,肺泡通气及换气减少,不能维持正常肺容积,胸内负压降低,体循环和肺循环的动脉氧合的发生减少从而直接影响肺功能,造成呼吸困难、甚至窒息以及精神异常等复杂症状,影响正常的工作与生活。因此,对空鼻综合症患者的鼻粘膜进行修复十分重要。现有治疗技术中一般采用一些鼻腔用凝胶或喷雾对受损的鼻粘膜处进行治疗和修复,虽然可以在一定程度上缓解鼻粘膜受损的状况,但效果有限,并不能很好地治疗鼻粘膜受损的状况,恢复鼻粘膜的相关功能,缓解空鼻综合症患者的症状。如果能采用鼻粘膜样上皮细胞对患者鼻黏膜处进行修复,将能最大程度的修复患者鼻粘膜受损处以及恢复鼻粘膜的相关功能。现有技术中也有一些对鼻粘膜干细胞进行分离培养技术,如cn201410228728.x公开了一种人类嗅粘膜间充质干细胞的分离培养方法,可以分离人类嗅粘膜间充质干细胞并进行培养,但该方法采用嗅粘膜间充质干细胞为原代细胞,存在嗅粘膜间充质干细胞来源少、采集时会对鼻粘膜产生损伤等问题,存在实际应用上的诸多困难。技术实现要素:为了解决上述技术问题,本发明提供一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,所述方法包括:将自体来源的间充质干细胞加入细胞诱导液中诱导分化得到鼻粘膜样上皮细胞,所述细胞诱导液主要是将dmem干粉培养基、胎牛血清、egf、fgf、氢化可的松溶液、谷氨酰胺、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述dmem干粉培养基40-60g、所述胎牛血清4-6g、所述egf6-10μg、所述fgf10-20μg、所述氢化可的松溶液5-10ml、所述谷氨酰胺0.15-0.3g、所述青霉素1-2×105u、所述链霉素0.1-0.2g;所述氢化可的松溶液是将氢化可的松用无水乙醇溶解而成,每l所述无水乙醇溶解所述氢化可的松5-10mg。egf:表皮细胞生长因子,又名人寡肽-1,是人体内的一种活性物质,由53个氨基组成的活性多肽,能够促进细胞的增殖分化,从而以新生的细胞代替衰老和死亡的细胞。fgf:成纤维细胞生长因子,能够促进内皮细胞的游走和平滑肌细胞的增殖。本发明采用自体来源的间充质干细胞经过诱导分化成鼻粘膜样上皮细胞,用于鼻粘膜受损患者进行鼻粘膜下细胞移植,可以对受损的鼻粘膜进行有效修复,恢复鼻粘膜生理功能、增加鼻腔容积和鼻腔阻力,阻断ens慢性功能衰竭的发生和发展,有效缓解病人的不适症状。进一步的,所述细胞诱导液还含有阿拉伯半乳聚糖、烟酰胺和胰岛素,每l所述注射用水溶解所述阿拉伯半乳聚糖1-3g、所述烟酰胺0.2-0.5g、所述胰岛素0.05-0.1g。在细胞诱导液中加入阿拉伯半乳聚糖、烟酰胺和胰岛素,可以进一步提高脂肪干细胞向鼻粘膜样上皮细胞的分化效果。进一步的,所述细胞诱导液还含有羧甲基纤维素钠、山梨酸钾和甘氨酸,每l所述注射用水溶解所述羧甲基纤维素钠0.5-1.5g、所述山梨酸钾0.05-0.08g、所述甘氨酸0.02-0.06g。在细胞诱导液中加入羧甲基纤维素钠、山梨酸钾和甘氨酸可以提高细胞诱导液防止细菌感染的能力,有效抑制细菌滋生,保障细胞诱导液的使用安全,提高分化方法中诱导分化过程的安全性。进一步的,所述诱导培养的条件为:在温度为37℃、co2体积分数为5%、饱和湿度的条件下诱导培养12-16天。进一步的,所述方法还包括:对自体来源的间充质干细胞进行诱导分化之前还包括分离获取间充质干细胞和培养扩增间充质干细胞。进一步的,所述分离获取间充质干细胞包括:无菌收集含有间充质干细胞的自体组织,用pbs缓冲液冲洗1-3min,再用眼科剪剪成1-2mm3大小的组织碎块,将组织碎块加入组织分解液中,水浴震荡,37℃、220r/min振荡30-45min,观察到脂肪逐渐变为乳糜状后置入离心机,2000r/min离心5min,弃上层清液,即可获得自体来源的间充质干细胞。优选的,所述组织分解液为含1%胶原酶i型的pbs缓冲。进一步的,所述培养扩增间充质干细胞包括:加入适量pbs缓冲液重悬分离后的自体来源的间充质干细胞,吹打后接种于细胞培养液中,在37℃、5%co2、饱和湿度的条件下进行培养,4h后更换细胞培养液,弃去未贴壁的细胞,每隔3-4d更换细胞培养液,待细胞生长达到80%融合时加入细胞消化液将贴壁细胞消化分离3-5min,按1:3比例进行传代接种,每3天更换细胞培养液1次,当贴壁细胞达到融合时再次传代,将传至第三代的间充质干细胞收集,融于0.9%的氯化钠溶液中去,呈悬浊液,保存于4℃环境中;所述细胞培养液主要是将h-dmem干粉培养基、胎牛血清、d-木糖、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述h-dmem干粉培养基30-50g、所述胎牛血清1-5g、所述d-木糖0.5-1g、所述青霉素1-2×105u、所述链霉素0.1-0.3g。优选的,所述细胞消化液为含0.25%胰酶的pbs缓冲液。进一步的,所述细胞培养液还含有甲壳糖、微晶纤维素和琥珀酸钠,每l所述注射用水溶解所述甲壳糖2-5g、所述微晶纤维素1-2g、所述琥珀酸钠0.3-0.8g。在细胞培养液中加入甲壳糖、微晶纤维素和琥珀酸钠可以进一步提高脂肪干细胞的培养增殖速度,减少或改变其中任何一个成分,提高培养扩增速度的效果变差。进一步的,所述细胞培养液还含有酒石酸钾钠和甲酸钙,每l所述注射用水溶解所述酒石酸钾钠1-2g、所述甲酸钙0.2-0.8g。在细胞培养液中加入酒石酸钾钠和甲酸钙可以提高细胞培养液防止细菌感染的能力,有效抑制细菌滋生,保障细胞培养液的使用安全,提高分化方法中培养扩增过程的安全性。本发明还提供一种用于自体来源的间充质干细胞向鼻粘膜样上皮细胞分化的试剂盒,包括盒体和位于盒体内部的若干试剂瓶,若干所述试剂瓶内分别盛装有组织分解液、细胞培养液、细胞消化液和细胞诱导液,所述细胞诱导液主要是将dmem干粉培养基、胎牛血清、egf、fgf、氢化可的松溶液、谷氨酰胺、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述dmem干粉培养基40-60g、所述胎牛血清4-6g、所述egf6-10μg、所述fgf10-20μg、所述氢化可的松溶液5-10ml、所述谷氨酰胺0.15-0.3g、所述青霉素1-2×105u、所属链霉素0.1-0.2g;所述氢化可的松溶液是将氢化可的松用无水乙醇溶解而成,每l所述无水乙醇溶解所述氢化可的松5-10mg。进一步的,所述细胞诱导液还含有阿拉伯半乳聚糖、烟酰胺和胰岛素,每l所述注射用水溶解所述阿拉伯半乳聚糖1-3g、所述烟酰胺0.2-0.5g、所述胰岛素0.05-0.1g。进一步的,所述细胞诱导液还含有羧甲基纤维素钠、山梨酸钾和甘氨酸,每l所述注射用水溶解所述羧甲基纤维素钠0.5-1.5g、所述山梨酸钾0.05-0.08g、所述甘氨酸0.02-0.06g。进一步的,所述细胞培养液主要是将h-dmem干粉培养基、胎牛血清、d-木糖、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述h-dmem干粉培养基30-50g、所述胎牛血清1-5g、所述d-木糖0.5-1g、所述青霉素1-2×105u、所述链霉素0.1-0.3g。进一步的,所述细胞培养液还含有甲壳糖、微晶纤维素和琥珀酸钠,每l所述注射用水溶解所述甲壳糖2-5g、所述微晶纤维素1-2g、所述琥珀酸钠0.3-0.8g。进一步的,所述细胞培养液还含有酒石酸钾钠和甲酸钙,每l所述注射用水溶解所述酒石酸钾钠1-2g、所述甲酸钙0.2-0.8g。进一步的,所述组织分解液为含1%胶原酶i型的pbs缓冲。进一步的,所述细胞消化液为含0.25%胰酶的pbs缓冲液。本发明采用自体来源丰富的脂肪间充质干细胞或其他干细胞经过分离、培养、诱导分化等步骤得到数量充足的鼻粘膜样上皮细胞,用于鼻粘膜受损患者进行鼻粘膜下细胞移植,可以对受损的鼻粘膜进行有效修复,恢复鼻粘膜生理功能、增加鼻腔容积和鼻腔阻力,阻断ens慢性功能衰竭的发生和发展,有效缓解病人的不适症状;而用于移植的细胞来源于患者自身组织,具有取材容易、安全可靠、避免免疫反应等优点。附图说明图1为本发明实施例3诱导分化前的细胞形态图;图2为本发明实施例3诱导分化后的细胞形态图。具体实施方式实施例1一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,所述方法包括:将自体来源的间充质干细胞加入细胞诱导液中诱导分化得到鼻粘膜样上皮细胞,所述细胞诱导液主要是将dmem干粉培养基、胎牛血清、egf、fgf、氢化可的松溶液、谷氨酰胺、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述dmem干粉培养基40g、所述胎牛血清4g、所述egf6μg、所述fgf10μg、所述氢化可的松溶液5ml、所述谷氨酰胺0.15g、所述青霉素1×105u、所述链霉素0.1g;所述氢化可的松溶液是将氢化可的松用无水乙醇溶解而成,每l所述无水乙醇溶解所述氢化可的松5mg。实施例2一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,所述方法包括:将自体来源的间充质干细胞加入细胞诱导液中诱导分化得到鼻粘膜样上皮细胞,所述细胞诱导液主要是将dmem干粉培养基、胎牛血清、egf、fgf、氢化可的松溶液、谷氨酰胺、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述dmem干粉培养基60g、所述胎牛血清6g、所述egf10μg、所述fgf20μg、所述氢化可的松溶液10ml、所述谷氨酰胺0.3g、所述青霉素2×105u、所述链霉素0.2g;所述氢化可的松溶液是将氢化可的松用无水乙醇溶解而成,每l所述无水乙醇溶解所述氢化可的松10mg。实施例3一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,所述方法包括:将自体来源的间充质干细胞加入细胞诱导液中诱导分化得到鼻粘膜样上皮细胞,所述细胞诱导液主要是将dmem干粉培养基、胎牛血清、egf、fgf、氢化可的松溶液、谷氨酰胺、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述dmem干粉培养基50g、所述胎牛血清5g、所述egf8μg、所述fgf15μg、所述氢化可的松溶液8ml、所述谷氨酰胺0.2g、所述青霉素1.5×105u、所述链霉素0.15g;所述氢化可的松溶液是将氢化可的松用无水乙醇溶解而成,每l所述无水乙醇溶解所述氢化可的松8mg。实施例4一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例1不同的是:所述细胞诱导液还含有阿拉伯半乳聚糖、烟酰胺和胰岛素,每l所述注射用水溶解所述阿拉伯半乳聚糖1g、所述烟酰胺0.2g、所述胰岛素0.05g。实施例5一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例2不同的是:所述细胞诱导液还含有阿拉伯半乳聚糖、烟酰胺和胰岛素,每l所述注射用水溶解所述阿拉伯半乳聚糖3g、所述烟酰胺0.5g、所述胰岛素0.1g。实施例6一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例3不同的是:所述细胞诱导液还含有阿拉伯半乳聚糖、烟酰胺和胰岛素,每l所述注射用水溶解所述阿拉伯半乳聚糖2g、所述烟酰胺0.3g、所述胰岛素0.08g。实施例7一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例1不同的是:所述细胞诱导液还含有羧甲基纤维素钠、山梨酸钾和甘氨酸,每l所述注射用水溶解所述羧甲基纤维素钠0.5g、所述山梨酸钾0.05g、所述甘氨酸0.02g。实施例8一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例5不同的是:所述细胞诱导液还含有羧甲基纤维素钠、山梨酸钾和甘氨酸,每l所述注射用水溶解所述羧甲基纤维素钠1.5g、所述山梨酸钾0.08g、所述甘氨酸0.06g。实施例9一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例3不同的是:所述细胞诱导液还含有羧甲基纤维素钠、山梨酸钾和甘氨酸,每l所述注射用水溶解所述羧甲基纤维素钠1g、所述山梨酸钾0.06g、所述甘氨酸0.04g。实施例10一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例8不同的是:所述诱导培养的条件为:在温度为37℃、co2体积分数为5%、饱和湿度的条件下诱导培养12天。实施例11一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例3不同的是:所述诱导培养的条件为:在温度为37℃、co2体积分数为5%、饱和湿度的条件下诱导培养14天。实施例12一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例10不同的是,所述方法还包括:对自体来源的间充质干细胞进行诱导分化之前还包括分离获取间充质干细胞和培养扩增间充质干细胞,所述分离获取间充质干细胞包括:无菌收集含有间充质干细胞的自体组织,用pbs缓冲液冲洗1min,再用眼科剪剪成1mm3大小的组织碎块,将组织碎块加入组织分解液中,水浴震荡,37℃、220r/min振荡30min,观察到脂肪逐渐变为乳糜状后置入离心机,2000r/min离心5min,弃上层清液,即可获得自体来源的间充质干细胞。实施例13一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例3不同的是,所述方法还包括:对自体来源的间充质干细胞进行诱导分化之前还包括分离获取间充质干细胞和培养扩增间充质干细胞,所述分离获取间充质干细胞包括:无菌收集含有间充质干细胞的自体组织,用pbs缓冲液冲洗2min,再用眼科剪剪成1.5mm3大小的组织碎块,将组织碎块加入组织分解液中,水浴震荡,37℃、220r/min振荡40min,观察到脂肪逐渐变为乳糜状后置入离心机,2000r/min离心5min,弃上层清液,即可获得自体来源的间充质干细胞。实施例14一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例12不同的是:所述培养扩增间充质干细胞包括:加入适量pbs缓冲液重悬分离后的自体来源的间充质干细胞,吹打后接种于细胞培养液中,在37℃、5%co2、饱和湿度的条件下进行培养,4h后更换细胞培养液,弃去未贴壁的细胞,每隔3d更换细胞培养液,待细胞生长达到80%融合时加入细胞消化液将贴壁细胞消化分离3min,按1:3比例进行传代接种,每3天更换细胞培养液1次,当贴壁细胞达到融合时再次传代,将传至第三代的间充质干细胞收集,融于0.9%的氯化钠溶液中去,呈悬浊液,保存于4℃环境中;所述细胞培养液主要是将h-dmem干粉培养基、胎牛血清、d-木糖、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述h-dmem干粉培养基30g、所述胎牛血清1g、所述d-木糖0.5g、所述青霉素1×105u、所述链霉素0.1g。实施例15一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例3不同的是,所述方法还包括:对自体来源的间充质干细胞进行诱导分化之前还包括分离获取间充质干细胞和培养扩增间充质干细胞,所述培养扩增间充质干细胞包括:加入适量pbs缓冲液重悬分离后的自体来源的间充质干细胞,吹打后接种于细胞培养液中,在37℃、5%co2、饱和湿度的条件下进行培养,4h后更换细胞培养液,弃去未贴壁的细胞,每隔3.5d更换细胞培养液,待细胞生长达到80%融合时加入细胞消化液将贴壁细胞消化分离4min,按1:3比例进行传代接种,每3天更换细胞培养液1次,当贴壁细胞达到融合时再次传代,将传至第三代的间充质干细胞收集,融于0.9%的氯化钠溶液中去,呈悬浊液,保存于4℃环境中;所述细胞培养液主要是将h-dmem干粉培养基、胎牛血清、d-木糖、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述h-dmem干粉培养基40g、所述胎牛血清3g、所述d-木糖0.8g、所述青霉素1.5×105u、所述链霉素0.2g。实施例16一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例14不同的是:所述细胞培养液还含有甲壳糖、微晶纤维素和琥珀酸钠,每l所述注射用水溶解所述甲壳糖2g、所述微晶纤维素1g、所述琥珀酸钠0.3g。实施例17一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例15不同的是,所述细胞培养液还含有甲壳糖、微晶纤维素和琥珀酸钠,每l所述注射用水溶解所述甲壳糖3g、所述微晶纤维素1.5g、所述琥珀酸钠0.5g。实施例18一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例14不同的是:所述细胞培养液还含有酒石酸钾钠和甲酸钙,每l所述注射用水溶解所述酒石酸钾钠2g、所述甲酸钙0.8g。实施例19一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例15不同的是,所述细胞培养液还含有酒石酸钾钠和甲酸钙,每l所述注射用水溶解所述酒石酸钾钠1.5g、所述甲酸钙0.5g。实施例20一种用于自体来源的间充质干细胞向鼻粘膜样上皮细胞分化的试剂盒,包括盒体和位于盒体内部的若干试剂瓶,若干所述试剂瓶内分别盛装有组织分解液、细胞培养液、细胞消化液和细胞诱导液,所述细胞诱导液是将dmem干粉培养基、胎牛血清、egf、fgf、氢化可的松溶液、谷氨酰胺、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述dmem干粉培养基40g、所述胎牛血清4g、所述egf6μg、所述fgf10μg、所述氢化可的松溶液5ml、所述谷氨酰胺0.15g、所述青霉素1×105u、所属链霉素0.1g;所述氢化可的松溶液是将氢化可的松用无水乙醇溶解而成,每l所述无水乙醇溶解所述氢化可的松5mg。实施例21一种用于自体来源的间充质干细胞向鼻粘膜样上皮细胞分化的试剂盒,与实施例20不同的是:所述细胞诱导液还含有阿拉伯半乳聚糖、烟酰胺、胰岛素、羧甲基纤维素钠、山梨酸钾和甘氨酸,每l所述注射用水溶解所述阿拉伯半乳聚糖2g、所述烟酰胺0.3g、所述胰岛素0.08g、所述羧甲基纤维素钠1g、所述山梨酸钾0.06g、所述甘氨酸0.05g;所述细胞培养液是将h-dmem干粉培养基、胎牛血清、d-木糖、青霉素、链霉素、甲壳糖、微晶纤维素、琥珀酸钠、酒石酸钾钠和甲酸钙用注射用水溶解而成,每l所述注射用水溶解所述h-dmem干粉培养基40g、所述胎牛血清3g、所述d-木糖0.8g、所述青霉素1×105u、所述链霉素0.2g、所述甲壳糖3g、所述微晶纤维素1.5g、所述琥珀酸钠0.5g、所述酒石酸钾钠1.5g、所述甲酸钙0.5g;所述组织分解液为含1%胶原酶i型的pbs缓冲;所述细胞消化液为含0.25%胰酶的pbs缓冲液。对照例1一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,所述方法包括:将自体来源的间充质干细胞加入细胞诱导液中诱导分化得到鼻粘膜样上皮细胞,所述细胞诱导液主要是将dmem干粉培养基、胎牛血清、egf、氢化可的松溶液、谷氨酰胺、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述dmem干粉培养基50g、所述胎牛血清5g、所述egf8μg、所述氢化可的松溶液8ml、所述谷氨酰胺0.2g、所述青霉素1.5×105u、所述链霉素0.15g;所述氢化可的松溶液是将氢化可的松用无水乙醇溶解而成,每l所述无水乙醇溶解所述氢化可的松8mg。对照例2一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,所述方法包括:将自体来源的间充质干细胞加入细胞诱导液中诱导分化得到鼻粘膜样上皮细胞,所述细胞诱导液主要是将dmem干粉培养基、胎牛血清、egf、fgf、氢化可的松溶液、天门冬酰胺、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述dmem干粉培养基50g、所述胎牛血清5g、所述egf8μg、所述fgf15μg、所述氢化可的松溶液8ml、所述天门冬酰胺0.2g、所述青霉素1.5×105u、所述链霉素0.15g;所述氢化可的松溶液是将氢化可的松用无水乙醇溶解而成,每l所述无水乙醇溶解所述氢化可的松8mg。对照例3一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例3不同的是:所述细胞诱导液还含有阿拉伯半乳聚糖和胰岛素,每l所述注射用水溶解所述阿拉伯半乳聚糖2g、所述胰岛素0.08g。对照例4一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例3不同的是:所述细胞诱导液还含有葡聚糖、烟酰胺和胰岛素,每l所述注射用水溶解所述葡聚糖2g、所述烟酰胺0.3g、所述胰岛素0.08g。对照例5一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例3不同的是:所述细胞诱导液还含有山梨酸钾和甘氨酸,每l所述注射用水溶解所述山梨酸钾0.06g、所述甘氨酸0.04g。对照例6一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例3不同的是:所述细胞诱导液还含有羧甲基纤维素钠、苯甲酸钠和甘氨酸,每l所述注射用水溶解所述羧甲基纤维素钠1g、所述苯甲酸钠0.06g、所述甘氨酸0.04g。对照例7一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例3不同的是,所述方法还包括:对自体来源的间充质干细胞进行诱导分化之前还包括分离获取间充质干细胞和培养扩增间充质干细胞,所述培养扩增间充质干细胞包括:加入适量pbs缓冲液重悬分离后的自体来源的间充质干细胞,吹打后接种于细胞培养液中,在37℃、5%co2、饱和湿度的条件下进行培养,4h后更换细胞培养液,弃去未贴壁的细胞,每隔3.5d更换细胞培养液,待细胞生长达到80%融合时加入细胞消化液将贴壁细胞消化分离4min,按1:3比例进行传代接种,每3天更换细胞培养液1次,当贴壁细胞达到融合时再次传代,将传至第三代的间充质干细胞收集,融于0.9%的氯化钠溶液中去,呈悬浊液,保存于4℃环境中;所述细胞培养液主要是将h-dmem干粉培养基、胎牛血清、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述h-dmem干粉培养基40g、所述胎牛血清3g、所述青霉素1.5×105u、所述链霉素0.2g。对照例8一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例3不同的是,所述方法还包括:对自体来源的间充质干细胞进行诱导分化之前还包括分离获取间充质干细胞和培养扩增间充质干细胞,所述培养扩增间充质干细胞包括:加入适量pbs缓冲液重悬分离后的自体来源的间充质干细胞,吹打后接种于细胞培养液中,在37℃、5%co2、饱和湿度的条件下进行培养,4h后更换细胞培养液,弃去未贴壁的细胞,每隔3.5d更换细胞培养液,待细胞生长达到80%融合时加入细胞消化液将贴壁细胞消化分离4min,按1:3比例进行传代接种,每3天更换细胞培养液1次,当贴壁细胞达到融合时再次传代,将传至第三代的间充质干细胞收集,融于0.9%的氯化钠溶液中去,呈悬浊液,保存于4℃环境中;所述细胞培养液主要是将h-dmem干粉培养基、胎牛血清、半乳糖、青霉素、链霉素用注射用水溶解而成,每l所述注射用水溶解所述h-dmem干粉培养基40g、所述胎牛血清3g、所述半乳糖0.8g、所述青霉素1.5×105u、所述链霉素0.2g。对照例9一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例15不同的是,所述细胞培养液还含有微晶纤维素和琥珀酸钠,每l所述注射用水溶解所述微晶纤维素1.5g、所述琥珀酸钠0.5g。对照例10一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例15不同的是,所述细胞培养液还含有甲壳糖、甲基纤维素和琥珀酸钠,每l所述注射用水溶解所述甲壳糖3g、所述甲基纤维素1.5g、所述琥珀酸钠0.5g。对照例11一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例15不同的是,所述细胞培养液还含有酒石酸钾钠,每l所述注射用水溶解所述酒石酸钾钠1.5g。对照例12一种自体来源的间充质干细胞向鼻粘膜样上皮细胞分化方法,与实施例15不同的是,所述细胞培养液还含有酒石酸钾钠和丙酸钠,每l所述注射用水溶解所述酒石酸钾钠1.5g、所述丙酸钠0.5g。间充质干细胞向鼻粘膜样上皮细胞分化效果评价1.细胞形态的变化采取脂肪组织,经常规方法进行分离和培养后,取第三代脂肪干细胞采用实施例3的方法进行诱导分化,诱导分化的结果见图1和图2由图1中诱导分化前的细胞形态和图2中的诱导分化后的细胞形态的对比可知:由成纤维样或纺锤样的脂肪干细胞经过诱导分化,逐渐发生鹅卵石样、铺路石样细胞的改变,细胞呈多边形单层生长,呈“鹅卵石样”分布,形态与典型的鼻粘膜样上皮细胞形态类似,说明采用本发明提供的诱导分化方法可使脂肪干细胞分化成鼻粘膜样上皮细胞。2.不同分化方法的分化效果比较采取脂肪组织,经常规方法进行分离和培养后,取第三代脂肪干细胞,分别采用实施例3、实施例6、对照例1-4的方法进行诱导分化,诱导分化结束以后检测鼻粘膜上皮细胞特异性蛋白ck-7、ck-14、ck-19的阳性率,结果见表1。表1ck-7、ck-14、ck-19阳性率评价组别ck-7(%)ck-14(%)ck-19(%)实施例327.7±5.123.9±1.240.2±4.0实施例642.1±4.337.6±2.253.2±3.3对照例115.3±3.513.6±1.922.5±3.8对照例214.8±2.514.9±2.828.5±5.6对照例328.9±2.125.3±2.740.9±2.9对照例428.1±3.527.1±2.142.0±2.5由上述结果可知,采用实施例3的方法对脂肪干细胞进行诱导分化与对照例1和对照例2的方法对比,其鼻粘膜上皮细胞特异性蛋白ck-7、ck-14、ck-19的阳性率均明显较高,说明采用本发明提供的分化方法可使脂肪干细胞向鼻粘膜样上皮细胞的分化效果更好。采用实施例6的方法对脂肪干细胞进行诱导分化后其鼻粘膜上皮细胞特异性蛋白ck-7、ck-14、ck-19的阳性率明显高于实施例3、对照例3、对照例4的方法,说明在分化方法所用细胞诱导液中加入阿拉伯半乳聚糖、烟酰胺和胰岛素,可以进一步提高脂肪干细胞向鼻粘膜样上皮细胞的分化效果。分化方法安全性评价1.诱导分化过程的安全性评价取实施例3、实施例9、对照例5、对照例6的分化方法中所使用的细胞诱导液,均在温度为25℃±2℃,相对湿度为60%±10%的条件下密闭保存12个月,检测细胞诱导液中的细菌总数。表2细胞诱导液中细菌总数统计实施例3实施例9对照例5对照例6细菌总数(cfu/ml)87997543428由上述结果可知,在细胞诱导液中加入羧甲基纤维素钠、山梨酸钾和甘氨酸可以提高细胞诱导液防止细菌感染的能力,有效抑制细菌滋生,保障细胞诱导液的使用安全,提高分化方法中诱导分化过程的安全性。2.培养扩增过程的安全性评价取实施例15、实施例19、对照例11、对照例12的分化方法中所使用的细胞培养液,均在温度为25℃±2℃,相对湿度为60%±10%的条件下密闭保存12个月,检测细胞培养液中的细菌总数。表3细胞培养液中细菌总数统计实施例15实施例19对照例11对照例12细菌总数(cfu/ml)79181574605由上述结果可知,在细胞培养液中加入酒石酸钾钠和甲酸钙可以提高细胞培养液防止细菌感染的能力,有效抑制细菌滋生,保障细胞培养液的使用安全,提高分化方法中培养扩增过程的安全性。培养扩增效果评价采取脂肪组织,按照实施例15、实施例17、对照例7-10的分化方法进行脂肪干细胞的分离和培养,采用台盼蓝经典染色法对细胞进行计数,分别统计原代和第3代活脂肪干细胞的数量,计算脂肪干细胞的培养扩增倍数,结果见表4。表4脂肪干细胞培养扩增效果评价组别实施例15实施例17对照例7对照例8对照例9对照例10培养扩增倍数3278514971343385由上述结果可以得出,采用本发明提供的分化方法培养的脂肪干细胞的扩增效果明显优于对照例7和对照例8的分化方法,说明本发明提供的分化方法中的培养扩增过程有利于提高脂肪干细胞的增殖速度。采用实施例17提供的分化方法培养的脂肪干细胞的扩增效果明显优于实施例15、对照例9和对照例10的分化方法,说明在细胞培养液中加入甲壳糖、微晶纤维素和琥珀酸钠可以进一步提高细胞培养液培养脂肪干细胞的增殖速度,减少或改变其中任何一个成分,提高培养扩增速度的效果变差。最后应说明的是,以上实施例仅用以说明本发明的技术方案而非限制,尽管参照较佳实施例对本发明进行了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的精神和范围,其均应涵盖在本发明的权利要求范围当中。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1