一株不产毒黄曲霉及其在降解黄曲霉毒素方面的应用的制作方法
本发明涉及微生物领域,具体地说,涉及一株不产毒黄曲霉及其在降解黄曲霉毒素方面的应用。
背景技术:
黄曲霉毒素(aflatoxin,aft)是一类由黄曲霉(a.flavus)、寄生曲霉(aspergillusparasiticus)及集峰曲霉(aspergillusnomius)等真菌产生的次级代谢产物,具有致癌、致畸和致细胞突变的作用,常见的有afb1、afb2、afg1、afg2和afm1等,其中afb1毒性最强。黄曲霉毒素的主要作用靶标是肝脏,大量的流行病学调查研究表明,世界范围内28%的肝细胞癌(hepatocellularcarcinoma,hcc;肝癌的一种主要类型)是由黄曲霉毒素引起的(liuetal.,2010;liuetal.,2012;wu,2014)。此外,黄曲霉毒素还可以引起肾脏和肾上腺的急性病变(poirieretal.,2000;kensleretal.,2011)。
黄曲霉毒素的基本结构是二呋喃环和氧杂萘邻酮(香豆素),前者为基本毒性结构,后者为主要致癌结构。黄曲霉毒素主要存在于花生、玉米、干果等食品中,严重威胁我国食品安全和人们身体健康;此外,饲料也常受到黄曲霉毒素的污染。因此,迫切需要一种高效的脱毒方法去除这类毒素。传统的黄曲霉毒素脱毒方法有物理和化学方法,包括氨化法、碱法、高温法、射线辐照法及超滤-渗透法、吸附法等,这些方法存在营养成分损失大、降解产物复杂、降解产物毒性不清、效果不稳定等缺点。生物脱毒法是利用微生物及其分泌的酶等代谢产物降解黄曲霉毒素的方法,生物脱毒法具有特异性强、效率高以及对食品、饲料和环境没有污染等优点,是黄曲霉毒素脱毒的主要发展方向,具有广泛的应用前景。目前,已经报道的黄曲霉毒素降解微生物及其酶主要有以下几种:铜绿假单胞菌、诺卡氏菌dsm12676、嗜麦窄食单胞菌、假蜜环菌、分支杆菌dsm44556t、黑曲霉、红串红球菌、糙皮侧耳等及其提取出的降解酶。
未见有关于可降解黄曲霉毒素的黄曲霉被研究和报道。
技术实现要素:
为了解决现有技术中存在的问题,本发明的目的是提供一株不产毒黄曲霉及其在降解黄曲霉毒素方面的应用。
为了实现本发明目的,本发明的技术方案如下:
本发明首先提供了一株不产毒黄曲霉(aspergillusflavus)jz2,保藏于中国微生物菌种保藏管理委员会普通微生物中心(简称cgmcc,地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮政编码:100101),保藏日期为2016年9月7日,保藏编号为cgmccno.12865。
上述不产毒黄曲霉菌落为绿色,产生大量的分生孢子,在pda培养基上生长较快,30℃黑暗培养5天可覆盖直径9cm的平板。该菌株缺失黄曲霉毒素合成基因所述黄曲霉菌株缺失黄曲霉毒素合成基因aflt、黄曲霉毒素合成基因pksa、黄曲霉毒素合成基因nor-1、黄曲霉毒素合成基因fas-2、黄曲霉毒素合成基因fas-1、黄曲霉毒素合成基因aflr、黄曲霉毒素合成基因aflj、黄曲霉毒素合成基因adha、黄曲霉毒素合成基因esta、黄曲霉毒素合成基因nora、黄曲霉毒素合成基因ver-1、黄曲霉毒素合成基因vera,因此该菌株不能合成黄曲霉毒素;缺失圆弧偶氮酸合成基因maoa,因此该菌株不能够合成圆弧偶氮酸;因此,该菌株不产黄曲霉毒素及圆弧偶氮酸。
进一步地,本发明提供了所述不产毒黄曲霉jz2在降解黄曲霉毒素方面的应用。
更为具体地,所述应用为利用不产毒黄曲霉jz2、或其菌悬液、或其发酵液、或其粗提物降解黄曲霉毒素。
本发明还进一步提供了所述不产毒黄曲霉(a.flavus)jz2在制备降解黄曲霉毒素的产品中的应用。
进一步地,所述降解黄曲霉毒素的产品中可含有不产毒黄曲霉jz2、或其菌悬液、或其发酵液、或其粗提物。
基于前述技术方案,本发明人还提供了一种降解黄曲霉毒素的方法,即使用不产毒黄曲霉jz2、或其菌悬液、或其发酵液、或其粗提物对黄曲霉毒素进行降解处理。
具体为:将不产毒黄曲霉jz2、或其菌悬液、或其发酵液、或其粗提物与含有黄曲霉毒素的样品混合。
所述样品可为含有黄曲霉毒素的农产品加工原料、食品、饲料及环境样品等。
本发明还进一步提供一种降解黄素霉毒素的试剂,含有前述不产毒黄曲霉jz2、或其菌悬液、或其发酵液、或其粗提物。
本发明技术方案中所述的黄曲霉毒素为b族黄曲霉毒素和/或g族黄曲霉毒素。所述b族黄曲霉毒素为黄曲霉毒素b1和/或黄曲霉毒素b2;所述g族黄曲霉毒素为黄曲霉毒素g1和/或黄曲霉毒素g2。
本发明涉及到的原料或试剂均为普通市售产品,涉及到的操作如无特殊说明均为本领域常规操作。
本发明的有益效果在于:
本发明首次提供了可降解黄曲霉毒素的黄曲霉菌株,也首次开发出了不产毒黄曲霉菌株jz2在降解黄曲霉毒素方面的新应用。
不产毒黄曲霉菌株jz2可高效降解黄曲霉毒素,可作为黄曲霉毒素降解的生物材料,无论在开发新的生物降解菌剂还是生物降解无菌制剂方面都具有很好的应用前景。
附图说明
图1为本发明所述不产毒黄曲霉菌株jz2的毒素合成基因缺失示意图。
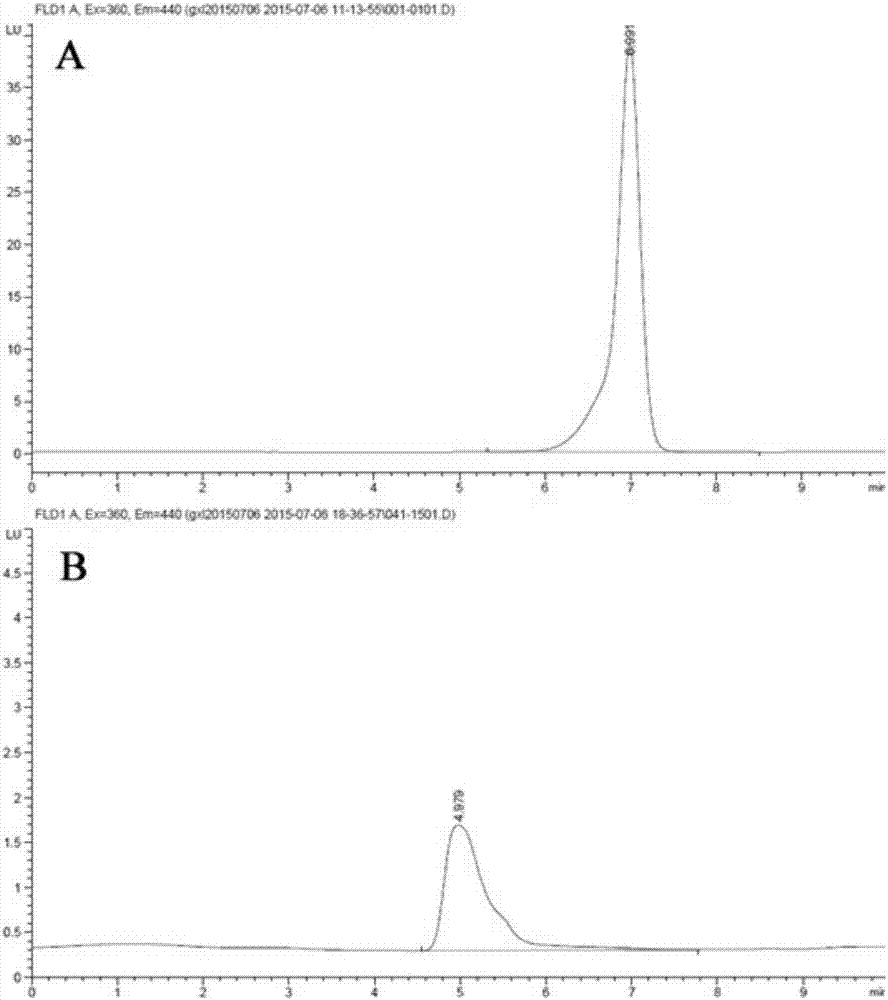
图2为本发明所述黄曲霉jz2培养液中黄曲霉毒素检测;(a)黄曲霉毒素b1标准溶液液相色谱图;(b)黄曲霉jz2在yes培养基上培养7天黄曲霉毒素提取液的液相色谱图。
图3为本发明所述黄曲霉jz2培养液中圆弧偶氮酸(cpa)检测;(a)cpa标准溶液液相色谱图;(b)黄曲霉jz2在yes培养基上培养7天cpa提取液的液相色谱图。
图4为本发明所述黄曲霉jz2对黄曲霉毒素b1的降解产物质谱图。
图5为黄曲霉毒素降解路径推导图。
具体实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
下述实施例中所使用的实验方法如无特殊说明,均为常规方法。
下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。
下述实施例中的定量实验均重复三次,结果取平均值。
dg18固体培养基:酪蛋白胨5.0g/l、无水葡萄糖10.0g/l、磷酸二氢钾1.0g/l、硫酸镁(mgso4·h2o)0.5g/l、氯硝胺0.002g/l、无水甘油200g/l、琼脂15g/l、氯霉素0.1g/l,蒸馏水溶解至1l。
pdb液体培养基:葡萄糖20g、马铃薯200g(加水煮沸20-30min,用2层纱布趁热过滤,留取滤液),蒸馏水补充至1l。
pda固体培养基:在pdb液体培养基中加入琼脂15g/l,得到pda固体培养基。
yes液体培养基:酵母提取物20g、蔗糖150g、硫酸镁(mgso4·7h2o),蒸馏水溶解至1l。
afpa培养基:蛋白胨10.0g/l、酵母挑取唔20.0g/l,柠檬酸铁铵0.5g/l,氯硝铵0.002g/l,氯霉素0.1g/l,琼脂15.0g/l,ph为6.3。
实施例1、不产毒黄曲霉菌的采集、分离及鉴定
一、从花生种植土壤中分离黄曲霉菌株jz2
从广东花生种植土壤中用dg18培养基分离黄曲霉菌株。具体操作如下:
1、土壤样品菌悬液的制备
取10g土样,加入90ml0.1%蛋白胨无菌水(w/v),在室温震荡30min,制成10-1菌悬液;在取0.5ml10-1菌悬液加4.5ml0.1%蛋白胨无菌水,制备出10-2稀释度菌悬液;按上述方法制备10-3稀释度菌悬液。
2、菌株的分离与纯化
每个稀释度取0.1ml菌液,涂布在dg18培养基上,30℃黑暗培养5d,每个稀释度重复3次,挑取长有黄色孢子的菌株在dg18培养基上进行二次划线分离,直至得到单个菌落。挑取单个菌落与pda斜面试管培养基上,于30℃培养3d后保存于4℃中。将其中一株菌记为jz2。
二、菌株jz2的鉴定:
1、形态学鉴定:
挑取保存于pda培养基上的菌株jz2与afpa培养基上,30℃培养3-5d,可见afpa培养基背面为亮橘色。
2、分子鉴定:
通过真菌钙调基因序列对菌株jz2进行分子鉴定(rodrigues,p.,santos,c.,venancio,a.,lima,n.,2011.speciesidentificationofaspergillussectionflaviisolatesfromportuguesealmondsusingphenotypic,includingmaldi-toficms,andmolecularapproaches.japplmicrobiol111877-892)。黄曲霉基因组钙调蛋白pcr扩增所用的引物为cl1和cl2a(序列如下)。pcr扩增反应程序为:94℃预变性5min,1个循环;94℃变性30s,54℃退火30s,72℃延伸90s,共30个循环;72℃最后延伸7min。扩增后,产物保存于4℃。产物送至上海生工生物工程有限公司测序。并在blastresearches上比对测序结果(http://www.ncbi.nlm.nih.gov/)。
cl1:5’-gartwcaaggaggccttctc-3’;
cl2a:5’-tttttgcatcatgagttggac-3’。
将菌株jz2的钙调蛋白基因的测序结果提交上ncbi进行比对,发现其与黄曲霉菌nrrl3357和nrrl21882的同源性均为99%。
经过以上形态学鉴定和分子鉴定,可知菌株jz2为黄曲霉(aspergillusflavus)。
3、黄曲霉(aspergillusflavus)jz2中黄曲霉毒素和圆弧偶氮酸(cpa)合成基因完整性检测
以genbank登录号为ay510451黄曲霉的毒素合成基因的序列为参照,设计了毒素合成相关基因damt、maoa、hypb、hypc、hypd和hype六对引物,其他基因的引物参考perng-kuangchang(chang,p.k.,horn,b.w.anddorner,j.w.(2005)sequencebreakpointsintheaflatoxinbiosynthesisgeneclusterandflankingregionsinnonaflatoxigenicaspergillusflavusisolates.fungalgenet.biol.42,941-923.)。
表1毒素合成基因缺失鉴定用引物信息
提取黄曲霉(aspergillusflavus)jz2(cgmccno.12865)的基因组dna,以其为模板,分别用表1中的各引物对进行常规pcr反应,每个反应均设置产黄曲霉毒素的黄曲霉菌gd-1的基因组dna对照和阴性对照(以无菌水作为模板)。
pcr反应体系:1μldna模板,上下游引物(10μm)各1μl,gotaq(gotagcolorlessmastermix,promega公司,m7133)10μl,无菌水补足至20μl。
反应条件:95℃预变性2min,94℃变性30s,各组引物55℃退火30s,72℃延伸1min30s,进行30个循环,最后72℃延伸7min。
pcr产物用1.0%的琼脂糖凝胶在1×tae缓冲液中电泳后,用凝胶成像系统进行拍照。
鉴定结果表明,黄曲霉jz2缺失黄曲霉毒素合成的基因aflt、pksa、nor-1、fas-2、fas-1、aflr、aflj、adha、esta、nora、ver-1、vera,因此该菌株不能合成黄曲霉毒素;缺失圆弧偶氮酸合成基因maoa,因此该菌株不能够合成圆弧偶氮酸。
三、黄曲霉毒素和cpa(圆弧偶氮酸)的检测
1、黄曲霉毒素检测
菌株在pda培养基上活化后用0.1%吐温80洗脱孢子液,将孢子液加入到50mlyes(20g/l酵母粉,150g/l蔗糖,1g/l硫酸镁)液体培养基中,并调整孢子液终浓度为1×104个/ml,在30℃180rpm条件下黑暗培养7天。培养液用滤纸过滤后取1ml加入等体积氯仿,用涡旋振荡器混匀后取上层水相再加入1ml氯仿提取黄曲霉毒素,合并有机相在60℃条件下氮吹至干,毒素复溶于50%甲醇-水溶液,用高效液相色谱检测黄曲霉毒素。色谱条件:流动相甲醇:水=1:1(v/v),流速1ml/min,色谱柱agilenttc-c18(4.6×250mm),进样量20μl;配备光化学衍生器并用荧光检测器检测,激发波长360nm,发射波长440nm。鉴定结果显示,黄曲霉毒素标准品在6.991min处出峰,而菌株jz2培养液的检测结果显示,jz2在6.991min附近没有任何色谱峰,表明jz2不产黄曲霉毒素。
2、cpa(圆弧偶氮酸)检测
菌株在yes培养基上培养7天后,取25ml滤液加入100ml甲醇:2%碳酸氢钠水溶液(7:3,v/v),大于200rpm震荡30min,取出50ml溶液至分液漏斗,并加入100ml正己烷萃取,震荡分层后弃去己烷层,随后加入50ml10%kcl溶液,混合均匀后加入2.0ml6.0mhcl溶液酸化,cpa用50ml氯仿提取两次,收集氯仿层取5ml氮气吹干后复溶于1ml乙腈:0.05m乙酸铵水溶液(8:2,v/v,ph=5),用hplc检测。色谱条件:流动相乙腈:0.05m乙酸铵水溶液(8:2,v/v,ph=5),流速0.6ml/min,检测波长284nm,色谱柱agilenttc-c18(4.6*250mm),进样量20μl。检测结果显示,圆弧偶氮酸的标准品在5.260min处出峰,而jz2在5.260min附近没有任何色谱峰,表明jz2不产圆弧偶氮酸。
实施例2、不产毒黄曲霉菌jz2对黄曲霉毒素b1的降解能力分析
1、黄曲霉毒素b1标准品的配制
将1mg黄曲霉毒素b1(afb1)的标品溶解于2ml色谱纯甲醇中获得浓度为500ppm的黄曲霉毒素b1溶液。
2、菌种的培养
将不产毒黄曲霉jz2接种于mea斜面试管培养基上,28℃培养5天,然后用棉签蘸取培养基上的孢子于无菌的0.1%吐温-80中,利用振荡器震荡均匀,再利用血球计数板分别将孢子浓度调至1×106cfu/ml。
3、不产毒黄曲霉菌jz2对黄曲霉毒素b1的降解
取菌株jz2孢子液(1×106cfu/ml)1ml于灭菌的50mlpdb培养基中,加入过滤除菌的黄曲霉毒素,使其在培养液中的浓度为500ppb,充分混匀后28℃摇床中180rpm培养,分别在培养的第3天、6天、9天取样、提取毒素并检测,记作实验组。阳性对照实验:取无菌的0.1%吐温-80溶液1ml于灭菌的50mlpdb培养基中,加入过滤除菌的黄曲霉毒素,使其在培养液中的浓度为500ppb,充分混匀后28℃摇床中180rpm培养,分别在培养的第3天、6天、9天取样、提取毒素并检测。阴性对照实验:取菌株jz2孢子液(1×106cfu/ml)1ml于灭菌的50mlpdb培养基中,充分混匀后28℃摇床中180rpm培养,分别在培养的第3天、6天、9天取样、提取毒素并检测。
4、jz2对黄曲霉毒素b1降解能力的检测
发酵液用定性滤纸过滤后,取滤液1ml,加入三氯甲烷1ml,涡旋振荡1min,8000rpm离心4min后移取下层溶液于干净的试管中,在下层溶液中继续加入三氯甲烷1ml,重复上述操作两次后进行50℃氮吹,用流动相复溶,过0.22μm滤膜,用hplc检测黄曲霉毒素含量并计算降解率。
hplc检测条件为流动相甲醇(色谱级):水=1:1,超滤后超声波脱气5min;流速:1ml/min;安捷伦c18色谱柱(4.6mm×250mm,5μm);检测器:荧光检测器,激发波长360nm,发射波长440nm;进样量:20μl。
结果如表2所示。结果表明,不产毒黄曲霉菌jz2对对黄曲霉毒素b1具有一定的降解作用,降解作用在第9天达到最大,降解率为80.9%。
表2不产毒黄曲霉菌jz2对黄曲霉毒素b1的降解率
实施例3、不产毒黄曲霉菌jz2降解黄曲霉毒素b1的产物分析
采用lc-qtof/ms解析黄曲霉毒素b1的降解产物。黄曲霉毒素b1降解产物首先用分离柱进行分离,分离组分用ms离子源进行电离化;通过第一级质谱后,通过没有cid质谱分析到达tof,cid模式用于ms/ms分析,母离子在cid中被裂解,得到裂解路径。
lc检测条件为流动相乙腈(色谱级):0.1%甲酸水溶液=70:30,超滤后超声波脱气5min;流速:0.4ml/min,时间12min;安捷伦加强型c18色谱柱(2.1mm×150mm,5μm);进样量:2μl。
质谱分析条件:化合物分析模式为阳离子模式;毛细管和碰撞诱导解离电压分别为3500v和175v;撇渣器电压65v;气体流速10l/min;喷雾压力为40psi;碰撞气体为氮气;在核质比m/z100-1000范围内以1.4光谱每秒的速度扫描获得裂解离子的质谱;masshunterworkstation软件vb.04.00用于质谱解析;121.0508和922.0097的离子作为参考离子用于保持质谱准确性。
由图4和图5可以看出,结果表明,经过培养不产毒黄曲霉菌jz2对黄曲霉毒素b1具有一定的降解作用,并推导出一个降解产物,分子式为c15h20o5,相对分子质量为281.14。
实施例4、不产毒黄曲霉菌jz2对黄曲霉毒素g1、g2的降解能力分析
1、黄曲霉毒素g1和g2标准品的配制
将1mg黄曲霉毒素g1(afg1)和g2(afg2)的标品溶解于2ml色谱纯甲醇中获得浓度为500ppm的afg1和afg2溶液。
2、菌种的培养
将不产毒黄曲霉jz2接种于mea斜面试管培养基上,28℃培养5天,然后用棉签蘸取培养基上的孢子于无菌的0.1%吐温-80中,利用振荡器震荡均匀,再利用血球计数板分别将孢子浓度调至1×106cfu/ml。
3、不产毒黄曲霉菌jz2对黄曲霉毒素g1和g2的降解
取菌株jz2孢子液(1×106cfu/ml)1ml于灭菌的50mlpdb培养基中,加入过滤除菌的黄曲霉毒素g1和g2,使其在培养液中的浓度为500ppb,充分混匀后28℃摇床中180rpm培养,分别在培养的第3天、6天、9天取样、提取毒素并检测,记作实验组。阳性对照实验:取无菌的0.1%吐温-80溶液1ml于灭菌的50mlpdb培养基中,加入过滤除菌的黄曲霉毒素g1和g2,使其在培养液中的浓度为500ppb,充分混匀后28℃摇床中180rpm培养,分别在培养的第3天、6天、9天取样、提取毒素并检测。阴性对照实验:取菌株jz2孢子液(1×106cfu/ml)1ml于灭菌的50mlpdb培养基中,充分混匀后28℃摇床中180rpm培养,分别在培养的第3天、6天、9天取样、提取毒素并检测。
4、jz2对黄曲霉毒素g1和g2降解能力的检测
发酵液用定性滤纸过滤后,取滤液1ml,加入三氯甲烷1ml,涡旋振荡1min,8000rpm离心4min后移取下层溶液于干净的试管中,在下层溶液中继续加入三氯甲烷1ml,重复上述操作两次后进行50℃氮吹,用流动相复溶,过0.22μm滤膜,用hplc检测黄曲霉毒素g1和g2含量并计算降解率。
hplc检测条件为流动相甲醇(色谱级):水=1:1,超滤后超声波脱气5min;流速:1ml/min;安捷伦c18色谱柱(4.6mm×250mm,5μm);检测器:荧光检测器,激发波长360nm,发射波长440nm;进样量:20μl。
结果如表3所示。结果表明,不产毒黄曲霉菌jz2对黄曲霉毒素g1和g2具有显著的降解作用,降解作用在第9天达到最大,降解率分别为84.5%和85.1%。
表3不产毒黄曲霉菌jz2对黄曲霉毒素g1和g2的降解
实施例5、不产毒黄曲霉菌jz2发酵液对b类或g类黄曲霉毒素的降解能力分析
1、黄曲霉毒素b1、b2、g1和g2标准品的配制
将1mg黄曲霉毒素b1、b2、g1和g2的标品溶解于2ml色谱纯甲醇中获得浓度为500ppm的贮存溶液,然后取100μl毒素贮存溶液溶解于5ml色谱纯甲醇中获得浓度为10ppm的降解添加溶液。
2、菌种的培养
将不产毒黄曲霉jz2接种于mea斜面试管培养基上,28℃培养5天,然后用棉签蘸取培养基上的孢子于无菌的0.1%吐温-80中,利用振荡器震荡均匀,再利用血球计数板分别将孢子浓度调至1×106cfu/ml。
3、不产毒黄曲霉菌jz2的培养
取菌株jz2孢子液(1×106cfu/ml)1ml于灭菌的50mlpdb培养基中,28℃摇床中180rpm培养,培养5天,取发酵体系,10000rpm离心5min,得到发酵液。
4、移取990μl上述发酵液(将pdb液体培养基作为发酵液的对照)和10μl浓度为10ppm的黄曲霉毒素b1、b2、g1和g2标准溶液混合,四种黄曲霉毒素的终浓度均为100ppb,加入到1.5ml灭菌离心管中,30℃、200rpm反应72h,取样,提取毒素并检测。
5、jz2发酵液对黄曲霉毒素b1、b2、g1和g2降解能力的检测
降解混合溶液用定性滤纸过滤后,取滤液1ml,加入三氯甲烷1ml,涡旋振荡1min,8000rpm离心4min后移取下层溶液于干净的试管中,在下层溶液中继续加入三氯甲烷1ml,重复上述操作两次后进行50℃氮吹,用流动相复溶,过0.22μm滤膜,用hplc检测黄曲霉毒素b1、b2、g1和g2含量并计算降解率。
hplc检测条件为流动相甲醇(色谱级):水=1:1,超滤后超声波脱气5min;流速:1ml/min;安捷伦c18色谱柱(4.6mm×250mm,5μm);检测器:荧光检测器,激发波长360nm,发射波长440nm;进样量:20μl。
结果如表4所示。结果表明,不产毒黄曲霉菌jz2发酵液对黄曲霉毒素b1、b2、g1和g2具有显著的降解作用,降解率分别为98.7%、96.5%、99.4%和98.6%。
表4不产毒黄曲霉菌jz2发酵液对黄曲霉毒素b1、b2、g1和g2的降解
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
- 还没有人留言评论。精彩留言会获得点赞!