通用型嵌合抗原受体T细胞制备技术的制作方法
本发明涉及免疫细胞治疗领域,更具体地涉及一种通用型嵌合抗原受体t细胞及其制备方法和应用。
背景技术:
细胞免疫治疗是一种新兴的、具有显著疗效的肿瘤治疗模式,是一种自身免疫抗癌的新型治疗方法。它是运用生物技术和生物制剂对从病人体内采集的免疫细胞进行体外培养和扩增后回输到病人体内的方法,来激发、增强机体自身免疫功能,从而达到治疗肿瘤的目的。
嵌合免疫抗原受体(chimericantigenreceptors,cars)由胞外抗原识别区域,通常是scfv(single-chainvariablefragment),跨膜区以及胞内共刺激信号区域组成。cars的胞外段可识别一个特异的抗原,随后通过胞内结构域转导该信号,引起t细胞的活化增殖、细胞溶解毒性和分泌细胞因子,进而清除靶细胞。
car-t细胞在血液系统恶性肿瘤的治疗中显示出前所未有的疗效,如对晚期复发难治性急性淋巴细胞白血病(all)治疗的完全缓解(cr)可达到90%,对慢性淋巴细白血病(cll)和部分b细胞淋巴瘤的cr达到50%以上。此外,car-t细胞在治疗实体瘤方面也表现出很大的潜力。
在传统的cart细胞治疗中,首先分离病人自体t细胞(或者异源供体),激活并进行基因改造产生car-t细胞,随后注入同一病人体内。这种方式患移植物抗宿主病概率极低,抗原被t细胞以非mhc限制方式识别。但这种治疗方式严重受制于患者的个体状况,分离改造细胞所造成的时间和金钱成本也非常高。因此,本领域仍然需要进一步的研究,开发一种可以大规模制备,质量均一稳定,随时可调用给任何患者的通用型car-t细胞。
技术实现要素:
本发明的目的在于提供一种通用型嵌合抗原受体t细胞及其制备方法和应用。
在本发明的第一方面,提供了一种通用型嵌合抗原受体t细胞(car-t细胞),所述car-t细胞具有以下特征:
(a)所述car-t细胞表达嵌合抗原受体car,所述car靶向肿瘤细胞的标志物;和
(b)所述car-t细胞hla-i类分子的α3区域与cd8分子的结合是被抑制的。
在另一优选例中,所述“α3区域与cd8分子的结合是被抑制的”指α3区域与cd8分子不结合或基本不结合。
在另一优选例中,所述“基本不结合”指所述car-t细胞hla-i类分子的α3区域与cd8分子的结合量c1与正常t细胞hla-i类分子的α3区域与cd8分子的结合量c0的比值,即c1/c0≤0.05,较佳地c1/c0≤0.03,更佳地≤0.02,更佳地≤0.01,最佳地为0。
在另一优选例中,所述的cd8分子来源于受体t细胞。
在另一优选例中,所述的cd8分子来源于的tcr(tcellreceptor)复合物。
在另一优选例中,所述的α3区域被突变,从而使得α3区域与cd8分子的结合被抑制。
在另一优选例中,所述的α3区域的第16-23位中有1个、2个、3个、4个、5个、6个、7个、或8个氨基酸被突变。
在另一优选例中,所述的α3区域对应于hla-aα序列的第222-229位中有1个、2个、3个、4个、5个、6个、7个、或8个氨基酸被突变。
在另一优选例中,所述的2个、3个、4个、5个、6个、7个氨基酸突变可以是连续的突变,也可以是不连续的突变。
在另一优选例中,所述的α3区域的氨基酸序列如seqidno.:7所示。
在另一优选例中,所述的α3区域为hla-a的α序列的α3区域。
在另一优选例中,所述细胞中的hla-i类分子的α3区域的基因表达是被沉默的。
在另一优选例中,所述“α3区域的基因表达是被沉默的”指α3区域的基因不表达或低表达。
在另一优选例中,所述“低表达”指所述car-t细胞α3区域的基因表达量g1与正常t细胞α3区域的基因表达量g0的比值,即g1/g0≤0.5,较佳地g1/g0≤0.3,更佳地≤0.2,更佳地≤0.1,最佳地为0。
在另一优选例中,所述car-t细胞中的tcr基因表达是被沉默的。
在另一优选例中,所述“tcr基因表达是被沉默的”指tcr基因不表达或低表达。
在另一优选例中,所述“低表达”指所述car-t细胞tcr基因表达量m1与正常t细胞tcr基因表达量m0的比值,即m1/m0≤0.5,较佳地m1/m0≤0.3,更佳地≤0.2,更佳地≤0.1,最佳地为0。
在另一优选例中,所述的car的结构如下式i所示:
l-scfv-h-tm-c-cd3ζ(i)
式中,
各“-”独立地为连接肽或肽键;
l为任选的信号肽序列;
scfv为抗原结合结构域;
h为任选的铰链区;
tm为跨膜结构域;
c为共刺激信号分子;
cd3ζ为源于cd3ζ的胞浆信号传导序列。
在另一优选例中,所述的l为选自下组的蛋白的信号肽:cd8、gm-csf、cd4、cd137、或其组合。
在另一优选例中,所述的l为gm-csf。
在另一优选例中,所述scfv为靶向肿瘤抗原的抗体单链可变区序列。
在另一优选例中,所述scfv为靶向选自下组抗原的抗体单链可变区序列:cd19、cd20、cd22、cd123、cd47、cd138、cd33、cd30、mesothelin、egfr、gpc3、bcma、erbb2、nkg2dligands、lmp1、epcam、vegfr-1、lewis-y、ror1、claudin18.2、或其组合。
在另一优选例中,所述scfv为靶向cd19的抗体单链可变区序列。
在另一优选例中,所述scfv为fmc63,序列如seqidno.:1第67-801位所示。
在另一优选例中,所述的h为选自下组的蛋白的铰链区:cd8、cd28、cd137、或其组合。
在另一优选例中,所述的h为cd28来源的铰链区。
在另一优选例中,所述的tm为选自下组的蛋白的跨膜区:cd28、cd3epsilon、cd45、cd4、cd5、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、cd154、或其组合。
在另一优选例中,tm包括cd28来源的跨膜区。
在另一优选例中,所述的c为选自下组的蛋白的共刺激信号分子:ox40、cd2、cd7、cd27、cd28、cd30、cd40、cd70、cd134、4-1bb(cd137)、pd1、dap10、cds、icam-1、lfa-1(cd11a/cd18)、icos(cd278)、nkg2d、gitr、tlr或其组合。
在另一优选例中,c包括cd28来源的共刺激信号分子。
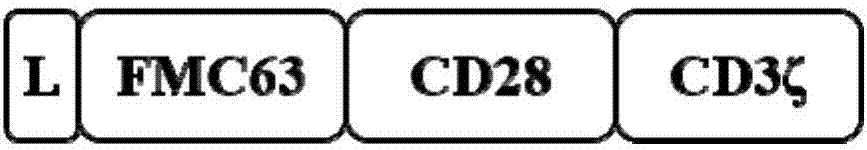
在另一优选例中,所述car的结构为l-fmc63-cd28-cd3ζ。
在另一优选例中,所述car的序列如seqidno.:2所示。
在另一优选例中,所述的car-t细胞用于异体肿瘤治疗。
在另一优选例中,所述的car-t细胞在异体治疗时不会引起gvhd及hvg反应。
在本发明的第二方面,提供了一种制备本发明的第一方面所述的car-t细胞的方法,包括以下步骤:
(a)提供一待改造的t细胞;和
(b)对所述的t细胞进行改造,从而使得所述的t细胞表达所述的car,并突变或沉默所述t细胞中hla-i类分子的α3区域,使得α3区域与cd8分子的结合被抑制,从而获得本发明的第一方面所述的car-t细胞。
在另一优选例中,在步骤(b)中,包括(b1)将表达所述car的第一表达盒导入所述t细胞;和(b2)将表达用于突变或沉默α3区域的第二表达盒导入所述t细胞;
其中,所述的步骤(b1)和(b2)的次序无任何限定。
在另一优选例中,在步骤(b)中,还包括步骤(b3)将表达用于沉默tcr基因的第三表达盒导入所述t细胞;
其中,所述的步骤(b1)、(b2)和(b3)的次序无任何限定。
在另一优选例中,当步骤(a)中的待改造的t细胞已经表达某一car时,则在步骤(b)中,包括(b2)将表达用于突变或沉默α3区域的第二表达盒导入所述t细胞;和(b3)将表达用于沉默tcr基因的第三表达盒导入所述t细胞;
其中,所述的步骤(b2)可在步骤(b3)之前、之后、同时、或交替进行。
在另一优选例中,所述的“次序无任何限定”指对于任何二个步骤而言,可以依次、同时、或以相反次序进行。
在另一优选例中,所述的第一表达盒、第二表达盒和第三表达盒位于相同或不同的载体上。
在另一优选例中,所述的第一表达盒、第二表达盒和第三表达盒位于同一载体。
在另一优选例中,所述的载体为病毒载体。
在另一优选例中,所述的载体选自下组:dna、rna、质粒、慢病毒载体、腺病毒载体、逆转录病毒载体、转座子、其他基因转移系统、或其组合。
在另一优选例中,所述的第二表达盒包含crispr/cas9(第一sgrna和cas9)、反义rna、或其组合。
在另一优选例中,所述的第一sgrna靶向hla-i类分子的α3区域。
在另一优选例中,所述的第一sgrna的序列如seqidno.:5、6所示。
在另一优选例中,所述的反义rna包括mirna、sirna、shrna、抑制性mrna、或dsrna。
在另一优选例中,所述的第三表达盒包含crispr/cas9(第二sgrna和cas9)、反义rna、或其组合。
在另一优选例中,所述的第二sgrna靶向tcr基因。
在另一优选例中,所述的第二sgrna的序列如seqidno.:3、4所示。
在本发明的第三方面,提供了一种制剂,所述制剂含有本发明的第一方面所述的car-t细胞,以及药学上可接受的载体、稀释剂或赋形剂。
在另一优选例中,所述制剂为液态制剂。
在另一优选例中,所述制剂的剂型为注射剂。
在另一优选例中,所述制剂中所述car-t细胞的浓度为1×103-1×108个细胞/ml,较佳地1×104-1×107个细胞/ml。
在本发明的第四方面,提供了本发明的第一方面所述的car-t细胞的用途,用于制备预防和/或治疗癌症或肿瘤的药物或制剂。
在另一优选例中,所述的药物或制剂用于预防和/或治疗与所述car-t细胞异体的癌症或肿瘤。
在另一优选例中,所述肿瘤选自下组:血液肿瘤、实体瘤、或其组合。
在另一优选例中,所述血液肿瘤选自下组:急性髓细胞白血病(aml)、多发性骨髓瘤(mm)、慢性淋巴细胞白血病(cll)、急性淋巴白血病(all)、弥漫性大b细胞淋巴瘤(dlbcl)、或其组合。
在另一优选例中,所述实体瘤选自下组:胃癌、胃癌腹膜转移、肝癌、白血病、肾脏肿瘤、肺癌、小肠癌、骨癌、前列腺癌、结直肠癌、乳腺癌、大肠癌、宫颈癌、卵巢癌、淋巴癌、鼻咽癌、肾上腺肿瘤、膀胱肿瘤、非小细胞肺癌(nsclc)、脑胶质瘤、或其组合。
在本发明的第五方面,提供了一种用于制备本发明的第一方面所述的car-t细胞的试剂盒,所述试剂盒含有容器,以及位于容器内的:
(1)第一核酸序列,所述第一核酸序列含有用于表达所述car的第一表达盒;
(2)第二核酸序列,所述第二核酸序列含有用于突变或沉默α3区域的第二表达盒或sgrna。
在另一优选例中,所述的试剂盒还含有:(3)第三核酸序列,所述第三核酸序列含有用于沉默tcr基因的第三表达盒或sgrna。
在另一优选例中,所述的第一、第二和第三核酸序列为独立的或相连的。
在另一优选例中,所述的第一、第二和第三核酸序列位于相同或不同的容器内。
在另一优选例中,所述的第一、第二和第三核酸序列中的任何二个或三个位于同一表达载体。
在另一优选例中,所述的试剂盒还含有:(4)第四核酸序列,所述第四核酸序列含有用于表达cas9蛋白的第四表达盒;或cas9蛋白。
在本发明的第六方面,本发明的第一方面所述的car-t细胞的用途,用于预防和/或治疗异体癌症或肿瘤。
应理解,在本发明范围内中,本发明的上述各技术特征和在下文(如实施例)中具体描述的各技术特征之间都可以互相组合,从而构成新的或优选的技术方案。限于篇幅,在此不再一一累述。
附图说明
图1显示了tcr的结构示意图。
图2显示了mhc分子的结构示意图。
图3显示了mhci类分子的三维结构。
图4显示了在中国北方汉族中kir受体的分布频率。
图5显示了kirs与hla-c分子的特异性识别示意图。
图6显示了kir与tcr分别与hla分子中不同位点结合的情况。
图7显示了实施例1中car的结构。
具体实施方式
本发明人经过广泛而深入地研究,首次意外地发现一种通用型嵌合抗原受体t细胞及其制备方法和应用。具体地,本发明提供了一种car-t细胞,所述的表达嵌合抗原受体car,并且所述细胞hla-i类分子的α3区域与cd8分子的结合是被抑制的,所述细胞中的tcr基因表达是被沉默的。实验表明,本发明的通用型car-t细胞可以用于异体肿瘤治疗,且异体输注时不会引起gvhd及hvg反应,改善了异体car-t细胞在受体体内的存活及抗肿瘤效果。在此基础上完成了本发明。
具体地,发明人意外的发现,hla-i类分子中α3区域与cd8分子关键部位结合位点突变后,hla-i类分子与cd8亲和力大幅减弱,减弱t细胞的激活,从而避免t细胞的攻击。另外,用基因沉默的方法将hla-i类分子中α3区域表达沉默后,hla-i类分子与cd8不结合,减弱t细胞的激活,从而避免t细胞的攻击。
本发明所述嵌合抗原受体t细胞为一种可治疗肿瘤,且异体治疗时不会引起gvhd及hvg反应的细胞。确切的说,是一种表达嵌合抗原受体的t细胞,通过基因编辑技术敲除细胞中的tcr表达,使得异体输注时不会因为tcr的识别而杀伤受体的正常细胞,即不会带来gvhd反应;同时通过以下手段避免宿主抗移植物的反应(hostversusgraft,hvg),提高异体car-t细胞在受体体内的存活及抗肿瘤效果:
(1)点突变hla-i类分子中α3区域中与cd8分子关键结合位点(222-229位点),使得hla-tcr结合后激活t细胞的能力减弱,避免受体t细胞的攻击及hvg反应;
(2)基因沉默hla-i类分子中α3区域,使得hla分子不与cd8分子结合,hla-tcr结合后激活t细胞的能力减弱,避免受体t细胞的攻击及hvg反应;
(3)通过基因编辑的手段敲除hla-i类分子中β2m的表达,使得hla-i分子表达沉默,同时外源性高表达nk细胞抑制性受体(killer-cellimmunoglobulin-likereceptor,kir)的配体片段或抗体片段;
(4)敲除或者敲低hla-a/hla-b的表达,使得受体tcr不识别cart细胞,避免hvg;
(5)突变hla-i类分子中α1、α2结构域中与tcr识别的位点,同时保留与kir结合的位点,使得hla-i与受体tcr不识别,又能与nk细胞中kir受体结合,避免hvg反应。
术语
为了可以更容易地理解本公开,首先定义某些术语。如本申请中所使用的,除非本文另有明确规定,否则以下术语中的每一个应具有下面给出的含义。在整个申请中阐述了其它定义。
术语“约”可以是指在本领域普通技术人员确定的特定值或组成的可接受误差范围内的值或组成,其将部分地取决于如何测量或测定值或组成。
术语“给予”是指使用本领域技术人员已知的各种方法和递送系统中的任一种将本发明的产品物理引入受试者,包括静脉内,肌内,皮下,腹膜内,脊髓或其它肠胃外给药途径,例如通过注射或输注。
术语“抗体”(ab)应包括但不限于免疫球蛋白,其特异性结合抗原并包含通过二硫键互连的至少两条重(h)链和两条轻(l)链,或其抗原结合部分。每条h链包含重链可变区(本文缩写为vh)和重链恒定区。重链恒定区包含三个恒定结构域ch1、ch2和ch3。每条轻链包含轻链可变区(本文缩写为vl)和轻链恒定区。轻链恒定区包含一个恒定结构域cl。vh和vl区可以进一步细分为称为互补决定区(cdr)的高变区,其散布有更保守的称为框架区(fr)的区域。每个vh和vl包含三个cdr和四个fr,从氨基末端到羧基末端按照以下顺序排列:fr1,cdr1,fr2,cdr2,fr3,cdr3,fr4。重链和轻链的可变区含有与抗原相互作用的结合结构域。
tcr/mhc复合物(tcellreceptor,tcr)
t细胞表面受体(tcellreceptor,tcr)为所有t细胞表面的特征性标志,以非共价键与cd3结合,形成tcr—cd3复合物。tcr的作用是识别抗原,并激活t细胞,发挥杀伤作用。tcr是由两条不同肽链构成的异二聚体,tcr分为两类:tcr1和tcr2。tcr1由γ和δ两条链组成,tcr2由α和β两条链组成。外周血中,90%-95%的t细胞表达tcr2。每条肽链又可分为可变区(v区),恒定区(c区),跨膜区和胞质区等几部分;其特点是胞质区很短。tcr的结构示意图如图1所示。
tcr分子属于免疫球蛋白超家族,其抗原特异性存在于v区;v区(vα、vβ)又各有三个高变区cdr1、cdr2、cdr3,其中以cdr3变异最大,直接决定了tcr的抗原结合特异性。在tcr识别mhc-抗原肽复合体时,cdr1、cdr2识别和结合mhc分子抗原结合槽的侧壁,而cdr3直接与抗原肽相结合。
主要组织相容性抗原(majorhistocompatibilitycomplex,mhc)是所有生物相容复合体抗原的一种统称(mhcmolecule),表示由mhc基因家族(mhcclassⅰ,classⅱ,classⅲ)编码而成的分子,位于细胞表面,不同种类哺乳动物mhc基因的编码产物的名称各异。人类的mhc通常被称为hla(humanleucocyteantigen,hla),即人类白细胞抗原。mhc基因(mhcgene),定位于人类第六号染色体短臂,呈高度多态性。
mhc分子在免疫应答过程中参与抗原识别,主要有两类,分别为mhci类分子、mhcii类分子,mhci类分子分布在基本所有的细胞表面,参与内部抗原递呈过程;mhcii类分子主要是分布在抗原递呈细胞表面(cd4+t细胞、巨噬细胞、b淋巴细胞等),参与外源性抗原递呈。其中mhci类分子由一条重链(α链,分为α1、α2和α3三个结构域)和一条轻链β微球蛋白组合而成;mhcii类分子由两条重链组合而成,分别为α链和β链,各有两个结构域:α1、α2,β1、β2。mhc分子的结构示意图如图2所示。
图3显示了mhci类分子的三维结构,当异体mhc复合物分子被apc递呈给t细胞时,tcr与异体mhc复合物特异性识别,tcrcdr1、cdr2与mhc分子中hla的α1与α2结合,tcrcdr3特异性的与抗原肽结合,tcr复合体中cd8分子与hla分子的α3区域识别,共同激活t细胞,使t细胞快速增殖,最终特异性杀伤异体细胞。因此异体移植时,需要降低或阻断受体tcr与供体mhc复合物的识别,以防止移植的细胞被受体内t细胞清除。因此,一方面,要敲除cart细胞的tcr分子,以防止异体输注时杀伤受体体内正常的细胞,另一方面,可以敲除cart表面的mhc分子,这样,避免了受体t细胞的攻击。这也是目前主流的做法,但是一旦cart细胞表面mhc分子不表达,受体内nk细胞不受mhc抑制,就会被激活从而行使杀伤功能,影响cart细胞的存活及治疗效果。因此,怎么调控mhc分子的表达,使得异体cart细胞既不受t细胞攻击,又不受nk细胞的攻击就显得尤为重要。
本发明通过基因编辑的手段,对cart细胞hlaα3区域的进行基因编辑,α3区域与cd8结合的关键区域(222-229位点)进行突变或者直接敲除α3区域,使cd8与α3亲和力减弱或者直接不与α3结合,避免受体中t细胞的激活对供体t细胞进行杀伤;同时保留了α1及α2区域,也因此受体nk细胞也不会杀伤供体t细胞,使得供体t细胞在体内存活时间延长,而更好的发挥抗肿瘤效果。
nk细胞抑制性受体(killer-cellimmunoglobulin-likereceptor,kir)
nk细胞是骨髓来源的淋巴细胞,不同于t细胞,nk细胞行使非特异性杀伤功能,不依赖于mhc限制性。nk细胞主要通过两种方式诱导靶细胞的凋亡:颗粒胞吐作用和死亡受体作用,也可以被直接激活而发挥抗体依赖细胞介导的细胞毒作用(adcc作用)。
nk细胞的活化主要是由抑制性受体和活化受体间的平衡调控。机体内正常细胞不会受到nk细胞攻击,是因为其表面表达自身mhci类分子,能够与nk细胞表面的抑制性受体结合,从而抑制nk细胞的活化。
与mhci结合的抑制受体主要有kir、异二聚体nkg2a/cd94和白细胞免疫球蛋白样受体(leukocyteig-likereceptor,lir)。经典的hlai类分子(hla-a、-b、-c)为kir及lir的配体。
kirs家族位于染色体19q13.4,属于ig超家族成员,胞外带有2个(kir2d)或3个(kir3d)ig结构域,并根据胞浆区尾的长短进一步分型,胞内片段较长的为kir2dl和kirdl,胞内较短的分为kir2ds和kir3ds。其中长尾的kirs,连接免疫受体酪氨酸抑制性基续(immunoreceptortyrosine-basedinhibitorymotif,itim)。kirs特异性识别mhc-i类等位基因,hla-a、-b、-c。hla-c是主要的同抑制性受体结合的i类分子配体。hla-c按其α螺旋第77位和第80位氨基酸残基的不同分为两组:hla-cw1,cw3,cw7,cw8为第一组,第77位、第80位分别为丝氨酸和天门冬氨酸,为抑制性受体kir2dl2、kir2dl3和激活性受体kir2ds2、kir2ds3所识别;第二组hla-c等位基因包括hla-cw2,cw4、cw5和cw6,α螺旋第77位和第80位氨基酸残基则为冬氨酸及赖氨酸,被抑制性受体kir2dl1和激活性受体kir2ds1识别。
统计发现,中国汉族中,hla-c分子的特异性受体分子kir2dl1、kir2dl3是在所有人中都表达的(图4)。因此,在异体cart细胞中所有mhc-i类分子敲除后,可以表达hla-c分子,以抑制受体nk细胞的活性,避免被nk杀伤,延长异体内存活时长。
图5显示了kirs与hla-c分子的特异性识别示意图,与tcr/hla识别类似,kir分子的d1和d2分别与hla分子的α1和α2识别。
kir与hla-c结合位点相对保守,如图6中黄色高亮处所示,12个结合位点中有11个保守序列,而tcr与hla-a结合的16个位点中,如图6中红色点所标示的位置,只有8个是保守的,其他8个是可变的。同时可以看到,kir与tcr分别与hla分子中不同位点结合,因此,可以突变hla位点中特异性识别tcr的位点,而保留与kir识别的位点,从而一方面不被tcr识别,避免受体t细胞的攻击,一方面又能结合kir受体,抑制nk细胞的活性,避免nk的攻击,延长供体细胞在体内的存活时间,更好的发挥疗效。
嵌合抗原受体(car)
本发明的嵌合抗原受体(car)包括细胞外结构域、跨膜结构域、和细胞内结构域。胞外结构域包括靶-特异性结合元件(也称为抗原结合结构域)。细胞内结构域包括共刺激信号传导区和ζ链部分。共刺激信号传导区指包括共刺激分子的细胞内结构域的一部分。共刺激分子为淋巴细胞对抗原的有效应答所需要的细胞表面分子,而不是抗原受体或它们的配体。
cars的设计经历了以下过程:第一代car只有一个胞内信号组份cd3ζ或者fcγri分子,由于胞内只有一个活化结构域,因此它只能引起短暂的t细胞增殖和较少的细胞因子分泌,而并不能提供长时间的t细胞增殖信号和持续的体内抗肿瘤效应,所以并没有取得很好地临床疗效。第二代cars在原有结构基础上引入一个共刺激分子,如cd28、4-1bb、ox40、icos,与一代cars相比功能有很大提高,进一步加强car-t细胞的持续性和对肿瘤细胞的杀伤能力。在二代cars基础上串联一些新的免疫共刺激分子如cd27、cd134,发展成为三代和四代cars。
在car的胞外结构域和跨膜结构域之间,或在car的胞浆结构域和跨膜结构域之间,可并入接头。如本文所用的,术语“接头”通常指起到将跨膜结构域连接至多肽链的胞外结构域或胞浆结构域作用的任何寡肽或多肽。接头可包括0-300个氨基酸,优选地2至100个氨基酸和最优选地3至50个氨基酸。
本发明的car当在t细胞中表达时,能够基于抗原结合特异性进行抗原识别。当其结合其关联抗原时,影响肿瘤细胞,导致肿瘤细胞不生长、被促使死亡或以其他方式被影响,并导致患者的肿瘤负荷缩小或消除。抗原结合结构域优选与来自共刺激分子和ζ链中的一个或多个的细胞内结构域融合。优选地,抗原结合结构域与cd28信号传导结构域、和cd3ζ信号结构域组合的细胞内结构域融合。
如本文所用,“抗原结合结构域”“单链抗体片段”均指具有抗原结合活性的fab片段,fab’片段,f(ab’)2片段,或单一fv片段。fv抗体含有抗体重链可变区、轻链可变区,但没有恒定区,并具有全部抗原结合位点的最小抗体片段。一般的,fv抗体还包含vh和vl结构域之间的多肽接头,且能够形成抗原结合所需的结构。抗原结合结构域通常是scfv(single-chainvariablefragment)。scfv的大小一般是一个完整抗体的1/6。单链抗体优选是由一条核苷酸链编码的一条氨基酸链序列。作为本发明的优选方式,所述scfv包含特异性识别肿瘤高表达的抗原的抗体,较佳地为单链抗体。
对于绞链区和跨膜区(跨膜结构域),car可被设计以包括融合至car的胞外结构域的跨膜结构域。在一个实施方式中,使用天然与car中的结构域之一相关联的跨膜结构域。在一些例子中,可选择跨膜结构域,或通过氨基酸置换进行修饰,以避免将这样的结构域结合至相同或不同的表面膜蛋白的跨膜结构域,从而最小化与受体复合物的其他成员的相互作用。
car-t细胞
如本文所用,术语“car-t细胞”、“car-t”、“本发明car-t细胞”均指本发明第一方面所述的通用型car-t细胞,所述car-t细胞表达嵌合抗原受体car,所述car靶向肿瘤细胞的标志物;且所述细胞的α3区域被突变或被沉默,从而使得α3区域与cd8分子的结合被抑制。此外,所述car-t细胞中的tcr基因表达也是被沉默的。
本发明的car-t细胞是通过基因编辑技术敲除细胞中的tcr表达,使得异体输注时不会因为tcr的识别而杀伤受体的正常细胞,即不会带来gvhd反应;同时通过突变或沉默α3区域,从而使得α3区域与cd8分子的结合减弱或直接抑制,避免了宿主抗移植物的反应(hostversusgraft,hvg),提高异体car-t细胞在受体体内的存活及抗肿瘤效果。
基因沉默方法
目前常用的基因沉默方法有crispr/cas9、rna干扰技术、talens(transcriptionactivator-like(tal)effectornucleases)和zincfingernucleases(zfns),其中crispr/cas9目前应用前景和效果最好。
crispr(clusteredregularlyinterspersedshortpalindromicrepeats)/cas(crispr-associated)系统是原核生物特有的一种天然免疫系统,用于抵抗病毒或外源性质粒的侵害。ⅱ型crispr/cas系统作为rna直接介导的基因组编辑工具已经在许多真核生物和原核生物体内成功应用。crispr/cas9系统的发展彻底改变了人们编辑dna序列和调控目标基因表达水平的能力,从而为生物体的精确基因组编辑提供了有力的工具。简化后的crispr/cas9系统由两部分组成:cas9蛋白和sgrna。其作用原理为sgrna通过自身的cas9把手与cas9蛋白形成cas9-sgrna复合体,cas9-sgrna复合体中sgrna的碱基互补配对区序列与目标基因的靶序列通过碱基互补配对原则进行配对结合,cas9利用自身的核酸内切酶活性对目标dna序列进行切割。与传统的基因组编辑技术相比,crispr/cas9系统具有几大明显的优势:易用性、简便性、低成本、可编程性以及可同时编辑多个基因。
表达盒
如本文所用,“表达盒”或“本发明表达盒”包括第一表达盒、第二表达盒和第三表达盒。所述第一表达盒包含编码所述car的核酸序列。所述第二表达盒包含用于突变或沉默α3区域的核酸序列。所述第三表达盒包含用于沉默tcr的核酸序列。在另一优选例中,本发明还包括用于表达cas9蛋白的第四表达盒。
在一个实施方式中,所述第一表达盒、第二表达盒和第三表达盒分别还包括启动子。在一个实施方式中,所述第一表达盒、第二表达盒和第三表达盒分别还包括终止子。
在一个实施方式中,所述的第一表达盒、第二表达盒和第三表达盒位于相同或不同的载体上。优选地,所述的第一表达盒、第二表达盒和第三表达盒位于同一载体。优选地,所述的载体选自下组:dna、rna、质粒、慢病毒载体、腺病毒载体、逆转录病毒载体、转座子、其他基因转移系统、或其组合。优选地,所述的载体为病毒载体。
载体
本发明提供了一种抑制tcr基因表达的干扰rna,优选的干扰rna为sgrna,优选地sgrna的序列如seqidno.:3、4所示。
本发明还提供了一种抑制hla-i类分子α3基因表达的干扰rna,优选的干扰rna为sgrna,优选地ghrna的序列如seqidno.:5、6所示。
编码期望分子的核酸序列可利用在本领域中已知的重组方法获得,诸如例如通过从表达基因的细胞中筛选文库,通过从已知包括该基因的载体中得到该基因,或通过利用标准的技术,从包含该基因的细胞和组织中直接分离。可选地,感兴趣的基因可被合成生产。
本发明也提供了其中插入本发明的表达盒的载体。源于逆转录病毒诸如慢病毒的载体是实现长期基因转移的合适工具,因为它们允许转基因长期、稳定的整合并且其在子细胞中增殖。慢病毒载体具有超过源自致癌逆转录病毒诸如鼠科白血病病毒的载体的优点,因为它们可转导非增殖的细胞,诸如肝细胞。它们也具有低免疫原性的优点。
简单概括,通常可操作地连接本发明的表达盒或核酸序列至启动子,并将其并入表达载体。该载体适合于复制和整合真核细胞。典型的克隆载体包含可用于调节期望核酸序列表达的转录和翻译终止子、初始序列和启动子。
本发明的表达构建体也可利用标准的基因传递方案,用于核酸免疫和基因疗法。基因传递的方法在本领域中是已知的。见例如美国专利号5,399,346、5,580,859、5,589,466,在此通过引用全文并入。在另一个实施方式中,本发明提供了基因疗法载体。
该核酸可被克隆入许多类型的载体。例如,该核酸可被克隆入如此载体,其包括但不限于质粒、噬菌粒、噬菌体衍生物、动物病毒和粘粒。特定的感兴趣载体包括表达载体、复制载体、探针产生载体和测序载体。
进一步地,表达载体可以以病毒载体形式提供给细胞。病毒载体技术在本领域中是公知的并在例如sambrook等(2001,molecularcloning:alaboratorymanual,coldspringharborlaboratory,newyork)和其他病毒学和分子生物学手册中进行了描述。可用作载体的病毒包括但不限于逆转录病毒、腺病毒、腺伴随病毒、疱疹病毒和慢病毒。通常,合适的载体包含在至少一种有机体中起作用的复制起点、启动子序列、方便的限制酶位点和一个或多个可选择的标记(例如,wo01/96584;wo01/29058;和美国专利号6,326,193)。
已经开发许多基于病毒的系统,用于将基因转移入哺乳动物细胞。例如,逆转录病毒提供了用于基因传递系统的方便的平台。可利用在本领域中已知的技术将选择的基因插入载体并包装入逆转录病毒颗粒。该重组病毒可随后被分离和传递至体内或离体的对象细胞。许多逆转录病毒系统在本领域中是已知的。在一些实施方式中,使用腺病毒载体。许多腺病毒载体在本领域中是已知的。在一个实施方式中,使用慢病毒载体。
额外的启动子元件,例如增强子,可以调节转录开始的频率。通常地,这些位于起始位点上游的30-110bp区域中,尽管最近已经显示许多启动子也包含起始位点下游的功能元件。启动子元件之间的间隔经常是柔性的,以便当元件相对于另一个被倒置或移动时,保持启动子功能。在胸苷激酶(tk)启动子中,启动子元件之间的间隔可被增加隔开50bp,活性才开始下降。取决于启动子,表现出单个元件可合作或独立地起作用,以起动转录。
合适的启动子的一个例子为即时早期巨细胞病毒(cmv)启动子序列。该启动子序列为能够驱动可操作地连接至其上的任何多核苷酸序列高水平表达的强组成型启动子序列。合适的启动子的另一个例子为延伸生长因子-1α(ef-1α)。然而,也可使用其他组成型启动子序列,包括但不限于类人猿病毒40(sv40)早期启动子、小鼠乳癌病毒(mmtv)、人免疫缺陷病毒(hiv)长末端重复(ltr)启动子、momulv启动子、鸟类白血病病毒启动子、艾伯斯坦-巴尔(epstein-barr)病毒即时早期启动子、鲁斯氏肉瘤病毒启动子、以及人基因启动子,诸如但不限于肌动蛋白启动子、肌球蛋白启动子、血红素启动子和肌酸激酶启动子。进一步地,本发明不应被限于组成型启动子的应用。诱导型启动子也被考虑为本发明的一部分。诱导型启动子的使用提供了分子开关,其能够当这样的表达是期望的时,打开可操作地连接诱导型启动子的多核苷酸序列的表达,或当表达是不期望的时关闭表达。诱导型启动子的例子包括但不限于金属硫蛋白启动子、糖皮质激素启动子、孕酮启动子和四环素启动子。
为了评估car多肽或其部分的表达,被引入细胞的表达载体也可包含可选择的标记基因或报道基因中的任一个或两者,以便于从通过病毒载体寻求被转染或感染的细胞群中鉴定和选择表达细胞。在其他方面,可选择的标记可被携带在单独一段dna上并用于共转染程序。可选择的标记和报道基因两者的侧翼都可具有适当的调节序列,以便能够在宿主细胞中表达。有用的可选择标记包括例如抗生素抗性基因,诸如neo等等。
报道基因用于鉴定潜在转染的细胞并用于评价调节序列的功能性。通常地,报道基因为以下基因:其不存在于受体有机体或组织或由受体有机体或组织进行表达,并且其编码多肽,该多肽的表达由一些可容易检测的性质例如酶活性清楚表示。在dna已经被引入受体细胞后,报道基因的表达在合适的时间下进行测定。合适的报道基因可包括编码荧光素酶、β-半乳糖苷酶、氯霉素乙酰转移酶、分泌型碱性磷酸酶或绿色萤光蛋白基因的基因(例如,ui-tei等,2000febsletters479:79-82)。合适的表达系统是公知的并可利用已知技术制备或从商业上获得。通常,显示最高水平的报道基因表达的具有最少5个侧翼区的构建体被鉴定为启动子。这样的启动子区可被连接至报道基因并用于评价试剂调节启动子-驱动转录的能力。
将基因引入细胞和将基因表达入细胞的方法在本领域中是已知的。在表达载体的内容中,载体可通过在本领域中的任何方法容易地引入宿主细胞,例如,哺乳动物、细菌、酵母或昆虫细胞。例如,表达载体可通过物理、化学或生物学手段转移入宿主细胞。
将多核苷酸引入宿主细胞的物理方法包括磷酸钙沉淀、脂质转染法、粒子轰击、微注射、电穿孔等等。生产包括载体和/或外源核酸的细胞的方法在本领域中是公知的。见例如sambrook等(2001,molecularcloning:alaboratorymanual,coldspringharborlaboratory,newyork)。将多核苷酸引入宿主细胞的优选方法为磷酸钙转染。
将感兴趣的多核苷酸引入宿主细胞的生物学方法包括使用dna和rna载体。病毒载体,特别是逆转录病毒载体,已经成为最广泛使用的将基因插入哺乳动物例如人细胞的方法。其他病毒载体可源自慢病毒、痘病毒、单纯疱疹病毒i、腺病毒和腺伴随病毒等等。见例如美国专利号5,350,674和5,585,362。
将多核苷酸引入宿主细胞的化学手段包括胶体分散系统,诸如大分子复合物、纳米胶囊、微球、珠;和基于脂质的系统,包括水包油乳剂、胶束、混合胶束和脂质体。用作体外和体内传递工具(deliveryvehicle)的示例性胶体系统为脂质体(例如,人造膜囊)。
在使用非病毒传递系统的情况下,示例性传递工具为脂质体。考虑使用脂质制剂,以将核酸引入宿主细胞(体外、离体(exvivo)或体内)。在另一方面,该核酸可与脂质相关联。与脂质相关联的核酸可被封装入脂质体的水性内部中,散布在脂质体的脂双层内,经与脂质体和寡核苷酸两者都相关联的连接分子附接至脂质体,陷入脂质体,与脂质体复合,分散在包含脂质的溶液中,与脂质混合,与脂质联合,作为悬浮液包含在脂质中,包含在胶束中或与胶束复合,或以其他方式与脂质相关联。与组合物相关联的脂质、脂质/dna或脂质/表达载体不限于溶液中的任何具体结构。例如,它们可存在于双分子层结构中,作为胶束或具有“坍缩的(collapsed)”结构。它们也可简单地被散布在溶液中,可能形成大小或形状不均一的聚集体。脂质为脂肪物质,其可为天然发生或合成的脂质。例如,脂质包括脂肪小滴,其天然发生在细胞质以及包含长链脂肪族烃和它们的衍生物诸如脂肪酸、醇类、胺类、氨基醇类和醛类的该类化合物中。
在本发明的一个优选地实施方式中,所述载体为慢病毒载体。
制剂
本发明提供了一种含有本发明第一方面所述的car-t细胞,以及药学上可接受的载体、稀释剂或赋形剂。在一个实施方式中,所述制剂为液态制剂。优选地,所述制剂为注射剂。优选地,所述制剂中所述car-t细胞的浓度为1×103-1×108个细胞/ml,更优地1×104-1×107个细胞/ml。
在一个实施方式中,所述制剂可包括缓冲液诸如中性缓冲盐水、硫酸盐缓冲盐水等等;碳水化合物诸如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸诸如甘氨酸;抗氧化剂;螯合剂诸如edta或谷胱甘肽;佐剂(例如,氢氧化铝);和防腐剂。本发明的制剂优选配制用于静脉内施用。
治疗性应用
本发明包括用编码本发明表达盒的慢病毒载体(lv)转导的细胞(例如,t细胞)进行的治疗性应用。转导的t细胞可靶向肿瘤细胞的标志物,并且可以用于异体肿瘤治疗,可以大规模制备,质量均一稳定,随时可调用给任何患者使用。
因此,本发明也提供了刺激对哺乳动物的靶细胞群或组织的t细胞-介导的免疫应答的方法,其包括以下步骤:给哺乳动物施用本发明的car-t细胞。
在一个实施方式中,本发明包括一类细胞疗法,给需要的患者直接施用本发明改造的通用型car-t细胞。本发明的ar-t细胞是通过基因编辑技术敲除细胞中的tcr表达,使得异体输注时不会因为tcr的识别而杀伤受体的正常细胞,即不会带来gvhd反应;同时通过突变或沉默α3区域,从而使得α3区域与cd8分子的结合被抑制,避免了宿主抗移植物的反应(hostversusgraft,hvg),提高异体car-t细胞在受体体内的存活及抗肿瘤效果。此外,一种car-t就可以治疗表达该抗原的所有癌症。不像抗体疗法,car-t细胞能够体内复制,产生可导致持续肿瘤控制的长期持久性。
在一个实施方式中,本发明的car-t细胞可经历稳固的体内t细胞扩展并可持续延长的时间量。另外,car介导的免疫应答可为过继免疫疗法步骤的一部分,其中car-修饰t细胞诱导对car中的抗原结合结构域特异性的免疫应答。例如,抗cd19car-t细胞引起抗表达cd19的细胞的特异性免疫应答。
尽管本文公开的数据具体公开了包括scfv、铰链和跨膜区、和4-1bb/cd28和cd3ζ信号传导结构域的慢病毒载体,但本发明应被解释为包括对构建体组成部分中的每一个的任何数量的变化。
可治疗的癌症包括没有被血管化或基本上还没有被血管化的肿瘤,以及血管化的肿瘤。癌症可包括非实体瘤(诸如血液学肿瘤,例如白血病和淋巴瘤)或可包括实体瘤。用本发明的car治疗的癌症类型包括但不限于癌、胚细胞瘤和肉瘤,和某些白血病或淋巴恶性肿瘤、良性和恶性肿瘤、和恶性瘤,例如肉瘤、癌和黑素瘤。也包括成人肿瘤/癌症和儿童肿瘤/癌症。
血液学癌症为血液或骨髓的癌症。血液学(或血原性)癌症的例子包括白血病,包括急性白血病(诸如急性淋巴细胞白血病、急性髓细胞白血病、急性骨髓性白血病和成髓细胞性、前髓细胞性、粒-单核细胞型、单核细胞性和红白血病)、慢性白血病(诸如慢性髓细胞(粒细胞性)白血病、慢性骨髓性白血病和慢性淋巴细胞白血病)、真性红细胞增多症、淋巴瘤、霍奇金氏疾病、非霍奇金氏淋巴瘤(无痛和高等级形式)、多发性骨髓瘤、瓦尔登斯特伦氏巨球蛋白血症、重链疾病、骨髓增生异常综合征、多毛细胞白血病和脊髓发育不良。
实体瘤为通常不包含囊肿或液体区的组织的异常肿块。实体瘤可为良性或恶性的。不同类型的实体瘤以形成它们的细胞类型命名(诸如肉瘤、癌和淋巴瘤)。实体瘤诸如肉瘤和癌的例子包括纤维肉瘤、粘液肉瘤、脂肪肉瘤间皮瘤、淋巴恶性肿瘤、胰腺癌卵巢癌、。
本发明的car-修饰t细胞也可用作对哺乳动物离体免疫和/或体内疗法的疫苗类型。优选地,哺乳动物为人。
对于离体免疫,以下中的至少一项在将细胞施用进入哺乳动物前在体外发生:i)扩增细胞(自体或异体的),ii)将编码car的核酸引入细胞,和/或iii)冷冻保存细胞。
离体程序在本领域中是公知的,并在以下更完全地进行讨论。简单地说,细胞(自体或异体的)从哺乳动物(优选人)中分离并用表达本文公开的car的载体进行基因修饰(即,体外转导或转染)。car-修饰的细胞可被施用给哺乳动物接受者,以提供治疗益处。哺乳动物接受者可为人,和car-修饰的细胞可相对于接受者为自体的。可选地,细胞可相对于接受者为同种异基因的、同基因的(syngeneic)或异种的。
除了就离体免疫而言使用基于细胞的疫苗之外,本发明也提供了体内免疫以引起针对患者中抗原的免疫应答的组合物和方法。
本发明提供了治疗肿瘤的方法,其包括施用给需要其的对象治疗有效量的本发明的car-修饰的t细胞。
本发明的car-修饰的t细胞可被单独施用或作为药物组合物与稀释剂和/或与其他组分诸如il-2、il-17或其他细胞因子或细胞群结合施用。简单地说,本发明的药物组合物可包括如本文所述的靶细胞群,与一种或多种药学或生理学上可接受载体、稀释剂或赋形剂结合。这样的组合物可包括缓冲液诸如中性缓冲盐水、硫酸盐缓冲盐水等等;碳水化合物诸如葡萄糖、甘露糖、蔗糖或葡聚糖、甘露醇;蛋白质;多肽或氨基酸诸如甘氨酸;抗氧化剂;螯合剂诸如edta或谷胱甘肽;佐剂(例如,氢氧化铝);和防腐剂。本发明的组合物优选配制用于静脉内施用。
本发明的药物组合物可以以适于待治疗(或预防)的疾病的方式施用。施用的数量和频率将由这样的因素确定,如患者的病症、和患者疾病的类型和严重度——尽管适当的剂量可由临床试验确定。
当指出“免疫学上有效量”、“抗肿瘤有效量”、“肿瘤-抑制有效量”或“治疗量”时,待施用的本发明组合物的精确量可由医师确定,其考虑患者(对象)的年龄、重量、肿瘤大小、感染或转移程度和病症的个体差异。可通常指出:包括本文描述的t细胞的药物组合物可以以104至109个细胞/kg体重的剂量,优选105至106个细胞/kg体重的剂量(包括那些范围内的所有整数值)施用。t细胞组合物也可以以这些剂量多次施用。细胞可通过使用免疫疗法中公知的注入技术(见例如rosenberg等,neweng.j.ofmed.319:1676,1988)施用。对于具体患者的最佳剂量和治疗方案可通过监测患者的疾病迹象并因此调节治疗由医学领域技术人员容易地确定。
对象组合物的施用可以以任何方便的方式进行,包括通过喷雾法、注射、吞咽、输液、植入或移植。本文描述的组合物可被皮下、皮内、瘤内、结内、脊髓内、肌肉内、通过静脉内(i.v.)注射或腹膜内施用给患者。在一个实施方式中,本发明的t细胞组合物通过皮内或皮下注射被施用给患者。在另一个实施方式中,本发明的t细胞组合物优选通过i.v.注射施用。t细胞的组合物可被直接注入肿瘤,淋巴结或感染位置。
在本发明的某些实施方式中,利用本文描述的方法或本领域已知的其他将t细胞扩展至治疗性水平的方法活化和扩展的细胞,与任何数量的有关治疗形式结合(例如,之前、同时或之后)施用给患者,所述治疗形式包括但不限于用以下试剂进行治疗:所述试剂诸如抗病毒疗法、西多福韦和白细胞介素-2、阿糖胞苷(也已知为ara-c)或对ms患者的那他珠单抗治疗或对牛皮癣患者的厄法珠单抗治疗或对pml患者的其他治疗。在进一步的实施方式中,本发明的t细胞可与以下结合使用:化疗、辐射、免疫抑制剂,诸如,环孢菌素、硫唑嘌呤、甲氨喋呤、麦考酚酯和fk506,抗体或其他免疫治疗剂。在进一步的实施方式中,本发明的细胞组合物与骨髓移植、利用化疗剂诸如氟达拉滨、外部光束放射疗法(xrt)、环磷酰胺结合(例如,之前、同时或之后)而施用给患者。例如,在一个实施方式中,对象可经历高剂量化疗的标准治疗,之后进行外周血干细胞移植。在一些实施方式中,在移植后,对象接受本发明的扩展的免疫细胞的注入。在一个额外的实施方式中,扩展的细胞在外科手术前或外科手术后施用。
施用给患者的以上治疗的剂量将随着治疗病症的精确属性和治疗的接受者而变化。人施用的剂量比例可根据本领域接受的实践实施。通常,每次治疗或每个疗程,可将1×106个至1×1010个本发明经修饰的t细胞(如,car-t细胞),通过例如静脉输注的方式,施用于患者。
本发明的主要优点包括:
(a)本发明的通用型car-t细胞可以用于异体肿瘤治疗。
(b)本发明通过敲除cart细胞表面tcr分子的表达,从而避免攻击受体正常细胞,使得安全性更有保障;
(c)本发明没有直接敲除cart细胞表面hla-i类分子,因此不会受到受体内nk细胞的攻击,在受体体内存活时间更长,疗效更佳;
(d)本发明通过敲除hla-i类分子的α3区域,使得受体t细胞表面cd8分子不被结合,因而tcr的激活减弱,避免了受体t细胞的攻击,在受体体内存活时间更长,疗效更佳。
(e)本发明的通用型car-t细胞可以大规模制备,质量均一稳定,随时可调用给任何患者使用。
下面结合具体实施例,进一步阐述本发明。应理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法,通常按照常规条件,或按照制造厂商所建议的条件。除非另外说明,否则百分比和份数按重量计算。
实施例1car的结构设计
以car19为例,进行car的构建。其中,car19结构使用二代cd19cars,包含来自fmc63的scfv,来自cd28的铰链和跨膜区,胞内段是cd28和cd3ζ,结构如图7所示。
car19的dna序列如下(seqidno.:1):
car19的氨基酸序列如下(seqidno.:2):
实施例2慢病毒载体构建
将cd19car克隆至fuw慢病毒载体骨架中,置于ef1α的启动子下,形成fuw-ef1α-cd19car;将fuw-ef1α-cd19car,pmd2.g和pspax2(addgene)三个质粒使用lipofectamine2000转入293t(atcc,crl-3216)中制备慢病毒表达载体,在第二天和第三天收集病毒上清,超离进行浓缩(merckmillipore)后获得病毒。
实施例3crispr-cas9系统构建
先在http://crispr.mit.edu网站上选择靶向tcr的保守区第一个外显子的sgrna序列及靶向hlaα3区域的sgrna,选择评分在80以上两个sgrna序列,敲除效率较高。在设计sgrna引物时,正向引物含有20bp的目标序列及前面加入t7启动子,20bp互补的序列作为反向引物,以px330质粒作为模板进行pcr,t7-pcr产物纯化后,并用做megashortscriptt7kit的模板得到的rna用megaclear柱进行纯化并用无rna水进行洗脱。cas9质粒购自addgene。同时使用surveyorassay和tide进行检测和分析所设计的sgrna敲除效率。结果表明,同时用两种sgrna敲除效率高于单用一种sgrna。本发明最终选择同时电转tcrsgrna、hlaα3sgrna和cas9质粒。
(1)tcr敲除
tcr由α和β两条链组成,通过设计靶向tcrα链保守区的第一个外显子的sgrna达到敲除tcr的目的。
sgrna序列如下:
trac-grna:ctggagggccctgagcagag(seqidno.:3)
trac-grna:gagcagcaggcaggttaggc(seqidno.:4)
(2)hlaα3敲除
mhci类分子由一条重链(α链,分为α1、α2和α3三个结构域)和一条轻链β微球蛋白组合而成。当α3敲除时,并不影响hla其他区域转运到膜表面,但α3敲除的hla不能与cd8分子结合,因而影响受体体内t细胞的活化。
sgrna序列如下:
α3-grna:ggtgggtcatatgtgtcttg(seqidno.:5)
α3-grna:cgagctccgtgtcctgggtc(seqidno.:6)
α3氨基酸序列(seqidno.:7):
dkthmthhsdhatrkwagyattwrdgdtdtvtragdgtkwaavvvsgrytchvhgktrw
实施例4cart细胞培养
4.1细胞分离与激活
获得的供体单采物获得后,使用histopaque-1077(sigma-aldrich)进行密度梯度离心,从供体单采物中分离单核细胞,富集t细胞,使用偶联anti-cd3/anti-cd28的磁珠激活培养和扩增t细胞。
cart细胞培养基使用x-vivo15(含5%fbs,2mml-glutamine,1mm丙酮酸钠,300iu/mlrhil2);所有细胞均置于37℃,5%co2恒温培养箱中培养。
cd19表达的细胞系:raji(burkitt’slymphomacellline,atcc-ccl86);k562cells(humanerythroleukemiccellline,atcc-ccl243),raji-ffluc细胞系使用fireflyluciferase的慢病毒感染raji细胞筛选后得到,以上细胞均使用rpmi1640培养基培养;293t(atcc-crl3216)使用dmem培养基培养。所有培养基均添加10%(v/v)胎牛血清和100u/ml的亲霉素和链霉素,2mm谷氨酰胺,1mm丙酮酸钠。
4.2慢病毒感染
分离纯化的原代t细胞在激活2天后,按moi(2-8)进行慢病毒载体感染,转移至细胞培养瓶,置于37℃,5%co2恒温培养箱中培养。
4.3电转
在病毒感染后第二天,去病毒后,收集电转所需的细胞置于离心管内,300g,5min离心后,dpbs洗涤2次,然后用opti-mem重悬至细胞密度为1-3×108/ml,根据细胞的密度计算所需的cas9/sgrna的量,各30ug/ml。取所需的cas9与sgrna,并按一比一混合,室温孵育10min后用加入到电转缓冲液中与细胞混合后加入到电极杯中,用4d-nucleofectorsystemn(lonza)电转系统,选择programeo-115程序进行电转。电转结束后,用已经预热的培养基重悬细胞密度至1-2×106/ml,并转移至相应的培养皿中,并置于37℃,5%co2培养箱中继续培养。
4.4细胞增殖及car阳性率检测
感染后第3天取样检测细胞数量及gfp阳性细胞得占比,即检测t细胞的car阳性率,同时用cd3抗体进行负筛选,cd3阴性的细胞为所需细胞,收集后置于培养箱中继续培养,每隔2-3天更换一半培养基,培养至14天后即可进行细胞数量、car-t细胞阳性率检测和tcr表达检测。
结果显示,所得细胞扩增倍率大于1000倍;检测后tcr阴性率达到99.9%以上,即hla-/-的t细胞比例达到99.9%以上;而car+阳性率达到50%以上。
实施例5细胞因子释放检测
将cd19car-t及tcr-/-hlaα3-/-cd19cart与肿瘤细胞1:1混合,置于rpmi培养基中,各细胞密度配制为1x106/ml,car-t细胞与肿瘤细胞各100ul,置于96孔板中,共培养过夜,收集上清,离心后取上清检测细胞因子ifn-γ与il2的释放水平,采用elisa试剂盒(biolegend)进行检测。
结果表明,被效应细胞刺激后,cd19car-t及tcr-/-hlaα3-/-cd19cart细胞都能大量分泌ifn-γ与il-2,两组间无显著差异。
实施例6细胞体外杀伤
通过将荧光素酶基因转入靶细胞,克隆筛选后获得稳转细胞株。进行实验时,加入荧光素底物,荧光素酶与荧光素反应即可产生荧光,通过检测荧光的强度可以测定荧光素酶的活性,检测靶细胞的存活比率,即可得到cart细胞的杀伤效应。
结果显示,cd19cart及tcr-/-α3-/-cd19cart细胞与对照组t细胞相比具有较强的靶细胞杀伤效果,cd19cart及tcr-/-α3-/-cd19cart组间无显著差异。
实施例7体内药效研究
选取6-12周大的nod-prkdcscidil2rgnull(npg)小鼠,腹腔注射2×105raji-ffluc细胞,50μldpbs和50μlmatrigelmatrix(corning)。两天后检测肿瘤移植物的负荷,分成肿瘤负荷相当的4组,分组后一天分别注射200uldpbs/mouse,5×106tcells/mouse,5×106cd19car-tcells/mouse,5x106tcr-/-α3-/-cd19cartcells/mouse,cart处理后7天后评估小鼠肿瘤负荷,腹腔注射3mgd-luciferinpermice反应四分钟,使用xenogenivisimagingsystem拍照,曝光30s。
结果显示,cd19cart及tcr-/-α3-/-cd19cart组小鼠肿瘤负荷量显著减少,两组间无显著差异。
实施例8体内gvhd实验
实验开始前,小鼠使用全身亚致死剂量辐照(175cgy)处理。使用fbs重悬t/tcr敲除的cart细胞,并注射进处理后的小鼠胸腔。使用gvhd临床标准检测小鼠,每周检测2-3次,临床指标包括:体重丢失、弓背、活跃、毛皮纹理、皮肤完整性。
结果显示,未敲除tcr的细胞小鼠都发生gvhd而致死,而tcr-/-α3-/-cd19cart细胞组未检测到gvhd反应。
实施例9体外hvg实验
将辐照过的tcr-/-α3-/-cd19cart及t细胞与异体t细胞及nk细胞1:1孵育过夜,检测细胞的凋亡及细胞因子释放(il-2、ifn-r)。
结果显示,相比对照组,tcr-/-α3-/-cd19cart细胞凋亡及细胞因子释放显著低于t细胞组。
在本发明提及的所有文献都在本申请中引用作为参考,就如同每一篇文献被单独引用作为参考那样。此外应理解,在阅读了本发明的上述讲授内容之后,本领域技术人员可以对本发明作各种改动或修改,这些等价形式同样落于本申请所附权利要求书所限定的范围。
序列表
<110>亘喜生物科技(上海)有限公司
<120>通用型嵌合抗原受体t细胞制备技术
<130>p2017-1755
<160>7
<170>siposequencelisting1.0
<210>1
<211>1470
<212>dna
<213>人工序列(artificialsequence)
<400>1
atgcttctcctggtgacaagccttctgctctgtgagttaccacacccagcattcctcctg60
atcccagacatccagatgacacagactacatcctccctgtctgcctctctgggagacaga120
gtcaccatcagttgcagggcaagtcaggacattagtaaatatttaaattggtatcagcag180
aaaccagatggaactgttaaactcctgatctaccatacatcaagattacactcaggagtc240
ccatcaaggttcagtggcagtgggtctggaacagattattctctcaccattagcaacctg300
gagcaagaagatattgccacttacttttgccaacagggtaatacgcttccgtacacgttc360
ggaggggggactaagttggaaataacaggctccacctctggatccggcaagcccggatct420
ggcgagggatccaccaagggcgaggtgaaactgcaggagtcaggacctggcctggtggcg480
ccctcacagagcctgtccgtcacatgcactgtctcaggggtctcattacccgactatggt540
gtaagctggattcgccagcctccacgaaagggtctggagtggctgggagtaatatggggt600
agtgaaaccacatactataattcagctctcaaatccagactgaccatcatcaaggacaac660
tccaagagccaagttttcttaaaaatgaacagtctgcaaactgatgacacagccatttac720
tactgtgccaaacattattactacggtggtagctatgctatggactactggggtcaagga780
acctcagtcaccgtctcctcagcggccgcaattgaagttatgtatcctcctccttaccta840
gacaatgagaagagcaatggaaccattatccatgtgaaagggaaacacctttgtccaagt900
cccctatttcccggaccttctaagcccttttgggtgctggtggtggttgggggagtcctg960
gcttgctatagcttgctagtaacagtggcctttattattttctgggtgaggagtaagagg1020
agcaggctcctgcacagtgactacatgaacatgactccccgccgccccgggcccacccgc1080
aagcattaccagccctatgccccaccacgcgacttcgcagcctatcgctccagagtgaag1140
ttcagcaggagcgcagacgcccccgcgtaccagcagggccagaaccagctctataacgag1200
ctcaatctaggacgaagagaggagtacgatgttttggacaagagacgtggccgggaccct1260
gagatggggggaaagccgagaaggaagaaccctcaggaaggcctgtacaatgaactgcag1320
aaagataagatggcggaggcctacagtgagattgggatgaaaggcgagcgccggaggggc1380
aaggggcacgatggcctttaccagggtctcagtacagccaccaaggacacctacgacgcc1440
cttcacatgcaggccctgccccctcgctaa1470
<210>2
<211>489
<212>prt
<213>人工序列(artificialsequence)
<400>2
metleuleuleuvalthrserleuleuleucysgluleuprohispro
151015
alapheleuleuileproaspileglnmetthrglnthrthrserser
202530
leuseralaserleuglyaspargvalthrilesercysargalaser
354045
glnaspileserlystyrleuasntrptyrglnglnlysproaspgly
505560
thrvallysleuleuiletyrhisthrserargleuhisserglyval
65707580
proserargpheserglyserglyserglythrasptyrserleuthr
859095
ileserasnleugluglngluaspilealathrtyrphecysglngln
100105110
glyasnthrleuprotyrthrpheglyglyglythrlysleugluile
115120125
thrglyserthrserglyserglylysproglyserglygluglyser
130135140
thrlysglygluvallysleuglngluserglyproglyleuvalala
145150155160
proserglnserleuservalthrcysthrvalserglyvalserleu
165170175
proasptyrglyvalsertrpileargglnproproarglysglyleu
180185190
glutrpleuglyvaliletrpglysergluthrthrtyrtyrasnser
195200205
alaleulysserargleuthrileilelysaspasnserlyssergln
210215220
valpheleulysmetasnserleuglnthraspaspthralailetyr
225230235240
tyrcysalalyshistyrtyrtyrglyglysertyralametasptyr
245250255
trpglyglnglythrservalthrvalserseralaalaalaileglu
260265270
valmettyrproproprotyrleuaspasnglulysserasnglythr
275280285
ileilehisvallysglylyshisleucysproserproleuphepro
290295300
glyproserlysprophetrpvalleuvalvalvalglyglyvalleu
305310315320
alacystyrserleuleuvalthrvalalapheileilephetrpval
325330335
argserlysargserargleuleuhisserasptyrmetasnmetthr
340345350
proargargproglyprothrarglyshistyrglnprotyralapro
355360365
proargaspphealaalatyrargserargvallyspheserargser
370375380
alaaspalaproalatyrglnglnglyglnasnglnleutyrasnglu
385390395400
leuasnleuglyargarggluglutyraspvalleuasplysargarg
405410415
glyargaspproglumetglyglylysproargarglysasnprogln
420425430
gluglyleutyrasngluleuglnlysasplysmetalaglualatyr
435440445
sergluileglymetlysglygluargargargglylysglyhisasp
450455460
glyleutyrglnglyleuserthralathrlysaspthrtyraspala
465470475480
leuhismetglnalaleuproproarg
485
<210>3
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>3
ctggagggccctgagcagag20
<210>4
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>4
gagcagcaggcaggttaggc20
<210>5
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>5
ggtgggtcatatgtgtcttg20
<210>6
<211>20
<212>dna
<213>人工序列(artificialsequence)
<400>6
cgagctccgtgtcctgggtc20
<210>7
<211>59
<212>prt
<213>智人(homosapiens)
<400>7
asplysthrhismetthrhishisserasphisalathrarglystrp
151015
alaglytyralathrthrtrpargaspglyaspthraspthrvalthr
202530
argalaglyaspglythrlystrpalaalavalvalvalserglyarg
354045
tyrthrcyshisvalhisglylysthrargtrp
5055
- 还没有人留言评论。精彩留言会获得点赞!