促进多能干细胞分化为心肌细胞成熟的方法与流程
本发明涉及细胞培养技术领域,尤其涉及一种促进多能干细胞分化为心肌细胞成熟的方法。
背景技术:
根据《中国心血管病报告2015》,2014年心血管病死亡率仍居首位,每5例死亡中就有2例死于心血管病。与1990年相比,2013年心血管病死亡的绝对数字增加了46%;其中,缺血性心脏病死亡人数增加了90.9%。冠状动脉堵塞造成的缺血和随后的再灌注会引起不可逆的细胞损伤,造成心肌细胞坏死,心脏收缩功能下降。由于成体心肌细胞缺乏再生能力,无法修复坏死心肌,细胞移植可能成为缺血性心脏病的有效治疗途径。目前,尽管间充质干细胞对心肌梗死病人心功能改善有积极作用,但其在体内分化为心肌细胞的能力有限,长期效果不佳,因此需要更为有效的种子干细胞。胚胎发育过程为干细胞定向分化提供了重要线索,在过去的几年中,通过操控心脏发育关键通路,在心肌定向分化方面取得了重要进展。
尽管目前有许多诱导心肌的方法,诱导心肌的效率也相对较高,但是这些心肌细胞表现出明显的不成熟表型,移植到动物体内致心率失常、收缩力减弱。目前,诱导心肌细胞的方法尽管是不断通过优化细胞因子和抑制剂的组合及浓度,可以高效诱导心肌细胞,但是这些心肌细胞仍存在成熟度不够,并且成熟程度不均一,存在肌丝排列不整齐等现象。而且心肌分化的最终目的是细胞移植,当前多能干细胞分化的心肌细胞是一个混合体,主要包括心室肌细胞、心房肌细胞和起搏肌细胞,在细胞移植后会增加心律失常的风险。目前在非人灵长类动物的实验中表明,心肌细胞的移植会导致心律失常的发生,其主要有两方面原因:1)移植的心肌细胞不能有效与宿主细胞偶联;2)心肌细胞的不均一性,成熟度低,移植到动物体内收缩力不足。
总之,目前关于诱导心肌的成熟技术的缺点主要有以下几个方面:(1)现有的分化方法仍不成熟,表现为细胞不均一、成熟度不够、分化效率不稳定;(2)分化的心肌细胞纯度低、安全性较低、均一性差;(3)干细胞分化的心肌细胞作为心肌修复和替代治疗的种子细胞,但是这些干细胞诱导成的心肌细胞发育不完全,移植到动物体内存在短暂的收缩功能。
视黄酸(ra,retinoicacid,all-trans-ra)是来源于视黄醇(retinol,又称维生素a,vitamina)的形态发生素,在细胞生长、分化和器官发生过程中发挥重要作用。过去研究的是视黄酸(ra)通路在心脏发育过程中发挥重要作用,ra缺失会导致心房变小、心室小梁减少、心肌壁增厚且细胞间连接松散。在体外心肌定向分化过程中,ra多用于促进多潜能干细胞向心房分化。深入研究ra在多能干细胞诱导成心肌细胞过程中的作用,有利于促进心肌细胞的成熟,这个研究目前还没有报道。
技术实现要素:
为解决上述技术问题,本发明的目的是提供一种促进多能干细胞分化为心肌细胞成熟的方法,本发明的方法简单、稳定高效,能有效促进多能干细胞分化为心肌细胞成熟。
本发明提供了一种促进多能干细胞分化为心肌细胞成熟的方法,包括以下步骤:
(1)在第0~1天对传代培养至4~5代的多能干细胞进行诱导分化,所使用的培养基中含有2~15μm的gsk-3抑制剂;
(2)在第2~3天使用培养基继续诱导分化;
(3)在第4~5天使用含有2~10μm的wnt抑制剂的培养基继续进行诱导分化;
(4)第7天以后利用培养基对细胞进行诱导分化,第9~10天能观察到心肌细胞的跳动;
(5)在第14~20天使用含有0.2~5μm视黄酸的培养基继续诱导分化,以后利用培养基对细胞进行诱导分化培养;其中,
在第1~6天,使用的培养基为第一诱导分化培养基,所述第一诱导分化培养基包括rpmi-1640基础培养基、不含胰岛素的细胞培养添加剂b27(简称b27-insulin);在第7天以后,使用的培养基为第二诱导分化培养基,所述第二诱导分化培养基包括rpmi-1640基础培养基以及含胰岛素的细胞培养添加剂b27(简称b27);或者
在整个诱导分化过程中,使用的培养基为cdm3诱导分化培养基或无血清的诱导分化培养基,所述cdm3诱导分化培养基包括rpmi-1640基础培养基、血清白蛋白、抗坏血酸和双抗。
进一步地,多能干细胞为胚胎干细胞(esc)或诱导多潜能干细胞(ipsc)。
进一步地,在步骤(1)之前,还包括使用mtesr1或e8等维持培养基培养所述多能干细胞的步骤,当细胞密度达到80~85%时,对细胞进行传代培养。
进一步地,gsk-3抑制剂为chir99021。优选地,gsk-3抑制剂的浓度为5μm。
进一步地,在步骤(1)中,还包括将传代培养至4~5代的多能干细胞以104/cm2的密度接种至培养皿中,然后培养至细胞密度达85%以上时,再进行诱导分化的步骤。
进一步地,在步骤(3)中,wnt抑制剂为iwr-1、iwp-2、iwp-4和c59中的一种。优选地,wnt抑制剂为iwr-1。优选地,wnt抑制剂的浓度为5μm。
优选地,在步骤(5)中,视黄酸的浓度为1μm。
进一步地,第一诱导分化培养基中b27-insulin的质量分数为2%。
进一步地,第二诱导分化培养基中b27的质量分数为2%。
进一步地,cdm3诱导分化培养基中血清白蛋白的浓度为450μg/ml,抗坏血酸的浓度为192μg/ml。
进一步地,细胞培养均在37℃、5%co2的条件下进行。
进一步地,血清白蛋白为牛血清白蛋白、人血清白蛋白等。
进一步地,采用本发明的方法诱导多能干细胞的分化为心肌细胞,在第30天获得成熟的心肌细胞。
借由上述方案,本发明至少具有以下优点:
在多能干细胞向心肌细胞分化的过程中,本发明在分化第14~20天添加特定浓度的小分子化合物视黄酸,能有效的促进心肌细胞的成熟,与对照组相比,肌小节排列整齐,收缩力增强,趋向成熟,更接近于成人样的心肌细胞表型。因此本发明的方法是一种创新性的诱导心肌成熟的方式,能有效的解决心肌细胞成熟度低的问题,同时可以为临床疾病治疗和药物筛选提供有效的成熟的心肌细胞,从而为临床级细胞的获得和细胞移植提供重要参考。
上述说明仅是本发明技术方案的概述,为了能够更清楚了解本发明的技术手段,并可依照说明书的内容予以实施,以下以本发明的较佳实施例并配合附图详细说明如下。
附图说明
图1为qpcr检测本发明的方法与对照组方法中hes3细胞分化的心肌细胞主要的结构性和功能性成熟的基因表达测试结果;
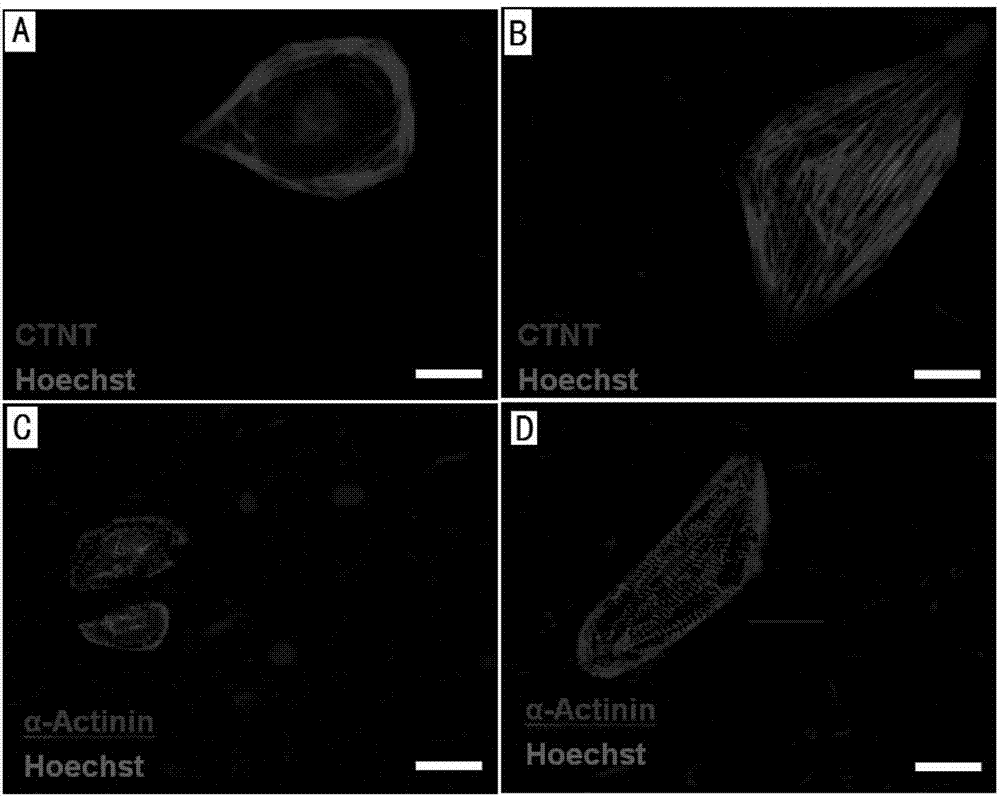
图2为免疫荧光检测本发明的方法与对照组方法中hes3细胞分化的心肌细胞的肌丝和肌节变化结果(n=30-50);
图3为本发明的方法与对照组方法中的hes3细胞分化的心肌细胞的ph值变化情况的光学照片;
图4为本发明的方法与对照组方法中的scctm-ipsc-1细胞分化的心肌细胞的电生理学指标膜片钳的测试结果。
具体实施方式
下面结合附图和实施例,对本发明的具体实施方式作进一步详细描述。以下实施例用于说明本发明,但不用来限制本发明的范围。
如无特殊说明,本发明以下实施例中,第一诱导分化培养基包括rpmi-1640基础培养基、2%的不含胰岛素的细胞培养添加剂b27,简称为rpmi1640+b27-insulin;第二诱导分化培养基包括rpmi-1640基础培养基以及2%的含胰岛素的细胞培养添加剂b27,简称为rpmi1640+b27。
实施例1胚胎干细胞的培养、传代
本实施例以hpscs中的hes3细胞系作为实验对象,hes3细胞生长在matrigel基质胶包被的培养皿上,以1:200dmem/f12基础培养基稀释使用。然后将hes3细胞种植在基质胶上,使用mtesr1或e8培养基进行细胞培养,每天换液。待hes3细胞密度达到80%左右,细胞克隆足够大的情况下,进行细胞传代。
传代时,先用dpbs洗涤2次,去除表面死掉的细胞碎片,加入0.1mol/ledta置于37℃、5%co2的恒温培养箱中消化7分钟。消化时间到了之后,在倒置显微镜下观察贴壁细胞间出现间隙但尚未相互分离,肉眼观察到细胞集落变得不透明且发白,吸去消化液,加入干细胞培养基,用移液器扇形吹打培养皿底部,使皿底贴附的干细胞脱落,轻柔缓慢吹打均匀制成细胞悬液。一般以1:10或1:12的比例接种到用基质胶包被的培养皿中,以后每4天传代一次。
实施例2胚胎干细胞定向诱导分化为成熟的心肌细胞
将培养传代至4~5代的hes3细胞用dpbs洗涤后,0.1mol/ledta消化7分钟,以104/cm2的密度接种于培养皿中,置于37℃、5%co2培养箱培养4天,细胞密度达到85%以上,换成rpmi1640+b27-insulin诱导培养基。
视黄酸处理组(ra组):第0~1天诱导分化是利用内含5μmchir99021的rpmi1640+b27-insulin进行诱导分化,第2~3天使用rpmi1640+b27-insulin培养;在第4~5天利用含有5μm的wnt抑制剂的rpmi1640+b27-insulin培养。第6天只使用rpmi1640+b27-insulin培养。第7天以后每天用rpmi1640+b27培养,诱导分化第9~10天(d9~d10)时能观察到明显的心肌跳动,第14~20天时换成含有1μm视黄酸(ra)的rpmi1640+b27诱导分化培养基培养对细胞进行培养,在第30天检测心肌细胞的一些成熟指标。
设置对照组(dmso组),其培养过程同上述步骤,区别在于第14~20天添加与处理组溶液等体积的内含dmso的诱导培养基进行培养。
在心肌细胞诱导过程中,ra在第14~20天进行处理,然后第30天收取细胞,提rna,通过实时荧光定量pcr(qpcr)仪进行检测主要的结构性和功能性成熟的基因表达。通过检测这些结构型及离子通道型基因在mrna水平上的表达,ra组与dmso组相比,这些基因均表现出明显的上调趋势,并且差异显著,结果如图1所示。这说明在诱导整个心肌分化的过程中,通过在特定时间特定浓度下添加ra,有利于促进心肌细胞的成熟,进而为临床疾病治疗及药物筛选提供有效的成熟心肌细胞。
通过免疫荧光染色鉴定心肌细胞特异性的心肌肌钙蛋白ctnt和辅肌动蛋白α-actinin的表达。将诱导分化的心肌细胞用0.25%胰酶消化传代到confocol皿。细胞贴壁两天,然后开始实验。先用pbs清洗细胞两次;采用4%pfa(多聚甲醛)固定15min;使用pbst清洗3次,每次5min;用0.5%tritonx-100在室温下透膜10分钟;5%bsa室温封闭1h;孵一抗4℃过夜,抗体比例为ctnt1:200,α-actinin1:200;pbst清洗3次,每次5min;孵二抗,室温避光1h,抗体比例均为1:600;pbst清洗3次,每次5min;添加hoechst染色,室温20min;pbst清洗3次,每次5min;封片,镜检。结果如图2所示,其中,图2a、b分别为dmso组、ra组的ctnt表达结果(scalebar=20μm),图2c、d分别为dmso组、ra组的α-actinin的表达结果(scalebar=20μm),结果表明,通过视黄酸处理后,心肌细胞的肌丝明显变长、排列有序,心肌细胞具有明显的肌小节且整齐排列。
心肌细胞的ph值变化测试:ra组与dmso组的培养基各取1ml于离心管中,然后拍照。处理前,dmso和ra组的颜色为粉红色,处理后,dmso组的颜色呈橙色,ra组的颜色呈黄色,结果表明,视黄酸处理后的心肌细胞的培养基颜色其酸度值更高,代谢更加旺盛,后续可能会利用细胞能量代谢仪检测其具体代谢过程,结果如图3所示。
实施例3诱导多潜能干细胞的培养、传代及定向诱导
本实施例将实施例1和2中的hes3细胞换成hpscs中的scctm-ipsc-1细胞系作为实验对象,其它具体实施方式参照实施例1和2。
利用膜片钳记录心室肌细胞的动作电位的变化。第30天的心肌细胞用0.25%胰酶消化5min,单细胞铺板,贴壁3天,进行检测,包括心肌细胞的跳动频率、动作电位振幅、上行速度和超极化舒张电位等。根据实验结果表明scctm-ipsc-1细胞诱导的心肌细胞结果如图4所示,图4a、b、c依次为dmso组心肌细胞的测试结果、ra组心肌细胞的测试结果、单频次下的检测结果对比图。经视黄酸处理后的心肌细胞,与对照相比,跳动频率减慢、动作电位振幅(apa)增大、具有较高的上行速度(dv/dt)和超级化的最大舒张压(mdp)。
以上所述仅是本发明的优选实施方式,并不用于限制本发明,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和变型,这些改进和变型也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!