一种3D打印可降解微球的制备方法及其在构建功能性体外微组织中的应用与流程
本发明涉及生物制造和组织工程技术领域,具体涉及一种基于3d生物打印技术的可降解微球的制备方法及其在构建功能性体外微组织中的应用。
背景技术:
目前,生物微球的生产和应用主要集中于药用方面,常作为药物载体用于药物在体内的递送与缓释。与药用微球不同,用于组织工程的微球通常作为细胞支架,为细胞提供粘附和生长的载体。因此,用于组织工程的微球应具有良好的生物相容性和可降解性。现有技术中的微球制备方法主要包括乳化分散法、凝聚法和聚合法。其中,乳化分散法与凝聚法均利用制备油/水两相分散乳剂,通过固化、蒸发的方式将两相分离制得微球;聚合法是将材料单体通过反应聚合,从而形成微球。上述制备方法虽然较为简单易行,可快速制备大量微球,然而,制备的微球粒径大小通常难以控制,微球形态的一致性较差。且在制备过程中使用的有机溶剂与反应引发剂难以通过分离去除干净,对粘附细胞的正常生物活性具有较大影响。上述制备方法存在的问题限制了微球在组织工程中的应用。为了克服上述问题,使得制备的微球满足组织工程中构建功能性体外微组织的应用需要,开发能够制备粒径和形态精确可控且均一性高的可降解微球的制备方法具有重要的意义。
技术实现要素:
为解决现有技术中生物微球制备方法存在的技术问题,满足生物微球在组织工程中的应用需要,本发明的目的在于提供一种利用生物3d打印技术制备可降解微球的方法及其在构建功能性体外微组织中的应用。
为实现上述目的,本发明的技术方案如下:本发明根据功能性体外微组织构建对于作为细胞粘附或支持载体的材料的要求,基于天然生物水凝胶材料的良好生物相容性和可降解性,选择天然生物水凝胶材料作为可降解微球的制备材料,根据天然生物水凝胶材料的特性开发了水凝胶微球的3d打印方案,实现了制备微球的粒径的精确控制和均一性;为提高3d打印制备的水凝胶微球的稳定性,进一步使用交联剂对打印微球进行交联反应处理,显著提高了微球的力学性能,使其能够满足构建功能性体外微组织的需要。由于水凝胶材料的可降解性,在水凝胶微球用于制备体外微组织时,可通过加入水凝胶材料对应的降解剂,实现了可控化水凝胶材料的降解,满足了组织工程中需要降解细胞粘附载体、形成特定仿生空间结构的需求。
本发明提供一种3d打印可降解微球的制备方法,包括:制备生物可降解水凝胶,3d打印制备水凝胶微滴,水凝胶微滴发生交联反应制备水凝胶微球。
为更好地满足体外微组织的制备需要,用于制备微球的水凝胶材料应具有良好的成形性和力学性能,作为优选,所述生物可降解水凝胶包括海藻酸钠水凝胶、透明质酸水凝胶、胶原水凝胶、纤维蛋白水凝胶、壳聚糖水凝胶、琼脂糖水凝胶中的一种或多种。
本发明中,所述交联反应包括物理交联或化学交联;所述物理交联包括光交联、热致交联或辐射交联等;所述化学交联包括离子交联、共混交联等。
为了使得制备的水凝胶微球具有更高的稳定性和力学性能,作为优选,所述交联反应为化学交联;所述化学交联为通过加入交联剂进行交联反应。
所述交联剂包括钙盐、钡盐、过氧化氢、凝血酶、京尼平、戊二醛中的一种或多种。
本领域技术人员可以根据用于制备所述生物可降解水凝胶的生物可降解高分子材料的不同,选择相应的交联剂,例如:当所述生物可降解高分子材料为海藻酸钠时,所述交联剂为钙盐、钡盐、京尼平或戊二醛;当所述生物可降解高分子材料为透明质酸时,所述交联剂为过氧化氢;当所述生物可降解高分子材料为纤维蛋白时,所述交联剂为凝血酶;当所述生物可降解高分子材料为壳聚糖或琼脂糖时,所述交联剂为京尼平或戊二醛。
本发明中,所述生物可降解水凝胶的制备原料包括生物可降解高分子材料,适宜的水凝胶浓度有利于提高水凝胶微球的力学性能,作为优选,所述制备原料中,所述生物可降解高分子材料的质量体积百分含量为0.2%~15%;更优选为0.2%~8%。
本发明中,所述生物可降解水凝胶的制备原料还包括溶剂或还包括溶剂和用于构建功能性体外微组织的细胞。
作为优选,所述细胞包括组织器官实质细胞、间质细胞、癌细胞中的一种或多种。
所述制备原料中,所述用于构建体外微组织的细胞浓度可以根据细胞的增殖速度和水凝胶材料的降解速度确定;以构建体外肿瘤组织海藻酸钠水凝胶微球为例,所述制备原料中,所述肿瘤细胞的浓度为105~106个/ml。
作为本发明的一种实施方式,所述生物可降解水凝胶为将所述生物可降解高分子材料充分溶解于溶剂中制备得到。
作为本发明的另一种实施方式,所述生物可降解水凝胶为将所述生物可降解高分子材料充分溶解于溶剂中,加入用于构建功能性体外微组织的细胞后混匀得到。
本发明以海藻酸钠水凝胶、透明质酸水凝胶和纤维蛋白水凝胶为例,利用3d打印制备可降解微球。
作为本发明的一种实施方式,当所述生物可降解高分子材料为海藻酸钠时,所述制备原料中,海藻酸钠的质量体积百分含量为1%~5%。作为优选,所述交联剂为钙盐或钡盐;所述交联剂的浓度为80~400mmol/l。
作为本发明的另一种实施方式,当所述生物可降解高分子材料为透明质酸时,所述制备原料中,所述透明质酸的质量百分含量为0.2%~0.4%。作为优选,所述交联剂为过氧化氢,以过氧化物酶为催化剂;所述交联剂的浓度为4~8mmol/l;所述催化剂的浓度为4~8u/ml。
作为本发明的另一种实施方式,当所述生物可降解高分子材料为纤维蛋白原时,所述制备原料中,所述纤维蛋白原的质量体积百分含量为4%~8%。作为优选,所述交联剂为凝血酶;所述交联剂的浓度为10-20u/ml。
为提高水凝胶微球的粒径和形态的均一性,所述3d打印采用异质细胞三维打印机的交变滞惯力打印喷头。
作为优选,所述3d打印以所述生物可降解水凝胶为打印原料,采用异质细胞三维打印机的交变滞惯力打印喷头,配合手工拉制的玻璃微喷管,打印得到水凝胶微滴,在所述水凝胶微滴中加入所述交联剂进行交联反应,得到所述可降解微球。
所述可降解微球的粒径大小为通过玻璃微喷管的喷口直径控制。根据打印微球所需的粒径大小,可以在手工拉制过程中自主设置微喷管的喷口直径,通过改变玻璃微喷管的喷口直径控制打印微球的粒径大小。
为提高水凝胶微球的粒径和形态的均一性,作为优选,所述3d打印的打印参数如下:温度4~20℃,采用5hz脉冲波形驱动喷头振荡、采样率5msa/s、振幅10vpp、每秒振荡两次;每振荡一次,打印机运动平台位移300μm一次。
本发明进一步提供上述制备方法制备的用于构建功能性体外微组织的可降解微球。
在此基础上,本发明提供利用上述制备方法制备的可降解微球在在构建功能性体外微组织中的应用。
所述功能性体外微组织可以为任意基于体外三维细胞培养模型构建的模块化体外微组织;包括但不限于体外三维肺泡模型、血管化组织、肿瘤模型。
进一步地,本发明提供一种构建功能性体外微组织的方法,为利用本发明所述的可降解微球的制备方法制备得到的可降解微球构建功能性体外微组织;
根据所构建的功能性体外微组织的结构,可以选择在利用本发明所述方法构建的含有组织细胞或不含组织细胞的可降解微球的表面进一步包覆细胞。或者,在可降解微球的表面包覆细胞后,加入降解剂将可降解微球降解,形成体外微组织的三维空间结构。
作为优选,所述构建功能性体外微组织的方法包括:在所述可降解微球表面包覆组织细胞,经培养后加入降解剂进行可降解微球的可控降解。
所述细胞包括组织器官实质细胞、间质细胞、癌细胞中的一种或多种。
所述降解剂包括分子解离剂、离子螯合剂、水解剂、酶所述降解剂包括分子解离剂、离子螯合剂、水解剂、酶中的一种或多种。
当选择不同的水凝胶材料时,需要选择与其对应的降解剂,作为本发明的一种实施方式,当所述生物可降解水凝胶为海藻酸钠水凝胶时,所述降解剂为柠檬酸钠。
根据不同结构的体外功能化微组织的构建需要,可以通过调整降解剂与制备水凝胶微球的水凝胶材料的浓度比,实现水凝胶微球不同速度与程度的降解。
例如:通过调整柠檬酸钠与可降解微球制备原料海藻酸钠的浓度比例(如1:1、1:2、1:4、3:4等),海藻酸钠水凝胶可按照不同速率降解,降解时间为3天~21天,进而实现水凝胶微球的可控降解。
本发明制备的生物可降解微球可广泛用于构建体外功能化微组织,包括但不限于体外三维肺泡模型、血管化组织、肿瘤模型等。
本发明的有益效果在于:
(1)本发明结合生物制造和组织工程技术,通过选择具有较好的力学性能、成型性、生物相容性和降解性的天然可降解水凝胶材料,提供了一种利用3d打印技术制备生物可降解微球的方法。
(2)本发明利用3d生物打印技术实现了由生物可降解水凝胶材料形成具有良好生物相容性、降解性和力学性能的水凝胶微球的快速制造,与采用传统的微球制备方法得到的微球相比,本发明提供的方法制备的水凝胶微球的粒径更加精确可控、且粒径和形态的均一性更高,具有更优异的力学性能,适用于构建不同尺度下的功能性体外微组织;利用本发明提供的方法制备的微球制备的体外微组织具有良好的生物学性能,在组织工程领域具有良好的应用价值。
附图说明
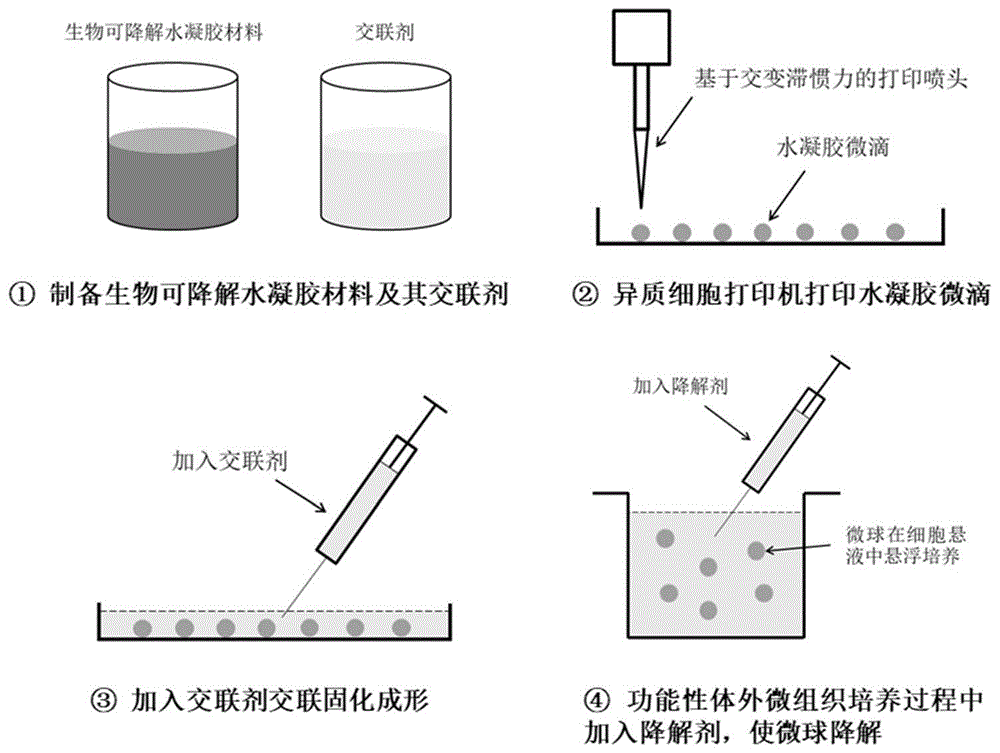
图1为本发明实施例1和实施例2中涉及的生物可降解微球和功能性体外微组织的制备流程图。
图2为本发明实施例1中利用交变滞惯力3d打印技术制备水凝胶微球的实物图。
具体实施方式
下面将结合实施例对本发明的优选实施方式进行详细说明。需要理解的是以下实施例的给出仅是为了起到说明的目的,并不是用于对本发明的范围进行限制。本领域的技术人员在不背离本发明的宗旨和精神的情况下,可以对本发明进行各种修改和替换。
实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。
所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购买得到的常规产品。
实施例1用于构建功能性体外微组织的生物可降解微球的制备
本实施例以天然可降解水凝胶材料——海藻酸钠水凝胶为原料制备可降解微球为例,提供一种用于构建功能性体外微组织的生物可降解微球的制备方法(制备流程如图1所示),具体包括如下步骤:
1、海藻酸钠水凝胶材料的制备
(1)海藻酸钠溶液的制备:
①以配制100ml浓度为1%的海藻酸钠溶液为例,称取1g海藻酸钠粉末溶解于100ml的0.9%无菌氯化钠水溶液中,置于70℃烘箱中反复加热冷却三次,每次30分钟,以达到灭菌的目的。然后置于70℃烘箱中至少6小时,以保证海藻酸钠充分溶解。制备的海藻酸钠溶液置于4℃冰箱中储存。
②当水凝胶微球作为微组织中细胞增殖的生物支架时,生物可降解水凝胶作为牺牲材料。需要在制备海藻酸钠水凝胶溶液时加入用于构建微组织的细胞,根据用于构建微组织的细胞的增殖速度和水凝胶材料降解速度选取合适的细胞密度。以构建体外肿瘤组织微球为例,在上述制备的海藻酸钠溶液中加入肿瘤细胞,使得肿瘤细胞的浓度为105~106个/ml。
(2)交联剂氯化钙溶液的制备:海藻酸钠分子能够与二价金属离子(如钙离子)等螯合,发生离子交联反应。本实施例以氯化钙作为交联剂。交联剂的制备方法如下:配制100ml浓度100mm的氯化钙溶液:称取1.11克氯化钙粉末充分溶解于无菌水中,定容至100ml,使用0.22μm过滤头过滤溶液以除菌,制备的氯化钙溶液置于4℃冰箱中储存。
2、3d生物打印制备水凝胶微球
3d打印所使用设备为异质细胞打印机以及交变滞惯力打印喷头(所用的异质细胞打印机以及交变滞惯力打印喷头参见cn201510455765.9),配合手工拉制的玻璃微喷管。根据打印微球所需的粒径大小,可以在拉制过程中自主设置微喷管的喷口直径,通过改变玻璃微喷管的喷口直径改变打印微球的粒径大小。本实施例分别制备喷口直径为100μm和200μm的手工拉制的玻璃微喷管。
利用200μm的玻璃微喷管和上述①中制备的海藻酸钠溶液打印粒径为200μm的海藻酸钠水凝胶微球;利用100μm的玻璃微喷管和上述②中制备的含有肿瘤细胞的海藻酸钠溶液打印粒径为100μm的含有肿瘤细胞的海藻酸钠水凝胶微球,3d打印的具体方法如下:
(1)打印参数与程序:异质细胞打印机的打印参数由一前端数字信号发生器所控制。数字信号发生器相关参数选择为:采用5赫兹脉冲波形驱动喷头振荡、采样率5msa/s、振幅10vpp、每秒振荡两次。异质细胞打印机的交变滞惯力打印程序由pc端软件所控制(交变滞惯力打印方法具体参见cn201510455765.9)。打印程序设置为:每振荡一次,打印机运动平台位移300μm一次。温度为20℃。
(2)3d打印制备流程:以上述制备的海藻酸钠水凝胶材料为打印原料,按照上述打印参数和程序开始打印。打印后,海藻酸钠水凝胶微球附着在置于针头下方的培养皿的底部(如图2所示),向培养皿内部加入上述制备的100mm的氯化钙溶液作为交联剂,使氯化钙溶液浸没微球,保持3-5分钟进行交联反应。交联反应完毕后,使用移液枪将微球吹离培养皿底面,收集至1.5ml离心管中,300~500rpm离心3分钟,弃掉上清液,加入pbs缓冲液浸泡清洗微球10分钟,重复上述清洗步骤3次,离心收集微球。
对比例1
本对比例采用传统的微球制备方法——乳化分散法制备可降解微球,具体方法如下:
将1%海藻酸钠水凝胶材料溶液滴加至植物油中,水/油(w/o)的比例为1:10,持续搅拌30分钟,制得均匀的w/o乳剂,然后加入100mm氯化钙溶液进行交联固化,搅拌,分离制得可降解水凝胶微球。
上述海藻酸钠水凝胶材料的制备方法与实施例1的①相同。
实验例1可降解水凝胶微球的粒径分布分析
对实施例1和对比例1制备的可降解水凝胶微球进行粒径分布测量,具体方法如下:
将可降解水凝胶微球充分洗涤后,使用全自动激光粒度分布仪进行实施例1和对比例1制备的可降解水凝胶微球的粒径分布测量。经测量,对比例1制备的微球的粒径分布范围较宽,表明该制备方法不能准确控制粒径大小,而与对比例1相比,实施例1制备的水凝胶微球的粒径分布明显更为集中,表明采用实施例1的方法制备得到的可降解水凝胶微球的粒径大小更为均一,该方法可以更为精确地控制水凝胶微球的粒径和均匀度。
实验例2可降解水凝胶微球的力学性能评估
对实施例1和对比例1制备得到的可降解水凝胶微球的力学强度、弹性等机械性能进行测试评估。
为对可降解水凝胶微球的力学性能进行评估,收集制备的水凝胶微球,选取实施例1和对比例1制备的水凝胶微球中粒径大小相近的微球,使用动静态疲劳拉伸试验机测量微球的拉伸弹性模量,采用微球压痕法测量微球的压缩弹性模量。结果表明,实验例1中较对比例1中制备的水凝胶微球的弹性模量略有提高。
为评估可降解水凝胶微球在培养环境下的力学性能变化,收集制备的水凝胶微球,使用pbs缓冲液浸洗微球,加入含细胞培养基的培养皿中,置于37℃培养箱中培养,持续观察水凝胶微球的结构形态变化。取不同培养时间的微球,使用pbs缓冲液清洗样品后,再进行上述力学性能测试。结果表明,经过一定时间的培养,实施例1中和对比例1中制备的水凝胶微球的弹性模量均出现一定程度的下降,但实施例1中制备的微球的弹性模量始终略高于对比例1中制备的水凝胶微球。
实施例2功能性体外微组织的构建
本实施例以体外三维肺泡模型和体外血管化肿瘤模型的构建为例,将实施例1制备的可降解水凝胶微球应用于功能性体外微组织的构建(制备流程如图1所示)。
1、体外三维肺泡模型的构建
将实施例1制备的与人体肺泡大小相近的200μm粒径的可降解水凝胶微球,加入至含有肺泡上皮细胞的细胞悬液中,进行悬浮震荡培养,使肺泡上皮细胞粘附于水凝胶微球表面。肺泡上皮细胞在微球表面增殖,进行生物功能表达,逐渐形成成熟的肺泡上皮层。此时,加入水凝胶材料降解剂——柠檬酸钠溶液(55mm母液),使得反应体系中柠檬酸钠与海藻酸钠的摩尔比为1:2,启动水凝胶微球的降解。在37℃培养箱环境下海藻酸钠水凝胶进行持续地缓慢降解,约14天水凝胶材料降解完毕,肺泡上皮层内部形成球状空腔结构,最终形成肺泡状空泡组织,完成体外三维肺泡模型的构建。
2、体外血管化肿瘤模型的构建
将实施例1制备大小为100μm的含有肿瘤细胞的海藻酸钠水凝胶微球加入至含有血管内皮细胞的细胞悬液中,进行悬浮震荡培养,使血管内皮细胞粘附于水凝胶微球表面。经一段时间培养,血管内皮细胞在水凝胶微球表面形成成熟的内皮细胞网,同时,微球内部的肿瘤细胞进行了一定程度的增殖。为了使肿瘤细胞与微球表面的内皮血管网充分接触,需要将水凝胶微球材料降解,为肿瘤细胞的进一步增殖提供空间。通过加入水凝胶材料降解剂——柠檬酸钠溶液(55mm母液),使得反应体系中柠檬酸钠与海藻酸钠的摩尔比为3:4,以控制微球以合适的速率降解,在37℃培养箱环境下放置约8天降解完成,肿瘤细胞团簇完全填充微球原本占据的空间,与微球表面的内皮血管网接触,形成一种体外血管化肿瘤模型。
对比例2
本对比例采用传统可降解的组织工程多孔支架:聚乳酸(pla)、聚己内酯(pcl)、聚乙烯醇(pva),构建功能性体外微组织。其中,利用聚乳酸(pla)构建类似的体外三维肺泡模型的方法参见sahoosk,pandaak,labhasetwarv.characterizationofporousplga/plamicroparticlesasascaffoldforthreedimensionalgrowthofbreastcancercells[j].biomacromolecules,2005,6(2):1132-1139;利用聚己内酯(pcl)构建类似的体外肿瘤模型的方法参见rabionetm,yestem,puigt,ciuranaj.electrospinningpclscaffoldsmanufactureforthree-dimensionalbreastcancercellculture[j].polymers,2017,9(8):328;利用聚乙烯醇(pva)构建类似的体外肿瘤模型的方法参见yem,mohantyp,ghoshg.biomimeticapatite-coatedporouspvascaffoldspromotethegrowthofbreastcancercells[j].materialsscienceandengineering:c,2014,44:310-316。
实验例3功能性体外微组织的生物学性能评估
分别对实施例2和对比利2中利用可降解水凝胶微球和传统可降解的组织工程多孔支架所构建的功能性体外微组织的基本生物学性能进行评估。
(1)细胞增殖检测:对构建的功能性体外微组织的细胞增殖情况进行评估。采用cck-8试剂盒进行细胞增殖检测,建立受试细胞的标准增殖曲线,并通过对体外微组织进行3~5天培养,观察细胞的增殖情况。
(2)体外微组织的显微观察:在微球和多孔支架加入细胞悬液进行悬浮共培养后,持续观察细胞在水凝胶微球表面及内部的增殖情况和形态变化。加入降解剂使水凝胶微球一定程度上降解,继续进行培养,观察微组织的形态变化。
(3)组织切片观察:收集培养的功能性体外微组织,采用苏木精——伊红染色法(he)制作微组织切片。通过切片观察功能性体外微组织的组织形态及细胞分布情况,评价体外微组织形态特征,并与体内实际微组织的形态结构进行比较。
(4)免疫组化染色:采用免疫组化染色对功能性体外微组织中细胞表达的相关特异性蛋白进行检测,以评估细胞在该体外微组织中的生物功能特性。例如,在构建体外三维肺泡模型中,对于肺泡上皮细胞,对其蛋白标志物如ttf-1、sp-a、sp-c等进行免疫荧光染色。在构建体外血管化肿瘤模型,对于肿瘤细胞,对其相应肿瘤标志物蛋白进行免疫荧光染色;对于血管内皮细胞,对其蛋白标志物如cd31、cd34、vegf等进行免疫荧光染色。通过荧光显色观察,评估细胞的相关蛋白特异性表达情况,并与体内实际微组织进行比较。
结果表明,实施例2中构建的功能性体外微组织与对比例2中采用传统可降解的组织工程多孔支架构建的体外微组织相比,前者的细胞具有更好的增殖能力,构建的微组织形态特征更符合实际体内组织的形态特征,并在相应组织的生物功能表达方面具有较为优异的性能。
以上所述仅是本发明的优选实施方式,应当指出,对于本技术领域的普通技术人员来说,在不脱离本发明技术原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!