一种喹唑啉类化合物及其制备方法和用途与流程
本发明涉及医药技术领域,具体涉及一种喹唑啉类化合物及其制备方法和用途。
背景技术:
癌症目前已成为威胁人类健康的一个重要因素,每年的致死人数远远超过艾滋病以及肺结核等疾病。与其它国家相比,我国癌症死亡率远高于全球17%的平均水平,位居全球癌症死亡率的第29位。因此降低发病率、提高早诊率、探寻有效治疗方法是未来肿瘤预防和治疗的手段。
作为癌症治疗中常见的治疗方式,化学治疗近年来发展势头迅猛,这主要是得益于小分子靶向抗癌药物的发现和使用。小分子靶向药物具有靶点特异、低毒、易吸收等特点,其可以特异性结合到靶蛋白上,选择性作用于癌细胞增殖、代谢、凋亡等重要信号转导关键分子,从而抑制癌细胞的增殖。在目前临床使用的化疗药物中,90%以上都是小分子靶向药物,但不可否认的是,这些小分子抗癌药物主要是针对G蛋白偶联受体以及激酶等靶点,针对其它靶点或近年新发现靶点药物研究则较少。因此,根据药物靶点近年最新研究进展,筛选到作用于新靶点的小分子先导化合物,将为肿瘤治疗提供重要的理论和现实意义。
自噬是一个吞噬自身细胞质蛋白或细胞器并使其包被进入囊泡,并与溶酶体融合形成自噬溶酶体,降解其所包裹的内容物的过程。通过自噬,细胞可将受损细胞器、错误折叠蛋白等降解以维持自身稳态。在肿瘤的发生发展中,自噬具有两面性,一方面自噬可通过介导细胞内能量和代谢产物循环利用为肿瘤细胞生长和繁殖提供基础;另一方面还可通过限制炎症、清除有毒的未折叠蛋白,除去生成活性氧簇(可损害DNA)的受损线粒体来抑制肿瘤形成。因此自噬对肿瘤细胞起双重调节作用,既可抑制肿瘤细胞增殖,也可促进其发生和发展,而这也就意味着上调或下调自噬活性对肿瘤治疗有重要的借鉴意义。已有很多报道证明自噬非特异性抑制剂和诱导剂通过调控自噬活性对肿瘤细胞有抑制作用,自噬抑制剂3-MA、氯喹、巴弗洛霉素A1等负调控自噬后可抑制结肠癌、肺癌、肝癌细胞的增殖;自噬诱导剂,雷帕霉素促进自噬后也可抑制肾癌细胞增殖。在2015年,自噬特异性抑制剂SBI-0206965始见报道,该小分子化合物靶向于自噬关键启动分子ULK1,可特异性抑制ULK1活性,并对A549细胞有明确地抑制作用。此后,靶向ULK1的其它小分子抑制剂如MRT67307、MRT68921、LYN1604等相继被发现。自噬通路中的其它分子的特异性抑制剂如AG-690以及veterporfin等在抗癌研究中也有巨大价值。例如靶向ATG4B的小分子抑制剂S130对肺癌、乳腺癌、结肠癌细胞等有明显抑制作用。以自噬通路为靶点的药物已成为未来新型小分子靶向抗癌药物研发的重要方向。
技术实现要素:
与其它通路小分子靶向药物相比,自噬特异性小分子靶向药物目前已报道的还很有限,这显然与自噬所具有的重要功能不符。针对现有技术的不足,本发明涉及新型靶向自噬通路的小分子抑制剂,以期获得一种通过抑制自噬活性促进肿瘤细胞程序性死亡的小分子靶向抗癌药物。
因此,本发明的一个目的是提供一种通过抑制自噬活性促进肿瘤细胞程序性死亡的通式(I)所示的喹唑啉类化合物或其药学上可接受的盐。
本发明的另一目的是提供所述通式(I)所示的喹唑啉类化合物或其药学上可接受的盐的制备方法。
本发明的又一目的是提供所述通式(I)所示的喹唑啉类化合物或其药学上可接受的盐在制备药物中的用途。
首先,本发明提供如下通式(I)所示的喹唑啉类化合物或其药学上可接受的盐,
其中:
R1选自:H、卤素、-C1~C3烷基或-O-C1~C3烷基;
R2选自:H、卤素、-OH、-C1~C3烷基、-O-C1~C3烷基、-C(O)-C1~C3烷基、-C(O)-NH2、-NH-C(O)-C1~C3烷基、-C(O)-O-R9或-N(R9)2;
R3选自:H、卤素、-OH、-C1~C3烷基、-O-C1~C3烷基、-C(O)-C1~C3烷基、-CH(C1~C3烷基)(OH)、-NO2、-NH-C(O)-C1~C3烷基、-CF3或-C(O)-O-R9;
R4选自:H、卤素、-OH、-C1~C3烷基或-O-C1~C3烷基;
R5选自:H或-N+(O)-O-;
R6选自:H或-C1~C3烷基;
R7选自:H或-O-C1~C3烷基;
R8选自:H、-C1~C3烷基或-P(O)(OH)2;
R9选自:H或-C1~C3烷基。
所述卤素包括F、Cl、Br和I;优选地,所述卤素为F、Cl或Br。优选地,
R1选自:
R2选自:
R3选自:
R4选自:
R5选自:
R6选自:
R7选自:
R8选自:
R9选自:
进一步优选地,所述通式(I)所示的喹唑啉类化合物或其药学上可接受的盐为下述通式(II)所示的喹唑啉类化合物或其药学上可接受的盐:
其中,R1、R2、R3和R4的一般范围、优选范围如上所述。
进一步优选地,通式(II)中,R1、R3和R4同时为H。
更进一步优选地,通式(II)中,R1、R3和R4同时为H;且R2选自:-OH、-F、-Cl、-Br、-CH3、-OCH3或-OCH2CH3。
在一个实施方案中,所述通式(I)或通式(II)所示的喹唑啉类化合物或其药学上可接受的盐为以下化合物或其药学上可接受的盐:
其次,本发明提供所述通式(I)所示的喹唑啉类化合物或其药学上可接受的盐的制备方法,所述制备方法包括以下步骤:
将化合物21、化合物22、N,N-二异丙基乙基胺(DIPEA)和DMF放入容器中;将反应液置于沸水浴中,溶解完全后,再水浴加热合适的时间(例如8小时);然后把反应液用过量的去离子水研磨并超声波处理,直至有晶体沉淀出现;将沉淀过滤,将粗产物进行色谱纯化,即得;
其中,R1、R2、R3、R4、R5、R6、R7、R8的定义如上;A为Cl、Br或I。
再次,本发明提供通式(I)所示的喹唑啉类化合物或其药学上可接受的盐在制备自噬抑制剂的药物中的用途。
在一个实施方案中,本发明提供通式(I)所示的喹唑啉类化合物或其药学上可接受的盐在制备作为自噬抑制剂治疗肿瘤的药物中的用途。
所述肿瘤包括良性肿瘤和恶性肿瘤(癌症)。
优选地,所述肿瘤包括:乳腺癌和肝癌。
优选地,所述通式(I)所示的喹唑啉类化合物或其药学上可接受的盐通过阻断自噬流实现对肿瘤细胞的自噬抑制。
优选地,所述通式(I)所示的喹唑啉类化合物或其药学上可接受的盐具有细胞毒作用,并抑制肿瘤细胞增殖和转移。
优选地,所述通式(I)所示的喹唑啉类化合物或其药学上可接受的盐促进细胞自噬体形成,但使得自噬体不能被溶酶体降解,从而降低自噬流活性。
优选地,所述通式(I)所示的喹唑啉类化合物或其药学上可接受的盐促进肿瘤细胞凋亡的发生。
优选地,所述通式(I)所示的喹唑啉类化合物或其药学上可接受的盐通过自噬抑制促进肿瘤细胞凋亡。
此外,本发明提供一种药物组合物,其包含所述通式(I)所示的喹唑啉类化合物或其药学上可接受的盐以及药学上可接受的辅料。
附图说明
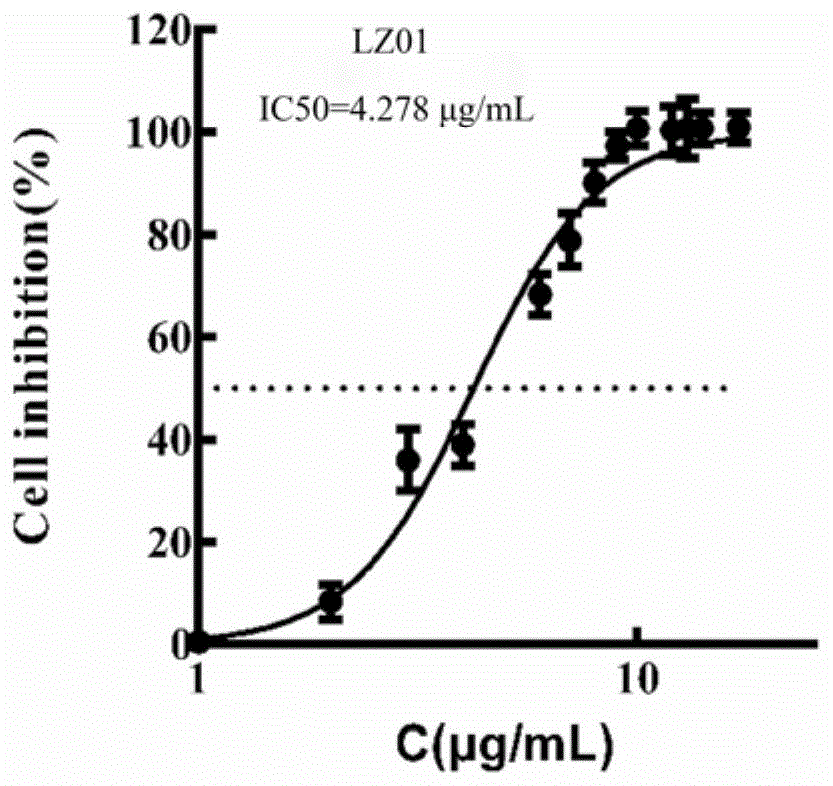
图1~2为本发明化合物对癌细胞的IC50的图。
图3~5为本发明化合物抑制细胞增殖的图。
图6~7为本发明化合物影响细胞DNA复制的图。
图8为本发明化合物抑制肿瘤细胞侵袭能力的图。
图9~15为本发明化合物抑制细胞自噬的图。
图16~21为本发明化合物促进癌细胞凋亡发生的图。
图22~25为本发明化合物通过抑制自噬促进癌细胞凋亡发生的图。
图26~30为本发明化合物抑制癌细胞在裸鼠体内增殖的图。
具体实施方式
下面通过实施例对本发明进行说明,但本发明并不限于此。下述实施例中所示实验方法,如无特殊说明,均为常规方法。所示试剂和材料,均为市售产品。
制备实施例1LZ01的制备
向烧瓶中加入2-[(2-氯喹唑啉-4-基)氨基]乙-1-醇(CAS 134517-34-3(530mg,2.37mmol,1当量))、4-甲氧基苯胺(2.37mmol,1当量)、N,N-二异丙基乙胺(DIPEA,CAS 7087-68-5(368mg,1.2当量))和1mL DMF。将反应混合物在沸水浴中搅拌5分钟。在试剂完全溶解后,将搅拌的反应混合物在水浴上加热8小时。将反应混合物与过量的去离子水一起研磨并超声处理直至形成结晶沉淀物。过滤沉淀物,用最少量的甲醇洗涤两次,并干燥。通过色谱法(硅胶,正相,洗脱液:氯仿和2-丙醇:4:1,v/v)纯化粗产物,得到纯品化合物LZ01,产率为42%。1H NMR(400MHz,DMSO-d6)δ10.33(s,1H),9.76(s,1H),8.43(d,J=8.2Hz,1H),7.81(t,J=7.8Hz,1H),7.55(d,J=8.3Hz,1H),7.49(s,1H),7.48–7.40(m,2H),7.05–6.97(m,2H),4.98(br,1H),3.79(s,3H),3.66(dq,J=16.0,6.2Hz,4H).HRMS(ES-API)cacld.for C17H18N4O2 311.1[M+1]+,found 311.2[M+1]+.
制备实施例2LZ02的制备
除了使用4-甲基苯胺替代4-甲氧基苯胺之外,采用与制备实施例1中相似的方法制备化合物LZ02,产率为61%。1H NMR(400MHz,DMSO-d6)δ9.06(br,1H),8.25(br,1H),8.11(d,J=8.1Hz,1H),7.74(d,J=8.1Hz,2H),7.57(t,J=8.3,6.9,1.3Hz,1H),7.40(d,J=8.2Hz,1H),7.18(t,J=7.6Hz,1H),7.08(d,J=8.2Hz,2H),4.80(t,J=5.2Hz,1H),3.73–3.57(m,4H),2.26(s,3H).HRMS(ES-API)cacld.for C17H18N4O 295.1[M+1]+,found 295.2[M+1]+.
实验实施例1本发明化合物LZ01和LZ02对癌细胞的抑制实验
实验:为了评估本发明化合物LZ01和LZ02对癌细胞的抑制效果,本发明从细胞毒性、细胞凋亡、细胞周期的阻滞、细胞克隆形成以及细胞的转移能力等方面进行了相关实验。
本发明化合物LZ01和LZ02对癌细胞活力的影响:将人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)接种于96孔培养板内(105/孔),培养24h后,分别用不同浓度的本发明化合物LZ01、LZ02(0~12.8μg/mL)处理细胞。处理结束后,每孔加入100μl 10%CCK-8溶液,轻微震荡后置于细胞培养箱中孵育3h,使用酶标仪检测各孔在450nm波长下的OD值。实验重复三次,计算细胞存活率。
细胞存活率%=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%
本发明化合物LZ01和LZ02对癌细胞凋亡的影响:将人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)消化后悬浮在一定量的培养液中,计数后调整细胞浓度。在6孔板中,人肝癌细胞(Hep3B)每孔接种8×105,人乳腺癌细胞(MCF-7)每孔接种5×105,每个处理3个复孔,置于37℃、5%二氧化碳培养箱中培养。24h后每孔中加入不同浓度的本发明化合物LZ01、LZ02(0~12.8μg/mL)。作用24h后,采用Annexin V/PI标记,并用流式细胞术检测细胞凋亡情况。
本发明化合物LZ01和LZ02对癌细胞周期的阻滞的影响:将不同浓度的本发明化合物LZ01、LZ02处理后(0~12.8μg/mL)的人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)用胰酶消化,各1×106,1000g左右离心5分钟,沉淀细胞。小心吸除上清,加入约1mL预冷的PBS洗3次。再加入1mL预冷70%乙醇,轻轻吹打混匀,4℃固定2小时或更长时间。1000g离心5分钟,沉淀细胞,使用预冷的PBS洗3次。每管细胞样品中加入0.5mL碘化丙啶染色液,缓慢并充分重悬细胞沉淀,37℃避光孵育30min,在24小时内完成流式检测。
本发明化合物LZ01和LZ02对癌细胞克隆形成的影响:取对数生长期的人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)的单层培养细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,把细胞悬浮在含有10%胎牛血清的RPMI1640培养液中,按照每孔200个细胞的密度分别接种在6孔板中,每孔预添加3mL含有不同浓度的本发明化合物LZ01、LZ02(0~12.8μg/mL)的37℃预温培养液的皿中,并轻轻转动,使细胞分散均匀。将6孔板置于37℃5%CO2及饱和湿度的环境下,静置培养2~3周。经常观察,当培养皿中出现肉眼可见的克隆时,终止培养。弃去上清液,用PBS小心浸洗2次。加入100%甲醇或1:3醋酸/甲醇5mL,固定15分钟。然后去固定液,加适量Giemsa应用染色液染10~30分钟,然后用流水缓慢洗去染色液,空气干燥。将平皿倒置并叠加一张带网格的透明胶片,用肉眼直接计数克隆,或在显微镜(低倍镜)计数大于10个细胞的克隆数。最后计算克隆形成率。
克隆形成率%=(克隆数/接种细胞数)×100%
本发明化合物LZ01和LZ02对癌细胞侵袭能力的影响:利用transwell小室进行细胞侵袭试验。将Matrigel基质胶预先置于4℃融化,用无血清的冷细胞培养基RPMI1640稀释Matrigel胶,取100μL稀释胶加到24孔的transwell上室中。37℃孵育transwell至少4~5h。取人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7),PBS洗3次。用含1%胎牛血清的RPMI1640悬浮细胞,调整细胞浓度为3×103/mL,取100μL加入上室,同时每孔上室中加入不同浓度的本发明化合物LZ01、LZ02(0~12.8μg/mL),下室加入含10%胎牛血清的RPMI1640培养基100μL,每个处理重复三次。置于37℃,5%二CO2培养箱中培养24h。取出小室,用PBS润湿,用棉签擦去微孔膜上层的细胞,侵袭到下室的细胞用4%多聚甲醛固定,结晶紫染色后置于显微镜下拍照计数。
结果:本发明化合物LZ01对人乳腺癌细胞(MCF-7)的IC50为4.278μg/ml(图1);本发明化合物LZ02对人肝癌细胞(Hep3B)的IC50为3.899μg/ml(图2)。细胞活力和克隆形成实验表明:本发明化合物LZ01和LZ02明显抑制细胞增殖,并呈现时间-浓度依赖性(图3、图4、图5),同时本发明化合物LZ01和LZ02影响细胞DNA复制,阻滞细胞于S期(图6、图7),transwell实验表明本发明化合物LZ01和LZ02也可抑制肿瘤细胞侵袭能力(图8)。
结论:通过检测本发明化合物LZ01和LZ02对人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)这两种癌细胞的增长抑制、活力、克隆形成、细胞周期以及侵袭能力等方面的影响,证实了本发明化合物LZ01和LZ02对人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)有明显的细胞毒作用,并抑制细胞增殖和转移。
实验实施例2本发明化合物LZ01和LZ02对癌细胞自噬活性抑制的实验
实验:采用western blot(WB)以及透射电镜(TEM)等方法检测本发明化合物LZ01和LZ02对癌细胞自噬活性的抑制。
收集不同浓度的本发明化合物LZ01、LZ02(0-12.8μg/mL)处理后的人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7),各1×106,进行WB实验,检测ULK1、磷酸化ULK1、Atg101、Fip200、LC3-I、LC3-II以及beclin1等自噬通路关键因子的表达情况。具体方法为:用细胞刮刮下细胞后,加入细胞裂解液(含蛋白酶抑制剂)置冰上15min,12000rpm离心10min,取上清,定量后分装在EP管中,煮沸10min,待样品恢复到室温后进行SDS-PAGE电泳;加入1000mL电转液,将胶平铺于海绵上,滴加少许电转液,再次驱赶气泡,封紧后放入电转槽。将电泳槽置于冰水混合物中。恒压100V,将SDS-PAGE胶上的蛋白转移到PVDF滤膜上;将PVDF滤膜从电转槽中取出,TBST漂洗三次,每次10min。浸没于含5%脱脂奶粉的TBST封闭液中室温封闭1h;将PVDF滤膜取出再用TBST漂洗3次,加入含一抗的TBST(含5%脱脂奶粉)4℃过夜;次日用TBST浸洗三次,每次10min。加入含辣根过氧化酶标记二抗的TBST(含5%脱脂奶粉)室温孵育1h后,TBST洗3次后拍照显影。
采用TEM方法观察本发明化合物LZ01、LZ02存在时细胞内自噬小体的形成情况。离心收集约5×106本发明化合物LZ01、LZ02(6.4μg/mL)处理后的人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7),用PBS洗涤两次后,弃上清,加入1mL 2.5%戊二醛悬浮细胞,固定细胞0.5~1h,用1%的锇酸固定液固定30min~1h;固定完毕后加入乙醇脱水,环氧树脂包埋,进行超薄切片,在日立H-7650透射电子显微镜下观察并拍照。
同时,本发明还使用western blot的方法检测了本发明化合物LZ01、LZ02与溶酶体抑制剂Bafilomycin A1联用时,细胞内自噬流尤其是LC3的变化情况。
结果:本发明化合物LZ01和LZ02作用细胞后,ULK1 317位和556位氨基酸磷酸化,而757位氨基酸发生去磷酸化,表明ULK1被激活。当ULK1激活后可启动自噬体形成,此时beclin1和LC3-II表达均升高,但ULK1复合物蛋白Atg101和Fip200表达下调(图9、图10)。与对照组相比,透射电镜下可发现药物处理后胞浆中有大量自噬体形成,且自噬体中还有未完全消化的细胞器(图11)。自噬底物蛋白P62/SQSTM1的表达随药物作用浓度增加而增加,提示药物作用后自噬流活性被抑制(图12、图13)。进一步通过溶酶体抑制剂Bafilomycin A1联合本发明化合物LZ01和LZ02作用细胞后,发现LC3-II的量与本发明化合物LZ01和LZ02单用时无明显变化(图14、图15)。表明在本发明化合物LZ01和LZ02存在时,溶酶体不能有效降解LC3-II。
结论:本实验进一步通过综合运用Western Blot以及透射电镜的方法检测了本发明化合物LZ01和LZ02对MCF-7和Hep3B这两种癌细胞自噬活性的影响。得出本发明化合物LZ01和LZ02作用后,可以促进细胞自噬体形成,但会使得自噬体不能被溶酶体降解,从而降低自噬流活性。
实验实施例3本发明化合物LZ01和LZ02促进肿瘤细胞发生凋亡
实验:通过western blot(WB)、线粒体膜电位检测、流式细胞检测、以及TUNEL检测等方法证明本发明化合物LZ01和LZ02可以促进肿瘤细胞发生凋亡。
通过WB检测本发明化合物LZ01和LZ02处理人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)后,相关凋亡指示因子(Bax、Bcl-2、Cleaved caspase 9和Cleaved caspase 3)在细胞内的变化情况,操作方法同实验实施例2中的WB检测。
通过JC-1线粒体膜电位检测试剂盒检测本发明化合物LZ01和LZ02处理人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)后,肿瘤细胞线粒体膜电位的变化情况。操作方法按照试剂盒说明书进行。
采用流式细胞术计算不同浓度本发明化合物LZ01和LZ02(0~12.8μg/mL)处理肿瘤细胞后人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)的凋亡率。操作方法同实验实施例1中的凋亡检测。
采用TUNEL细胞凋亡检测试剂盒检测细胞凋亡,不同浓度的本发明化合物LZ01和LZ02(0~12.8μg/mL)处理人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7),固定后与TUNEL反应混合物,包括末端脱氧核苷酸转移酶(TdT),荧光素-dUTP,在避光湿盒中37℃孵育60min。在光学显微镜下观察并记录实验结果。
结果:使用0~12.8μg/ml的本发明化合物LZ01和LZ02处理人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)后,促凋亡蛋白Bax的表达量随药物浓度增加而提高,而抗凋亡蛋白Bcl-2的表达则出现下调,同时cleaved caspase-3和cleaved caspase-9表达也升高(图16)。线粒体膜电位随作用浓度增加而降低(图17、图18)。流式细胞检测和TUNEL测试结果直接显示凋亡细胞数量增加(图19、图20、图21)。
结论:表明本发明化合物LZ01和LZ02可促进人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)发生凋亡。
实验实施例4本发明化合物LZ01和LZ02通过抑制自噬促进癌细胞的凋亡
实验:LZ01和LZ02均可同时引起凋亡和自噬的发生,为研究凋亡和自噬在肿瘤抑制中的关系,本发明人分别用凋亡抑制剂z-vad-FMK抑制凋亡,用自噬抑制剂氯喹(CQ)及自噬形成关键分子Atg7的siRNA(siRNA-Atg7)抑制自噬后再施加药物,并观察细胞程序性死亡情况。z-vad-FMK、氯喹(CQ)、以及本发明化合物LZ02的使用方法与实验实施例1-3中的方法类似,下面主要详细描述siRNA-Atg7对Atg7表达的干扰抑制。
实验设置5组,分别是正常对照组(细胞未经任何处理)、阴性对照组(转染非特异性siRNA)、siRNA-ATG7-1转染组、siRNA-ATG7-2转染组、siRNA-ATG7-3转染组。转染前一天,胰酶消化人肝癌细胞(Hep3B)和人乳腺癌细胞(MCF-7)并计数,细胞铺六孔板,第二天细胞融合铺满孔壁约70%后转染。取100pmol siRNA加入到盛有100μL无血清opti-MEM基础培养基的离心管中,标记为A液;取5μL HighGene转染试剂加入到另一个盛有100μL无血清opti-MEM基础培养基离心管中,标记为B液。将100μL含有HighGene转染试剂B液缓慢滴加到100μL含有siRNA质粒的A液中,用移液枪轻轻吹打几次混匀,室温静置15~20min;将200μL HighGene转染试剂/质粒复合物均匀滴加到6孔细胞培养板孔中,轻轻晃动细胞培养板使其均匀分布;细胞转染4-6h后,更换新鲜的完全培养基;细胞转染48h后,在荧光显微镜下观察FAM所激发出的绿色荧光,检测转染效率,拍照记录。其余孔细胞加入不同浓度的本发明化合物LZ01和LZ02,使用适当方法进行检测。siRNA序列如下:
Atg7-1-sense(5'-3')CCAACACACUCGAGUCUUUTT
Atg7-1-antis(5'-3')AAAGACUCGAGUGUGUUGGTT
Atg7-2-sense(5'-3')GCCUCUCUAUGAGUUUGAATT
Atg7-2-antis(5'-3')UUCAAACUCAUAGAGAGGCTT
Atg7-3-sense(5'-3')CCAACAUCCCUGGUUACAATT
Atg7-3-antis(5'-3')UUGUAACCAGGGAUGUUGGTT
结果:CQ及siRNA-Atg7抑制自噬后,细胞凋亡数量比单纯药物处理多,而z-vad-FMK却可以减轻本发明化合物LZ01和LZ02单独处理或与氯喹(CQ)、siRNA-Atg7协同处理后引起的细胞死亡数量(图22、图23)。同样,氯喹(CQ)及siRNA-Atg7处理后促进促凋亡蛋白Bax表达和caspase-9活化,降低抗凋亡蛋白Bcl-2表达,而z-vad-FMK可改善氯喹(CQ)及siRNA-Atg7引起的效应(图24、图25)。
结论:表明凋亡是本发明化合物LZ01和LZ02抗肿瘤的机制,而自噬抑制促进肿瘤细胞凋亡。
实验实施例5化合物LZ02对裸鼠体内MCF-7细胞增殖的抑制实验
实验:本发明所用的是由第四军医大学实验动物中心提供的6周大的雌鼠,体重20-25g。在种植肿瘤细胞前1周,对雌鼠每隔1天注射28.3μg 17β-雌二醇。选择生长状态良好的对数期人乳腺癌细胞(MCF-7),胰酶消化后离心,PBS洗3次。重悬人乳腺癌细胞(MCF-7)后,将细胞浓度调整为5×106个/mL,在雌鼠的右侧腹股沟处,用1mL注射器皮下注射,100μL/只。大约注射后4-6天,即可观察到移植瘤。当肿瘤体积达到100mm3后将雌性鼠随机分为三组:对照组(生理盐水)、LZ02(30mg/kg)组和LZ02(30mg/kg)+氯喹(CQ),每隔一天尾静脉注射治疗,同时记录老鼠体重和肿瘤体积。游标卡尺测量肿瘤尺寸,公式=(length*width2)/2。治疗30天后,处死雌鼠,剥离肿瘤后称重并拍照。肿瘤冻存或用4%多聚甲醛固定后进行后续组化实验以及western blot(WB)检测。
采用组化实验和WB实验检测上述三种不同处理的肿瘤细胞内凋亡、自噬、以及细胞周期相关蛋白的变化情况。WB操作方法同实验实施例2,而组化实验则是依次使用4%多聚甲醛固定肿瘤组织、酒精脱水、二甲苯透明、石蜡包埋后、以及苏木精-伊红染色。最后在光学显微镜下观察并拍照。
结果:本发明化合物LZ02单独使用即可抑制人乳腺癌细胞(MCF-7)在裸鼠体内增殖,当与氯喹(CQ)联合使用后,这种抑制效应更为明显(图26),与对照组相比,肿瘤体积和重量都显著减轻(图27、图28)。组化结果表明药物处理后肿瘤组织中FoxO3a、Atg7、Bim及p27Kip1表达增高(图29),同样Western blot结果也表明凋亡蛋白和自噬、细胞周期相关蛋白表达上调,而抗凋亡蛋白表达下调,此种情况在与氯喹(CQ)联合作用时更明显(图30)。
结论:本发明化合物LZ02作用后,可以有效抑制人乳腺癌细胞(MCF-7)在裸鼠体内增殖,在于氯喹(CQ)联用时,对肿瘤细胞的抑制效果会显著增强。组化实验和WB检测也进一步验证了本发明化合物LZ02对肿瘤细胞的细胞毒作用。本发明化合物LZ02除了抑制肿瘤细胞的增殖,还可以引发细胞的凋亡和自噬,并对细胞周期有阻滞作用。
基于以上发明内容的描述,本领域技术人员能够全面地应用本发明,所有相同原理或类似的改动均应视为包括在本发明的范围之内。
- 还没有人留言评论。精彩留言会获得点赞!