重组人Notch1蛋白在制备神经干细胞及皮层神经元中的应用的制作方法
本发明属于生物医学技术领域,具体涉及重组人notch1蛋白在制备神经干细胞及皮层神经元中的应用。
背景技术:
脑卒中是由于脑血管阻塞或是破裂导致脑组织损伤的一组疾病,包括缺血性脑卒中和出血性脑卒中,其死亡率位居全球第二位,也是中国成年人残疾的首要原因。其中,缺血性脑卒中的发病率较高,占脑卒中总数的60-70%。目前,缺血性脑卒中的急性期治疗为应用溶栓药物重组人组织型纤溶酶原激活物(rt-pa),但该药的应用有严格的时间限制,为发病4.5小时之内,而且其引起的继发性颅内出血的副作用也限制了它的应用,所以,找寻新的神经保护药物成为当务之急。近20年,科学家在不停的研发新的药物,但在动物实验中有效的药物而临床试验却失败了,究其原因,实验动物和人类对药物的反应还是有很大区别。随着人诱导性多能干细胞(ipscs)的建立,新的疾病模型也随之产生,由于来源于正常人或病人,ipscs建立的模型更接近于人本身的特性,利用人ipscs诱导来的皮层神经元进行药物筛选既避免了伦理问题又大大提高了药物转化效率。
皮层神经元从ipscs分化的第一步是神经诱导以产生神经干细胞(nsc),最常用的方法为通过双smad抑制,即bmp拮抗剂noggin和tgf-β信号传导的小分子抑制sb431542,促进神经外胚层分化。通过该方法形成的神经干细胞需经多次传代而进一步纯化、扩增,待细胞稳定后再行神经诱导为皮层神经元。研究表明,表皮生长因子(egf)及成纤维细胞生长因子-2(fgf-2)对于维持神经干细胞的稳定增殖至关重要,另外,添加wnt信号传导拮抗剂dkk1也可以增强神经干细胞的衍生。目前,常用的神经干细胞维持培养基为neurobasal培养基+1×n2+1×b27+egf(10ng/ml)+fgf-2(10ng/ml)+脑源性生长因子(bdnf,20ng/ml)。但在这种培养条件下的神经干细胞仍然增殖缓慢,不能在短时间内获得功能稳定且数量高的神经干细胞,影响了下一步神经元的诱导。mccaughey-chapman统计了常用的诱导方法指出ipscs技术的主要缺点是该策略的效率低,其中通常少于1%的细胞经历ipscs的诱导成为神经细胞。
目前已利用人ipscs诱导为神经干细胞,然后进行神经干细胞的扩增,之后再诱导为皮层神经元来进行脑卒中神经保护药物筛选。在此过程中,神经干细胞的稳定衍生最为关键,决定诱导分化神经元的效率及活性,对药物效果的鉴定,起到至关重要的作用,因此,高效筛选高活性神经干细胞的方法决定了药物筛选的成败。
中国文献《notch1信号通路对人牙周膜干细胞应力分化过程的调控》(周述作,秦凡,崔嘉玺等,局解手术学杂志,2017,26(4)),该文献中表述了notch1是notch家族在人类体内最重要的受体之一,属于i型跨膜蛋白,该文献通过激动剂人重组jagged1蛋白,抑制剂γ外分泌酶抑制剂(dapt)上、下调notch1通路关键蛋白(nicd),研究动态张应力作用下notch1信号通路参与人牙周膜干细胞(pdlscs)成骨的作用。文献《人胚胎神经干细胞向神经元分化过程中notch1基因的表达》(王飞,李世亭,黄强等,细胞与分子免疫学杂志,2004:6)中,随着nsc向神经元的分化,notch1的表达量逐渐减少,提示notch1在nsc向神经元分化的过程中可能主要起负调控作用,也说明notch信号通路可能在维持人胚胎神经干细胞自我增殖中发挥正向调控作用。
由人源ipscs诱导来的神经干细胞与人牙周膜干细胞和人胚胎神经干细胞均存在显著差异。人牙周膜干细胞属于人间充质干细胞,其来源于外胚层间充质,可进一步分化为成骨细胞和脂肪细胞;而神经干细胞来源于外胚层,进一步分化为神经元和胶质细胞。文献《single-cellstudyofneuralstemcellsderivedfromhumanipscsrevealsdistinctprogenitorpopulationswithneurogenicandgliogenicpotential》(mattilam,tsukasasanosaka,anderslundin,etal.,genestocells,2019:24)中,对由人ipscs诱导来的神经干细胞及原代培养的人胚胎干细胞进行了单细胞测序,虽然两者都存在向神经和胶质分化的潜质,但两者的基因型还是存在很大的差距。
技术实现要素:
针对现有技术的不足,本发明提供了重组人notch1蛋白在制备神经干细胞及皮层神经元中的应用。
目前,由ipscs向神经元诱导分化常用的方法分为两个阶段,第一阶段为ipscs诱导分化为神经干细胞,第二阶段为神经干细胞诱导分化为神经元。如若想获得大量的神经元用于下一步的研究,就需要有数量大并且可以稳定增殖的神经干细胞,但应用目前的添加生长因子的方法,在传代过程中,神经干细胞的数量随着传代次数的增加反而减少,且增殖缓慢,这种现象考虑神经干细胞活性降低导致。本发明通过改良第一阶段神经干细胞维持培养基,加入notch信号通路受体notch1的方法来增加神经干细胞活性,缩短了神经干细胞的增殖周期,稳定传代,后期可获得大量有功能的皮层神经元。
本发明通过加入notch信号通路受体notch1的方法解决神经干细胞高效扩增的问题,可以获得功能稳定且活性高的神经干细胞,可进一步分化为数量大的皮层功能神经元,为皮层功能神经元的获得奠定了基础,可以满足同时筛选多种药物的目的。
本发明的技术方案:
重组人notch1蛋白在制备神经干细胞中的应用。
所述神经干细胞为能够分化为具有产生动作电位功能的皮层神经元的神经干细胞。
重组人notch1蛋白在制备神经干细胞中的应用,具体涉及上述神经干细胞的制备方法,包括如下步骤:
(1)当人源ipscs细胞汇合度达到100%以上时开始利用神经干细胞诱导培养基进行神经干细胞诱导分化培养4-6天,停止诱导,然后进行消化,收集细胞;
(2)步骤(1)中收集的细胞,用神经干细胞维持培养基重悬细胞继续培养4-7天后进行消化传代;获得神经干细胞,所述神经干细胞维持培养基组分中包括重组人notch1蛋白。
根据本发明优选的,步骤(1)中神经干细胞诱导培养基为:neurobasal培养基+1×n2+1×b27+1×glutamax-i+500ng/ml人重组noggin+20μmsb431542+4ng/mlfgf-2。
根据本发明优选的,步骤(1)中的诱导分化培养过程中,每3天进行半量换液。
所述步骤(1)中诱导分化培养4-6天至在显微镜下可观察到多个散在的rosette(凸起状)结构,停止诱导。
根据本发明优选的,步骤(1)中用胰酶进行消化,收集细胞。
进一步优选的,步骤(1)中用0.25%trpsin-edta进行消化。
根据本发明优选的,步骤(2)中培养基组分中重组人notch1蛋白的质量浓度为90-110ng/ml。
进一步优选的,步骤(2)中神经干细胞维持培养基为:neurobasal培养基+1×n2+1×b27+10ng/mlegf+10ng/mlfgf-2+20ng/mlbdnf+100ng/ml重组人notch1蛋白。
根据本发明优选的,步骤(2)中继续培养过程中,每3天进行半量换液。
根据本发明优选的,步骤(2)中继续培养4-7天,进行消化传代。
所述步骤(2)中继续培养4-7天至神经球中心开始出现发黑现象时,需要进行消化传代。
进一步优选的,步骤(2)中继续培养4天,进行消化传代。
根据本发明优选的,步骤(2)中将步骤(1)收集的细胞,按105/cm2接种于神经干细胞维持培养基。
根据本发明优选的,步骤(2)中消化传代的方法为将神经球培养物收集于离心管中,1000rpm离心2分钟,弃上清液,加入无钙镁磷酸缓冲盐溶液(以下简称pbs)重悬神经球,1000rpm离心2分钟,弃上清,在离心管中加入0.25%trpsin-edta,放入体积浓度为5%co2的37℃恒温细胞培养箱中消化至神经球为单细胞时,终止消化,1000rpm离心5分钟,弃上清,用上述神经干细胞维持培养基重悬细胞按105/cm2接种于6孔板中,放入体积浓度为5%co2的37℃恒温细胞培养箱中培养,每3天半量换液。
根据本发明优选的,步骤(2)中消化传代2-3次可获得纯化的神经干细胞。
进一步优选的,消化传代8-10次获得神经干细胞。
更优选的,消化传代12-30次获得神经干细胞。
上述神经干细胞的制备方法中,消化传代2-3次可获得纯化的神经干细胞,然后继续按照上述方法消化传代,经过8-10次传代,可获得性能稳定且数量大的神经干细胞,之后可按照107/ml冻存神经干细胞;也可继续进行诱导分化为皮层神经元,取第12-30代神经干细胞进行诱导,在此代数内,传代次数对诱导分化为皮层神经元无影响。
上述制备的神经干细胞在分化为具有产生动作电位功能的皮层神经元中的应用。
一种神经干细胞维持培养基,包括如下组分:neurobasal培养基+1×n2+1×b27+10ng/mlegf+10ng/mlfgf-2+20ng/mlbdnf+90-110ng/ml重组人notch1蛋白。
上述制备的神经干细胞用于神经保护药物的筛选。
根据本发明优选的,所述神经保护药物的筛选,具体涉及所述神经干细胞用于诱导分化制备具有产生动作电位功能的皮层神经元。
进一步优选的,所述皮层神经元用于神经保护药物的筛选。
所述神经干细胞用于诱导分化制备具有产生动作电位功能的皮层神经元,所述诱导分化的方法采用常规技术。
本发明的有益效果
本发明涉及的技术方案可以使神经球稳定增殖,并且神经球发黑现象减少,神经干细胞活性增高,神经干细胞诱导为皮层神经元的数量增加,可实现一次筛选多种药物的目的。
附图说明
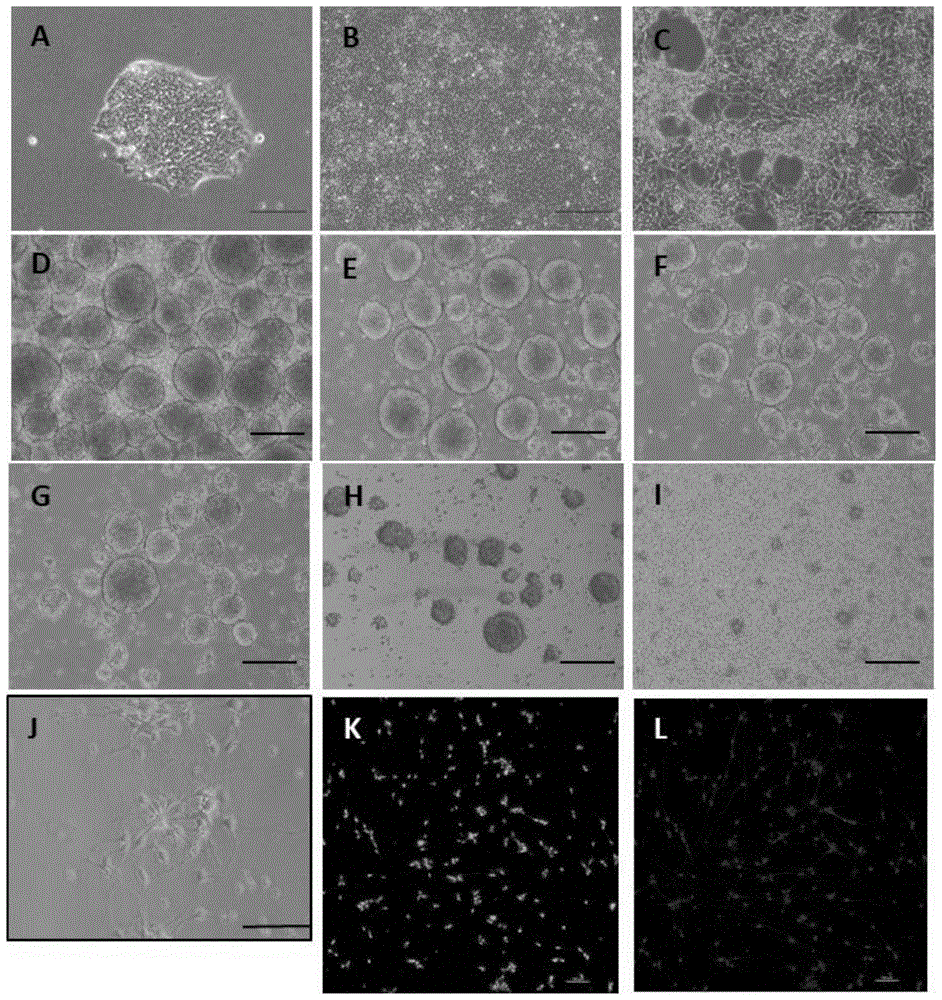
图1为神经诱导过程中人源u1ipscs形态变化照片;
图中,a-i.标尺=250μm;j-k.标尺=100μm;
a.ipscs克隆;b.ipscs达到100%融合;c.rosette结构形成;d-f.在改良神经干细胞维持培养基培养条件下收集诱导的ipscs消化传代后形成的神经干细胞,该神经干细胞增殖周期为4天,d图为第1代传代第4天时生成的神经球,e图为第3代传代第4天时生成的神经球,f图为第12代传代第4天时生成的神经球;g-i.在现有的神经干细胞维持培养基培养条件下收集诱导的ipscs消化传代后形成的神经干细胞,该神经干细胞增殖周期为7天,g图为第1代传代第7天时生成的神经球,h图为第3代传代第7天时生成的神经球,可见神经球发黑,增殖缓慢,i图为第4代传代第7天,可见细胞漂浮于培养基中,未见明显神经球形成;j.应用本发明改良培养基培养的神经干细胞诱导分化为神经元的第5天,镜下可见神经元样细胞;k-l.应用本发明改良培养基培养的神经干细胞分化来的神经元,第10天进行免疫荧光,k图为神经元标记物map2阳性,l图为神经元标记物tuj1阳性;
图2为神经诱导过程中人源dkipscs形态变化照片;
图中,a-f.标尺=250μm;g-h.标尺=100μm;
a.ipscs克隆;b.rosette结构形成;c-d.在改良神经干细胞维持培养基培养条件下收集诱导的ipscs消化传代后形成的神经干细胞,该神经干细胞增殖周期为4天,c图为第1代传代第4天时生成的神经球,d图为第12代传代第4天时生成的神经球;e-f.在现有的神经干细胞维持培养基培养条件下收集诱导的ipscs消化传代后形成的神经干细胞,该神经干细胞增殖周期为7天,e图为第1代传代第7天时生成的神经球,f图为第5代传代第7天,可见细胞漂浮于培养基中,未见明显神经球形成;g-h.应用本发明改良培养基培养的神经干细胞分化来的神经元,第10天进行免疫荧光,g图为神经元标记物map2阳性,h图为神经元标记物tuj1阳性;
图3为全细胞膜片钳记录诱导分化的神经元的动作电位;
图中,a.实施例1诱导分化神经元动作电位,神经元静息膜电位为-72mv,当注入电流达70pa时,记录到1个动作电位,随着注入电流增加,动作电位发放频率增加,当注入电流增到到300pa时,可记录到7个动作电位。b.对比例1诱导分化神经元动作电位,神经元静息膜电位为-67mv,当给予70pa刺激时,未记录到动作电位,随着注入电流增加,仍未有明显动作电位产生,当注入电流增到到300pa时,未记录到典型的动作电位波形。
具体实施方式
下面结合具体的实施例对本发明进一步阐述,但保护范围不限于此。
实施例中未注明具体条件的内容,按照常规条件进行;所用试剂或仪器未注明生成厂商的,均为普通市售产品。
主要材料来源见表1:
表1
实施例1
一种神经干细胞的制备方法
实施例1应用的u1ipscs来源于健康男性成人尿液肾上皮细胞,用于实验的细胞为第22代,具体包括如下步骤:
(1)配置培养基
神经干细胞诱导培养基:neurobasal培养基+1×n2+1×b27+1×glutamax-i+500ng/ml人重组noggin+20μmsb431542+4ng/mlfgf-2;
改良神经干细胞维持培养基:neurobasal培养基+1×n2+1×b27+10ng/mlegf+10ng/mlfgf-2+20ng/mlbdnf+100ng/ml重组人notch1蛋白;
(2)当u1ipscs细胞汇合度达到100%以上时开始进行诱导分化,弃去ipscs培养基,用pbs洗一次,加入步骤(1)中的神经干细胞诱导培养基,放入体积浓度为5%co2的37℃恒温细胞培养箱中培养,第3天加入半量新鲜培养基,第6天时显微镜下观察到多个散在的rosette结构,停止诱导。
(3)将步骤(2)诱导后的细胞用pbs洗一次,加入0.25%trpsin-edta,放入体积浓度为5%co2的37℃恒温细胞培养箱中消化8分钟,显微镜下观察到细胞变圆,收集细胞于15ml离心管,1000rpm离心5分钟,弃上清液,用步骤(1)中的改良神经干细胞维持培养基按105/cm2重悬细胞接种于6孔板中,每3天半量换液。
(4)显微镜下观察步骤(3)培养的细胞,培养到第4天时,神经球较大、神经球中心出现发黑现象,需要进行神经球消化传代。将神经球收集于15ml离心管中,1000rpm离心2分钟,弃上清,加入pbs重悬神经球一次,1000rpm离心2分钟,弃上清,加入0.25%trpsin-edta至离心管中,放入体积浓度为5%co2的37℃恒温细胞培养箱中消化8分钟,轻轻晃动离心管,当神经球成为单细胞便终止消化,此时肉眼观察球状物存留较少,1000rpm离心5分钟,弃上清,按105/cm2重悬细胞于改良神经干细胞维持培养基中并接种于6孔板中。
(5)继续重复步骤(4),可获得大量活性高的神经干细胞,该神经干细胞增殖稳定,每4天可传一代。传代到第10代后开始冻存细胞,按照107/ml冻存神经干细胞,取传代到第12代的细胞进行神经元诱导分化。
对比例1
一种神经干细胞的制备方法,包括如下步骤:
对比例1所应用的ipscs细胞与实施例1中的细胞为同一细胞系,同样为第22代,常规ipscs诱导为神经干细胞的制备方法,具体包括如下步骤:
步骤(1)与实施例1的不同之处在于:神经干细胞维持培养基中没有100ng/ml重组人notch1蛋白,其它均相同;
步骤(2)与实施例1相同;
步骤(3)将步骤(2)诱导后的细胞用pbs洗一次,加入0.25%trpsin-edta,放入体积浓度为5%co2的37℃恒温细胞培养箱中消化8分钟,显微镜下观察到细胞变圆,收集细胞于15ml离心管,1000rpm离心5分钟,弃上清液,用步骤(1)中的神经干细胞维持培养基按105/cm2重悬细胞接种于6孔板中,每3天半量换液。
步骤(4)显微镜下观察步骤(3)培养的细胞,培养到第7天时,神经球较大、神经球中心出现发黑现象,需要进行神经球消化传代。将神经球收集于15ml离心管中,1000rpm离心2分钟,弃上清,加入pbs重悬神经球一次,1000rpm离心2分钟,弃上清,加入0.25%trpsin-edta至离心管中,放入体积浓度为5%co2的37℃恒温细胞培养箱中消化8分钟,轻轻晃动离心管,当神经球成为单细胞便终止消化,此时肉眼观察球状物存留较少,1000rpm离心5分钟,弃上清,按105/cm2重悬细胞于上述神经干细胞维持培养基中并接种于6孔板中。
步骤(5)中当细胞消化传代至第3代时,从传代后第2天开始整个神经球出现发黑现象,且增殖速度减慢,甚至有些发黑的神经球不再增大,第7日时将细胞分两批,第一批继续按步骤(4)进行消化传代,每3天半量换液,显微镜下观察到第4代细胞漂浮于培养基中,在一个增殖周期7日内无神经球形成;另一批细胞进行神经元诱导分化。
效果例1
由实施例1和对比例1获得的神经干细胞进一步诱导分化为神经元,具体方法步骤如下:
(1)提前一天用2μg/ml层连蛋白(laminin)包被培养皿,放置于体积浓度为5%co2的37℃恒温细胞培养箱中过夜。
(2)显微镜下观察,选择状态较好的神经球(神经干细胞)进行分化。收集神经球至15ml离心管中,用pbs洗一次培养皿并收集于离心管中,1000rpm离心2分钟,弃上清,加入4mlpbs重悬神经球,1000rpm离心2分钟,弃上清,在离心管中加入0.25%trpsion-edta1ml,横放于培养箱中消化7分钟。
(3)轻轻摇动步骤(2)培养箱中的离心管,当神经球成为单细胞时可终止消化,肉眼观察球状物存留较少或没有,1000rpm离心5分钟,弃上清,在离心管中加入神经元分化培养基:neurobasal培养基+1×n2+1×b27+1×glutamax-i,按照5×104/ml接种的接种量,加入上述培养基。
(4)将步骤(3)接种的细胞置于体积浓度为5%co2的37℃恒温细胞培养箱中继续培养,每3天半量换液,实施例1来源的神经干细胞经诱导分化到第5天时,显微镜下可观察到神经元样细胞,长期培养获得大量成熟的神经元。对比例1来源的神经干细胞经诱导分化仅观察到少量的神经元样细胞。
map2、tuj1为神经元标志物,可用于神经元的鉴定,为了鉴定诱导的细胞为神经元,进一步进行细胞的免疫荧光双标和激光共聚焦显微镜检测,方法如下:
(1)溶液配置:
0.3%tritonx-100:取0.3mltritonx-100溶于100mlpbs中。
封闭液:取1g牛血清白蛋白(bsa)溶于0.3%tritonx-100的pbs中。
(2)提前一天用2μg/mllaminin包被激光共聚焦专用小皿(小皿中间有凹槽),放置于体积浓度为5%co2的37℃恒温细胞培养箱中过夜。将消化的实施例1和对比例1来源的神经干细胞接种于小皿中,给予神经元分化培养基,每3天半量换液,培养至10天时,将培养基弃去,用pbs洗3次,每次3分钟。
(3)向步骤(2)中洗后的细胞中,加入1ml4%多聚甲醛(pfa)固定15分钟,将pfa弃去,用pbs洗3次,每次5分钟。
(4)向步骤(3)洗后的细胞中加入1ml0.3%tritonx-100在细胞膜上打孔,让抗体更易进入细胞与抗原结合,15分钟后,弃上清液,加入封闭液,室温封闭1小时。
(5)步骤(4)中封闭完成后,弃去封闭液,向小皿中间凹槽内加入一抗稀释液,即含有2μl鸡抗map2(1:100)和2μl兔抗tuj1(1:100)的200μl封闭液,4℃孵育过夜。
(6)吸去步骤(5)中的一抗稀释液,pbs洗3次,每次5分钟;向小皿中间凹槽内加入二抗稀释液,即含有荧光标记的二抗1μl山羊抗鸡(1:200)和1μl山羊抗兔(1:200)的200μlpbs缓冲液,室温避光孵育1小时。
(7)弃去二抗稀释液,pbs洗3次,每次5分钟,向小皿中间凹槽内加入含有0.2μldapi(1:1000)的200μlpbs染细胞核,室温避光20分钟。
(8)弃去dapi稀释液,pbs洗3次,每次5分钟,向小皿中加入2mlpbs,用激光共聚焦显微镜拍照。
神经元诱导培养过程中u1ipscs形态变化照片见图1,对比例1中在现有神经干细胞培养条件下,传至第3代时显微镜下可见神经球发黑,且增殖速度减慢,将此神经球诱导为神经元时,仅有少量神经元形态细胞;实施例1中在改良神经干细胞维持培养基培养条件下,神经球扩增稳定,神经球内部并无明显变黑,扩增效率明显提高,细胞活性增高,神经球增殖时间由7天缩短为4天;将此神经球传到第12代时诱导为神经元,可观察到神经元形态细胞,经过免疫荧光验证,神经元标记物map2阳性(绿色)、tuj1阳性(红色),实施例1与对比例1中形成的神经球直径见表2。
表2.实施例1与对比例1形成的神经球直径(μm)
为了进一步证明诱导的神经元样细胞具有神经元功能,应用全细胞膜片钳电生理方法记录诱导出的神经元的动作电位。具体方法如下:
(1)主要溶液的配制
电极内液:k-gluconate100mm+kcl50mm+egta10mm+mgcl25mm+hepes2mm,用1m的koh调至ph=7.3。
细胞外液:nacl140mm+kcl3mm+cacl22mm+mgcl22mm+hepe10mm+glucose10mm,用1m的naoh调至ph=7.4。
(2)提前一天用2μg/mllaminin包被电生理用玻片,放于小皿中,放置于体积浓度为5%co2的37℃恒温细胞培养箱中过夜。将消化的实施例1和对比例1来源的神经干细胞接种于玻片上,给予神经元分化培养基,每3天半量换液,培养至14天时,将玻片放入浴槽中。
(3)全细胞膜片钳实验由hekaepc10放大器以及hekapatchmaster软件完成,化合物溶液通过重力灌流系统(vm8alascientificinstruments)利用重力给药,dmz电极拉制仪进行电极的拉制与抛光,所得电极入液阻值范围为2-6mω。拉制好的电极内加入相应的电极内液,并将电极安装在支持器上。
(4)入液之前,先给与记录电极正压,之后电极入液,此时电极阻值应为2-6mω,并形成方波。电极无限贴近细胞后,给予负压直到形成高阻封接,并且补偿电极电容(快电容成分c-fast)。
(5)继续施加负压形成全细胞记录模式,补偿膜电容(慢电容成分c-slow)及串联电阻,然后将记录模式切换至电流钳(currentclamp),将细胞钳制在0pa,采用gap-free程序记录细胞静息膜电位;动作电位的记录采用越阶式,以15pa一个越阶,从0pa开始逐渐越阶至300pa。
神经干细胞诱导分化至第14天,由对比例1分化来的神经元样细胞在不同电流刺激下未记录到动作电位,而由实施例1分化来的神经元样细胞在电流刺激下可记录到动作电位,说明该神经元样细胞具有神经元功能;动作电位记录见图3。
综上实验结果说明,实施例1诱导分化来的神经元样细胞既能表达神经元标志物又能发放动作电位产生神经兴奋,其表型和功能更接近于正常神经元。
实施例2
一种神经干细胞的制备方法
实施例2应用的dyipscs来源于健康男性成人皮肤成纤维细胞,用于实验的细胞为第18代,具体包括如下步骤:
(1)配置培养基
神经干细胞诱导培养基:neurobasal培养基+1×n2+1×b27+1×glutamax-i+500ng/ml人重组noggin+20μmsb431542+4ng/mlfgf-2;
改良神经干细胞维持培养基:neurobasal培养基+1×n2+1×b27+10ng/mlegf+10ng/mlfgf-2+20ng/mlbdnf+100ng/ml重组人notch1蛋白;
(2)当dyipscs细胞汇合度达到100%以上时开始进行诱导分化,弃去ipscs培养基,用pbs洗一次,加入步骤(1)中的神经干细胞诱导培养基,放入体积浓度为5%co2的37℃恒温细胞培养箱中培养,分别于第2天、第4天加入半量新鲜培养基(第2天时,培养基明显发黄,固提前加入新鲜培养基),第5天时显微镜下观察到多个散在的rosette结构,停止诱导。
(3)将步骤(2)诱导后的细胞加入0.25%trpsin-edta消化8分钟,细胞变圆,收集细胞于15ml离心管,1000rpm离心5分钟,弃上清液,用步骤(1)中改良神经干细胞维持培养基按105/cm2重悬细胞接种于6孔板中,每3天半量换液。
(4)显微镜下观察步骤(3)培养的细胞,培养到第4天时,神经球较大、神经球中心出现发黑现象,需要进行神经球消化传代。将神经球收集于15ml离心管中,1000rpm离心2分钟,弃上清,加入pbs重悬神经球,1000rpm离心2分钟,弃上清,加入0.25%trpsin-edta至离心管中,放入体积浓度为5%co2的37℃恒温细胞培养箱中消化8分钟,轻轻晃动离心管,当神经球成为单细胞便终止消化,此时肉眼观察球状物存留较少,1000rpm离心5分钟,弃上清,按105/cm2重悬细胞于改良神经干细胞维持培养基中并接种于6孔板中。
(5)继续重复第4步,可获得大量活性高的神经干细胞,该神经干细胞增殖稳定,每4天可传一代。传代到第10代后开始冻存细胞,按照107/ml冻存神经干细胞。取传代到第12代的细胞进行神经元诱导分化。
对比例2
一种神经干细胞的制备方法
对比例2所应用的ipscs细胞与实施例2中的细胞为同一细胞系,同样为第18代,常规ipscs诱导为神经干细胞的制备方法,具体包括如下步骤:
步骤(1)与实施例2的不同之处在于:神经干细胞维持培养基中没有100ng/ml重组人notch1蛋白,其它均相同;
步骤(2)与实施例2相同;
步骤(3)将步骤(2)诱导后的细胞加入0.25%trpsin-edta消化8分钟,细胞变圆,然后将消化后的细胞转入于15ml离心管,1000rpm离心5分钟,弃上清液,用步骤(1)中的神经干细胞维持培养基按105/cm2重悬细胞接种于6孔板中,每3天半量换液。
步骤(4)显微镜下观察步骤(3)培养的细胞,培养到第7天时,神经球较大、神经球中心出现发黑现象,需要进行神经球消化传代,将神经球收集于15ml离心管中,1000rpm离心2分钟,弃上清,加入pbs重悬神经球一次,1000rpm离心2分钟,弃上清,加入0.25%trpsin-edta至离心管中,放入体积浓度为5%co2的37℃恒温细胞培养箱中消化8分钟,轻轻晃动离心管,当神经球成为单细胞便终止消化,此时肉眼观察球状物存留较少,1000rpm离心5分钟,弃上清,按105/cm2重悬细胞于上述神经干细胞维持培养基中并接种于6孔板中;
(5)当细胞传至第3代时,神经球增殖缓慢,从第4天开始整个神经球有发黑的现象,第7日按照步骤(4)进行传代,从传代后第2日开始整个神经球出现发黑现象,且已形成的神经球不再增大,第7日时将细胞分两批处理,第一批继续按步骤(4)进行消化传代,每3天半量换液,显微镜下观察到第5代细胞漂浮于培养基中,在一个增殖周期7日内无神经球形成;另一批细胞进行神经元诱导分化。
效果例2
由实施例2和对比例2获得的神经干细胞进一步诱导为皮层神经元,具体方法步骤如下:
(1)提前一天用2μg/mllaminin包被培养皿,放置于体积浓度为5%co2的37℃恒温细胞培养箱中过夜。
(2)显微镜下观察,选择状态较好的神经球(神经干细胞)进行分化。将神经球收集于15ml离心管中,用pbs冲洗一次培养皿并收集于离心管中,1000rpm离心2分钟,弃上清,加入4mlpbs重悬神经球,1000rpm离心2分钟,弃上清,在离心管中加入0.25%trpsion-edta,横放于培养箱中消化7分钟。
(3)轻轻摇动步骤(2)培养箱中的离心管,当神经球成为单细胞可终止消化,肉眼观察球状物存留较少或没有,1000rpm离心5分钟,弃上清,在离心管中加入神经元分化培养基:neurobasal培养基+1×n2+1×b27+1×glutamax-i,按照5×104/ml接种的接种量,加入上述培养基。
(4)将步骤(3)接种的细胞置于体积浓度为5%co2的37℃恒温细胞培养箱中继续培养,每3天半量换液。实施例2来源的神经干细胞经诱导分化到第5天时,显微镜下可观察到神经元样细胞,长期培养获得大量成熟的神经元。对比例2来源的神经干细胞经诱导分化仅观察到少量神经元样细胞。
map2、tuj1为神经元标志物,可用于神经元的鉴定,为了鉴定诱导的细胞为神经元,进一步进行细胞的免疫荧光双标和激光共聚焦显微镜检测,方法如下:
(1)溶液配置:
0.3%tritonx-100:取0.3mltritonx-100溶于100mlpbs中。
封闭液:取1gbsa溶于0.3%tritonx-100的pbs中。
(2)提前一天用2μg/mllaminin包被激光共聚焦专用小皿(小皿中间有凹槽),放置于体积浓度为5%co2的37℃恒温细胞培养箱中过夜。将消化的实施例1和对比例1来源的神经干细胞接种于小皿中,给予神经元分化培养基,每3天半量换液,培养至10天时,将培养基弃去,用pbs洗3次,每次3分钟。
(3)向步骤(2)中洗后的细胞中,加入1ml4%多聚甲醛(pfa)固定15分钟,将pfa弃去,用pbs洗3次,每次5分钟。
(4)向步骤(3)洗后的细胞中加入1ml0.3%tritonx-100在细胞膜上打孔,让抗体更易进入细胞与抗原结合,15分钟后,弃上清液,加入封闭液,室温封闭1小时。
(5)步骤(4)中封闭完成后,弃去封闭液,向小皿中间凹槽内加入一抗稀释液,即含有2μl鸡抗map2(1:100)和2μl兔抗tuj1(1:100)的200μl封闭液,4℃孵育过夜。
(6)吸去步骤(5)中的一抗稀释液,pbs洗3次,每次5分钟;向小皿中间凹槽内加入二抗稀释液,即含有荧光标记的二抗1μl山羊抗鸡(1:200)和1μl山羊抗兔(1:200)的200μlpbs缓冲液,室温避光孵育1小时。
(7)弃去二抗稀释液,pbs洗3次,每次5分钟,向小皿中间凹槽内加入含有0.2μldapi(1:1000)的200μlpbs染细胞核,室温避光20分钟。
(8)弃去dapi稀释液,pbs洗3次,每次5分钟,向小皿中加入2mlpbs,用激光共聚焦显微镜拍照。
神经元诱导培养过程中dkipscs形态变化照片见图2,对比例2中在现有神经干细胞培养条件下,传至第4代时显微镜下可见神经球发黑,且增殖速度减慢,将此神经球诱导为神经元时仅见少陵神经元形态细胞;实施例2中在改良神经干细胞维持培养基培养条件下,神经球扩增稳定,神经球内部并无明显变黑,扩增效率明显提高,细胞活性增高,原有增殖时间由7天缩短为4天;将此神经球传到第12代时诱导为神经元,可观察到神经元形态细胞,经过免疫荧光验证,神经元标记物map2阳性(绿色)、tuj1阳性(红色)。实施例2与对比例2中形成的神经球直径见表3。
表3.实施例2与对比例2中形成的神经球直径(μm)
综上,本发明涉及的技术方案制备的神经球(即神经干细胞)扩增稳定,神经球内部并无明显变黑,扩增效率明显提高,细胞活性增高,神经球增殖时间由7天缩短为4天;经过8-10次传代,可获得性能稳定且数量大的神经干细胞,之后可按照107/ml冻存神经干细胞;也可继续进行诱导分化为皮层神经元,取第12-30代神经干细胞进行诱导,在此代数内,传代次数对诱导分化为皮层神经元无影响;由对比例1分化来的神经元样细胞在不同电流刺激下未记录到动作电位,而由实施例1分化来的神经元样细胞在电流刺激下可记录到动作电位,说明该神经元样细胞具有神经元功能;即由本发明涉及的技术方案制备的神经干细胞诱导分化来的神经元样细胞既能表达神经元标志物又能发放动作电位产生神经兴奋,其表型和功能更接近于正常神经元。
- 还没有人留言评论。精彩留言会获得点赞!